Известия РАН. Серия физическая, 2022, T. 86, № 10, стр. 1418-1423
Спектральные свойства супрамолекулярных комплексов арабиногалактана и родаминовых красителей
Е. В. Хименко 1, *, Е. А. Слюсарева 1, Н. Ю. Васильева 1, Н. В. Слюсаренко 1
1 Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
Красноярск, Россия
* E-mail: katrinfly@bk.ru
Поступила в редакцию 01.06.2022
После доработки 15.06.2022
Принята к публикации 22.06.2022
- EDN: TLKEUU
- DOI: 10.31857/S0367676522100106
Аннотация
Методом ионного обмена синтезированы новые водорастворимые супрамолекулярные комплексы из аммониевой соли сульфата арабиногалактана и родаминовых красителей. Стабильные флуоресцирующие комплексы обладают достаточным для визуализации квантовым выходом флуоресценции (10–20%). Молекулярное содержание полимера на два порядка превышает содержание красителя. Высокая концентрация функциональных сульфогрупп арабиногалактана позволяет использовать комплексы в системах доставки лекарств.
ВВЕДЕНИЕ
При связывании полимеров с белками, красителями, квантовыми точками и другими функциональными структурами расширяется спектр их практических приложений. Флуоресцентно-меченые полимеры применяют для маркирования, создания сенсоров [1], в системах доставки лекарств [2]. Кроме ковалентного связывания коньюгатов широко применяется нековалентное связывание (например, за счет водородных связей, электростатического взаимодействия и т.д.), характерное для супрамолекулярных систем [3]. Комплексы, полученные таким способом, могут быть чувствительны к изменению температуры, pH, ионной силы и др.
Целью работы было создание новых супрамолекулярных комплексов на основе полимера и двух флуоресцирующих красителей. В качестве основы комплекса мы использовали природный водорастворимый разветвленный полимер арабиногалактан, получаемый из лиственницы сибирской. Мембранотропные, иммуномодулирующие, антикоагулянтные и др. важные для медицины свойства этого полимера хорошо известны [4, 5]. Сульфатированный арабиногалактан (САГ) может быть структурирован в форме частиц в результате электростатического взаимодействия с катионным полимером [6, 7]. Для придания САГ флуоресцентных свойств мы впервые использовали родаминовые красители (родамин B и родамин 6G), обладающие необходимой для синтеза комплексов катионной природой, высоким квантовым выходом флуоресценции. Кроме того, эти красители имеют хорошо изученные стабильные оптические свойства в широком диапазоне pH [8]. Родаминовые красители как самостоятельные соединения и в составе систем широко применяются в качестве флуоресцентных зондов, сенсоров, в микроскопии сверхвысокого разрешения. Спектральные свойства синтезированных комплексов изучены методами адсорбционной, флуоресцентной, в том числе разрешенной во времени спектроскопии и сопоставлены со свойствами водных растворов красителей. Обсуждены механизмы межмолекулярного взаимодействия красителей с полимером.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Супрамолекулярные комплексы были синтезированы из аммониевой соли сульфата арабиногалактана и родаминовых красителей – родамина B (9-(2-Carboxyphenyl)-6-(diethylamino)-N,N-diethyl-3H-xanthen-3-iminium chloride) и родамина 6G (9-[2-(Ethoxycarbonyl)phenyl]-N-ethyl-6-(ethylamino)-2,7-dimethyl-3H-xanthen-3-iminium), производства Sigma-Aldrich. Арабиногалактан (производства ООО “Химия древесины”, Иркутск, Россия), выделенный из древесины лиственницы сибирской (Larix sibirica Ledeb.) был сульфатирован по методике, описанной в [6]. Молярная масса арабиногалактана 17 кДа, содержание серы 8.5 и 14.2 мас. % для образцов с родамином B и родамином 6G соответственно.
Синтез супрамолекулярных комплексов
Синтез супрамолекулярных комплексов проводили согласно методике [9]. Синтез комплексов проводили ионным обменом катиона аммония в аммониевой соли сульфата арабиногалактана на катион родамина с использованием ионообменной смолы КУ-2-8. Схема синтеза супрамолекулярных комплеков (на примере сульфата арабиногалактана и родамина B) представлена на рис. 1. Для закрепления на катионите, находящемся в NH4+-форме, родаминового красителя к 5 мл набухшего катионита добавляли 0.1 г соответствующего родаминового красителя, растворенного в 30 мл дистиллированной воды. Смесь перемешивали на магнитной мешалке при комнатной температуре в течение 1 ч. Затем отделяли от модифицированного красителем катионита водный раствор. Модифицированный катионит многократно промывали порциями воды по 20–30 мл до бесцветных промывных вод. Далее к модифицированному катиониту добавляли 0.3 г САГ, растворенного в 20 мл дистиллированной воды и перемешивали на магнитной мешалке при комнатной температуре в течение 30 мин. Водный раствор САГ с присоединенным к нему красителем отделяли от катионита фильтрованием. После этого водный раствор упаривали досуха при температуре 50–60°С, образовавшийся твердый остаток промывали порциями этанола до бесцветных промывных растворов.
Абсорбционные и флуоресцентные измерения
Спектры поглощения измерялись на спектрофотометре Lambda 35. Спектры флуоресценции измерялись на спектрофлуориметре Fluorolog 3-22 (Horiba Scientific, США) при возбуждении длинами волн 520 нм и 500 нм для родамина B и родамина 6G соответственно. Спектры были скорректированы на спектральную чувствительность ФЭУ и эффект реабсорбции.
Стационарная анизотропия флуоресценции определялась как [10]:
где ${{I}_{\parallel }}$ и ${{I}_{ \bot }}$ – интенсивности флуоресценции при вертикальной поляризации возбуждения и вертикальной и горизонтальной поляризации регистрируемого сигнала соответственно, G – фактор. Измерения анизотропии проводили в максимуме спектра испускания не менее 10 раз, данные усреднялись.Спады флуоресценции измерялись с использованием спектрофлуориметра, оснащенного модулем DeltaHub (Horiba Scientific, США), работающего в режиме счета одиночных фотонов. Источником возбуждения служил импульсный лазерный диод NanoLED N-490 c максимумом 493 нм, работающий на частоте 100 МГц с длиной импульсов <1.3 нс. Процедуру деконволюции и анализ спадов флуоресценции проводили с помощью программного обеспечения DAS6 (Horiba Scientific, США) с использованием статистического критерия χ2. Спады интенсивности были сняты на длинах волн, соответствующих максимумам спектра флуоресценции и описаны суммой от одной до трех экспонент. Среднее время жизни $\tau $ было вычислено с учетом амплитудного вклада каждой временной составляющей.
Для всех измерений использовалась L-геометрия, стандартные кварцевые кюветы сечением 1 × 1 см. Измерения проводились при комнатной температуре.
Для спектральных измерений использовались водные растворы комплексов с максимальной концентрацией 5 мас. %. Более концентрированные растворы характеризовались значимым светорассеянием и повышенной вязкостью, и нами не исследовались.
Определение квантового выхода флуоресценции, радиационного времени жизни, коэффициента молярной экстинкции комплексов и размера излучателя
Квантовый выход флуоресценции комплексов (φ) определяли относительным методом [11]. Измерения проводились при взаимной ориентации поляризатора и анализатора под “магическим углом” (57.4°) [10]. В качестве стандарта использовали водные растворы соответствующих родаминовых красителей. Для расчета радиационного времени жизни τрад использовалось соотношение:
Коэффициенты молярной экстинкции были рассчитаны из соотношения Стриклера–Берга [12]. Для оценки размера излучателя использовалось уравнение Перрена [10]:
где ${{r}_{0}}$ – предельное значение анизотропии, r – стационарная флуоресцентная анизотропия, k – константа Больцмана, τ – время жизни, D – гидродинамический диаметр молекулы излучателя, η – вязкость и T – температура.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры поглощения и флуоресценции
В результате синтеза были получены окрашенные водорастворимые комплексы из САГ с родамином B и родамином 6G. На рис. 2 представлены нормированные спектры поглощения и флуоресценции 1.25 мас. % водных растворов комплексов в сравнении с аналогичными характеристиками водных растворов красителей. Спектры поглощения красителей в составе супрамолекулярных комплексов отличаются от спектров водных растворов как по форме, так и по положению: максимумы сдвинуты в красную область на 4 и 11 нм для родамина B и родамина 6G соответственно (табл. 1). Спектры флуоресценции красителей, связанных с полимером, сохраняют форму и положение относительно аналогичных для водных растворов. Подобные закономерности наблюдались для концентраций растворов супрамолекулярных комплексов до 5 мас. %.
Рис. 2.
Спектры поглощения и флуоресценции родамина B (а) и родамина 6G (б). Сплошная линия – водный раствор красителя, пунктирная линия – супрамолекулярный комплекс. Вставка: супрамолекулярный комплекс при дневном свете (1) и в темноте при возбуждении УФ-лазером (2).

Таблица 1.
Фотофизические свойства родаминовых красителей в воде и в составе супрамолекулярного комплекса (концентрация 1.25 мас. %)
| Параметр | Водный раствор | Супрамолекулярный комплекс | ||
|---|---|---|---|---|
| Родамин B | Родамин 6G | Родамин B | Родамин 6G | |
| Максимум спектра поглощения, нм | 554 ± 1 | 526 ± 1 | 558 ± 1 | 537 ± 1 |
| Максимум спектра флуоресценции, нм | 576 ± 1 | 552 ± 1 | 576 ± 1 | 553 ± 1 |
| Квантовый выход флуоресценции (φ), % | 34 [13] | 83 [14] | 15 ± 2* | 17 ± 2* |
| $\left\langle \tau \right\rangle $, нс (χ2) |
1.6 (1.09) |
4.1 (1.07) |
1.6 (1.16) |
3.6 (1.08) |
| Анизотропия (r) | 0.03 | 0.01 | 0.04 | 0.05 |
| τрад, нс | 4.8** | 4.6** | 10.3** | 21.1** |
| Молярный коэффициент экстинкции, М‒1 · см‒1 | 10.3 · 104 [15] | 8.1 · 104 [16] | 4.8 · 104*** | 1.8 · 104*** |
| Стехиометрия комплекса (молекула полимера : молекула красителя) |
– | – | 1 : 120 | 1 : 130 |
Квантовый выход, время жизни и анизотропия флуоресценции
Квантовый выход полимерных комплексов с красителями уменьшился относительно водных растворов соответствующих красителей, но остался достаточно высоким для визуализации. При более, чем двукратном различии квантовых выходов родамина 6G и родамина B (табл. 1), их значения для супрамолекулярных комплексов на их основе оказались близки (15–17%). Флуоресцентное время жизни родамина 6G в водном растворе превышает таковое для родамина B (табл. 1). Значения времени жизни для красителей после связывания с полимером изменились незначительно. Анизотропия флуоресценции родамина B и родамина 6G в составе супрамолекулярных комплексов увеличилась по сравнению с водными растворами красителей (табл. 1).
Молярный коэффициент экстинкции связанного с полимером красителя и стехиометрия комплекса
Существенные изменения молярного коэффициента экстинкции при связывании с полимером наблюдались для обоих красителей: коэффициент уменьшился в 2–4 раза. Таким образом, при связывании с полимером спектры поглощения красителей не только батохромно сдвигаются и изменяются по форме, но и уменьшаются по амплитуде. Такие закономерности характерны для красителей, связанных с полимерами [17].
Стехиометрическое соотношение молекул родаминовых красителей к молекулам арабиногалактана в составе супрамолекулярных комплексов составило 1 : 130 для родамина B и 1 : 120 родамина 6G. Эти отношения оцениваются как ~0.3% М. Аналогичное значение (~1% М) было получено в работе [18] для комплекса флуоресцеина и хитозана. Вследствие того, что большинство функциональных групп САГ не связаны с красителем, синтезированные супрамолекулярные комплексы могут быть использованы в системах доставки лекарственных средств.
Механизм тушения флуоресценции родаминовых красителей в составе супрамолекулярных комплексов
Анализ спектральных свойств красителей в составе комплексов, показал, что наибольшие изменения при связывании произошли с абсорбционными свойствами красителей. Из флуоресцентных свойств изменилась поляризация, квантовый выход, а форма спектров флуоресценции и время жизни сохранились. Сравнение двух красителей показало, что свойства родамина 6G изменяются сильнее при связывании с полимером, чем свойства родамина B. Обсудим эти изменения с точки зрения межмолекулярных взаимодействий краситель-полимер и различия в химическом строении этих красителей.
Основным механизмом формирования супрамолекулярного комплекса из анионного полимера и катионного красителя является, предположительно, электростатический механизм. Относительная прочность образовавшейся связи подтверждается отсутствием флуоресценции этанола после промывки им данных комплексов. Для выяснения роли этого механизма мы экранировали заряд в комплексе путем добавления хлорида натрия, однако это не привело к разрушению комплекса. Это означает, что электростатический механизм не является единственным при формировании связи красителя и полимера. Основной механизм формирования комплекса не исключает наличия других механизмов: гидрофобного, образования водородных связей и т.д. Эти механизмы могут быть достаточно эффективными, чтобы связать краситель с полимером даже при одинаковом заряде взаимодействующих молекул. Например, в работе [19] обнаружено связывание катионного родамина 6G c полиэлектролитным комплексом на основе хитозана. Разделение вклада различных взаимодействий является достаточно сложной задачей.
Сохранение времени жизни и изменение спектра поглощения красителя при связывании с полимером однозначно относит наблюдаемое тушение флуоресценции красителей к статическому механизму [10]. Основным механизмом тушения флуоресценции является формирование нефлуоресцирующего комплекса в результате межмолекулярных взаимодействий красителей и полимера, описанных выше. Дополнительно можно утверждать, что димеризация красителей маловероятна, поскольку в этом случае наблюдался бы гипсохромный сдвиг спектров поглощения красителей [20].
На рис. 3 показано отношение квантовых выходов красителя в составе супрамолекулярных комплексов в зависимости от их концентрации. Для родамина B характерна линейная зависимость в координатах Штерна–Фольмера. Для родамина 6G линейность наблюдается не на всем участке: квантовый выход сильнее падает в составе супрамолекулярных систем на начальных концентрациях.
Рис. 3.
Отношения квантовых выходов красителей в воде (φ0) и супрамолекулярных комплексов (φ) в зависимости от массовой концентрации комплексов.
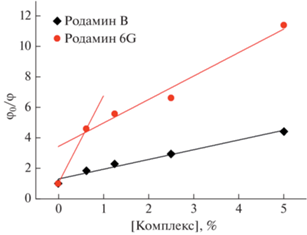
При связывании красителя с полимером происходит изменение анизотропии флуоресценции (табл. 1). С помощью формулы (3) был оценен размер излучателя. Для водных растворов он составил примерно 1.1 нм, что соответствует размеру молекул обоих красителей. Для супрамолекулярных комплексов размер излучателя увеличивается до 1.2–1.5 (с родамином B) и 1.6–1.8 нм (с родамином 6G). Эти величины не достигают размера молекулы арабиногалактана (~4 нм), что говорит о нежесткой связи молекулы флуорофора с молекулой полимера и ее подвижности в пределах области связывания. Другой причиной изменения анизотропии, помимо увеличения размера излучателя, может быть изменение вязкости растворителя. Как показали наши результаты, изменение концентрации комплекса в пределах порядка (от 0.5 до 5%) приводит к изменению анизотропии флуоресценции родамина 6G в составе комплекса на 20%, а родамина B на 40%.
Причину разного поведения зависимостей на рис. 5 для двух красителей следует искать в их разном химическом строении. Родамин B и родамин 6G в исследованных растворах находятся в форме цвиттер-иона и катиона соответственно, а также родамин 6G имеет в своем составе метильную группу. Это, вероятно, усиливает гидрофобное взаимодействие родамина 6G с САГ [21] и способствует формированию более жесткой связи родамина 6G c полимером по сравнению с родамином B.
ЗАКЛЮЧЕНИЕ
Синтезированы водорастворимые супрамолекулярные комплексы на основе сульфата арабиногалактана и родаминовых красителей (родамин B и родамин 6G) со стехиометрическим соотношением краситель:полимер около 1 : 100. Диапазон полученных значений квантовых выходов флуоресценции составил 10–20%. Показано, что нежесткая связь красителя с полимером может формироваться при реализации нескольких межмолекулярных механизмов, среди которых вероятными являются электростатический и гидрофобный механизмы. Статическое тушение флуоресценции красителей в составе комплекса зависит от концентрации комплексов и происходит в результате формирования нефлуоресцирующего комплекса в основном состоянии. Значения квантовых выходов флуоресценции и стехиометрические соотношения полученных супрамолекулярных комплексов позволяют использовать их для флуоресцентных исследований, а также для создания систем доставки лекарственных средств.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (проекты № FSRZ-2020-0008 и МК-995.2022.1.2).
Список литературы
Yang T.X., Zuo Y.J., Zhang Y. et al. // Spectrochim. Acta A. 2019. V. 216. P. 207.
Trubitsyn G., Nguyen V.N., Di Tommaso C. et al. // Eur. J. Pharm. Biopharm. 2019. V. 142. P. 480.
Lim S., Kuang Y., Ardona H.A.M. // Front. Chem. 2021. V. 9. Art. No. 723111.
Бабкин В.А., Неверова Н.А., Медведева Е.Н. и др. // Химия растит. сырья. 2015. № 2. С. 29; Babkin V.A., Neverova N.A., Medvedeva E.N. et al. // Russ. J. Bioorg. Chem. 2016. V. 42. No. 7. P. 707.
Qin L., He M., Yang Ya. et al. // Carbohydr. Polym. 2020. V. 242. Art. No. 116394.
Slyusarenko N.V., Vasilyeva N.Y., Kazachenko A.S. et al. // Polym. Sci. Ser. B. 2020. V. 62. No. 3. P. 272.
Slyusarenko N., Gerasimova M., Atamanova M. et al. // Colloids Surf. A Physicochem. Engin. Asp. 2021. V. 610. Art. No. 125731.
Mchedlov-Petrossyan N.O., Kukhtik V.I., Alekseeva V.I. // Dyes Pigments. 1994. V. 24. P. 11.
Васильева Н.Ю., Хименко Е.В., Слюсарева Е.А. и др. Способ получения флуоресцентных производных арабиногалактана. Патент РФ № 2768707. 2022.
Lakowicz J.R. Principles of fluorescence spectroscopy. New York: Springer Science & Business Media, 2006. 954 p.
Williams A.T.R., Winfield S.A., Miller J.N. // Analyst. 1983. V. 108. P. 1067.
Strickler S.J., Berg R.A. // J. Chem. Phys. 1962. V. 37. P. 814.
Gaigalas A.K., Wang L. // J. Res. NIST. 2008. V. 113. P. 17.
Würth C., Gonzalez M.G., Niessner R. et al. // Talanta. 2012. V. 90. P. 30.
Lopez Arbeloa F., Lopez Arbeloa T., Tapia Estevez M.J., Lopez Arbeloa I. // J. Phys. Chem. 1991. V. 95. P. 2203.
Paula P.K., Hussain S.A., Bhattacharjee D. et al. // Chin. J. Chem. Phys. 2011. V. 24. No. 3. P. 348.
Slyusareva E., Gerasimova M., Plotnikov A., Sizykh A. // J. Colloid Interface Sci. 2014. V. 417. P. 80.
Hidalgo T., Gimenez-Marques M., Bellido E. et al. // Sci. Rep. 2017. V. 7 Art. No. 43099.
Slyusareva E., Gerasimova M., Slabko V. et al. // Chem. Phys. Chem. 2015. V. 16. No. 18. P. 3997.
Reisch A., Klymchenko A.S. // Small. 2016. V. 12. No. 15. P. 1968.
Shen K., Gondal M.A. // J. Saudi Chem. Soc. 2017. V. 21. Suppl. 1. P. S120.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая



