Известия РАН. Серия физическая, 2023, T. 87, № 2, стр. 194-200
Систематическое исследование спектров гигантского комбинационного рассеяния света катионных рамановских красителей, адсорбированных на цитрат-стабилизированные серебряные наночастицы
Д. А. Грибанев 1, *, Е. В. Рудакова 1, 2, Е. Г. Завьялова 3
1 Федеральное государственное бюджетное учреждение науки
Институт физики твердого тела имени Ю.А. Осипьяна Российской академии наук
Черноголовка, Россия
2 Институт физиологически активных веществ Федерального государственного бюджетного учреждения науки Федерального исследовательского центра проблем химической физики и медицинской химии
Российской академии наук
Черноголовка, Россия
3 Федеральное государственное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
* E-mail: digrib@gmail.com
Поступила в редакцию 17.09.2022
После доработки 05.10.2022
Принята к публикации 26.10.2022
- EDN: AEJCMV
- DOI: 10.31857/S0367676522700363
Аннотация
Методом спектроскопии гигантского комбинационного рассеяния исследована адсорбция (кинетика и устойчивость сигнала) катионных триарилметановых красителей и производного акридина с различными противоионами на цитрат-стабилизированные гидроксиламин-восстановленные серебряные золи. При помощи спектроскопии гигантского комбинационного рассеяния света изучено влияние способа получения наночастиц, а также состава и ионной силы среды на устойчивость комплексов наночастица-краситель.
ВВЕДЕНИЕ
Явление рамановского рассеяния, открытое в 30-х гг. 20 в., долгое время не получало широкого распространения в практике из-за низкой чувствительности метода. Однако в 70-х гг. 20 в. было обнаружено явление поверхностно-усиленного рамановского рассеяния [1]. Согласно теории, что сечения светорассеяния молекул, адсорбированных на некоторых шероховатых поверхностях металла или нано-размерных металлических частиц или рядом с ними, значительно увеличиваются при лазерном возбуждении, усиливая спектры комбинационного рассеяния (КР) в миллионы раз. Согласно общепринятой теории гигантского комбинационного рассеяния (ГКР), основной вклад в усиление сигнала рассеяния неупругих колебаний вносит электромагнитная (ЭМ) составляющая. ЭМ усиление возникает за счет значительного увеличения напряженности электрического поля (в 103–104 раз) вблизи шероховатых поверхностей [2], на границе между средами с различной диэлектрической проницаемостью [3], или горячих точек в случае коллоидных растворов [4], что соответствует значению фактора усиления КР в 106–108 для различных молекул, независимо от их структуры или электронного состояния [5].
Кроме того, заметное дополнительное усиление комбинационное рассеяния в 102–103 раза было получено для конкретных молекул и колебательных мод при химическом усилении, которое возникает в результате резонанса переноса электрона между металлом и молекулами [2]. Однако целостная картина процессов, лежащих в основе химического усиления, так и не была полностью развита. Соответственно, дальнейшее накопление эмпирической информации о механизмах электромагнитного и химического усилений имеет важное значение для установления оптимальных механизмов усиления ГКР-сигнала и создания методик обнаружения отдельных молекул, которая требует фактора усиления КР более чем 1010 раз. Обнаружение отдельных молекул с помощью спектроскопии ГКР необходимо для надежного применения в биохимическом анализе [6] и медицинской диагностике [7] с высокой спектральной специфичностью, мультиплексными возможностями и фотостабильностью [8].
Механизм химического усиления изучался многими группами, так в работе Hildebrandt и Stockburger [9], сигнал ГКР красителя R6G, адсорбированного исключительно на наночастицах серебра, дает лишь незначительное усиление (фактор G = 1.3 ⋅ 104), но в присутствии галогенид-анионов фактор усиления возрастает более чем на три порядка (до G = 4.3 ⋅ 107). Деринг и Ни изучали роль галогенида в спектрах ГКР, в наночастиц Ag, иммобилизованных на стеклянной подложке [10]. Они обнаружили резкую активацию сигнала КР, вызванную добавлением галогенида, и оценили коэффициент химического усиления в данной системе в 102–103.
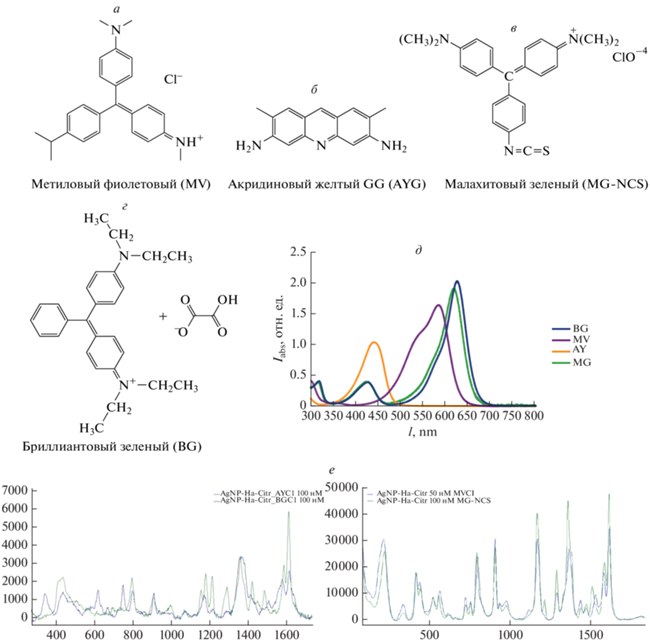
В ходе этой работы был рассмотрен механизм адсорбции катионных красителей (структура красителей показана на рис. 1а–1в) в растворах серебряных наночастиц (d ~ 12–14 nm), полученных путем восстановления нитрата серебра боргидридом и гидроксиламином в присутствии цитрата натрия. Также было изучено поведение цитрат-стабилизированных гидроксиламин-восстановленных серебряных наночастиц с адсорбированными красителями в средах различного состава, а также была исследована устойчивость полученных систем с течением времени.
УСЛОВИЯ ЭКСПЕРИМЕНТА
В синтезах растворов серебряных наночастиц и в приготовлении стоковых растворов и буферов использовалась деионизированная (18 МОм/см) полученная на установке Millipore (Merck Millipore, Burlington, Massachusetts, США)
Синтез растворов серебряных наночастиц
Синтез гидроксиламин-восстановленных серебряных коллоидов производили по известной методике без добавления цитрата [11]. Синтез цитрат-стабилизированных боргидрид-восстановленных серебряных наночастиц проводили согласно методике [12].
Синтез гидроксиламин-восстановленных серебряных коллоидов, стабилизированных цитратом, проводили следующим образом. К 40 мл воды при комнатной температуре и при умеренном перемешивании (450 об./мин) добавили последовательно водные растворы гидроксиламина гидрохлорида NH2OH.HCl (150 мМ), гидроксида натрия NaOH (300 мМ) по 400 мкл каждый, 90 мкл 500 мМ цитрата натрия. Растворы перемешивали в течение 1 мин. К полученной смеси быстро добавили 4.5 мл 10 мМ раствора AgNO3. Полученный золь перемешивали в течение часа до окончания реакции восстановления серебра.
Для исследования ГКР-активности получаемых наночастиц использовался стоковый 100 мкМ водный раствор малахитового зеленого изотиоцианата перхлората, полученный разведением коммерческой соли (Thermo Fisher) водой.
Получение стоковых растворов катионных красителей с различными противоионами
Замена противоиона в катионных красителей осуществлялась взаимодействием 2 мМ водных растворов хлоридных солей катионных красителей (бриллиантового зеленого, метилового фиолетового и акридинового желтого G, исходные соли марки ч. д. а – Реахим) с равным объемом 2 мМ раствора соответствующих растворимых серебряных солей (AgF, AgNO3, Ag2SO4, AgBF4, исходные соли х.ч. – Sigma Aldrich) с последующей очисткой от золя хлорида серебра путем центрифугирования при 10 000 мин–1, в течение 20 мин при 4°С. Концентрация растворов полученных солей красителей определялась по максимальной интенсивности поглощения, в согласии с известными коэффициентами экстинкции. Растворы после удаления хлорида серебра разбавлялись деионизированной водой до концентрации 10–4 моль/л.
Адсорбция катионных красителей на поверхность цитрат-стабилизированных гидроксиламин восстановленных серебряных наночастиц
Адсорбция катионных красителей с различными противоионами проводилась путем разбавления в 1000 раз 100 мкМ стоковых растворов красителей серебряными золями с последующим перемешиванием при 300 об./мин в течение 2 ч и выдерживанием в течение 20 ч в темноте при комнатной температуре.
Измерение изменений ГКР сигналов красителей в различных средах. Для исследований поведения серебряных золей с адсорбированным метиловым фиолетовым исходный раствор разбавляли в 2 раза водой и соответствующими соляными буферами (см. результаты экспериментов). Полученные коллоидные системы содержали 0.5 мМ металлического серебра.
Спектры ГКР адсорбированных на серебряных золях катионных красителей записывали на приборе RaPort (Enhanced Spectrometry, США) с длиной волны лазерного излучения 532 нм, для регистрации использовали рабочую мощность 30 мВт. Спектрометр имеет спектральный диапазон 160–4000 см–1. Спектры записывали с экспозицией 1 с в 9 повторах. Диаметр лазерного луча составляет 20 мкм. Щель спектрометра составляла 20 мкм. Схема спектрометра основана на схеме Черни–Тернера. Лазерный луч фокусируется в центре стеклянного флакона объемом 1.5 мл (Аквилон, Россия), а рассеянный свет через тот же выход поступает обратно в спектрометр. Спектры поглощения красителей и серебряных золей регистрировали на спектрометре NanoDrop 2000 (Thermo Scientific, Waltham, MA, США). Размеры наночастиц и агрегатов оценивали методом динамического светорассеяния с использованием Zetasizer Nano ZS (Malvern, Worcestershire, Великобритания). Усреднение проводили по 3–5 повторам.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Основными достоинствами коллоидных растворов серебра, полученных восстановлением раствора AgNO3 гидроксиламином, является узкое распределение по размерам серебряных наночастиц (средний размер НЧ – 23 нм) и их высокоразвитая поверхность [11]. На поверхности частиц отсутствуют какие-либо сильные стабилизаторы (двойной электрический слой на поверхности частиц образуют хлорид-анионы и продукты реакции окисления гидроксиламина), что позволяет легко модифицировать наночастицы прямо во время их синтеза (“one-pot reaction”) любыми анионными стабилизаторами [13]. С другой стороны устойчивость серебряных золей, полученных данным путем сравнительно невелика, и за достаточный промежуток времени при хранении в растворе образуется довольно заметное количество агрегатов серебряных наночастиц. Низкая устойчивость исследуемых золей особенно заметна при добавлении катионного рамановского красителя в концентрациях меньших чем 10–7 М. Так, перемешивание гидроксиламин-восстановленных серебряных наночастиц в течение 20 мин в 50 нМ растворе малахитового зеленого изотиоцианата ведет к видимой агрегации наночастиц (постепенное обесцвечивание золя и образования серого осадка). Цитрат-стабилизированные борогидрид-восстановленные серебряные золи обладают куда большей стабильностью в присутствии того же катионного рамановского красителя, однако, при этом они же и обладают заметно более низкой ГКР-активностью (рис. 2).
Рис. 2.
Видимые спектры цитрат-стабилизированных наночастиц и спектр гидроксиламин-восстановленных цитрат-стабилизированных серебряных наночастиц с адсорбированным красителем (малахитовый зеленый изотиацианат перхлорат, MG-NCS) (а). ГКР-спектры MG-NCS, адсорбированного на цитрат-стабилизированные борогидрид-восстановленные серебряные наночастицы (спектр выделен синим), гидроксиламин-восстановленные (зеленым) и на агрегаты, полученные в 20 мМ растворе NaCl гидроксиламин-восстановленных серебряных наночастиц без стабилизатора (LL-MG) (б).
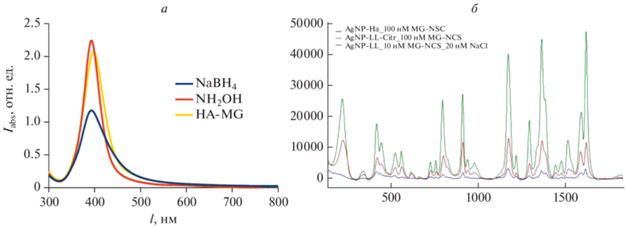
С целью получения высокоактивных плазмонных серебряных золей, обладающих при этом высокой стабильностью, нами была модифицирована их методика получения путем добавления в реакционную смесь раствора цитрата натрия. Из обзора [14] по синтезу серебряных золей известно, что 1 мМ серебряные золи достаточно устойчивы в диапазоне концентраций цитрата натрия 0.25 мМ–2.5 мМ, поэтому для удобства сравнения c цитрат-восстановленными серебряными золями (AgNP-Citr) мы выбрали концентрацию цитрата равную 1 мМ. Далее обозначение полученных НЧ – AgNP-HA-Citr.
Следует отметить, что гидродинамический диаметр полученных в данной работе серебряных коллоидов (12–14 нм) незначительно отличается от гидроксиламин-восстановленных серебряных золей, полученных без добавления цитратов (8–10 нм) [11, 13], полученные наночастицы обладают несколько меньшим коэффициентом усиления КР, чем агрегированные в 20 мМ растворе NaCl AgNP-LL (рис. 2). ζ-потенциал после адсорбции малахитового зеленого значительно повышается (с –60 мВ до –10 мВ), что указывает на практически полную компенсацию поверхностного заряда AgNP-HA-Citr катионным красителем, гидродинамический размер повышается тоже незначительно (d ~ 14–16), таким образом при адсорбции красителя не происходит образования агрегатов, но возможно образование скоплений наночастиц (т.е. комплексов из нескольких наночастиц и краски).
В следующей части работы исследовалась степень адсорбции исследуемых красителей за одинаковый промежуток времени в зависимости от противоиона и pH раствора красителя. Ранее подобные исследования по адсорбции малых количеств катионных красителей проводились группой M. Futamata. Авторы в работе обнаружили, что близко расположенные НЧ Ag образуют флокуляты в водном растворе при добавлении следовых количеств катионных ксантеновых красителей в концентрации 10–7–10–8 моль/л [15]. Для понимания механизма образования флокулятов серебра в коллоидных растворах эти же авторы в дальнейшем [16] изучали спектры экстинкции и SERS для нейтральных молекул и сравнивали их со спектрами для катионных форм. Действительно, катионные ксантеновые и трифенилметановые красители давали заметное красное смещение пиков флуоресценции. Последнее наблюдение предполагает возмущенное электронное состояние красителей, связанное с механизмом химического усиления. Поскольку красители адсорбируются на поверхности Ag через амино группы, авторы исследовали влияние размера и количества амино =N+(C2H5)2, –NH2, –N(CH3)2 и –N(C2H5)2 в красителях на флокуляцию серебряных золей и спектры флуоресценции. Было сделано предположение, что электростатическое взаимодействие между катионными красителями и наночастицами серебра приводит к образованию близко расположенных скоплений наночастиц. Катионные красители располагались в зазорах скоплений, что приводило к огромному усилению КР и значительному сдвигу длины волны испускания флуоресценции в красную область. Объемность аммонийной или амино групп в красителях не повлияла на флокуляцию серебряных золей из-за доминирующей роли электростатического взаимодействия.
В данной работе изучалась адсорбция катионных красителей, содержащих амино группы с разной степенью замещенностью и разной симметричностью расположения в молекулах красителей. Исследовались малахитовый зеленый изотиацианат с тремя симметрично расположенными азот-содержащими группами соответственно (=N+(CH3)2 и –N=C=S), метиловый фиолетовый – 2 группы =N+(CH3)2 и одна (=+NH–CH3), а также менее симметричные производные трифенилметана – бриллиантовый зеленый 2 группы =N+(CH3)2 на три ароматических кольца и производное акридина (акридиновый желтый G) с двумя незамещенными (–NH2) амино группами и азотом в ароматическом кольце. Исследования проводились в среде с меньшей чем в работе [16] ионной силой, при этом дополнительно исследовано с помощью видимой спектроскопии и спектроскопии ГКР влияние противоиона исходной соли красителя, а также поведение комплексов НЧ-краситель с течением времени (рис. 3).
Рис. 3.
Зависимость интенсивностей полос в ГКР-спектрах акридинового желтого (ν = 1370 см–1) (а), метилового фиолетового (ν = 1585 см–1) (б) и бриллиантового зеленого (ν = 1615 см–1) (в) от времени адсорбции в зависимости от противоиона. Устойчивость сигнала хлоридных солей адсорбированных красителей с течением времени (в днях выдержки) (г).
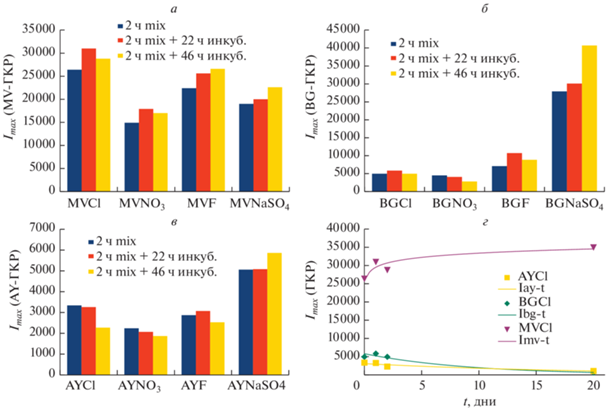
Можно заметить, что при одинаковом анионе наиболее сильная и стабильная адсорбция наблюдается у метилового фиолетового и малахитового зеленого изотиацианата, содержащего в своей структуре симметрично расположенные атомы азота, при этом интенсивность сигналов красителей не сильно зависит от противоиона. Более слабые сигналы наблюдаются либо у красителей с несимметричным расположением аминогрупп (бриллиантового зеленого и акридинового желтого). Из рис. 3 можно заметить, что максимумы ГКР-сигналов исследуемых красителей с различными анионами (кроме ${\text{N}}{{{\text{a}}}^{{\text{ + }}}}{\text{SO}}_{4}^{{2 - }}$) наблюдаются в основном после 2 ч перемешивания и 20 ч инкубации смесей. При этом особенно заметно влияние пары ${\text{N}}{{{\text{a}}}^{{\text{ + }}}}{\text{SO}}_{4}^{{2 - }}$ на ГКР-спектр этих красителей, что, по-видимому, связано со значительной степенью замещения этой ионной парой цитрат-аниона в двойном электрическом слое наночастицы. Как следствие, сульфат-анион оказывает значительное влияние на подвижность электронов проводимости в металлических нано-частицах и на изменение диэлектрической постоянной двойного электрического слоя наночастиц. Согласно выводам в обзоре Paul Mulvaney [17] подобный эффект будет наиболее выражен в случае очень мелких нано-кристаллов, где отношение величины двойного слоя к объемному заряду наиболее существенно.
Зависимость ГКР-сигнала от pH стокового раствора красителя изучалась на примере гидро-оксалатной соли бриллиантового зеленого (BGHOx, где Ox2– = ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$). Изменение pH производилось путем полного или частичного замещения (нейтрализации) аниона HOx– 200 мкМ раствора BGHOx равным объемами 100 или 200 мкМ растворами HCl и NaOH. Для корректного сравнения с нейтральному 200 мкМ раствору BGHOx добавлялся равный объем 200 мкМ раствора NaCl. Адсорбция полученных солей на AgNP-HA-Citr производилась путем перемешивания в течение 2 ч вышеуказанных растворов с раствором AgNP-HA-Citr в соотношении 1 : 999, без дополнительной инкубации. Оказалось, что в нейтральной среде наблюдается наименьший ГКР-сигнал полосы при ν = 1615 см–1 красителя (IBG-нейтр ~ 2500), в то время как в более кислой и более щелочной средах интенсивность ГКР-спектра почти в три раза выше (IBG-кисл ~ IBG-щел ~ ~ 7000). Такое заметное падение интенсивности КР в нейтральной среде связано со слабой способностью Н-оксалат аниона менять диэлектрические свойства цитратного слоя наночастиц.
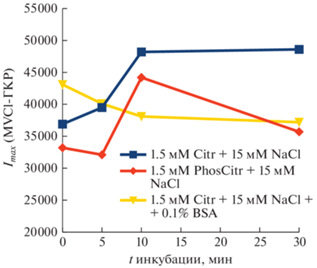
Для дальнейшего использования полученных комплексов (адсорбатов) в аналитических и диагностических целях изучалось поведение наиболее устойчивого из них, а именно AgNP-HA-Citr:MV в различных средах. Из рис. 3 видно, что даже в течение 3 недель интенсивность ГКР-спектра адсорбированного красителя в этом комплексе не падала, а даже, наоборот, выросла на ~10%. Интенсивность сигнала красителя с течением времени измерялась в трех средах: в растворе 1.5 мМ цитрата натрия + 15 мМ NaCl с pH ~ 8.2 (1); в растворе 1,5 мМ цитратно-фосфатного буфера + + 15 мМ NaCl с pH ~ 7.6 (2); и в растворе (1), содержащего дополнительно 0.1% BSA (3).
На рис. 4 приведена зависимость интенсивности полосы метилового фиолетового (ν = 1585 см–1) от времени во всех трех системах. Можно заметить, что в среде смеси цитрата и хлорида наблюдается определенный рост сигнала до насыщения, связанный, по-видимому, с дополнительным образованием флокулянтов наночастиц. При внесении в систему фосфат-аниона наблюдается хаотическое изменение сигнала. В присутствии белка (BSA) наблюдается устойчивое падение сигнала с выходом на плато. Такой характер возможно связан с частичным замещением на серебряных наночастицах цитратного слоя с адсорбированным красителем отрицательно заряженной при pH ~ 8.2 молекулы BSA (изоэлектрическая точка BSA находится в диапазоне pH 4.5–4.8) с образованием белковой короны [18].
Рис. 4.
Зависимость интенсивности пика (при ν = = 1585 см–1) в ГКР-спектре метилового фиолетового адсорбированного на AgNP-HA-Citr от времени в трех средах. 1.5 мМ три натрия цитрат + 15 мМ NaCl (синяя линия), 1.5 мМ фосфатно-цитратный буфер (pH ~ 7.6) + 15 мМ NaCl (красная линия), 1.5 мМ три натрия цитрат + 15 мМ NaCl (линия) + 0.1% BSA (желтая линия).
ЗАКЛЮЧЕНИЕ
Результаты экспериментов по адсорбции катионных красителей с различными анионами на цитрат-стабилизированные наночастицы с развитой поверхностью показали, что при сильном взаимодействии катиона красителя (метилового фиолетового и малахитового зеленого изотиацианата) с поверхностью наночастицы влияние природы противоиона на скорость адсорбции, образования флокулятов наночастиц и, соответственно, на ГКР-сигнал красителя незначительно. Для катионов красителей бриллиантового зеленого и акридинового желтого, слабо взаимодействующих с двойным электрическим слоем наночастицы способность противоиона воздействовать на свойства поверхности наночастиц начинает играть заметную роль, что проявляется в сильной вариации усилений сигналов ГКР красителей в зависимости от аниона.
Было отмечено, что при увеличении ионной силы с помощью цитрата и хлорида натрия может быть достигнута точка максимального сигнала ГКР для данной системы за счет максимального образования флокулятов серебряных наночастиц. Внесение же новых анионов в систему приводит к нарушению комплексов краситель–частица и, следовательно, хаотическому изменению сигнала. Присутствие в системе отрицательного заряженного высокомолекулярного соединения, способного к взаимодействию с поверхностью серебряных наночастиц приводит к постепенному понижению сигнала ГКР красителя.
Исследование выполнено при поддержке Российского научного фонда (проект № 19-72-30003).
Список литературы
Fleischmann M., Hendra P.J., McQuillan A.J. // Chem. Phys. Lett. 1974. V. 26. No. 2. P. 163.
Otto A., Mrozek I., Grabhorn H., Akemann W. // J. Phys. Cond. Matter. 1992. V. 4. P. 1143.
Kukushkin V.I., Van’kov A.B., Kukushkin I.V. // JETP Lett. 2013. V. 98. P. 64.
Moskovits M. // Rev. Mod. Phys. 1985. V. 57. P. 783.
Le Ru E.C., Etchegoin P.G. Principles of surface-enhanced Raman spectroscopy. New York: Elsevier, 2009.
Cialla D., Polloka S., Steinbrücker C., Weber K., Popp J. // Nanophotonics. 2014. V. 3. No. 6. P. 383.
Moisoiu V., Iancu S.D., Stefancu A. et al. // Coll. Surf. B. 2021. V. 208. Art. No. 112064.
Ambartsumyan O., Gribanyov D., Kukushkin V. et al. // Int. J. Mol. Sci. 2020. V. 21. No. 9. P. 3373.
Hildebrandt P., Stockburger M. // J. Phys. Chem. 1984. V. 88. P. 5935.
Doering W.E., Nie S. // J. Phys. Chem. B. 2002. V. 106. P. 311.
Leopold N., Lendl B. // J. Phys. Chem. B. 2003. V. 107. No. 24. P. 5723.
Langxing Chen, Wenfeng Zhao, Yufen Jiao et al. // Spectrochim. Acta A. 2007. V. 68. No. 3. P. 484.
Canamares M.V., Garcia-Ramos J.V., Sanchez-Cortes S. et al. // J. Colloid. Interface. Sci. 2008. V. 326. P. 103.
Krutyakov Yu.A., Kudrinskiy A.A., Olenin A.Yu., Lisichkin G.V. // Russ. Chem. Rev. 2008. V. 77. P. 233.
Futamata M., Yu Y., Yanatori T., Kokubun T.J. // Phys. Chem. C. 2010. V. 114. P. 7502.
Futamata M., Yu Y., Yajima T. // J. Phys. Chem. C. 2011. V. 115. P. 5271.
Mulvaney P. // Langmuir. 1996. V. 12. No. 3. P. 788.
Banerjee V., Das K.P. // Coll. Surf. B. 2013. V. 111. P. 71.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая