Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 1, стр. 62-70
ВЛИЯНИЕ АГОНИСТА TAAR5 α-NETA НА ПОВЕДЕНИЕ МЫШЕЙ ЛИНИИ C57BL/6
Е. П. Виноградова 1, *, Н. В. Полякова 1, Л. Н. Станкевич 1, А. А. Александров 1
1 Кафедра высшей нервной деятельности и психофизиологии Санкт-Петербургского государственного университета
Санкт-Петербург, Россия
* E-mail: katvinog@yahoo.com
Поступила в редакцию 25.02.2019
После доработки 26.04.2019
Принята к публикации 03.06.2019
Аннотация
Системное введение агониста TAAR5 (Trace amine-associated receptor 5) α-NETA (2-(alpha-naph-thoyl)ethyltrimethylammonium iodide) в дозе 10 мг/кг приводит к существенному увеличению уровня тревожности, а также к увеличению длительности груминга через полчаса после введения препарата при сравнении с контрольными животными препарата. Двигательная и исследовательская активности существенно снижаются. Через 48 ч двигательная активность и исследовательское поведение возвращаются к норме, уровень тревожности остается несколько повышенным. Введение агониста не оказывало влияния на социальное предпочтение в тесте “свой–чужой”.
ВВЕДЕНИЕ
Следовые амины, такие как β-фенилэтиламин, тирамин, триптамин и октопамин, относятся к эндогенным аминам, и структурно, и метаболически близки к классическим моноаминам [Lindemann, Hoener, 2005]. Однако, по сравнению с классическими моноаминами, они присутствуют в следовых концентрациях и гетерогенно распределены по всему мозгу [Berry et al., 2017; Rutigliano et al., 2018].
Известно, что следовые амины имеют очевидный нейрологический эффект и могут рассматриваться как нейромодуляторы, а возможно, и как настоящие нейромедиаторы [Borowsky et al., 2001]. Предполагается, что следовые амины вовлечены в формирование широкого спектра психических заболеваний человека, таких как шизофрения, депрессия и др. Известно также, что следовые амины проявляют некоторые амфетаминоподобные свойства за счет ингибирования переносчика дофамина [Berry, 2004]. В связи с этим в последнее время большое внимание уделяется изучению TAARs (trace amine associated receptor) рецепторов следовых аминов (TAAR1 – TAAR9). Рецепторы следовых аминов (TAARs), относящиеся к классу G-белковых рецепторов, идентифицированы как у человека (6 подтипов), так и у других позвоночных и беспозвоночных [Berry, 2017]. Биохимические и физиологические характеристики TAARs описаны в нескольких обзорах [Lindemann, Hoener, 2005; Grandy, 2007; Liberles, 2015; Berry et al., 2017].
Наиболее подробно исследована функциональная роль TAAR1 [Espinoza et al., 2018]. В настоящее время принято считать, что в ЦНС TAAR1 модулируют функции дофаминергической, глутаматергической и серотонинергической систем и их рассматривают в качестве новой терапевтической мишени лечения шизофрении, депрессии и наркотических зависимостей [Gainetdinov et al., 2018]. Это связано с тем, что TAAR1 локализованы в тех отделах ЦНС, нарушение функций которых принято связывать с формированием психических расстройств: вентральная тегментальная область, дорзальное ядро шва [John et al., 2017].
В то же время влияние TAAR5 на функции ЦНС и поведение изучено крайне мало [Gainetdinov et al., 2018; Aleksandrov et al., 2018 a, b].
Целью работы было исследование препарата α-NETA, являющегося агонистом TAAR5, на тревожность, двигательную и исследовательскую активность, а также социальное поведение.
МЕТОДИКА
Объект исследования. В исследовании использовали самцов мышей линий C57BL/6. Все опыты учитывали международные нормы по проведению медико-биологических исследований с использованием животных [European Convention for the Protection of Vertebrate Animals Used for Experimentation and other Scientific Purposes, 1986.]. Протокол эксперимента одобрен Этическим комитетом биологического факультета СПбГУ (номер 131-03-4, 14 марта, 2016). Животные были получены из вивария Института трансляционной биомедицины СПбГУ в возрасте от 2 до 3 мес. Средняя масса животных составляла 28.1 ± 0.9 г. Животных содержали в стандартных условиях при свободном доступе к пище и воде. В каждую клетку помещали самцов только из одного помета от 2 до 5 особей. До начала проведения всех манипуляций животные находились в лаборатории 7–10 дней. Перед началом опытов животных подвергали процедуре хэндлинга с тем, чтобы предотвратить возникновение стрессорной реакции на взятие в руки во время проведения эксперимента.
Аппаратура и методы. Приподнятый крестообразный лабиринт (ПКЛ) (OpenScience, Russia) – классический тест на тревожность. В настоящее время данный тест широко используется в исследованиях, посвященных изучению тревожности и тестированию анксиолитических препаратов: согласно проведенному анализу опубликованных научных работ за период с 1990 по 2011 г., тест ПКЛ использовался примерно в 50% подобных исследований [Haller et al., 2013]. Регистрировали время пребывания в открытых рукавах ПКЛ, пройденную дистанцию за время теста, число вертикальных стоек и свешиваний с открытых рукавов лабиринта, а также длительность реакций груминга. Увеличение времени пребывания в открытых рукавах свидетельствует об уменьшении уровня тревожности [Pellow et al., 1985].
Приподнятый круговой лабиринт (Open Science, Russia). Приподнятый круговой лабиринт является модификацией приподнятого крестообразного лабиринта, его преимуществом является отсутствие центральной области, которая есть в ПКЛ [Tucker, McCabe, 2017], поскольку не существует однозначной трактовки, относится ли время пребывания в центре к нахождению в открытых или закрытых рукавах. Приподнятый круговой лабиринт состоит из двух открытых и двух закрытых отсеков, которые образуют круг. Приподнятый круговой лабиринт использовали через два дня после тестирования животных в приподнятом крестообразном лабиринте для выявления отдаленных последствий введения препаратов, поскольку предшествующее тестирование в ПКЛ может оказывать влияние на результаты тестов через 2 дня [Tucker, McCabe, 2017]. В этом тесте регистрировали все те же параметры, что и в тесте ПКЛ.
Трехкамерная установка для выявления социального предпочтения [Jamain et al., 2008], представляет собой камеру размером 66 × 40 × 40 см, разделенную на три отсека (22 × 40 см) прозрачными перегородками с дверцами (5 × 5 см) для свободного перемещения. Она изготовлена из красного оргстекла с целью предотвращения визуального контакта животного с окружающей средой. В двух крайних отсеках камеры помещали клетки для резидентов 5 × 10 см; в одну клетку помещали мышь из той же клетки, что и тестируемое животное, а в другую – мышь из чужой клетки. Ширина участка, прилегающего к клеткам с резидентами, составляла 10 см2. Тестируемую мышь помещали в центральный отсек камеры. В качестве критерия предпочтения оценивали время, которое животные проводили на разных участках: рядом со “своим”, рядом с “чужим” или на нейтральной территории. Также оценивали общую пройденную дистанцию за все время тестирования. В данной работе был выбран один из наиболее широко распространенных тестов, который оценивает “предпочтение социальной новизны” [Crawley et al., 2004; Moy et al., 2004]. Основной характеристикой данного теста является предотвращение прямых агонистических взаимодействий при сохранности сенсорного взаимодействия. Нарушения в реализации социальных взаимодействий рассматриваются как один из признаков многих психических расстройств. В частности, расстройства аутистического спектра и шизофрения характеризуются выраженным дефицитом социального поведения [Couture et al., 2010], также нарушения социальных отношений приводят к повышенному риску развития депрессии [Zisook et al., 1991]. В норме у мышей в данном тесте регистрируют более длительное время нахождения рядом с ранее незнакомым животным по сравнению со знакомым [Moy et al., 2004], в то время как при разного рода патологиях может наблюдаться исчезновение предпочтения социальной новизны [Silverman et al., 2010; Moy et al., 2004].
Во всех трех тестах длительность эксперимента для каждого животного составляла пять минут. После тестирования каждого животного поверхность установки протирали спиртом для уничтожения запаха. Исследование проводили в одно и то же время с 13:00 до 18:00. Велась видеозапись поведения животных на видеокамеру SONY DCR-HC17E PAL (Japan) и вебкамеру Logitech Webcam (Switzerland).
Использованные препараты. Агонист TAAR5 α-NETA: полное название α-NETA 2-(alpha-naphthoyl) ethyltrimethylammonium iodide; химическая формула C16H20INO, молекулярный вес 369.246 g/mol. Производство фирмы ABCAM (UK).
Схема эксперимента. Тестировали поведение мышей в ПКЛ в группе “опыт” (n = 20) через 30 мин после внутрибрюшинного введения агониста TAAR5 α-NETA, в дозе 10 мг/кг. Данная дозировка препарата выбрана на основании анализа предварительных экспериментов по изучению влияния α-NETA при регистрации вызванных потенциалов у мышей (неопубликованные данные). Животным группы “контроль” (n = 20) вводили физиологический раствор (0.9% NaCl) в том же объеме, что и препарат (от 0.13 до 0.2 мл, в соответствии с массой тела животного).
Тестирование в трехкамерной установке было через 24 ч после введения препарата, тестирование в приподнятом круговом лабиринте через 48 ч после введения агониста TAAR5.
Для статистической оценки использовали непараметрический критерий Манна–Уитни для независимых выборок и критерий Вилкоксона для зависимых выборок (SPSS 11.5). За уровень статистической значимости принято значение α < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
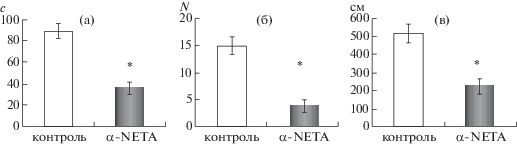
Через 30 мин после введения α-NETA в дозе 10 мг/кг в тесте ПКЛ были выявлены достоверные различия по всем показателям тревожности между животными группы “контроль” и “опыт” (р ≤ 0.0001). В целом уровень тревожности, оцениваемый по времени пребывания в открытых рукавах ПКЛ, числу свешиваний с открытых рукавов и пройденной в открытых рукавах дистанции у животных подопытной группы был существенно выше по сравнению с аналогичными данными у животных группы “контроль” (рис. 1). Время пребывания в открытых рукавах лабиринта составило 88.65 ± 6.96 с и 36.25 ± 5.81с, дистанция, пройденная в открытых рукавах, составляла 513.97 ± 49.19 см и 219.45 ± 44.67 см для животных групп “контроль” и “опыт” соответственно. Количество свешиваний составило 14.9 ± 1.67 и 3.7 ± 0.99. Уменьшение числа свешиваний у животных группы “опыт” по сравнению с животными группы “контроль” связано не только с увеличением уровня тревожности, но и с уменьшением времени пребывания в открытых рукавах (где, собственно, и реализуется такой тип реакции).
Рис. 1.
Изменения уровня тревожности у мышей C57BL/6 в ПКЛ через 30 мин после введения агониста TAAR5 в дозе 10 мг/кг. (а) – длительность пребывания в открытых рукавах лабиринта (с), (б) – число свешиваний, (в) – дистанция, пройденная в открытых рукавах (см). Здесь и далее по горизонтали – группы животных, светлые столбики – животные группы “контроль”, темные – группы “опыт”. * – р ≤ 0.0001.
Fig. 1. Anxiety in C57BL/6 mice in elevated plus-maze 30 min later TAAR5 agonist injection (in dose 10 mg/ kg). (а) – Mean time spent in open arms in elevated plus maze (s), (б) – number of edge, (в) – distance in open arms (cm). Empty bar – control group, filled bar – α-NETA, data shown as Mean ± S.E.M.* – р ≤ 0.0001.
Также статистически значимо (р ≤ 0.0001) отличались и показатели двигательной активности для всех исследованных параметров. Суммарная пройденная дистанция за все время тестирования в ПКЛ у животных группы “опыт” была почти в два раза меньше по сравнению с животными группы “контроль” 2052.6 ± 92.86 см и 1140.15 ± 139.92 см, (рис. 2 (а)). Еще более выраженное статистически значимое снижение локомоторной активности после введения α-NETA было выявлено при оценке длительности неподвижности – 5.8 ± ± 2.21с и 95.95 ± 17.38 с для животных групп “контроль” и “опыт” соответственно (рис. 2 (б)).
Рис. 2.
Изменения двигательной и исследовательской активности у мышей C57BL/6 в ПКЛ через 30 мин после введения агониста TAAR5 в дозе 10 мг/кг. (а) – общая пройденная дистанция (см), (б) – длительность неподвижности (с). (в) – число стоек, (г) – груминг (с). ** – р ≤ 0.0001, * – р ≤ 0.05.
Fig. 2. Locomotion and rearing in C57BL/6 mice in elevated plus-maze 30 min after TAAR5 agonist injection (in dose 10 mg/ kg). (а) – total distance (cm), (б) – duration of immobility (s). (в) – number of rearing, (г) – grooming (s) ** – р ≤ 0.0001, * – р ≤ 0.05.
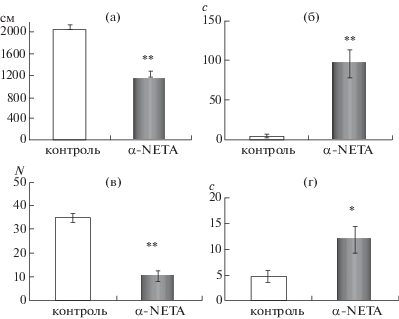
Исследовательская активность также существенно снижалась у мышей группы “опыт” – число стоек в закрытых рукавах приподнятого крестообразного лабиринта составило 34.7 ± ± 1.96 и 10.35 ± 2.38 (р ≤ 0.0001) для животных групп “контроль” и “опыт” соответственно (рис. 2 (в)).
Длительность реакции груминга (рис. 2 (г)) была статистически значимо выше (р = 0.043) у животных группы “опыт” (4.75 ± 1.22 с и 11.8 ± 2.66 с для животных групп контроль и “опыт” соответственно).
Поскольку сразу после введения α-NETA в дозе 10 мг/кг наблюдаются двигательные нарушения в форме дискинезии [Aleksandrov et al., 2019], которые продолжаются в течение 2–4 ч, это могло сказаться на измеряемых показателях поведения.
Дискинезия проявлялась в виде тонических спазмов длительностью 1–10 с, как в покое, так и во время движения животного. Проявления дискинезии исчезают через три часа после введения препарата. За время тестирования регистрировали от 1 до 6 спазмов. Тонические спазмы проявлялись в виде искривления тела в поясничном отделе либо прогибания спины в позе гиперлордоза.
В связи с тем, что изменение времени пребывания в открытых рукавах лабиринта могло быть связано не только с изменением уровня тревожности, но и следствием развития дискинезии, предпринималось повторное тестирование через 48 ч в тесте приподнятый круговой лабиринт.
В этом тесте такие параметры поведения, как пройденная дистанция, длительность неподвижности, число вертикальных стоек, длительность груминга не отличались у животных в группах “опыт” и “контроль”. Также у животных группы “опыт” полностью исчезли все проявления дискинезии.
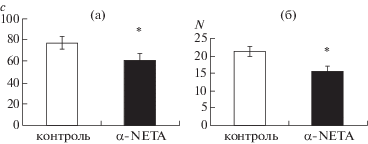
Однако, несмотря на полное восстановление моторной функции через двое суток после инъекций сохранились различия по уровню тревожности. Получены статистически значимые различия по времени пребывания в открытых рукавах (р = 0.035) и числу свешиваний (р = 0.008) между животными в группах “опыт”–“контроль” (рис. 3). Следует отметить, что по этим параметрам различия между животными групп “опыт” и “контроль” были менее выражены, чем через 30 мин после введения препарата: длительность пребывания в открытых рукавах приподнятого кругового лабиринта у животных подопытной группы через двое суток была на 20% ниже, чем у контрольных животных, число свешиваний снижено на 27.4%.
Рис 3.
Изменение уровня тревожности мышей в приподнятом круговом лабиринте через 48 ч после введения агониста TAAR5 в дозе 10 мг/кг. (а) – длительность пребывания в открытых рукавах лабиринта (с), (б) – число свешиваний. По горизонтали – группы животных. Светлые столбики – животные группы “контроль”, темные – группы “опыт”. * – р ≤ 0.01.
Fig. 3. Anxiety in C57BL/6 mice in elevated plus-maze 48 hours after TAAR5 agonist injection (in dose 10 mg/ kg). (а) – Mean time spent in open arms in elevated plus maze (s), (б) – number of edge. Empty bar – control group, filled bar – α-NETA, data shown as Mean ± S.E.M.* – р ≤ 0.01.
Все остальные параметры поведения (пройденная дистанция, длительность неподвижности, число вертикальных стоек, длительность груминга) не отличались у животных в группах “опыт” и “контроль”. В тесте на социальное предпочтение не было обнаружено влияние введения препарата на предпочтение “свой–чужой” в трехкамерной установке. Временная структура пребывания в различных отсеках камеры была сходной в обеих группах. Животные и подопытной, и контрольной группы проводили статистически значимо меньше времени (р = 0.002) в отсеке рядом со “своим”, чем в отсеке рядом с “чужим”, и на нейтральной территории у животных группы “контроль” и группы “опыт” (рис. 4).
Рис. 4.
Влияние введения агониста TAAR5 в дозе 10 мг/кг на социальное предпочтение у самцов мышей линий C57BL/6. Светлые столбики –длительность пребывания со “своим”, черные столбики – длительность пребывания с “чужим”, серые столбики – длительность пребывания на нейтральной территории. По вертикали – время пребывания в разных отсеках камеры (в секундах).
Fig. 4. Social interaction in C57BL/6 mice 24 hours after TAAR5 agonist injection (in dose 10 mg/ kg). Ordinate – time (s). Empty bar – mean time spent next to familiar conspecific; black bar – mean time spent next to unfamiliar conspecific; gray hatched bar – mean time spent in the neutral area. Data are shown as Mean ± S.E.M.
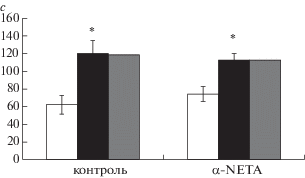
Животные обеих групп продемонстрировали “предпочтение социальной новизны”, которое характеризуется большим по длительности временем нахождения рядом с ранее незнакомым животным по сравнению со знакомым [Moy et al., 2004]. Такое соотношение времени пребывания рядом со знакомым и незнакомым конспецификом является типичным именно для мышей и демонстрирует сохранность социальной памяти и склонность к получению новой информации [Kaidanovich-Beilin et al., 2011].
Также в этом тесте оценивалась общая локомоторная активность животных. Пройденная дистанция у животных группы “опыт” через 24 ч после введения α-NETA в дозе 10 мг/кг не отличалась у мышей в группах “опыт” и “контроль” и составила 1550 ± 65 см и 1496 ± ± 71 см за 5 мин тестирования (для животных группы “контроль” и “опыт” соответственно). Это совпадает со снижением эффекта нарушений движений, выявленного сразу после препарата.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, в поведенческих тестах было впервые показано, что через 30 мин после системного введения α-NETA в дозе 10 мг/кг агонист TAAR5 оказывает существенное влияние на все параметры поведения, регистрируемые в тесте приподнятый крестообразный лабиринт. Эти различия могут быть опосредованы прямым действием α-NETA на рецепторы TAAR5 в тех отделах ЦНС, которые регулируют уровень тревожности и моторную функцию. Изменения моторной функции могут проявляться в локомоции и дискинезии. То есть дискинезия появляется вследствие воздействия препарата на отделы ЦНС, которые принимают участие в регуляции моторной функции.
Уровень тревожности и длительность груминга резко возрастают, двигательная и исследовательская активность существенно снижается. При этом торможение двигательной активности выявляется через 30 мин после введения, а через 24 час локомоция у мышей группы “опыт” и группы “контроль” не различаются, в то время как уровень тревожности оказывается повышенным и через 48 час после введения. Это заставляет предположить, что одним из важных факторов, опосредующих снижение двигательной активности, является дискинезия.
Не только повышенный, но и пониженный уровень тревожности снижает адаптивные возможности особи в естественных условиях. Однако повышенный уровень тревоги, тревожные расстройства, наряду с депрессиями, являются одними из наиболее распространенных в клинике психических заболеваний. По своей природе нейрохимические механизмы регуляции тревожности гетерогенны. Наиболее распространенные препараты при лечении тревожных расстройств модулируют функции ГАМК-ергической системы [Cloos, Ferreira, 2009; Ravindran, Stein, 2010]. Однако показано, что в регуляции тревожности принимают участие и серотонинергическая, норадренергическая, холинергическая, дофаминергическая и глутаматергическая системы [Belzung, Le Раре, 1994; Tanaka et al., 2000; Yoo et al., 2004; Salgado-Pineda et al., 2005; Berry et al., 2019].
Экспрессия TAAR5 выявлена в нескольких областях головного мозга. Наиболее широко TAAR5 представлены в обонятельной системе [Li et al., 2015; Wallrabenstein et al., 2013; Zhang et al., 2013]. Кроме того, они были найдены в аркуатном ядре, а также в миндалине и вентромедиальном гипоталамусе, где их локализация перекрывается с локализацией TAAR1 [Dinter et al., 2015; Li et al., 2013; Wallrabenstein et al., 2013; Zhang et al., 2013].
Миндалина рассматривается как один из центральных отделов ЦНС, участвующих в формировании состояния страха и модуляции уровня тревожности [Павлова, Рысакова, 2018; Forster et al., 2012; Babaev et al., 2018]. Известно, что ее стимуляция вызывает увеличение тревожности у грызунов [Adamec, Morgan, 1994; Helfer et al., 1996; Hannesson et al., 2008; Chen et al., 2016]. У пациентов с конверсионными заболеваниями (т.е. с расстройствами, сопровождающимися утратой способности осознанно контролировать свои ощущения, моторные функции и память) выявлена повышенная активность миндалины при одновременной активации моторной и эмоциональной сферы [Hassa et al., 2017]. В настоящее время при лечении тревожных расстройств у человека для многих анксиолитических (ГАМКергических) препаратов основной мишенью оказывается миндалина, однако детальные механизмы воздействия остаются до конца не выясненными [Forster et al., 2012].
Модуляция уровня тревожности может быть связана и с изменением активности обонятельной системы, поскольку предполагают, что TAAR5 играют существенную роль в восприятии запахов у мышей [Liberles, Buck, 2006], включая социально значимые запахи [Liberles, Buck, 2006; Li et al., 2013]. Возможно, что более длительный эффект влияния введения α-NETA на уровень тревожности по сравнению с влиянием на двигательную активность связан с комплексным изменением функционирования как миндалины, так и обонятельной системы.
Как показало данное исследование, введение агониста рецепторов TAAR5 приводит к увеличению уровня тревожности, которое сохраняется до 2 сут, и краткосрочному снижению двигательной активности у мышей. Можно предположить, что эти изменения обусловлены прямым влиянием α-NETA на рецепторы следовых аминов (TAAR5), идентифицированных как в миндалине, так и в обонятельной системе.
ВЫВОДЫ
1. Системное введение агониста TAAR5 – α-NETA (2-(alpha-naph-thoyl)ethyltrimethylammonium iodide) в дозе 10 мг/кг через 30 мин после введения препарата приводит к существенному увеличению уровня тревожности и длительности груминга по сравнению с контрольными животными.
2. Системное введение агониста TAAR5 α-NETA в дозе 10 мг/кг через 30 мин после введения препарата вызывает резкое снижение двигательной и исследовательской активности.
3. Через 48 ч после введения агониста TAAR5 α-NETA в дозе 10 мг/кг двигательная активность и исследовательское поведение возвращаются к норме, уровень тревожности остается несколько повышенным.
4. Введение агониста TAAR5 α-NETA не оказывало влияния на социальное предпочтение в тесте “свой–чужой”.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 17-04-00082. The reported study was funded by RFBR, project number 17-04-00082.
Список литературы
Павлова И.В., Рысакова М.П. Роль бета1,2-адренорецепторов миндалины в поведении крыс с разным уровнем замирания при условно-рефлекторном страхе. Журн. высш. нервн. деят. им. И.П. Павлова 2018. 68 (1): 76–91.
Adamec R.E., Morgan H.D. The effect of kindling of different nuclei in the left and right amygdala on anxiety in the rat. Physiol. Behav. 1994. 55: 1–12.
Aleksandrov A.A., Dmitrieva E.S., Volnova A.B., Knyazeva V.M., Gerasimov A.S., Gainetdinov R.R. TAAR5 receptor agonist affects sensory gating in rats. Neurosci. Lett. 2018a. 666: 144–147.
Aleksandrov A.A., Knyazeva V.M., Volnova A.B., Dmitrieva E.S., Korenkova O, Espinoza S., Gerasimov A., Gainetdinov R.R. Identification of TAAR5 agonist activity of alpha-NETA and its effect on mismatch negativity amplitude in awake rats. Neurotox. Res. Res. 2018b. 34 (3): 442–451.
Aleksandrov A.A., Polyakova N.V., Vinogradova E.P., Gainetdinov R.R., Knyazeva V.M. The TAAR5 agonist α-NETA causes dyskinesia in mice. Neurosci.Let. 2019. 704: 208–211. https://doi.org/10.1016/j.neulet.2019.04.028
Babaev O., Piletti C. C., Krueger-Burg D. Inhibition in the amygdala anxiety circuitry. Exp. Mol. Med. 2018. 50 (4): 18. https://doi.org/10.1038/s12276-018-0063-8
Belzung C., Le Pape G. Comparison of different behavioral test situations used in psychopharmacology for measurement of anxiety. Physiol. Behav.1994. 56: 623–628.
Berry M.D. Mammalian central nervous system trace amines. Pharmacologic amphetamines, physiologic neuromodulators. J. Neurochem. 2004. 90: 257–271.
Berry M.D., Gainetdinov R.R., Hoener M.C., Shahid M. Pharmacology of human trace amine-associated receptors: therapeutic opportunities and challenges. Pharmacol. Ther. 2017. 180: 161–180.
Berry A.S., White R.L., Furman D.J., Naskolnakorn J.R., Shah V.D., D’Esposito M., Jagust W.J. Dopaminergic mechanisms underlying normal variation in trait anxiety. J Neurosci. 2019. pii: 2382-18. https://doi.org/10.1523/JNEUROSCI.2382-18.2019
Borowsky B., Adham N., Jones K.A., Raddatz R., Artymyshyn R., Ogozalek K.L., Durkin M.M., Lakhlani P.P., Bonini J.A., Pathirana S., Boyle N., Pu X., Kouranova E., Lichtblau H., Ochoa F.Y., Branchek T.A., Gerald C. Trace amines: identification of a family of mammalian G protein-coupled receptors. Proc. Natl. Acad. Sci. USA. 2001. 98: 8966–8971.
Chen S.D., Wang Y.L., Liang S.F., Shaw F.Z. Rapid Amygdala Kindling Causes Motor Seizure and Comorbidity of Anxiety- and Depression-Like Behaviors in Rats. Frontiers in Behav. Neurosci. 2016. https://doi.org/10.3389/fnbeh.2016.00129
Cloos J.-M., Ferreira V. Current Use of Benzodiazepines in Anxiety Disorders. Curr. Opin. Psychiatry. 2009. 22: 90–95.
Couture S.M., Penn D.L., Losh M., Adolphs R., Hurle R., Piven J. Comparison of social cognitive functioning in schizophrenia and highfunctioning autism: more convergence than divergence. Psycholog. medic. 2010. 40 (4): 569–579.
Crawley J.N. Designing mouse behavioral tasks relevant to autistic-like behaviors. Mental retardation and developmental disabilities research rev. 2004. 10 (4): 248–258.
Dinter J., Mühlhaus J., Wienchol C.L., Yi C.X., Nürnberg D., Morin S., Grüters A., Köhrle J., Schöneberg T., Tschöp M., Krude H., Kleinau G. Biebermann H. Inverse agonistic action of 3-iodothyronamine at the human trace amine-associated receptor 5. PLoS One 2015.10:e0117774.
Espinoza S., Leo D., Sotnikova, T.D., Shahid M., Kääriäinen T.M., Gainetdinov R.R. Biochemical and Functional Characterization of the Trace Amine-Associated Receptor 1 (TAAR1) Agonist RO5263397 Front Pharmacol. 2018. 9: 645. https://doi.org/10.3389/fphar.2018.00645
European Convention for the Protection of Vertebrate Animals Used for Experimentation and other Scientific Purposes, 1986. Experientia. 51: 1–5. 1995.
Gainetdinov R.R., Hoener M. C., Berry M. D. Trace Amines and Their Receptors Pharmacol. Rev. 2018. 70: 549–620.
Grandy D.K. Trace amine-associated receptor 1-Family archetype or iconoclast? Pharmacol. Ther. 2007. 116: 355–390.
Forster G.L., Novick A.M., Scholl J.L., Watt M.J. The Role of the Amygdala in Anxiety Disorders 2012. doi.org/.https://doi.org/10.5772/50323
Jamain S., Radyushkin K., Hammerschmidt K., Granon S., Boretius S., Varoqueaux F., Ramanantsoa N., Gallego J., Ronnenberg A., Winter D., Frahm J., Fischer J., Bourgeron T., Ehrenreich H., Brose N. Reduced social interaction and ultrasonic communication in a mouse model of monogenic heritable autism. Proc. Natl Acad. Sci. USA. 2008. 105: 1710–1715.
John J., Kukshal P., Bhatia T., Chowdari K.V., Nimgaonkar V.L., Deshpande S.N., Thelma B.K. Possible role of rare variants in Trace amine associated receptor 1 in schizophrenia. Schizophr. Res. 2017. 189 (1–3):190–195.
Haller J., Aliczki M., Gyimesine Pelczer K. Classical and novel approaches to the preclinical testing of anxiolytics: A critical evaluation. Neurosci. Biobehav. Rev. 2013. 37 (10 Pt 1): 2318–2330.
Hannesson D.K., Pollock M.S., Howland J.G., Mohapel P., Wallace A.E., Corcoran M.E. Amygdaloid kindling is anxiogenic but fails to alter object recognition or spatial working memory in rats. Epilepsy Behav. 2008. 13: 52–61.
Hassa T., Sebastianc A., Liepertb J., Weillerd C., Schmidte R., Tüscherc O. Symptom-specific amygdala hyperactivity modulates motor control network NeuroImage: Clinical 2017. 15: 143–150.
Helfer V., Deransart C., Marescaux C., Depaulis A. Amygdala kindling in the rat: anxiogenic-like consequences. Neurosci. 1996. 73: 971–978.
Kaidanovich-Beilin O., Lipina T., Vukobradovic I., Roder J., Woodgett J. R. Assessment of Social Interaction Behaviors. J. Vis. Exp. 2011. (48), e2473, https://doi.org/10.3791/2473
Li Q., Tachie-Baffour Y., Liu Z., Baldwin M.W., Kruse A.C., Liberles S.D. Nonclassical amine recognition evolved in a large clade of olfactory receptors. eLife 2015. 4: e10441
Li Q., Korzan W.J., Ferrero D.M., Chang R.B., Roy D.S., Buchi M., Lemon J.K., Kaur A.W., Stowers L., Fendt M., Liberles S.D. Synchronous evolution of an odor biosynthesis pathway and behavioral response. Curr Biol. 2013. 23 (1): 11–20.
Liberles S.D., Buck L.B. A second class of chemosensory receptors in the olfactory epithelium. Nature 2006. 442: 645–650.
Liberles S.D. Trace amine-associated receptors: ligands, neural circuits, and behaviors. Curr. Opin. Neurobiol. 2015. 34: 1–7.
Lindemann L., Hoener M.C. A renaissance in trace amines inspired by a novel GPCR family. Trends Pharmacol. Sci. 2005. 26: 274–281.
Moy S.S., Nadler J.J., Perez A., Barbaro R.P., Johns J.M., Magnuson T.R., Piven J., Crawley J.N. Sociability and preference for socialnovelty in five inbred strains: an approach to assess autistic-like behavior in mice. Genes, brain, and behave. 2004. 3 (5): 287–302.
Pellow S., Chopin P., File S., Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. Neurosci. Methods. 1985. 14: 149–167.
Rutigliano G., Accorroni A. Zucchi R. The case for TAAR1 as a modulator of central nervous system function. Frontiers in Pharmacol. 2018. 8: article 987. https://doi.org/10.3389/fphar.2017.00987
Ravindran L.N., Stein M.B. The Pharmacologic Treatment of Anxiety Disorders: A Review of Progress. J Clin Psychiatry. 2010. 71: 839–854.
Salgado-Pineda P., Delaveau P., Blin O., Nieoullon A. Dopaminergic contribution to the regulation of emotional perception. Clin Neuropharmacol. 2005. 28 (5): 228–237.
Silverman J.L., Yang M., Lord C., Crawley J.N. Behavioural phenotyping assays for mouse models of autism. Nat. Rev. Neurosci. 2010. 11:490–502.
Tanaka M., Yoshida M., Emoto H., Ishii H. Noradrenaline systems in the hypothalamus, amygdala and locus coeruleus are involved in the provocation of anxiety: basic studies. Eur J Pharmacol. 2000. 405 (1–3): 397–406.
Tucker L.B., McCabe J.T. Behavior of Male and Female C57BL/6J Mice Is More Consistent with Repeated Trials in the Elevated Zero Maze than in the Elevated Plus Maze. Front. Behavioral Neuroscie. 2017. 11, Article 13 https://doi.org/10.3389/fnbeh.2017.00013
Wallrabenstein I., Kuklan J., Weber L., Zborala S., Werner M., Altmüller J., Becker C., Schmidt A., Hatt H., Hummel T., Gisselmann G. Human trace amine-associated receptorTAAR5 can be activated by trimethylamine. PLoS One 2013.8:e54950.
Yoo J.H., Lee S.Y., Loh H.H., Ho I.K., Jang C.G. Altered emotional behaviors and the expression of 5-HT1A and Ml muscarinic receptors in micro-opioid receptor knockout mice. Synapse. 2004. 54 (2): 72–82.
Zhang J., Pacifico R., Cawley D., Feinstein P., Bozza T. Ultrasensitive detection of amines by a trace amine-associated receptor. J Neurosci. 2013. 33: 3228–3239.
Zisook S., Shuchter S.R. Depression through the first year after the death of a spouse. The Am. J. of psychiatry.1991. 148 (10): 1346–1352.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


