Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 3, стр. 375-382
СРАВНЕНИЕ ТРЕХЧАСТНОЙ ОРГАНИЗАЦИИ СИНАПТИЧЕСКИХ ОКОНЧАНИЙ В ИНТРАОКУЛЯРНЫХ СЕПТАЛЬНЫХ ТРАНСПЛАНТАТАХ И В СЕПТАЛЬНОЙ ОБЛАСТИ МОЗГА
З. Н. Журавлева *
Лаборатория системной организации нейронов, Федеральное государственное бюджетное учреждение науки Институт теоретической и экспериментальной биофизики РАН
г. Пущино, Московской обл., Россия
* E-mail: zhuravleva@iteb.ru
Поступила в редакцию 12.09.2019
После доработки 07.12.2019
Принята к публикации 16.12.2019
Аннотация
Септальная область мозга функционально связана с другими лимбическими структурами и участвует в когнитивных процессах. В качестве экспериментальной модели для изучения эндогенных морфофункциональных свойств септума были использованы интраокулярные нейротрансплантаты. Целью настоящей работы было сравнение строения синаптических контактов в септальных интраокулярных нейротрансплантатах и в септальной области мозга in situ. Синапсы рассматривались как трехчастные комплексы, в состав которых входили не только пре- и постсинаптические компоненты, но и окружающие их отростки астроцитов. Ультраструктурное исследование показало, что, несмотря на отсутствие нормальных афферентных и эфферентных связей в интраокулярных нейротрансплантатах, синапсы воспроизводили трехчастную организацию. При морфометрическом анализе их параметров были обнаружены уменьшенные среднестатистические размеры площади и периметра пресинаптических компартментов по сравнению с нормой. В то же время степень их окружения перисинаптическими отростками астроцитов в трансплантатах была, наоборот, достоверно выше, чем в септуме in situ. Средняя протяженность активных зон в синаптических профилях трансплантированных нейронов превышала таковую в контроле. Полученные морфометрические данные указывают на координированное регулирование размеров трех компартментов синапсов в соответствии с функциональным состоянием синаптического аппарата в целом.
ВВЕДЕНИЕ
Метод нейротрансплантации в мозг и переднюю камеру глаза (ПКГ) был введен О.С. Виноградовой в арсенал исследований активности септальных и гиппокампальных нейронов. Этот экспериментальный подход давал возможность разграничить роль внешних афферентов и эндогенных факторов в формировании определенных паттернов электрической активности. Помимо этого, метод позволял оценить морфофункциональную пластическую реорганизацию этих отделов лимбической системы при их аномальной афферентации или полном отсутствии контактов с мозгом. Проведенные исследования показали, что развивающиеся в трансплантатах нейроны адаптируются к новым условиям и воспроизводят специфические морфологические и физиологические характеристики структуры-донора [Vinogradova,1988; Zhuravleva et al., 1985; 1986]. Распределение синаптических окончаний по поверхности дендритов и сомы нейронов в основном не отличается от нормы, и их строение соответствует классическим представлениям [Zhuravleva et al., 1986]. Однако остались недостаточно изученными взаимоотношения синаптических окончаний трансплантированных нейронов с глиальными клетками, хотя по современным представлениям функциональные синаптические контакты должны рассматриваться с точки зрения их трехчастной организации (tripartite synapses) с включением перисинаптических астроцитарных отростков [Araque et al., 1999, Verchratsky, Nedergaard, 2018]. О.С. Виноградова, подводя итоги в области нейронауки к концу второго тысячелетия, называет большим достижением пересмотр взглядов на функции астроцитарной глии и на ее значение в регуляции синаптической передачи [Виноградова, 2000]. В плане дальнейшего развития представлений об участии астроцитов в функционировании синапсов в настоящей работе была поставлена цель морфометрически изучить трехчастное строение синаптических окончаний в условиях нейротрансплантации, когда контакты устанавливаются не только со специфическими, но и с несвойственными им в норме нейрональными мишенями.
В качестве экспериментальной модели для этого были использованы интраокулярные нейротрансплантаты септальной области мозга. Ранее мы показали, что такие трансплантаты по клеточному составу близки к ткани септум in situ, имеют хорошо дифференцированные нейропильные области с нормальным соотношением нервных и глиальных элементов [Zhuravleva et al., 1985; 1986]. В то же время интраокулярные нейротрансплантаты функционируют в изоляции от других отделов мозга, и их нейроны ограничены взаимодействиями друг с другом. Подобные аномальные и даже патологические нейрональные сети могут формироваться и в мозге in situ при нейродегенеративных заболеваниях и эпилептических состояниях, сопровождающихся гибелью части нейронов. Изучение строения синаптических окончаний с учетом степени выраженности астроцитарного компонента в интраокулярных трансплантатах и сравнение его с таковым в интактном мозге позволяют выявить адаптивные структурные реакции всех трех компартментов синаптических комплексов на изменение паттерна функциональных связей.
МЕТОДИКА
Эксперименты выполняли на крысах породы Вистар с соблюдением требований к работе на лабораторных животных (ГОСТ Р ИСО 10993-2-2009) и в соответствии с Этическими принципами, разработанными в Институте теоретической и экспериментальной биофизики РАН. Все процедуры проводили под наркозом: при выделении донорского эмбрионального материала крысе-самке внутрибрюшинно вводили нембутал (40 мг/кг); при трансплантации в переднюю камеру глаза взрослым крысам-самцам использовали общий эфирный наркоз и дополнительную анестезию глаза двумя каплями дикаина. Эмбриональную септальную закладку выделяли из мозга 17-дневных плодов крыс на льду под стереомикроскопом и имплантировали в ПКГ с помощью специальной пипетки Microman через небольшой разрез в роговице (n = 3). Через 3 мес после операции трансплантаты выделяли из ПКГ и подвергали гистологическому (метод Ниссля) и ультраструктурному исследованию. Для электронной микроскопии трансплантаты разрезали на кусочки (0.8–1.0 мм3), фиксировали раствором 4% параформальдегида на 0.1 М фосфатном буфере при pH 7.3 и дофиксировали в 1% растворе четырехокиси осмия. После обезвоживания в спиртах и ацетоне образцы заливали в эпон 812 и получали ультратонкие срезы. Для контроля использовали ткань септальной области нормального мозга, выделенную из животных трехмесячного возраста (n = 3), и проводили такую же подготовку материала для электронно-микроскопического исследования.
Ультраструктурное изучение проводили на электронном микроскопе JEOL JEM 100B и получали микрофотографии нейропильных участков из контрольного септума и септальных трансплантатов. Микрофото оцифровывали и анализировали с помощью программы UTHSCSA Image Tool. Для морфометрического анализа из контрольного и экспериментального материалов выбирали микроизображения синаптических окончаний с четкими структурными признаками возбуждающих функциональных контактов, используя известную классификацию Грея [Gray, 1959]. Сравнение синапсов производили по следующим параметрам: длина постсинаптического уплотнения (ПСУ), полный периметр сечения пресинаптической терминали (Т) и часть периметра терминали, находящейся в непосредственной аппозиции к отросткам астроцита (А). Для вычисления степени развития астроцитарного окружения синапса (перисинаптической глии) вводили коэффициент (К), равный отношению протяженности А к периметру Т. Число использованных для статистики синаптических комплексов (n) указано в таблице. Цифровые данные представлены в виде среднего значения и стандартной ошибки среднего (M ± m). Достоверность различий определяли по критерию Стьюдента. Статистически значимыми считались различия при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
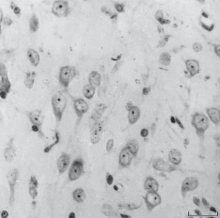
Интраокулярные нейротрансплантаты септума представляли собой нейронально-глиальные композиции, располагающиеся в ПКГ между радужной оболочкой и роговицей. Из радужки в них врастали кровеносные сосуды и симпатические/парасимпатические нервы периферической нервной системы. Нервные и глиальные клетки в септальных трансплантатах распределялись диффузно, без какой-либо ориентации. Почти все нейроны имели выраженную мультиполярную форму, типичную для медиальной септальной области крыс в норме. Они были полностью дифференцированы, имели крупные, светлые ядра, интенсивно окрашенные ядрышки и обширную цитоплазму, содержащую глыбки нисслевского вещества. Глиальные клетки выделялись меньшими размерами, более компактной и яркой окраской ядер (рис. 1). По ультраструктурным характеристикам нейроны и глиоциты соответствовали полноценным, зрелым клеткам, цитоплазма которых содержала все необходимые органеллы.
Рис. 1.
Гистологический срез (метод Ниссля). Нейроны и глиальные клетки в интраокулярном септальном трансплантате. Масштаб: 100 мкм.
Fig. 1. Histological slice (Nissl method). The neurons and glial cells are in the intraocular septal graft. Bar: 100 µm.
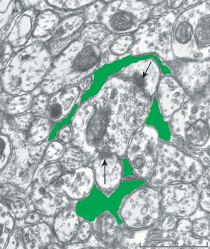
В соответствии с поставленной задачей в настоящем исследовании внимание уделялось изучению нейропильных участков трансплантатов, где нейрональные отростки и синаптические комплексы перемежались с перерезанными в разных направлениях астроцитарными отростками разного калибра. От более крупных отростков астроцитов ответвлялись тонкие астроцитарные веточки, неровные контуры которых повторяли изгибы соседних ультраструктур (рис. 2). Концевые ветвления астроцитарных отростков в бόльшей или меньшей степени окружали синаптические окончания, но очень редко достигали синаптических щелей. Как правило, такое окружение на срезах было фрагментированным (отдельные части, выделенные цветом, показаны на рис. 3). Кроме того, почти в 17% синаптических профилей непосредственные аппозиции с глиальными отростками отсутствовали. Синапсы, локализованные на дендритных веточках и шипиках, по морфологическим критериям имели признаки возбуждающих контактов. Их пресинаптические компоненты содержали светлые синаптические везикулы диаметром около 35–40 нм с примесью одного–двух гранулярных пузырьков от 80 до 120 нм в диаметре. С противоположной стороны активной зоны под плазматической мембраной они имели хорошо выраженные скопления электронно-плотного материала, так называемые постсинаптические уплотнения – ПСУ. Достаточно часто встречались синапсы с множественными активными зонами, когда на одном шипике заканчивались по 2–3 терминали, и, наоборот, когда с одним аксональным бутоном формировали синаптические связи 2–3 дендритные веточки или головки дендритных шипиков (рис. 3).
Рис. 2.
Электронная микрофотография нейропиля в септальном трансплантате. Синаптические контакты указаны стрелками. АО – разветвленный астроцитарный отросток. Масштаб: 0.5 мкм.
Fig. 2. Electron micrograph of neuropil in the septal graft. The synaptic contacts are marked with arrows. AO – branched astrocytic process. Bar: 0.5 µm.
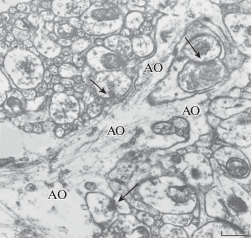
Рис. 3.
Участок нейропиля в интраокулярном септальном трансплантате. Видны два синаптических контакта (стрелки) с головками дендритных шипиков. Перисинаптические отростки астроцитов выделены зеленым цветом. Масштаб: 0.5 мкм.
Fig. 3. Neuropil area in the intraocular septal graft. Two synaptic contacts (arrows) with dendritic spine heads are present. Perisynaptic astrocyic processes are indicated in green. Bar: 0.5 µm.
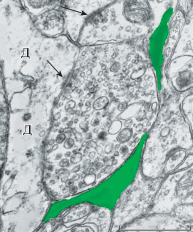
В нейропиле медиальной септальной области, служащей в настоящей работе в качестве контроля, так же как в трансплантатах, было много синаптических контактов, имеющих структурные характеристики возбуждающих связей. Они встречались повсеместно, независимо от дендритной или дендро-шипиковой локализации, в том числе и на поверхности дендритов большого диаметра (рис. 4). В контрольных образцах чаще, чем в трансплантатах, наблюдались перфорированные активные зоны, а их пресинаптические терминали были более густо заполнены синаптическими везикулами. Взаимоотношения синаптических окончаний с перисинаптическими отростками астроцитов были типичны для ЦНС и визуально не различались с таковыми в нейротрансплантатах. В то же время синаптических профилей, не имеющих прилегающих к ним глиальных отростков, в контроле было несколько меньше (только около 12%), чем в экспериментальном материале.
Рис. 4.
Нейропиль в септальной области мозга крысы in situ. Синаптический контакт на поверхности дендритного ствола (Д). Остальные обозначения те же, что и на рис. 3. Масштаб: 0.5 мкм.
Fig. 4. Neuropil area in the septal region of the rat brain in situ. The synaptic contact is seen on the surface of a dendritic trunk (D). The other marks are the same as in Fig. 3. Bar: 0.5 µm.
С помощью компьютерной оцифровки микроизображений был получен большой массив данных для морфометрического анализа параметров синаптических окончаний. Как в трансплантатах, так и в контроле был обнаружен большой разброс размеров индивидуальных аксональных терминалей (площадь сечений от 0.1 до 2.0 мкм2; периметр – от 1.1 до 5.0 мкм). При этом синаптические терминали площадью более 1.0 мкм2 в нейротрансплантатах встречались в 3 раза реже, чем в нормальном септуме. Среднестатистические показатели площади и периметра пресинаптических отделов синапсов в интраокулярных трансплантатах также были достоверно меньше по сравнению с контролем (табл. 1). Периметр, находящийся в прямой аппозиции с астроцитарными отростками, в каждом синаптическом профиле вычисляли сложением отдельных фрагментов (рис. 3). При сравнении средних показателей степени окружения синапсов глиальными отростками достоверной разницы между трансплантационным и контрольным материалом не было выявлено. Однако их отношение к полному периметру пресинаптических компартментов (коэффициент “К”), указывающее на степень окружения синапсов перисинаптической глией, в трансплантатах достоверно выше, чем в контроле (табл. 1).
Таблица 1.
Морфометрический анализ синапсов в интраокулярных трансплантатах септума и септальной области мозга крыс (контроль), (M ± m) Table 1. Morphometric analysis of synapses in intraocular septal grafts and septal area of rat brain in situ (control), (M ± m)
| Параметры синаптических окончаний | Септальные трансплантаты (n = 212) | Контроль (n = 103) | Достоверность |
|---|---|---|---|
| Площадь пресинаптических терминалей (мкм2) | 0.503 ± 0.024 | 0.650 ± 0.038 | p ≤ 0.001 |
| Периметр пресинаптических терминалей (Т) (мкм) | 2.135 ± 0.055 | 2.79 ± 0.09 | p ≤ 0.001 |
| Периметр пресинаптических терминалей в контакте с отростками астроцитов (А) (мкм) | 0.735 ± 0.035 | 0.84 ± 0.05 | p ≤ 0.1 |
| Коэффициент (К = А/Т) | 0.349 ± 0.019 | 0.289 ± 0.023 | p ≤ 0.05 |
| Протяженность активных зон – ПСУ (мкм) | 0.385 ± 0.012 | 0.347 ± 0.013 | p ≤ 0.05 |
Детальное морфометрическое изучение постсинаптических отделов трехчастных синаптических окончаний в экспериментальном и контрольном материале провести не удалось из-за сложности точного определения границы постсинаптических локусов индивидуальных синапсов, сформированных на поверхности дендритов. Поэтому сравнение было проведено только по протяженностям ПСУ, которые рассматривались как эквивалент размеров активных зон. В случаях перфорированных ПСУ их полную длину определяли сложением отдельных фрагментов. Хотя величина активных зон в индивидуальных синапсах широко варьировала (от 0.1–0.2 мкм до 0.8–1.0 мкм), средние значения были достоверно больше в трансплантатах, чем в контроле (табл. 1). Кроме того, в трансплантатах около 20% синапсов имели ПСУ более 0.5 мкм, в то время как в контроле ПСУ такого размера были только в 13%. Как правило, в обеих экспериментальных группах активные зоны были длиннее в аксодендритных синаптических профилях по сравнению с аксошипиковыми.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования подтвердили наши предыдущие представления о том, что микроскопическая организация нервных и глиальных клеток в септальных трансплантатах аналогична таковой в септальной области мозга in situ [Журавлева, 2004; Журавлева и др., 2016; Zhuravleva et al., 1985]. Распределение и строение синаптических контактов и даже наличие синапсов возбуждающего типа на дендритных стволах также соответствовали норме. На этом основании можно полагать, что характер функциональных взаимодействий в нейротрансплантатах подобен тому, что существует в перегородке мозга in situ. Еще в электрофизиологических работах О.С. Виноградовой с соавторами была продемонстрирована органотипичность основных функциональных характеристик этой области мозга в интраокулярных трансплантатах [Bragin, Vinogradova, 1983; Vinogradova, 1988]. В то же время авторы отмечали, что для нейронов трансплантатов характерны повышенная возбудимость и легкая провокация эпилептиформных разрядов. Такие функциональные особенности, по-видимому, отражены в результатах нашего морфометрического исследования, показавшего возрастание, по сравнению с контролем, средних размеров постсинаптических уплотнений в синапсах интраокулярных трансплантатов септума. Это предположение подтверждается многими морфофункциональными исследованиями мозга, в которых обнаружена четкая коррелятивная зависимость размеров ПСУ от эффективности синаптической передачи [Geinisman, 2000; Meyer et al., 2014]. Увеличение размеров ПСУ в возбуждающих синапсах при долговременной потенциации убедительно показано также на культивированных органотипических срезах гиппокампа [Lushnikova et al., 2009], которые можно считать неким экспериментальным аналогом нейротрансплантатов in oculo. Как в интраокулярных трансплантатах, так и в переживающих срезах мозга нейроны функционируют в условиях дефицита внешних афферентных связей, что отражается на их свойствах. Известно, что даже в мозге in vivo частичная деафферентация нейронов приводит к гиперактивности синапсов и развитию пароксизмальных явлений [Nita et al., 2006].
Сравнительная морфометрия синаптических комплексов показала, что несмотря на увеличенные средние размеры ПСУ в интраокулярных нейротрансплантатах, пресинаптические отделы, везикулы которых высвобождают возбуждающий нейромедиатор, наоборот, имеют заметно уменьшенные значения площади и периметра по сравнению с контролем. Возможно, разнонаправленный характер структурных изменений двух компартментов синапсов способствует защите нейронов от развития острого гипервозбуждения. Интересно, что в экспериментах с долговременной потенциацией на переживающих срезах [Lushnikova et al., 2009] повышение паттерна активности нейронов сопровождалось однонаправленными изменениями параметров синапсов в сторону их увеличения. Кажется, что синаптические контакты в ПКГ, в отличие от таковых в органотипической культуре, обладают возможностью на морфологическом уровне координировать диапазон их функциональной активности. Этот процесс можно рассматривать как одну из форм гомеостатической пластичности возбуждающих синапсов, которая предложена в дополнение к известной Хеббовской пластичности [Fernandes, Carvalho, 2016].
Сложной структурной динамике в интраокулярных нейротрансплантатах подвергается астроцитарная глия. Ранее мы показали, что астроциты активно пролиферируют на поверхности септальных трансплантатов, развивающихся в ПКГ, образуя подобие многослойной оболочки, однако внутри паренхимы трансплантатов отмечалось нормальное соотношение нервных и глиальных клеток [Журавлева, 2004; Zhuravleva et al., 1985]. В настоящем исследовании особое внимание уделялось дистальным астроцитарным отросткам, которые простирались до плазматических мембран синаптических окончаний. Результаты показали, что большинство синапсов в той или иной степени имели прямые аппозиции с астроцитарными отростками. Однако по сравнению с контрольным септумом в трансплантатах несколько чаще встречались синапсы без перисинаптических отростков (17 против 12%). Возможно, это связано с тем, что в интраокулярных графтах сохраняется какая-то часть не полностью созревших синапсов. В предыдущих исследованиях мы отмечали наличие даже в долгоживущих трансплантатах in oculo признаков продолжающегося развития синаптических связей [Журавлева, 2004; Zhuravleva et al., 1986]. Именно процессом восстановительного синаптогенеза и присутствием вновь образованных контактов другие авторы объясняли аналогичную и даже более выраженную диспропорцию в объеме перисинаптических отростков в переживающих органотипических срезах при сравнении их с нативным гиппокампом [Witcher et al., 2007].
В то же время из анализа наших морфометрических данных (вычисление коэффициента “К”) следует, что в синапсах, включающих в свой состав перисинаптические астроцитарные отростки, вклад астроцитов в их трехчастную организацию был достоверно выше в материале in oculo, чем в контроле. Особенно следует отметить корреляцию показателей степени глиального покрытия и эффективности синаптической передачи. Ранее мы обнаружили высокую динамичность и пластическую реорганизацию концевых отростков астроцитов в интраокулярных нейротрансплантатах при изменении функциональной активности нервной ткани. Они первыми из трех синаптических компартментов реагировали на кратковременную электрическую стимуляцию [Журавлева и др., 2016]. Хотя величина окружения синаптических компартментов глиальными отростками может зависеть от многих факторов, в том числе и от отдела мозга, показательно, что аналогичная взаимозависимость перисинаптической глии и уровня синаптической активности была обнаружена также в органотипической культуре гиппокампа [Lushnikova et al., 2009].
В настоящее время общепризнано, что перисинаптические отростки астроцитов, регулируя ионный состав и баланс нейротрансмиттеров, играют важную роль в контроле синаптической передачи [Chung et al., 2015; Ghezali et al., 2016; Verkhratsky, Nedergaard; 2018; Hasan, Singh, 2019]. Астроциты секретируют ростовые и нейротрофические факторы, а на своей поверхности экспрессируют рецепторы к многочисленным биоактивным компонентам. Их влияние на синаптические комплексы осуществляется как через прямые межклеточные контакты, так и через гуморальную систему [Schipke, Kettenmann, 2004; Rose et al., 2018]. Результаты, полученные в настоящей работе на интраокулярных трансплантатах септальной области мозга, подтверждают литературные данные об участии перисинаптической глии в формировании, функционировании и пластической перестройке трехчастных синаптических комплексов.
ЗАКЛЮЧЕНИЕ
Таким образом, сравнение трехчастной организации синаптических окончаний в интраокулярных септальных трансплантатах и в септальной области мозга in situ показало, что развитие синаптических функциональных связей в условиях трансплантации в большой степени детерминировано. Несмотря на отсутствие нормальных афферентных и эфферентных связей в нервной ткани, дифференцирующейся в ПКГ, синаптические контакты в нейротрансплантатах имеют типичную для ЦНС трехчастную организацию, которая объединяет в единый комплекс пре- и постсинаптические отделы с окружающими их отростками астроцитов. В то же время с помощью морфометрического анализа обнаружено, что неадекватная иннервация трансплантированных нервных и глиальных элементов, а также их адаптация к новому клеточному и нейрохимическому окружению приводят к некоторой пластической реорганизации структуры синаптических комплексов. Увеличенные показатели протяженности активных зон синапсов в трансплантатах септума по сравнению с одноименным интактным отделом мозга как бы уравновешиваются уменьшенными размерами пресинаптических аксональных терминалей. В работе выявлены интересные взаимоотношения синаптических контактов с перисинаптической астроцитарной глией. Если по усредненным значениям периметров аксональных терминалей, ассоциированных с отростками астроцитов, трансплантаты и интактный контроль не различаются, то из-за меньших размеров пресинаптических отделов в трансплантатах степень их окружения астроцитарной глией приобретает более высокие по сравнению с контролем значения. Таким образом, сравнение морфометрических показателей синапсов трансплантированной и интактной септальной области мозга показало координированное регулирование размеров трех составных частей синапсов в соответствии с функциональным состоянием синаптического аппарата в целом.
Проведенное исследование свидетельствует о больших адаптационных возможностях нервной ткани и ее способности к координированным пластическим перестройкам. Это позволяет использовать интраокулярные трансплантаты в качестве модели для многих морфологических и физиологических исследований, которые сложно провести на целом мозге. Полученные результаты находятся в соответствии с представлением О.С. Виноградовой о том, что нейротрансплантация в иммунопривилегированные области организма значительно расширяет понимание феномена пластичности мозга.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 17-04-00786).
Список литературы
Виноградова О.С. Нейронаука конца второго тысячелетия: смена парадигм. Журн. высш. нерв. деят. им. И.П. Павлова. 2000. 50 (5): 743–774.
Журавлева З.Н. Гиппокамп и нейротрансплантация. Журн. высш. нерв. деят. им. И.П. Павлова. 2004. 54 (2): 149–162.
Журавлева З.Н., Хуцян С.С., Журавлев Г.И. Ультраструктура возбуждающих синаптических контактов в очаге эпилептиформной активности: эксперименты на интраокулярных нейротрансплантатах. Журн. высш. нервн. деят. им. И.П. Павлова. 2016. 66 (6): 742–750.
Araque A., Parpura V., Sanzgiri R.P., Haydon P.G. Tripartite synapses: glia, the unacknowledged partner. Trends Neurosci. 1999. 22 (5): 208–215.
Bragin A.G., Vinogradova O.S. Comparison of neuronal activity in septal and hippocampal grafts developing in the anterior eye chamber of the rat. Brain Res. 1983. 312 (2): 279–286.
Chung W.S., Allen N.J., Eroglu C. Astrocytes control synapse formation, function, and elimination. Cold Spring Harb. Perspect. Biol. 2015. 7 (9). a020370. https://doi.org/10.1101/cshperspect.a020370
Fernandes D., Carvalho A.L. Mechanisms of homeostatic plasticity in the excitatory synapse. J. Neurochem. 2016. 139 (6): 973–996.
Geinisman Y. Structural synaptic modifications associated with hippocampal LTP and behavioral learning. Cereb. Cortex. 2000. 10 (10): 952–962.
Ghezali G., Dallerac G., Rouach N. Perisynaptic astroglial processes: dynamic processors of neuronal information. Brain Struct. Funct. 2016. 221: 2427–2442.
Gray E.G. Axo-somatic and axo-dendritic synapses of the cerebral cortex: An electron microscope study. J. Anat (L.). 1959. 93: 420–433.
Hasan U., Singh S.K. The astrocyte-neuron interface: An overview on molecular and cellular dynamics controlling formation and maintenance of the tripartite synapse. Methods Mol. Biol. 2019. 1938: 3–18.
Lushnikova I., Skibo G., Muller D., Nikonenko I. Synaptic potentiation induces increased glial coverage of excitatory synapses in CA1 hippocampus. Hippocampus. 2009. 19: 753–762.
Meyer D., Bonhoeffer T., Scheuss V. Balance and stability of synaptic structures during synaptic plasticity. Neuron. 2014. 82 (2): 430–443.
Nita D., Cissé Y., Timofeev I., Steriade M. Increased propensity to seizures after chronic cortical deafferentation in vivo. J. Neurophysiol. 2006. 95 (2): 902–913.
Rose C.R., Felix L., Zeug A., Dietrich D., Reiner A., Henneberger C. Astroglial glutamate signaling and uptake in the hippocampus. Front. Mol. Neurosci. 2018. 10: 451.
Schipke C.G., Kettenmann H. Astrocyte responses to neuronal activity. Glia. 2004. 47 (3): 226–232.
Verkhratsky A., Nedergaard M. Physiology of astroglia. Physiol. Reviews. 2018. 98 (1): 239–389.
Vinogradova O.S. Functional characteristics of nervous tissue (hippocampus and septum) transplanted into the anterior eye chamber and brain. Sov. Sci. Rev. F. Physiol. Gen. Biol. 1988. 2: 477–528.
Witcher M.R., Kirov S.A., Harris K.M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 2007. 55: 13–23.
Zhuravleva Z.N., Bragin A.G., Vinogradova O.S. Organization of the nervous tissue (hippocampus and septum) developing in the anterior eye chamber. II. Neuronal perikarya and dendritic processes. J. Hirnforsch. 1985. 26 (4): 417–437.
Zhuravleva Z.N., Bragin A.G., Vinogradova O.S. Organization of the nervous tissue (hippocampus and septum) developing in the anterior eye chamber. III. Axonal processes and their synaptic ending. J. Hirnforsch. 1986. 27 (3): 323–341.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


