Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 38-51
Ассоциация полиморфизма rs1344706 гена ZNF804A c индуцированными изменениями ритмов ЭЭГ при зрительном восприятии вербальных стимулов у здоровых испытуемых и больных шизофренией
Ж. В. Гарах 1, *, В. Е. Голимбет 2, Е. В. Ларионова 1, Т. В. Лежейко 2, В. Б. Стрелец 1, Ю. С. Зайцева 3, 4
1 Федеральное государственное бюджетное учреждение науки
Институт Высшей Нервной Деятельности и Нейрофизиологии РАН
Москва, Россия
2 Федеральное государственное бюджетное научное учреждение “Научный центр психического здоровья”
Москва, Россия
3 Национальный центр психического здоровья
Клецаны, Чехия
4 3-й лечебный факультет, Карлов университет в Праге
Прага, Чехия
* E-mail: garakh@yandex.ru
Поступила в редакцию 14.02.2022
После доработки 04.04.2022
Принята к публикации 26.04.2022
- EDN: GJGLQN
- DOI: 10.31857/S0044467723010070
Аннотация
Изучена ассоциация полиморфизма rs1344706 гена ZNF804A с параметрами синхронизации/десинхронизации ритмов ЭЭГ при зрительном восприятии смысловой и бессмысленной вербальной информации у больных шизофренией и расстройствами шизофренического спектра (n = 93) и психически здоровых испытуемых (n = 93). Установлено, что при чтении вербальной информации вне зависимости от психического статуса у испытуемых с генотипом АА синхронизация тета-ритма меньше, чем у носителей аллеля С. У здоровых испытуемых – носителей генотипа АА, по сравнению с носителями варианта С, снижена синхронизация тета-ритма в задних корковых областях левого полушария, а также отсутствуют различия синхронизации гамма- и десинхронизации мю-ритмов при восприятии смысловой и бессмысленной вербальной информацией. У пациентов – носителей варианта АА, по сравнению с носителями варианта С, меньше степень десинхронизации мю-ритма, что коррелирует с выраженностью речевых нарушений по шкале PANSS. Результаты исследования свидетельствуют о модулирующем эффекте полиморфизма rs1344706 гена ZNF804A на нейрофизиологические характеристики процесса чтения и его вкладе в вариативность клинически выраженных речевых нарушений.
Шизофрения – психическое расстройство, характеризующееся нарушениями ряда когнитивных функций. Языковые дисфункции могут быть ключевой особенностью этого заболевания (de Boer et al., 2020). Известно, что у пациентов с шизофренией отмечается значительный дефицит навыков чтения, которые важны для нормального функционирования в повседневной жизни. В недавнем метаанализе (Vanova et al., 2021) показаны множественные нарушения различных аспектов чтения при шизофрении: снижение скорости чтения, аномалии фонологической обработки и понимания текста и другие.
Снижение навыков чтения у пациентов с шизофренией может быть обусловлено дефицитом на ранних этапах обработки вербальной информации (Revheim et al., 2014). С помощью метода вызванных потенциалов было продемонстрировано, что амплитуда компонента Р100 меньше у больных шизофренией по сравнению со здоровыми испытуемыми как при чтении единичных слов (Стрелец и др., 2012), так и при чтении отрывков текста (Dias et al., 2021), что может быть связано с недостаточностью внимания. Компонент вызванных потенциалов N170 ассоциируют с активацией области зрительной формы слова (Visual Word Form Area) (Dehaene, Cohen, 2011). Амплитуда этого компонента также снижена при зрительном восприятии вербальной информации у больных шизофренией (Стрелец и др., 2012). На выборке здоровых испытуемых показан значимый эффект полиморфизмов Val66Met и 5-HTTLPR на характеристики компонентов Р100 и N170 при чтении единичных слов (Голимбет и др., 2016). Временное окно около 200 мс (соответствует вызванному потенциалу Р200) связано с семантической обработкой информации. Ранее было показано, что в этом временном интервале выявляются нарушения и у больных шизофренией (Takashima et al., 2001). Был также продемонстрирован эффект полиморфизма DRD2 C957T на амплитуду P200 при чтении слов у здоровых испытуемых. Носители генотипа ТТ имели более высокие амплитуды P200 по сравнению с носителями аллеля С, который ассоциируют с риском развития шизофрении (Golimbet et al., 2018). Волну Р300 (временное окно около 300 мс) рассматривают в качестве биомаркера нейрокогнитивных изменений как у хронических больных, так и при первом эпизоде шизофрении, отмечена также ценность этого компонента ВП для определения прогноза для пациентов (Tang et al., 2020). Сниженную по сравнению со здоровыми испытуемыми амплитуду компонента Р300 при шизофрении, в том числе и на зрительные стимулы, отмечают многие исследователи (Ford, 1999; Jeon, Polich, 2003 и др.). Р300 рассматривают как промежуточный фенотип, или эндофенотип, шизофрении, что, как следует из определения понятия эндофенотип, указывает на его связь с генетическими факторами, лежащими в основе этого заболевания Проведен ряд исследований по обнаружению ассоциированных с Р300 генов. В метаанализе (Hederih et al., 2021) показано, что аномалии характеристик Р300 при шизофрении могут быть опосредованы полиморфизмами rs1045642 в гене ABCB1, rs4680 COMT, rs1625579 MIR137HG, rs1344706 ZNF804A.
В последние годы интерес исследователей направлен на ген ZNF804A, расположенный на хромосоме 2q32.1, который был идентифицирован как первый ген, связанный с шизофренией, в полногеномном анализе ассоциаций (GWAS от genome-wide association study) (O’Donovan et al., 2008). По данным GWAS с шизофренией ассоциирован полиморфизм rs1344706, обусловленный заменой аденина на цитозин (A\C) в интроне 2, а вариантом риска является генотип АА (O’Donovan et al., 2008). Этот полиморфизм также связан с тяжестью заболевания (обзор Chang et al., 2017). Полиморфизм ZNF804A rs1344706 может также ассоциироваться с заболеваниями, имеющими общую с шизофренией генетическую основу. Например, показана связь ZNF804A с дефицитом вербальных навыков при аутизме (Anitha et al., 2014).
В исследовании на мышах выявлено, что ген ZNF804A играет важную роль в когнитивных и сенсомоторных функциях (Huang et al., 2020). В работах с использованием фМРТ было показано изменение активации и связности ряда мозговых регионов как в состоянии спокойного бодрствования, так и при когнитивной нагрузке у носителей аллеля А. У больных шизофренией значительное снижение функциональной связи в состоянии покоя между левым гиппокампом и правой дорсолатеральной префронтальной корой, обнаруженное у гомозигот по аллелю А ZNF804A rs1344706 (AA), ассоциируется с худшими когнитивными показателями и тяжестью психоза (Zhang et al., 2018). В другой работе аллель А rs1344706 как у здоровых, так и у пациентов с шизофренией был связан с измененной активацией в правой дорсолатеральной префронтальной коре во время запоминания лиц (Linden et al., 2013). Были представлены доказательства того, что ZNF804A может играть роль в когнитивных процессах, имеющих отношение к чтению и правописанию, и подчеркивается фенотипическая сложность, которая может быть связана с ZNF804A (Becker et al., 2012). Кроме того, ZNF804A ассоциируется с процессами семантической вербальной беглости (Nicodemus et al., 2014).
В патофизиологии шизофрении центральную роль могут играть аномалии осцилляторной активности, так как нейронные колебания являются фундаментальным механизмом установления точных временных соотношений между реакциями нейронов, которые, в свою очередь, важны для памяти, восприятия и сознания (Uhlhaas, Singer, 2015). В то же время известно, что характеристики колебательной активности в значительной степени являются наследуемыми (Smit et al., 2010 и др.), включая осцилляции, связанные с языком (Araki et al., 2016).
Осцилляторная динамика сигнала ЭЭГ отражает механизмы, посредством которых мозг интегрирует различные типы информации о языке (например, фонологическую, орфографическую, семантическую и синтаксическую информацию), представленные в различных областях мозга (обзор Bastiaansen, Hagoort, 2006). Показано, что пациенты с шизофренией демонстрируют патологические паттерны синхронизации/десинхронизации как во время процесса лексического кодирования, так и в период после кодирования практически во всех частотных диапазонах (1–4, 8–12, 12–32, 32–48 Гц), а основными дисфункциональными областями при этом являются затылочная и левая лобно-височная доля (Xu et al., 2013). По мнению некоторых авторов изучение ритмической активности мозга предоставляет наилучший путь к интерпретации языковых дефицитов при шизофрении и их возможных связей с аллелями риска для этого заболевания (Murphy, Benítez-Burraco, 2017). Одним из генов, ассоциированных со специфическими языковыми нарушениями при шизофрении, может быть ZNF804A (Murphy, Benítez-Burraco, 2018). Однако до настоящего времени молекулярно-генетические основы параметров аберрантной активности ЭЭГ при зрительном восприятии вербальной информации у больных шизофренией не исследовались.
Цель настоящего исследования – изучение ассоциации полиморфизма rs1344706 гена ZNF804A с показателями синхронизации/десинхронизации ритмов ЭЭГ на разных этапах восприятия смысловой и бессмысленной вербальной информации у больных шизофренией и расстройствами шизофренического спектра и здоровых испытуемых в первые 400 мс после стимула.
МЕТОДИКА
Выборку испытуемых составили психически здоровые люди (n = 93) и больные шизофренией и расстройствами шизофренического спектра (n = 93). Пациенты принимали участие в эксперименте через 3–20 дней после поступления в Московский научно-исследовательский институт психиатрии. В течение этого времени они получали терапию атипичными антипсихотиками. Начало первого психотического эпизода, а именно начало психотических симптомов у пациентов разнилось, но на момент исследования все пациенты были в подостром состоянии. Диагноз ставился клиницистами отделения по МКБ-10. Пациенты имели диагнозы: шизофрения (F20, 37 человек), шизотипическое расстройство (F21, 28 человек), шизоаффективное расстройство (F25, 29 человек). Выраженность психопатологической симптоматики определялась по шкале PANSS (Kay et al., 1987).
В выборку были отобраны соматически здоровые правши. Группы были уравнены по полу и возрасту (р > 0.75, t-test). Все испытуемые подписали информированное согласие на участие в нейрофизиологическом исследовании и сдачу смыва из ротовой полости для выделения ДНК с последующим генотопированием. Исследование было одобрено этическим комитетом Московского научно-исследовательского института психиатрии (приказ № 30 от 26 сентября 2007 г.) и проводилось с 2007 по 2013 гг. Более подробно описание групп испытуемых приведено в таблице 1.
Таблица 1.
Демографические и клинические характеристики испытуемых Table 1. Demographical and clinical characteristics of the sample
| Демографические и клинические характеристики | Психически здоровые, n = 93 | Пациенты, n = 93 | ||
|---|---|---|---|---|
| АА | C | АА | C | |
| Всего человек (%) | 32 (34.4%) | 61 (65.6%) | 43 (46.2%) | 50 (53.8%) |
| Мужчины* | 15 | 351 | 22 | 273 |
| Женщины* | 17 | 262 | 21 | 234 |
| Возраст | 25.78 ± 7.57 | 28.26 ± 7.76 | 27.21 ± 8.81 | 28.24 ± 8.64 |
| 27.41 ± 7.74 | 27.76 ± 8.69 | |||
| PANSS, сумма позитивных симптомов, баллы | – | – | 16.21 ± 4.31 | 16.98 ± 5.56 |
| PANSS, сумма негативных симптомов, баллы | – | – | 15.21 ± 4.62 | 15.621 ± 4.67 |
| PANSS, сумма общепатологических симптомов, баллы | – | – | 38.97 ± 6.54 | 39.48 ± 7.79 |
| F20 (шизофрения), человек, % | – | – | 17 (40%) | 20 (40%) |
| F21 (шизотипическое расстройство личности), человек, % | – | – | 11 (26%) | 16 (32%) |
| F25 (шизоаффективное расстройство), человек, % | – | – | 15 (34%) | 14 (28%) |
Молекулярно-генетическое исследование предусматривало отбор биологического материала (смыв из ротовой полости), выделение ДНК с использованием стандартного фенол-хлороформного метода и генотипирование с использованием полимеразной цепной реакции (ПЦР). Условия генотипирования полиморфизма ZNF804A rs1344706 и последовательности олигонуклеотидных праймеров описаны ранее (Лежейко и др., 2019)
Связанные с событиями отрезки ЭЭГ регистрировали при чтении вербальных стимулов без моторного ответа (слова и псевдослова). Стимулы предъявляли на экране 14-дюймового монитора на расстоянии 0.75 м от испытуемого, сидящего в кресле перед компьютером в затемненной комнате. Стимулы белого цвета предъявлялись на черном экране (80 слов и 80 псевдослов). Все слова были существительными. Каждый из стимулов состоял из 5–6 букв. Время предъявления – 100 мс. Межстимульный интервал варьировал от 1500 до 4000 мс. Слова и псевдослова предъявлялись в псевдослучайном порядке. Время выполнения экспериментального задания – 7 мин.
Связанную с событиями ЭЭГ регистрировали от 19 отведений: Fp1, Fp2, F3, F4, F7, F8, C3, C4, T3, T4, T5, T6, P3, P4, O1, O2, Fz, Cz, Pz на 24-канальном усилителе фирмы МБН (Россия). Фильтры низких частот – 70 Гц, постоянная времени – 0.3 с. Частота квантования 200 Гц, импеданс ниже 10 кОм. Левая и правая мочки ушей были референтными каналами для монополярной ипсилатеральной схемы записи ЭЭГ. Одновременно с активными электродами регистрировался потенциал правого референтного электрода относительно левого. Для апостериорного перереферирования на объединенные ушные электроды из активности отведений левого полушария вычиталась, а к отведениям правого полушария добавлялась половина активности правого референта относительно левого. Для выделения мю-ритма из смеси с альфа-ритмом дополнительно записывали ЭЭГ в спокойном бодрствовании с открытыми глазами и при воображении собственного движения с закрытыми глазами.
Для вычисления индуцированных осцилляций, связанных со стимулом, использовали анализ, заключающийся в полосовой фильтрации биопотенциалов с последующим возведением отфильтрованных сигналов в квадрат, нормированием на среднюю мощность базовой линии и логарифмическим преобразованием. Каждую запись привязанных к событию отрезков ЭЭГ фильтровали с использованием фильтров Баттерворта 2-го порядка. Для исключения влияния краевых эффектов, связанных с фильтрацией и сглаживанием, первые и последние 10 сек записи ЭЭГ исключались из дальнейшей обработки. Для избегания фазовых искажений сигнала, вносимых рекурсивными фильтрами, к которым относится и фильтр Баттерворта, фильтрация проводилась в два этапа: первый раз – в прямом (по времени) направлении, второй – в обратном. Такая процедура гарантирует нулевой сдвиг фаз на любой частоте. Полосовая фильтрация проводилась в следующих частотных диапазонах: тета (4–8 Гц), альфа (8–13 Гц), бета1 (13–20 Гц), бета2 (20–30 Гц) и гамма (30–40 Гц).
Результаты полосовой фильтрации биопотенциалов возводились в квадрат. В каждой эпохе анализа (включая базовую линию) полученные значения квадратов усреднялись в течение каждого полупериода фильтрованного сигнала с помощью плавающего дискретно смещающегося окна (интервал между пересечениями нулевой линии). Эта процедура позволяет подавить вторую гармонику сигнала и провести сглаживание “выбросов” (Новотоцкий-Власов, 2000). Эпоха анализа составила 200 мс до стимула, 700 мс после стимула. Усреднение по ансамблю реализаций проводили стандартным способом. Число безартефактных реализаций для каждого испытуемого варьировалось от 50 до 80. Нормирование мощности эпохи анализа (включая базовую линию) на среднюю мощность базовой линии и перевод результата в децибелы по формуле: Prel(dB) = 10lg(Pinst/Pbase), где Pinst (P instanteneous) – мгновенное значение мощности. Поскольку частота квантования – 200 Гц, шаг для каждого Pinst составил 5 мс; Pbase – усредненная за 200 мс мощность базовой линии. Увеличение мощности в каждой отфильтрованной полосе называли синхронизацией, связанной с событием (event-related synchronization, ERS), тогда как снижение мощности – десинхронизацией, связанной с событием (event-related desynchronization, ERD) (Pfurtscheller, Lopes Da Silva, 1999).
На первом этапе оценивали экстремумы ERD/ERS исследуемых диапазонов в первые 400 мс после стимула с шагом в 5 мс. Для этого анализировали усредненные по двум типам стимулов кривые ERD/ERS по общей выборке испытуемых. Временные окна и области интереса ERD/ERS в первые 200 мс выбирали с учетом имеющихся данных о динамике активационных процессов при чтении (Стрелец и др., 2012, Carreiras et al., 2014, Dias et al., 2021, Xu et al., 2013, и др.). После этого для каждого типа стимула рассчитывались индивидуальные результаты в выбранных временных окнах, частотных диапазонах и локализациях. Около 120 мс после стимула наблюдалась синхронизация альфа-, бета1-, бета2-ритмов в теменных, затылочных и теменно-затылочных областях: Р3, Р4, О1, О2, Т5 и Т6. Для анализа выбрано временное окно 105–145 мс. Около 170 мс после стимула наблюдалась синхронизация тета-ритма в теменных, затылочных и теменно-затылочных областях (ТРО). Для анализа выбрано временное окно 130–210 мс в отведениях Р3, Р4, О1, О2, Т5 и Т6 (примеры топографического распределения – рис. 1 и 2). Около 200 мс после стимула выявлялась синхронизация бета2- и гамма-ритмов в левом височном отведении (F7) и десинхронизация в ТРО. Для анализа выбрано временное окно 180–230 мс (пример топографического распределения индуцированной гамма-активности – рис. 3). Десинхронизацию бета2- и гамма-ритмов анализировали в отведениях Р3, Р4, О1, О2, Т5, Т6. Синхронизацию этих ритмов анализировали в отведениях F7 и F8.
Рис. 1.
Синхронизация (а) и (б) тета-ритма и ее топографическое распределение (в) в интервале 130–210 мс. Черная линия и с – носители аллеля С, серая линия и АА – носители генотипа АА. ТРО – усредненная синхронизация по двум типам стимулов в отведениях Р3, Р4, О1, О2, Т5 и Т6. * – p < 0.05. Fig. 1. Synchronization (а) and (б) of theta rhythm and its topographical distribution (в) in 130-210 ms time window. Black line and C are the C allele carriers, grey line and AA – AA genotype carriers. TPO – averaged synchronization for two types of the stimuli in the sites: Р3, Р4, О1, О2, Т5 and Т6. * – p < 0.05.
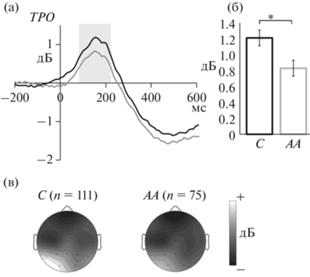
Рис. 2.
Асимметрия синхронизации тета-ритма (130–210 мс) у здоровых испытуемых. С – носители аллеля С, АА – носители генотипа АА. * – p < 0.05, ** – p < 0.01, *** – p < 0.001. Fig. 2. Theta-band synchronization asymmetry (130–210 ms.) in healthy subjects. С – carriers of allele С, AA – carriers of the genotype AA. * – p < 0.05, ** – p < 0.01, *** – p < 0.001.
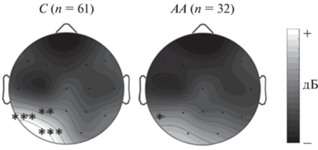
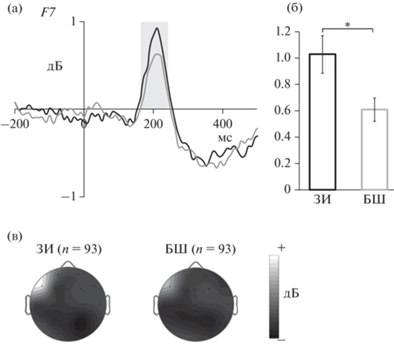
Рис. 3.
Синхронизация (а) и (б) гамма-ритма в левой передне-височной области (F7) и топографическое распределение (в) гамма-ритма в интервале 180–230 мс. Черная линия и ЗИ – здоровые испытуемые, серая линия и БШ– больные шизофренией и расстройствами шизофренического спектра. * – p < 0.05. Fig. 3. Gamma-band synchronization (а) and (б) in the left anterior temporal region (F7) and the topographic distribution (в) of the gamma rhythm in 180–230 ms time window. Black line and ЗИ – healthy subjects, grey line and БШ – patients with schizophrenia and schizophrenia spectrum disorders. * – p < 0.05.
Около 300 мс после стимула наблюдалась десинхронизация альфа-ритма, преимущественно выраженная в центральных (С3, С4), а также фронтальных областях (F3, F4). Мы предположили, что такая локализация изменений активности в частотном диапазоне 8–13 Гц может быть отражением динамики мю-ритма, поскольку есть единичные данные о том, что чтение, в частности глаголов, приводит к активации областей моторной коры (Hauk, Pulvermuller, 2004). В связи с этим у каждого испытуемого выделяли мю-ритм из смеси с альфа-ритмом с помощью метода главных компонент. Для получения факторов, относящихся к мю-ритму ЭЭГ, использовали разность ковариационных матриц, определенных по записям ЭЭГ с открытыми глазами и при воображении движения с закрытыми глазами. В качестве мю-ритма рассматривали те компоненты, реактивность которых на воображаемое движение больше, чем при открывании глаз (с учетом совокупности факторов). Затем матрица индивидуального набора выбранных факторов была использована для определения индуцированных изменений мю-ритма при чтении слов и псевдослов (Garakh et al., 2020). Дальнейший анализ ERD/ERS проводился так же, как для других выделенных диапазонов. Для анализа выбрано временное окно 290–350 мс.
Статистическая обработка полученных показателей проводилась с помощью пакета программ STATISTICA 10.0. В анализ были включены четыре подгруппы испытуемых: здоровые, носители генотипа АА и аллеля С, а также пациенты, носители генотипа АА и аллеля С. С применением Н-теста Краскела-Уоллиса показано, что у этих четырех подгрупп не было различий по возрасту (p > 0.25) и полу (p > 0.8). Распределение пациентов по нозологическим группам (p > 0.7) и выраженность психопатологической симптоматики по шкале PANSS (p > 0.8) у разных генотипов не имело значимых различий. Дисперсионный анализ проводили для каждого частотного диапазона и каждой области интереса отдельно. При статистической обработке данных на первом этапе использовали анализ МANOVA с включением двух категориальных факторов: “группа” (здоровые испытуемые и пациенты) и “генотип” (генотип АА и аллель С (генотипы АС и СС)). В качестве внутригрупповых вводили факторы “стимул” (слово и псевдослово), “электрод”, “полушарие” (левое и правое). При определении достоверности влияния основных факторов и их взаимодействия применялась поправка Гринхауза-Гейсера, учитывающая сферичность данных.
При обнаружении достоверных межгрупповых различий по фактору “группа” или взаимодействию этого фактора с фактором “генотип” на втором этапе использовали ANOVA RM более низкого порядка: с включением факторов “генотип”, “стимул”, “область”, “полушарие” отдельно для каждой группы испытуемых (психически здоровые и пациенты). В качестве апостериорного анализа применяли критерий Фишера (Fisher LSD).
Дополнительно в группе пациентов проводили анализ взаимосвязи значений нейрофизиологических параметров с выраженностью позитивной и негативной психопатологической симптоматики по шкале PANSS. Применяли тест Спирмена, поскольку распределение балльных оценок по шкале PANSS не подчинялось нормальному. Учитывалась поправка на множественные сравнения (Benjamini, Hochberg, 1995).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Синхронизация альфа-, бета1- и бета2-активности во временном окне 105–145 мс в теменных, затылочных и теменно-затылочных областях
Не было выявлено значимых факторов “группа” и “генотип” и их взаимодействий в частотных диапазонах альфа- и бета2-ритмов. В диапазоне бета1 получены значимые взаимодействия “электрод” × “группа” (F(2, 364) = 3.98, p = 0.025) и “стимул” × × “электрод” × “полушарие” × “генотип” (F(2, 364) = 3.45, p = 0.033), однако апостериорный анализ не показал достоверных результатов. Анализ ANOVA RM отдельно в группах здоровых испытуемых и пациентов не выявил значимых эффектов.
Синхронизация тета-активности во временном окне 130–210 мс в теменных, затылочных и теменно-височных областях
Обнаружен значимый эффект фактора “генотип” (F(1, 182) = 5.17, p = 0.024). У испытуемых двух групп (n = 186) синхронизация тета-ритма была меньше у носителей генотипа АА (рис. 1). Значимым также было взаимодействие факторов “полушарие” × “группа” × × “генотип” (F(1, 182) = 8.01, p = 0.0052). Поскольку было значимо взаимодействие с фактором “группа”, провели анализ ANOVA RM отдельно для здоровых испытуемых и пациентов.
У здоровых испытуемых был значим эффект “полушарие” × “генотип” (F(1, 91) = 5.56, p = 0.021). Апостериорный анализ показал, что у носителей генотипа АА синхронизация тета-ритма больше в левой теменно-височной области, чем в правой, а у носителей аллеля С – в теменной, затылочной и теменно-височной областях левого полушария (рис. 2). Синхронизация этого ритма была больше у носителей аллеля С по сравнению с генотипом АА в затылочной (О1) и теменно-височной (Т5) областях левого полушария (p < 0.05).
У пациентов выявлен только эффект фактора “генотип” (F(1, 91) = 5.19, p = 0.039). Как и у объединенной группы испытуемых, синхронизация тета-ритма была меньше у пациентов – носителей генотипа АА, чем у пациентов – носителей варианта С.
Синхронизация бета2- и гамма-ритмов в лобно-височных областях и их десинхронизация в теменных, затылочных и теменно-затылочных областях во временнóм окне 180–230 мс
Значимых эффектов в диапазоне бета2-ритма получено не было. При исследовании синхронизации гамма-ритма в височно-лобных областях получен эффект фактора “группа” (F(1, 182) = 5.45, p = 0.021) и взаимодействие факторов “электрод” × “группа” (F(1, 182) = 4.24, p = 0.041). Апостериорный анализ показал, что синхронизация этого ритма была больше у здоровых испытуемых по сравнению с больными шизофренией и расстройствами шизофренического спектра в отведении F7 (рис. 3).
У здоровых испытуемых было значимо взаимодействие “стимул” × “электрод” × × “генотип” (F(1, 91) = 4.84, p = 0.03). Апостериорный анализ показал, что у носителей варианта С синхронизация гамма-ритма была больше при восприятии стимула “слово”, чем стимула “псевдослово”, в отведении F7 (p < 0.001). У носителей варианта АА не выявлено значимых эффектов. В группе пациентов значимых эффектов также не было.
При анализе десинхронизации гамма-ритма в теменных, затылочных и теменно-затылочных областях выявлено значимое влияние взаимодействия факторов “стимул” × “полушарие” × “генотип” (F(2, 364) = 5.20, p = = 0.007). Эффекта фактора “группа” не выявлено. Апостериорный анализ по общей выборке испытуемых показал, что у испытуемых с вариантом АА десинхронизация гамма-ритма в затылочной области правого полушария больше, чем десинхронизация левого только при восприятии стимула “слово”: O1 < O2 (p < 0.01). У испытуемых с вариантом С преобладание десинхронизации в правом полушарии по сравнению с левым выявлено как при чтении слов, так и псевдослов во всех анализируемых отведениях: Р3 < Р4 (p < 0.05), O1 < O2 (p < 0.001), Т5 < Т6 (p < 0.001). Величина десинхронизации этого ритма у вариантов С и АА не различалась.
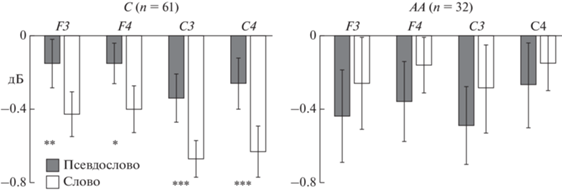
Десинхронизация мю-ритма в центральных и фронтальных областях во временном окне 290–350 мс. На общей выборке испытуемых выявлено значимое взаимодействие факторов “стимул” × “группа” × “генотип” (F(1, 182) = 5.37, p = 0.022). У здоровых испытуемых (“стимул” × “генотип” F(1, 91) = 7.08, p = 0.009) достоверно различалась десинхронизация мю-ритма при восприятии двух типов вербальных стимулов у носителей варианта С во всех анализируемых корковых областях, но не у носителей варианта АА. Апостериорный анализ показал, что у испытуемых с вариантом С подавление мю-ритма было больше при чтении слов, чем псевдослов в отведениях F3, F4, C3 и C4 (рис. 4). Величина десинхронизации этого ритма у носителей вариантов АА и С не имела различий.
Рис. 4.
Десинхронизация мю-ритма ЭЭГ (290–350 мс) при восприятии разных типов вербальных стимулов у здоровых испытуемых. С – носители аллеля С, АА – носители генотипа АА. * – p < 0.05, ** – p < 0.01, *** – p < 0.001. Fig. 4. Desynchronization of mu-rhythm (290–350 ms) in the perception of various types of verbal stimuli. С – carriers of allele С, AA – carriers of the genotype AA. * – p < 0.05, ** – p < 0.01, *** – p < 0.001.
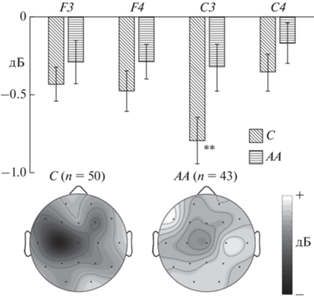
В группе пациентов выявлен значимый эффект взаимодействия факторов “электрод” × “полушарие” × “генотип” (F(1, 91) = = 6.848, p = 0.010). Апостериорный анализ показал, что вне зависимости от типа стимула у носителей аллеля С подавление мю-ритма в отведении С3 было больше, чем у группы АА (p < 0.05) (рис. 5). У носителей аллеля С также наблюдалась асимметрия десинхронизации мю-ритма: этот показатель был больше в отведении С3, чем С4 (p < 0.001).
Рис. 5.
Десинхронизация мю-ритма ЭЭГ (290–350 мс), усредненная по двум типам вербальных стимулов, у больных шизофренией и расстройствами шизофренического спектра. С – носители аллеля С, АА – носители генотипа АА. ** – p < 0.01. Fig. 5. Desynchronization of mu-rhythm (290–350 ms), averaged on two types of verbal stimuli in patients with schizophrenia and schizophrenia spectrum disorders: С – carriers of allele С, AA – carriers of the genotype AA. ** – p < 0.01.
Корреляционный анализ значимых нейрофизиологических показателей и выраженности психопатологической симптоматики по шкале PANSS у пациентов. В корреляционный анализ были включены семь подшкал выраженности позитивных и семь подшкал выраженности негативных симптомов, сумма позитивных и сумма негативных симптомов, с одной стороны, и показатели синхронизации тета-ритма, усредненной по шести корковым областям и двум типам стимулов, синхронизации гамма-ритма в левой передне-височной области (F7), а также десинхронизации мю-ритма в левой центральной области (С3), с другой стороны. Анализ проводили как для общей группы пациентов (5-процентный уровень значимости с поправкой на множественные сравнения, р = 0.0035), а также отдельно для носителей вариантов АА и С (5-процентный уровень значимости с поправкой на множественные сравнения, р = 0.0017). В общей выборке пациентов, а также отдельно у носителей аллеля С не выявлено значимых корреляций. У носителей варианта АА сниженные показатели десинхронизации мю-ритма коррелировали с выраженностью негативного симптома “Спонтанность и плавность речи” (N6): r = 0.474, p = 0.0013.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что при зрительном восприятии вербальных стимулов полиморфизм rs1344706 гена ZNF804A ассоциируется с индуцированными тета (130–210 мс после стимула), гамма (180–230 мс) и мю (290–350 мс) осцилляциями. Однако значимых эффектов генетического влияния во временном окне 105–145 мс для индуцированной альфа-, бета1- и бета2-активности, а также синхронизации и десинхронизации бета2-ритма во временном окне 180–230 мс не было выявлено. Такая избирательность эффекта полиморфизма rs1344706 на нейрофизиологические показатели зрительного восприятия вербальной информации может свидетельствовать о его частотной и временнóй специфичности. Анализ ассоциаций полиморфизма rs1344706 гена ZNF804A с индуцированными осцилляторными колебаниями мозга при чтении проведен впервые.
В исследованиях осцилляторной активности во время чтения обнаруживается усиление синхронизации тета-ритма, в том числе в задних корковых зонах (Goto et al., 2011; Meyer et al., 2015). Нами показано, что как у здоровых испытуемых, так и у пациентов синхронизация тета-ритма на этапе переработки вербальной информации около 170 мс снижена у носителей генотипа АА по сравнению с вариантом С. Следует отметить, что пониженная тета-активность в затылочных корковых зонах при чтении наблюдается и у людей с дислексией (Fraga González et al., 2016). Многие авторы отмечают схожесть дефицитов навыков чтения при шизофрении и дислексии (метаанализ Vanova et al., 2021), а ZNF804A может влиять на когнитивные функции, имеющие отношение к чтению и правописанию у людей с шизофренией и дислексией (Becker et al., 2012).
В настоящей работе полиморфизм rs1344706 гена ZNF804A оказывал влияние на характер синхронизации тета-ритма в задних областях левого полушария у здоровых испытуемых. Синхронизация тета-ритма в этих корковых зонах была снижена у носителей генотипа АА. У испытуемых с вариантом С, в отличие от генотипа АА, при восприятии слов и псевдослов выявлено преимущественное преобладание синхронизации этого ритма в левом полушарии по сравнению с правым. Этап переработки зрительно предъявляемой вербальной информации около 170 мс, когда в нашем исследовании наблюдался максимум синхронизации тета-ритма в задних корковых зонах, совпадает по времени развертывания с компонентом вызванных потенциалов N170. Этот компонент ассоциируют с активацией области зрительной формы слова при чтении (Brem et al., 2010). Также известно, что функционирование этой области частично определяется генетическими факторами (Pinel et al., 2015). По-видимому, в нашем исследовании у здоровых испытуемых – носителей варианта риска развития шизофрении наблюдался дефицит активации области зрительной формы слова при восприятии вербальных стимулов.
В нашем исследовании синхронизация гамма-ритма во временно́м окне 180–230 мс была больше у здоровых испытуемых по сравнению с больными шизофренией и расстройствами шизофренического спектра в отведении F7 (проекция зоны Брока), однако эффект полиморфизма ZNF804A не был значим. Возможно, в этом случае роль играют другие гены, например, недавно было показано, что у пациентов с первым эпизодом болезни гены, родственные FOXP2, играют критическую роль в функциональном нарушении связи (по данным фМРТ в состоянии покоя) между зоной Брока и передней поясной корой (Du et al., 2021).
В отличие от больных шизофренией, у здоровых испытуемых показано модулирующее влияние полиморфных вариантов ZNF804A rs1344706 на синхронизацию гамма-ритма в лобно-височной корковой зоне левого полушария. У носителей варианта С синхронизация была больше на стимул “слово”, чем “псевдослово”, тогда как у испытуемых с вариантом АА категориальные различия по этому показателю не выявлены. С пониманием языка многие исследователи связывают бета- и гамма-колебания (см. обзор Lewis et al., 2015). В ряде работ показано, что мощность в гамма-диапазоне увеличивалась при предъявлении слов, подходящих по смыслу к предложению, это увеличение отсутствовало при нарушении семантики предложения (Hald et al., 2006; Rommers et al., 2013). Используя нейронную модель речевых областей левого полушария, также было продемонстрировано, что спектральная мощность в диапазоне 20–40 Гц была больше для слов, чем для псевдослов (Garagnani et al., 2017).
В том же временно́м интервале, когда нами наблюдалась синхронизация гамма-активности в левой лобно-височной области при восприятии вербальной информации, была выражена десинхронизация этого ритма преимущественно в правом полушарии (рис. 3). У носителей аллеля С межполушарная асимметрия десинхронизации гамма-ритма была значима для теменных, затылочных и теменно-затылочных областей, тогда как у носителей генотипа АА – только затылочных. В процессе переработки вербальной информации участвует распределенная сеть мозговых областей, охватывающих в том числе и правое полушарие (Poeppel et al., 2012). В то же время известно об участии теменных областей в процессах внимания и памяти (например, Agosta et al., 2017). В настоящее время мы установили тот факт, что rs1344706 оказывает влияние на активность теменных и затылочных областей в процессе чтения во временно́м интервале около 200 мс. Нельзя исключить предположения о том, что у носителей генотипа АА наблюдаются изменения во внимании, связанные с семантической обработкой. Действительно, функциональные эффекты полиморфизма rs1344706 могут распространяться на широкий спектр процессов, задействованных в переработке информации, в том числе связанных с вниманием и памятью (Linden et al., 2013).
С лингвистическими процессами ассоциируется и мю-ритм (см. обзор (Ларионова и др., 2022)). Например, при предъявлении предложений с описанием действий наблюдалось подавление мю-ритма, аналогичное наблюдению за реальными движениями (Moreno et al., 2013). Показано также, что во время пассивного прослушивания речи происходит автоматическая активация моторных и премоторных областей мозга, отражающаяся в показателе подавления мю-ритма (Oliveira et al., 2021). В нашем исследовании было обнаружено, что полиморфные варианты ZNF804A rs1344706 у здоровых испытуемых, так же, как и на гамма-частоте, модулируют восприятие смысловой и бессмысленной вербальной информации. У носителей аллеля С десинхронизация мю-ритма в центральных и фронтальных областях во временно́м окне 290–350 мс была больше на стимул “слово”, чем “псевдослово”, тогда как у испытуемых с вариантом АА не выявлено категориальных различий при восприятии разных типов стимулов по этому показателю. Существуют сведения о том, что десинхронизация мю-ритма после 150 мс во время чтения слов родного языка больше, чем при чтении слов неродного языка. Это, по мнению авторов, может говорить о том, что увеличение лингвистического опыта приводит к более сильной сенсомоторной активации (Vukovic, Shtyrov, 2014). В нашем эксперименте для стимула “псевдослово” у испытуемых отсутствовал какой-либо лингвистический опыт.
У больных шизофренией и расстройствами шизофренического спектра не выявлено значимого влияния генетических вариантов на нейрофизиологические показатели при чтении разных типов стимулов, в отличие от здоровых испытуемых. В целом у пациентов с генотипом АА, по сравнению с вариантом С, обнаружена сниженная синхронизация тета-ритма в теменных, затылочных и теменно-височных областях и сниженная десинхронизация мю-ритма в левом центральном отведении. Такой дефицит десинхронизации мю-ритма у пациентов – носителей генотипа АА был в нашем исследовании корреляционно связан со шкалой негативных симптомов по шкале PANSS, в частности “Спонтанность и плавность речи”. Ассоциация генотипа АА гена ZNF804A и специфических нарушений речи при шизофрении требует дальнейшего изучения.
Наблюдаемая нами десинхронизация мю-ритма при восприятии вербальной информации отмечалась во временном окне, соответствующем развертыванию компонента Р300 вызванного потенциала. Компонент Р300 исследуется и в парадигмах, требующих лексического решения (например, Alday, Kretzschmar, 2019). Также этот компонент рассматривается в качестве одного из биомаркеров нейрокогнитивных аномалий как при хронической шизофрении, так и при первом эпизоде болезни, имеющих высокую прогностическую ценность для этого заболевания (Tang et al., 2020). На выборке здоровых испытуемых было показано, что вариабельность латентности компонента Р3b была более изменчива у варианта AA, чем у носителей аллеля C (Saville et al., 2015).
Следует отметить, что в настоящее время мы не можем ответить на вопрос о том, что именно может быть причиной выявленных нами отличий у носителей разных вариантов интронного полиморфизма. Функции полиморфизма rs1344706 (A/C), в частности его влияние на экспрессию мРНК или белка, до сих пор не установлены. Предполагают, что аллель А является индексным аллелем в составе гаплотипа, связанного с уровнем экспрессии, также выявлена аллель-специфическая аффинность к белку неизвестной природы при исследовании методом сдвига электрофоретической подвижности и обнаружена связь rs1344706 с экспрессией гена в лимфобластоидных клеточных культурах (обзор (Hess J.L., Glatt S.J., 2014)). Исследование образцов эмбрионального головного мозга выявило укороченный транскрипт ZNF804A, экспрессия мРНК которого была связана с полиморфизмом rs1344706, что может быть частью механизма, с помощью которого варианты rs1344706 влияют на риск развития психоза (Tao et al., 2014).
У настоящего исследования имеется ряд ограничений. Несмотря на то, что корректнее было бы анализировать нейрофизиологические параметры отдельно для каждого генотипа (АА, АС и СС), мы объединили носителей вариантов АС и СС в общую выборку аллеля С, поскольку носителей генотипа СС было недостаточно для статистического анализа как в группе здоровых испытуемых, так и пациентов. Также в общую когорту больных были объединены нозологические группы шизофрении, шизоаффективного и шизотипического расстройств. Впрочем, есть данные о том, что генотип АА связан с риском шизофрении вне зависимости от клинической группы (Лежейко и др., 2020).
Таким образом, ZNF804A модулирует нейрофизиологические параметры когнитивных характеристик, имеющих отношение к чтению. В то же время, по данным GWAS, его полиморфизм rs1344706 ассоциирован с шизофренией (O’Donovan et al., 2008). В настоящее время широко обсуждаются пути исследования лингвистических аномалий при шизофрении и их генетических детерминант (DeLisi 2021; Palaniyappan et al., 2021). Исследование временнóй динамики синхронизации/десинхронизации ритмов ЭЭГ и влияния на эту активность генетического фактора может быть перспективным для будущих работ, направленных на понимание патофизиологии языковых расстройств при шизофрении.
ВЫВОДЫ
1. Полиморфизм rs1344706 гена ZNF804A оказывает модулирующее влияние на индуцированную осцилляторную активность при зрительном восприятии вербальной информации на определенных этапах мозговой обработки информации в частотных диапазонах тета-, мю- и гамма-ритмов, что может говорить о частотно-временнóй специфичности этих эффектов.
2. Обнаружен значимый эффект полиморфизма rs1344706 гена ZNF804A на паттерны синхронизации тета- и десинхронизации гамма-ритмов у всех испытуемых вне зависимости от наличия или отсутствия клинического статуса, что может указывать на то, что ZNF804A влияет на широкий спектр процессов, задействованных в переработке вербальной информации.
3. У здоровых испытуемых синхронизация гамма-ритма в левой передне-височной области и десинхронизация мю-ритма во фронтальных и центральных корковых зонах была больше при чтении слов, чем псевдослов, только у носителей варианта С, но не у генотипа АА, что может свидетельствовать о дефиците механизмов категоризации вербальных стимулов у носителей генотипа АА.
4. У больных шизофренией не выявлено значимого влияния полиморфизма rs1344706 на нейрофизиологические показатели при чтении разных типов стимулов, в отличие от здоровых людей. Однако у пациентов с генотипом АА снижена десинхронизация мю-ритма в левом центральном отведении по сравнению с вариантом С. Вместе с тем этот дефицит десинхронизации корреляционно связан с выраженностью симптома, связанного с нарушениями спонтанности и плавности речи, что указывает на вклад изученного полиморфизма в вариативность речевых нарушений при шизофрении.
Список литературы
Голимбет В.Е., Гарах Ж.В., Коровайцева Г.И., Лежейко Т.В., Зайцева Ю.С., Гурович И.Я., Шмуклер А.Б., Родионов Г.И., Стрелец В.Б. Связь генов нейротрофического мозгового фактора и переносчика серотонина с параметрами ранних компонентов вызванных потенциалов при пассивном восприятии слов. Журн. высш. нервн. деят. им. И.П. Павлова. 2016. 66 (5): 556–564.
Ларионова Е.В., Гарах Ж.В., Зайцева Ю.С. Мю-ритм в современных исследованиях: теоретические и методологические аспекты. Журн. высш. нервн. деят. им. И.П. Павлова. 2022. 72 (1): 3–27.
Лежейко Т.В., Габаева М.В., Колесина Н.Ю., Голимбет В.Е. Исследование влияния гена ZNF804А и родовых осложнений на клинические особенности шизофрении. Генетика. 2019. 55 (6): 701–706.
Лежейко Т.В., Габаева М.В., Крикова Е.В., Голимбет В.Е. Полиморфизм гена ZNF804A rs1344706 и клиническая гетерогенность шизофрении. Научные результаты биомедицинских исследований. 2020. 6 (1): 51–62.
Новотоцкий-Власов В.Ю. Анализ постстимульных изменений ЭЭГ, не выявляемых методом когерентного накопления. Диссертация к.б.н. 2000.
Стрелец В.Б., Гарах Ж.В., Марьина И.В., Зайцева Ю.С., Гурович И.Я. Временны́е характеристики начальной стадии обработки вербальной информации в норме и при шизофрении. Журн. высш. нервн. деят. им. И.П. Павлова. 2012. 62 (2): 165–173.
Agosta S., Magnago D., Tyler S., Grossman E. The pivotal role of the right parietal lobe in temporal attention. Journal of Cognitive Neuroscience. 2017. 29: 805–815.
Alday P.M., Kretzschmar F. Speed-Accuracy Tradeoffs in Brain and Behavior: Testing the Independence of P300 and N400 Related Processes in Behavioral Responses to Sentence Categorization. Frontiers in Human Neuroscience. 2019. 13.
Anitha A., Thanseem I., Nakamura K., Vasu M.M., Yamada K., Ueki T., Iwayama Y., Toyota T., Tsuchiya K.J., Iwata Y., Suzuki K., Sugiyama T., Tsujii M., Yoshikawa T., Mori N. Zinc finger protein 804A (ZNF804A) and verbal deficits in individuals with autism. Journal of psychiatry & neuroscience: JPN. 2014. 39 (5): 294–303.
Araki T., Hirata M., Yanagisawa T., Sugata H., Onishi M., Watanabe Y., Ogata S., Honda C., Hayakawa K., Yorifuji Sh. Language-related cerebral oscillatory changes are influenced equally by genetic and environmental factors. Neuroimage. 2016. 142: 241–247.
Bastiaansen M., Hagoort P. Oscillatory neuronal dynamics during language comprehension. Progress in brain research. 2006. 159: 179–196.
Becker J., Czamara D., Hoffmann P., Landerl K., Blomert L., Brandeis D., Vaessen A., Maurer U., Moll K., Ludwig K.U., Müller-Myhsok B., Nöthen M.M., Schulte-Körne G., Schumacher J. Evidence for the involvement of ZNF804A in cognitive processes of relevance to reading and spelling. Translational psychiatry. 2012. 2 (7): e136.
Benjamini Y., Hochberg Y. Controlling the false discovery rate – a practical and powerful approach to multiple testing. Journal of the Royal Statistical Society. Series B. 1995. 57: 289–300.
Brem S., Bach S., Kucian K., Guttorm T.K., Martin E., Lyytinen H., Brandeis D., Richardson U. Brain sensitivity to print emerges when children learn letter-speech sound correspondences. Proc. Natl. Acad. Sci. USA. 2010. 107 (17): 7939–7944.
Carreiras M., Armstrong B.C., Perea M., Frost R. The what, when, where, and how of visual word recognition. Trends Cogn. Sci. 2014. 18 (2): 90–98.
Chang H., Xiao X., Li M. The schizophrenia risk gene ZNF804A: clinical associations, biological mechanisms and neuronal functions. Mol Psychiatry. 2017. 22: 944–953.
De Boer J.N., van Hoogdalem M., Mandl R.C.W., Brummelman J., Voppel A.E., Begemann M.J.H., Voppel A.E., Begemann M.J.H., van Dellen E., Wijnen F.N.K., Sommer I.E.C. Language in schizophrenia: relation with diagnosis, symptomatology and white matter tracts. npj Schizophrenia. 2020. 6 (1): 1–10.
Dehaene S., Cohen L. The unique role of the visual word form area in reading. Trends in Cognitive Sciences. 2011. 15 (6): 254–262.
DeLisi L.E. Historical pursuits of the language pathway hypothesis of schizophrenia. npj Schizophr. 2021. 7: 53.
Dias E.C., Sheridan H., Martínez A., Sehatpour P., Silipo G., Rohrig S., Hochman A., Butler P.D., Hoptman M.J., Revheim N., Javitt D.C. Neurophysiological, Oculomotor, and Com-putational Modeling of Impaired Reading Ability in Schizophrenia. Schizophrenia bulletin. 2021. 47 (1): 97–107.
Du J., Palaniyappan L., Liu Z., Cheng W., Gong W., Zhu M., Feng J. The genetic determinants of language network dysconnectivity in drug-naïve early stage schizophrenia. npj Schizophr. 2021. 7(1): 1–10.
Ford J. Schizophrenia: The broken P300 and beyond. Psychophysiology. 1999. 36 (6): 667–682.
Fraga González G., Van der Molen M.J.W., Žarić G., Bonte M., Tijms J., Blomert L., Stam C.J., Van der Molen M.W. Graph analysis of EEG resting state functional networks in dyslexic readers. Clin Neurophysiol. 2016. 127 (9): 3165–3175.
Garagnani M., Lucchese G., Tomasello R., Wennekers T., Pulvermüller F. A Spiking Neurocomputational Model of High-Frequency Oscillatory Brain Responses to Words and Pseudowords. Frontiers in Computational Neuroscience. 2017. 10: 145.
Garakh Z., Novototsky-Vlasov V., Larionova E., Zaytseva Y. Mu rhythm separation from the mix with alpha rhythm: Principal component analyses and factor topography. Journal of Neuroscience Methods. 2020. 346: 108892.
Golimbet V., Garakh Zh., Zaytseva Y., Alfimova M., Lezheiko T., Kondratiev N., Shmukler A., Gurovich I., Strelets V.B. The Dopamine Receptor D2 C957T Polymorphism Modulates Early Components of Event-Related Potentials in Visual Word Recognition Task. Neuropsychobiology. 2018. 76: 143–150.
Goto T., Hirata M., Umekawa Y., Yanagisawa T., Shayne M., Saitoh Y., Kishima H., Yorifuji S., Yoshimine T. Frequency-dependent spatiotemporal distribution of cerebral oscillatory changes during silent reading: a magnetoencephalograhic group analysis. Neuroimage. 2011 54 (1): 560–567.
Hald L.A., Bastiaansen M., Hagoort P. EEG theta and gamma responses to semantic violations in online sentence processing. Brain and Language. 2006. 96 (1): 90–105.
Hauk O., Pulvermuller F. Neurophysiological distinction of action words in the fronto-central cortex. Hum. Brain Mapp. 2004. 21: 191–201.
Hederih J., Nuninga J.O., van Eijk K., van Dellen E., Smit D.J.A., Oranje B., Luykx J.J. Genetic underpinnings of schizophrenia-related electroencephalographical interme-diate phenotypes: A systematic review and meta-analysis. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2021. 104: 110001.
Hess J.L., Glatt S.J. How might ZNF804A variants influence risk for schizophrenia and bipolar disorder? A literature review, synthesis, and bioinformatic analysis. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics. 2014. 165B: 28–40.
Huang Y., Huang J., Zhou Q.X., Yang C.X., Yang C.P., Mei W.Y., Ding Y.Q. ZFP804A mutant mice display sex-dependent schizophrenia-like behaviors. Molecular psychiatry. 2020. 1–19.
Jeon Y.W., Polich J. Meta-analysis of P300 and schizophrenia: Patients, paradigms, and practical implications. Psychophysiology. 2003. 40 (5): 684–701.
Kay S.R., Fizbein A., Opler L.A. The Positive and Negative Symptom Scale (PANSS) for schizophrenia. Schizophr. Bull. 1987. 13: 261–276.
Lewis A.G., Wang L., Bastiaansen M. Fast oscillatory dynamics during language comprehension: Unification versus maintenance and prediction? Brain Lang. 2015. 148: 51–63.
Linden D.E., Lancaster T.M., Wolf C., Baird A., Jackson M.C., Johnston S.J., Thome J. ZNF804A genotype modulates neural activity during working memory for faces. Neuropsychobiology. 2013. 67 (2): 84–92.
Meyer L., Grigutsch M., Schmuck N., Gaston P., Friederici A.D. Frontal-posterior theta oscillations reflect memory retrieval during sentence comprehension. Cortex. 2015. 71: 205–218.
Moreno I., de Vega M., León I. Understanding action language modulates oscillatory mu and beta rhythms in the same way as observing actions. Brain Cogn. 2013. 82 (3): 236–242.
Murphy E., Benítez-Burraco A. Language deficits in schizophrenia and autism as related oscillatory connectomopathies: an evolutionary account. Neuroscience & Biobehavioral Reviews. 2017. 83: 742–764.
Murphy E., Benítez-Burraco A. Toward the Language Oscillogenome. Frontiers in psychology. 2018. 9: 1999.
Nicodemus K.K., Elvevåg B., Foltz P.W., Rosenstein M., Diaz-Asper C., Weinberger D.R. Category fluency, latent semantic analysis and schizophrenia: a candidate gene approach. Cortex. 2014. 55: 182–191.
O’Donovan M.C., Craddock N., Norton N., Williams H., Peirce T., Moskvina V., Nikolov I., Hamshere M., Carroll L., Georgieva L. Identification of loci associated with schizophrenia by genome-wide association and follow-up. Nat Genet. 2008. 40 (9): 1053–1055.
Oliveira D.S., Saltuklaroglu T., Thornton D., Jenson D., Harkrider A.W., Rafferty M.B., Casenhiser D.M. Mu rhythm dynamics suggest automatic activation of motor and premotor brain regions during speech processing. Journal of Neurolinguistics. 2021. 60: 101006.
Palaniyappan L., Du J., Zhang J., Feng J. Reply to: “Historical pursuits of the language pathway hypothesis of schizophrenia”. NPJ schizophrenia. 2021. 7 (1): 1–3.
Pfurtscheller G., Lopes da Silva F.H. Event-related EEG/MEG synchronization and desynchronization: Basic principles. Clinical Neurophysiology. 1999. 110 (11): 1842–1857.
Pinel P., Lalanne C., Bourgeron T., Fauchereau F., Poupon C., Artiges E., Dehaene S. Genetic and environmental influences on the visual word form and fusiform face areas. Cerebral Cortex. 2015. 25 (9): 2478–2493.
Poeppel D., Emmorey K., Hickok G., Pylkkänen L. Towards a new neurobiology of language. J. Neurosci. 2012. 32 (41): 14125–14131.
Revheim N., Corcoran C.M., Dias E., Hellmann E., Martinez A., Butler P.D., Lehrfeld J.M., DiCostanzo J., Albert J., Javitt D.C. Reading deficits in schizophrenia and individuals at high clinical risk: relationship to sensory function, course of illness, and psychosocial outcome. The American journal of psychiatry. 2014. 171 (9): 949–959.
Rommers J., Dijkstra T., Bastiaansen M. Context-dependent semantic processing in the human brain: Evidence from idiom comprehension. Journal of Cognitive Neuroscience. 2013. 25 (5): 762–776.
Saville C.W., Lancaster T.M., Davies T.J., Toumaian M., Pappa E., Fish S., Feige B., Bender S., Mantripragada K.K., Linden D.E., Klein C. Elevated P3b latency variability in carriers of ZNF804A risk allele for psychosis. Neuroimage. 2015. 116: 207–213.
Smit D.J., Boersma M., van Beijsterveldt C.E., Posthuma D., Boomsma D.I., Stam C.J., de Geus E.J. Endophenotypes in a dynamically connected brain. Behav Genet. 2010. 40 (2): 167–177.
Takashima A., Ohta K., Matsushima E., Toru M. The event-related potentials elicit-ed by content and function words during the reading of sentences by patients with schizophrenia. Psychiatry Clin Neurosci. 2001. 55 (6): 611–618.
Tang Y., Wang J., Zhang T., Xu L., Qian Z., Cui H., Niznikiewicz M.A. P300 as an index of transition to psychosis and of remission: data from a clinical high risk for psychosis study and review of literature. Schizophrenia research. 2020. 226: 74–83.
Tao R., Cousijn H., Jaffe A.E., Burnet P.W., Edwards F., Eastwood S.L., Shin J.H., Lane T.A., Walker M.A., Maher B.J., Weinberger D.R., Harrison P.J., Hyde T.M., Kleinman J.E. Expression of ZNF804A in human brain and alterations in schizophrenia, bipolar disorder, and major depressive disorder: a novel transcript fetally regulated by the psychosis risk variant rs1344706. JAMA Psychiatry. 2014. 71 (10): 1112–1120.
Uhlhaas P.J., Singer W. Oscillations and neuronal dynamics in schizophrenia: the search for basic symptoms and translational opportunities. Biological psychiatry. 2015. 77 (12): 1001–1009.
Vanova M., Aldridge-Waddon L., Jennings B., Puzzo I., Kumari V. Reading skills deficits in people with mental illness: A systematic review and meta-analysis. Eur Psychiatry. 2021. 64 (1): e19.
Vukovic N., Shtyrov Y. Cortical motor systems are involved in second-language comprehension: evidence from rapid mu-rhythm desynchronization. NeuroImage. 2014. 102: 695–703.
Xu T., Stephane M., Parhi K.K. Multidimensional analysis of the abnormal neural oscillations associated with lexical processing in schizophrenia. Clinical EEG and neuroscience. 2013. 44 (2): 135–143.
Zhang Y., Yan H., Liao J., Yu H., Jiang S., Liu Q., Yue W. ZNF804A Variation May Affect Hippocampal-Prefrontal Resting-State Functional Connectivity in Schizophrenic and Healthy Individuals. Neurosci Bull. 2018. 34 (3): 507–516.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


