Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 52-61
Оценка эффективности управления мозг-компьютерным интерфейсом при обучении воображению движений верхних и нижних конечностей
Е. В. Боброва 1, *, В. В. Решетникова 1, Е. А. Вершинина 1, А. А. Гришин 1, М. Р. Исаев 2, 3, П. Д. Бобров 2, 3, Ю. П. Герасименко 1
1 ФГБУН Институт физиологии РАН им. И.П. Павлова
Санкт-Петербург, Россия
2 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
3 Институт трансляционной медицины ГБОУ ВПО Российского национального исследовательского
медицинского университета им. Н.И. Пирогова
Москва, Россия
* E-mail: eabobrovy@gmail.com
Поступила в редакцию 08.04.2022
После доработки 29.06.2022
Принята к публикации 31.10.2022
- EDN: GJESWY
- DOI: 10.31857/S0044467723010069
Аннотация
Эффективность управления мозг-компьютерным интерфейсом (ИМК) и успешность воображения движений верхних и нижних конечностей оценивали по точности распознавания ЭЭГ-сигналов мозга (точность классификации) при воображении движений кистей, стоп и локомоции в процессе 10-дневного обучения 10 волонтеров. В среднем по испытуемым в первый день обучения точность классификации выше при воображении локомоции, чем движений стоп, во второй день – кистей, чем локомоции, в пятый день – стоп, чем кистей. В среднем по группе выявлено значимое увеличение точности классификации к 3-му дню обучения воображению движению кистей и стоп, затем в ходе обучения точность классификации уменьшается и вновь растет. При обучении воображению локомоции точность классификации значимо не меняется. Оценка динамики индивидуальных изменений точности классификации по линейным трендам показала, что у троих участников обучение приводило к увеличению точности классификации (движений кистей и локомоции – у одного, стоп – у двоих); у троих – к уменьшению (движений кистей и локомоции – у одного, у второго – локомоции, стоп – у третьего). У четырех участников, как и в среднем по выборке, значимых изменений не было. Результаты обсуждаются в аспекте изменений активности структур мозга при обучении и в зависимости от типа воображаемых движений.
ВВЕДЕНИЕ
Системы “интерфейс мозг-компьютер” (ИМК), основанные на кинестетическом воображении движений, применяются в нейрореабилитации пациентов с нарушениями движений, в частности возникших в результате инсульта (Kruse et al., 2020; Столбков и др., 2018; Столбков, Герасименко, 2021). Наиболее исследованная в этой сфере область – реабилитация верхних конечностей (Khan et al., 2020; Frolov et al., 2017). Использование же ИМК для реабилитации нижних конечностей, как предполагается, имеет свои методические трудности (см. обзор (Боброва и др., 2019)), связанные с тем, что представительство ног в моторной коре располагается в продольной щели головного мозга и зарегистрировать сигналы структур мозга, участвующих в активации нижних конечностей, при помощи электроэнцефалографии (ЭЭГ), которая часто используется в системах ИМК, достаточно сложно. В связи с этим возникает потребность сравнить реальную точность классификации сигналов мозга при использовании ИМК для верхних и нижних конечностей.
В литературе имеются немногочисленные данные о сравнении точности классификации состояний мозга при воображении верхних и нижних конечностей. Yi и соавт. (2013) сравнивали активность мозга при воображении простых движений (правая рука, левая рука, ступни) и сложных координированных движений (обе руки, правая рука и левая нога, левая рука и правая нога). Показано, что при воображении движений каждой кисти по отдельности активируются соответствующие контралатеральные области моторного представительства мышц верхних конечностей, при одновременном воображении движений обеих рук эти области активируются одновременно, причем сильнее в левом полушарии (что, вероятно, объясняется праворукостью). При воображении движений стоп происходит активация среднецентральной области сенсомоторной коры, а при одновременном воображении движений верхней конечности и контралатеральной нижней конечности кроме среднецентральной области активируются и обе области представительства рук (Yi et al., 2013).
Сравнение активности коры методом фБИК-спектроскопии показало, что различие активности при воображении движений верхних конечностей (постукивание пальцами левой и правой руки) больше, чем нижних (постукивание носками левой и правой стопы) (Batula et al., 2017).
Сравнение точности классификации состояний мозга при воображении движений стоп и кистей было проведено в работе (Müller–Putz et al., 2013). Для стоп точность классификации составила 69 ± 13 (μ ± σ), а для кистей – 60 ± 8, что означает, что успешность воображения стоп была не хуже, чем для кистей.
Также малоизученным является вопрос о динамике обучения управлению ИМК, основанным на воображении движений как верхних, так и нижних конечностей. Большая часть всех исследований, в которых можно найти информацию о ходе обучения управлению ИМК, посвящены проверке гипотез о влиянии тренинга (Stieger et al., 2020) или дополнительной обратной связи – при успешном воображении движений запускается либо функциональная электростимуляция (ФЭС) (Irimia et al., 2018; Qui et al., 2018), либо движение ортезов (Buch et al., 2008). В подавляющем большинстве работ принимали участие постинсультные пациенты с различными нарушениями движений (Irirmia et al., 2018; Prasad et al., 2010; Buch et al., 2008; Perdikis et al., 2018; Qui et al., 2018), и лишь в нескольких – здоровые испытуемые (Stieger et al., 2020; Corsi et al., 2019). В большинстве исследований лишь у части пациентов наблюдались значимые улучшения точности классификации при обучении.
Предполагаемые методические трудности при использовании ИМК, основанных на воображении движений нижних конечностей, могут объяснять меньшее количество случаев их клинических применений (Боброва и др., 2019). Так, метаанализ клинических исследований (Kruze et al., 2020) выделяет только одну работу с ИМК такого типа (Mrachacz–Kersting et al., 2016). В ней было показано, что сочетание ИМК, основанного на представлении односуставного движения, и функциональной электрической стимуляции позволило достоверно увеличить показатели шкалы Фугл–Мейера, частоту теппинга стопой и увеличить скорость ходьбы по сравнению с тем случаем, когда стимуляция давалась независимо от работы ИМК.
В данной работе осуществляется сравнение успешности воображения движений верхних и нижних конечностей, используемых в клинике для реабилитации: разжимания кисти, тыльного сгибания стопы и локомоции; проводится анализ динамики обучения воображению этих движений при управлении ИМК.
МЕТОДИКА
В экспериментах принимали участие 10 здоровых испытуемых (5 мужчин и 5 женщин) в возрасте 21–35 лет. Протокол исследования соответствовал требованиям Хельсинкской декларации и был одобрен Этической комиссией Института физиологии им. И.П. Павлова РАН. Исследования проводили с соблюдением основных биоэтических правил, все испытуемые дали письменное согласие на участие в экспериментах.
Каждый испытуемый принял участие в 10 сессиях (1 сессия в день в течение 10 дней подряд). Одна сессия включала в себя три сеанса управления ИМК со зрительной обратной связью: при представлении разжимания правой или левой кисти, тыльного сгибания правой или левой стопы, локомоции, начинающейся с правой или левой ноги. Перед началом каждой сессии испытуемым давалась инструкция осуществлять вышеуказанные движения и обращать при этом внимание на кинестетические ощущения, а в процессе эксперимента только воображать кинестетические ощущения при этих движениях.
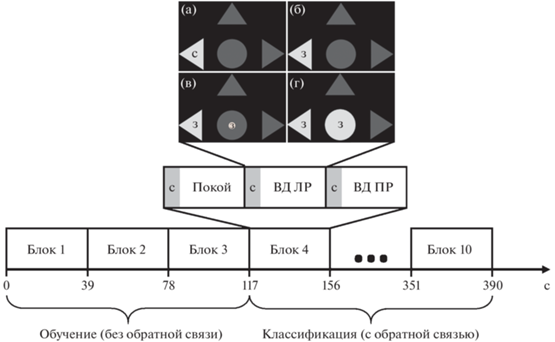
Каждый сеанс управления ИМК состоял из 10 последовательных блоков. Каждый блок содержал три инструкции, подаваемые в случайном порядке: расслабиться, представлять движение левой или правой конечности (или локомоции, начинающейся с правой или левой ноги). Инструкции подавались путем изменения цвета одной из трех стрелок (рис. 1 (а–г)): верхняя стрелка соответствовала задаче находиться в состоянии покоя, левая – представлять движение левой конечности (рис. 1 (б)), правая – правой. Синий цвет означал “приготовиться”, а зеленый – “выполнять задачу”. На протяжении первых трех блоков обратная связь не предъявлялась – полученные данные использовались для обучения классификатора. В течение следующих семи блоков обратная связь была включена. После каждого нового блока происходило дообучение классификатора с использованием вновь полученных данных. Обратная связь предъявлялась при помощи изменения размера (радиуса) зеленого круга в центральном сером круге (рис. 1 (в, г)). В случае, когда распознавалось выполнение задачи, соответствующей предъявляемой инструкции, радиус зеленого круга увеличивался (рис. 1 (г)), в противном случае уменьшался (рис. 1 (в)). Радиус изменялся от 0 (зеленый круг не виден) до 1.5 см (полностью заполняя центральный серый круг), он рос и уменьшался линейно, т.е. если была распознана команда, соответствующая инструкции, радиус увеличивался на фиксированный шаг, равный 1/30 от максимального радиуса, иначе – уменьшался на этот же шаг. Распознавание успешности выполнения задачи испытуемым происходило каждые 100 мс, т.е. при идеальном распознавании радиус становился максимальным за 3 сек.
Рис. 1.
Схема эксперимента. Вверху (а–г) — вид центральной части монитора, демонстрируемой испытуемому. Для примера показан один из трех возможных вариантов команды испытуемому – воображать движение левой руки (ВД ЛР); два других варианта команды аналогичны – воображать движение правой руки (ВД ПР) или находиться в покое (Покой), но подсвечиваются правый или верхний треугольник соответственно. (а) – подсветка треугольника синим цветом (С) – приготовиться к ВД; (б) – подсветка зеленым (З) выполнять ВД; (в), (г) – обратная связь об успешности воображения движения в виде подсвеченного зеленым (З) круга внутри центрального серого круга. Ниже: блок, содержащий три возможных варианта команды (Покой, ВД ПР, ВД ЛР), подаваемые в случайном порядке. Нижний ряд: 10 последовательно предъявляемых блоков, формирующих один сеанс управления ИМК. Остальные объяснения в тексте. Fig. 1. The scheme of the experiment. At the top (a–г) is a view of the central part of the monitor shown to the subject. For example, one of the three possible variants of the command to the subject is shown – to imagine the movement of the left hand (ВД ЛР); the other two variants of the command are similar – to imagine the movement of the right hand (ВД ПР) or to be at rest (Покой), but the right or upper triangle is highlighted, respectively. (а) – highlighting the triangle in blue (C) – get ready to imagine the movement; (б) – highlighting in green (З) – to perform to imagine the movement; (в), (г) – feedback on the success of the imagination of movement in the form of a green-highlighted (З) circle inside the central gray circle. Below: a block containing three possible variants of the command: to be at rest (Покой), to imagine the movement of the left hand (ВД ЛР), to imagine the movement of the left hand (ВД ЛР), submitted in random order. Bottom row: 10 sequentially presented blocks forming one IMC management session. The rest of the explanations are in the text.
ЭЭГ регистрировали с помощью беспроводного электроэнцефалографа SmartBCI (производства компании “Мицар”, Санкт-Петербург), обеспечивающего возможность записи ЭЭГ с 32 отведений. Электроэнцефалограф (вес 50 г) закреплялся в непосредственной близости от места контакта электродов с поверхностью головы, отсутствие длинного шлейфа позволяло минимизировать влияние сетевых помех и артефактов движения на регистрируемую ЭЭГ.
Для распознавания состояния покоя и выполнения задач на представление движений использовался квадратичный дискриминантный анализ, который эквивалентен Байесовскому подходу, предложенному в статье (Бобров и др., 2012) и успешно применявшемуся при внедрении ИМК в клиническую практику (Frolov et al., 2017; Bobrov et al., 2022). В отличие от работы (Бобров и др., 2012) вместо фильтрованной ЭЭГ на вход классификатора подавался сигнал, полученный после применения оптимальных пространственных фильтров, полученных при помощи метода общих пространственных паттернов (Common Spatial Patterns), обобщенного на случай более двух классов (Dornhege et al., 2003). Как показывает обзор (Lotte et al., 2018), метод Common Spatial Patterns не утратил популярности у разработчиков ИМК, является распространенным методом предобработки сигнала и может при малых вычислительных затратах увеличить точность классификации.
Для оценки качества классификации строилась нормированная матрица ошибок Q = (qij), элементами которой являлись оценки вероятностей того, что при инструкции испытуемому выполнять задачу j классификатор распознавал выполнение задачи i. Успешность воображения движений оценивалась по схожести паттернов активности мозга с таковыми при предыдущем выполнении этой же задачи. Численным показателем качества классификации P было среднее от диагональных элементов матрицы Q. P = 1 при идеальной классификации и P = 1/K при случайной классификации и числе классов K (уровень случайного гадания, chance-level, 0.33 в нашем эксперименте). Величина P – вероятность распознавания именно того ментального состояния, которое задавалось инструкцией, использовалась в этом исследовании для оценки точности классификации.
Проверку влияния типа воображаемого движения (кисти, стопы и локомоция) на точность классификации проводили с использованием однофакторного дисперсионного анализа для зависимых переменных по всем сессиям после предварительной проверки гипотезы об отклонении от нормальности с использованием критерия Колмогорова–Смирнова. Гипотезу о наличии линейного тренда оценок точности классификации в зависимости от дня обучения проверяли при помощи линейного регрессионного анализа. Расчеты проводились с использованием программного комплекса SPSS Inc. Статистические решения принимались на 5%-ном уровне.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Средняя по всем участникам и по 10 дням эксперимента точность классификации для воображения движений кистей составила 50.5 ± ± 7.9% (m ± SD) (минимальное значение – 41.7%, что выше уровня случайного гадания (33%), максимальное значение – 69.3%), стоп – 49 ± 7.4% (минимальное значение – 40.8, максимальное значение – 64.6%), локомоции – 49.4 ± 6.8% (минимальное значение – 47.4%, максимальное значение – 62.2%).
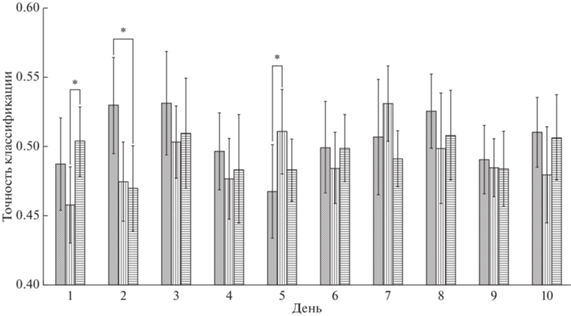
После получения результатов проверки гипотезы об отклонении от нормальности (ни для одной выборки отклонений не было выявлено), для каждого дня эксперимента был проведен однофакторный дисперсионный анализ для зависимых переменных ANOVA (фактор – тип движения: кисти/стопы/локомоция). Для 1-го дня получен значимый главный эффект F(2.8) = 6.83, р = 0.019, η2 = 0.631. Множественные сравнения (постхок) дают значимые различия между стопами и локомоцией (р = 0.004/0.011). В скобках здесь и ниже указаны значимости при использовании теста LSD (минимальная значимая разность) и поправки Бонферрони. Для 2-го дня получена тенденция к значимости (0.05 < p < 0.1) для главного эффекта F(2.8) = = 2.89, р = 0.1, η2 = 0.420. Тем не менее мы считаем необходимым привести результат множественных сравнений – значимые различия между кистями и локомоцией (р = = 0.004/0.1). Для 5-го дня получен значимый главный эффект F(2.8) = 4.52, р = 0.049, η2 = 0.531. Множественные сравнения дают значимые различия между кистями и стопами (р = 0.012/0.036).
Таким образом, успешность воображения движений в среднем по всем испытуемым в первый день выше при воображении локомоции, чем стоп, во второй день – кистей, чем локомоции, и в пятый день – стоп, чем кистей (рис. 1).
На протяжении периода обучения точность классификации при воображении движений кистей и стоп значимо меняется, при воображении локомоции наблюдается лишь тенденция (табл. 1, рис. 2). По сравнению с 1-м днем обучения на 3-й день значимо увеличивается точность классификации при воображении движений как кистей, так и стоп. Затем точность классификации для кистей значимо уменьшается от 3-го к 5-му дню и вновь увеличивается к 8-му дню. Колебания величины точности классификации для стоп не так очевидны, однако в 4-й и 10-й день она значимо меньше, чем в 5-й и 7-й день, а в 6-й – чем в 7-й.
Таблица 1.
Значимость различий точности классификации при воображении движений кистей, стоп и локомоции в разные дни обучения (↑ – увеличение точности классификации, ↓ – уменьшение) Table 1. Significance of differences of classification accuracy during motor imagery of hands, foot and locomotion on different training days (↑ – increase of classification accuracy, ↓ – decrease)
| Кисти | p | Стопы | p | Локомоция | p |
|---|---|---|---|---|---|
| 1–3 ↑ | 0.017* | 1–3 ↑ | 0.041* | 3–4 ↓ | 0.074 |
| 3–5 ↓ | 0.042* | 4–5 ↑ | 0.042* | ||
| 2–5 ↓ | 0.040* | 4–7 ↑ | 0.016* | ||
| 5–8 ↑ | 0.04* | 5–10 ↓ | 0.029* | ||
| 1–8 ↑ | 0.075 | 7–10 ↓ | 0.029* | ||
| 6–7 ↑ | 0.023* | ||||
| 1–7 ↑ | 0.08 | ||||
| 5–6 ↓ | 0.08 |
Рис. 2.
Точность классификации состояний мозга при воображении движений кистей (серый цвет), стоп (вертикальные полосы) и локомоции (горизонтальные полосы) с 1-го по 10-й день обучения. Среднее 10 испытуемых. Значимые отличия в точности классификации (p < 0.05) отмечены звездочкой (*). Fig. 2. Classification accuracy of brain states during motor imagery of hands (gray), feet (vertical stripes) and locomotion (horizontal stripes) from the 1st to the 10th day of training. Average of 10 subjects. Significant differences in classification accuracy (p < 0.05) are marked with an asterisk (*).
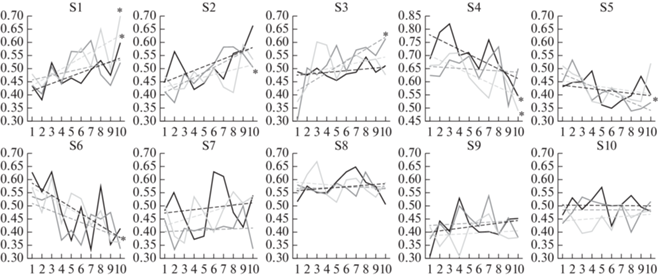
Оценка динамики изменения точности классификации с помощью линейной аппроксимации зависимости точности классификации от дня обучения выявила значимость (р < 0.05) у 6 из 10 испытуемых: у испытуемого № 1 – положительные тренды для кистей и локомоции, № 2 и № 3 – положительный тренд для стоп, № 4 – отрицательные тренды для кистей и локомоции, № 5 – отрицательный тренд для стоп, № 6 – отрицательный тренд для локомоции (рис. 3). У четырех участников, как и в среднем по выборке, значимых изменений не выявлено.
Рис. 3.
Индивидуальные кривые обучения для 10 испытуемых (S1–S10). По оси абсцисс: день обучения; по оси ординат: точность классификации состояний мозга. Сплошные линии – кривые обучения, пунктирные линии –тренды. Черные линии – кривые обучения и тренды при воображении движений кистей, темно-серые – стоп, светло-серые – локомоции. Значимые (p < 0.05) тренды отмечены звездочкой (*). Fig. 3. Individual learning curves for 10 subjects (S1–S10). Abscissa: day of training; ordinate: classification accuracy of brain states. Solid lines are learning curves, dotted lines are trends. Black lines are learning curves and trends during motor imagery of hand movements, dark gray lines – of feet, and light gray lines – of locomotion. Significant (p < 0.05) trends are marked with an asterisk (*).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ данных не выявил существенных преобладаний точности классификации при воображении движений верхних конечностей по сравнению с нижними. Более того, ни в один из дней воображаемые движения кисти не распознавались лучше движений стоп. Это дает основания считать, что предполагаемые методические трудности, отмеченные выше (при работе ИМК, основанного на кинестетическом воображении движений нижних конечностей), не столь значительны, как предполагалось.
Выявленные отличия между точностью классификации в зависимости от типа воображаемых движений связаны, как можно предполагать, с различиями в активности мозга при воображении этих разных движений. В отличие от воображаемых в наших экспериментах сравнительно простых движений кистей (раскрытие кисти) и стоп (тыльное сгибание в голеностопном суставе), локомоция представляет собой высококоординированный двигательный навык, реализация и воображение которого обеспечивается активацией большого количества структур мозга: лобной коры, мозжечка, покрышки мозга (pontomesencephalic tegmentum), парагиппокампальной, фузиформной и затылочной извилины, – а также деактивацией в мультисенсорной вестибулярной коре (преимущественно в верхней височной извилине и нижней теменной доле) (La Fougère еt аl., 2009). Кроме того, можно предположить, что в реальной жизни люди гораздо чаще представляют себе локомоцию (например, когда у них возникает намерение куда-то пойти), чем воображают движения в отдельных суставах, в особенности тыльное сгибание стопы.
Динамика изменений точности классификации сигналов мозга при воображении движений разных типов, как можно предположить, связана с различиями в динамике изменения программ организации этих движений при обучении их воображению.
Приведем имеющиеся в литературе сведения об этих изменениях при реальных и воображаемых движениях. При организации реальных движений и приобретении моторных навыков критическую роль играют полосатое тело, мозжечок и двигательные области коры лобной доли (Karni, 1996; Doyon, 1997; Sanes, Donoghue, 2000). Анатомическими исследованиями было показано, что эти структуры формируют две корково-подкорковые сети: кортико-стриато-таламо-кортикальную петлю и кортико-мозжечково-таламо-кортикальную петлю (Middleton, Strick, 1997). Эти две сети в разной степени активны в ходе обучения. Так, показано, что успешность выполнения новой последовательности движений (оцененная по количеству ошибок) связана с фронтальной корой, полосатым телом, мозжечком и теменной корой (Doyon, Ungerleider, 2002; Floyer-Lea, Matthews, 2004), а выполнение уже выученных (автоматических) движений опосредовано кортико-стриарной сетью, включающей первичную моторную кору, добавочную моторную область, зубчатое ядро мозжечка, таламус и скорлупу (Floyer-Lea, Matthews, 2004). Т.е. при переходе от выполнения новых к уже выученным действиям уменьшается активация префронтальной коры и мозжечка и происходит переход от кортико-мозжечковой к кортико-стриарной сети.
Исследований, посвященных изменению активности мозга при воображении движений, немного. Лафлер с соавторами (Lafleur et al., 2002) анализировали активность мозга при реальном и воображаемом сгибании и разгибании левой стопы. В начале процесса обучения при реальных движениях в обоих полушариях активировались дорсальная премоторная кора и мозжечок, а также часть левой нижней теменной доли. После тренировки большинство из этих областей не были существенно активированы, а повышенный уровень активности наблюдался билатерально в медиальной орбитофронтальной коре и полосатом теле, а также в левой ростральной части передней поясной извилины и в нижней теменной доле (не та ее часть, что в начале обучения). При воображаемых движениях наблюдались сходные паттерны активации.
Увеличение роли стриарной системы при обучении воображению движений было также выявлено при нажатии и воображении определенной последовательности четырех кнопок в аппарате фМРТ (Lacourse et al., 2005). В начале эксперимента при реальных движениях были более активны первичные и вторичные двигательные области мозга, а также мозжечок, а при воображаемых движениях – полосатое тело. В ходе обучения воображению движений увеличивалась активация полосатого тела и уменьшалась – мозжечка, что может, как пишут авторы, “отражать сдвиг перехода от кортико-мозжечковой к кортико-стриарной сети”.
Итак, согласно имеющимся в литературе данным, при обучении как реальным, так и воображаемым движениям происходит переход от кортико-мозжечковой к кортико-стриарной сети (Lafleur et al., 2002; Lacourse et al., 2005; Floyer–Lea, Matthews, 2004). Представляется вероятным, что этот переход отражается в изменении точности классификации ЭЭГ-сигналов при обучении воображению движений в нашем эксперименте, причем эти изменения могут происходить по-разному в зависимости от того, какие нейронные сети задействованы в этом процессе – связанные с воображением движений кистей, стоп или локомоции.
Полученные данные могут, по-видимому, быть сопоставлены с результатами, описанными в одном из последних обзоров, посвященных двигательному обучению, в котором показано, что в зависимости от типа обучения задействуются разные области мозга (Krakauer et al., 2019).
Сложный характер кривых обучения, полученных в нашем исследовании, – с увеличением и снижением точности классификации – соответствует упомянутым Бернштейном соображениям о многоступенчатом характере обучения (Бернштейн, 1991).
Кроме того, представляется, что существенным фактором, влияющим на динамику успешности воображения движений, может быть стратегия воображения движений (Ritter, Schooler, 2001). Можно предположить, что изменения точности классификации на протяжении процесса обучения воображению движений связаны с изменениями стратегии воображения движений при работе с ИМК, например, переход от стратегии “воображаю лучше каждый раз” к стратегии “воображаю стабильнее” (что мы отмечали в своих экспериментах в некоторых субъективных отчетах испытуемых).
Индивидуальный характер успешности/неуспешности обучения, выявленный в наших экспериментах, соответствует имеющимся в литературе данным о т.н. “ИМК-неграмотности” (BCI illiteracy), т.е. неспособности около 10–30% людей работать с ИМК (Jeunet et al., 2015; Guillot, Rienzo, Collet, 2014). Показано, что личностные характеристики определяют успешность управления ИМК (Jeunet et al., 2015; Боброва и др., 2020, Решетникова и др., 2021; Bobrova et al., 2020; Bobrova et al., 2021).
Данные о динамике обучения воображению движений также свидетельствуют об индивидуальном характере этого процесса. Показано, что увеличение успешности управления ИМК со зрительной обратной связью, основанным на воображении движений рук, наблюдалось лишь у 5 из 20 здоровых испытуемых при их работе 4 раза в течение 2 недель (Corsi et al., 2019). Лишь у 3 из 12 постинсультных пациентов улучшение наблюдалось при управлении ИМК со зрительной и сенсомоторной (ФЭС) обратной связью 3 раза в неделю в течение месяца (Qui et al., 2018), при управлении тем же ИМК от 10 до 24 дней подряд по одному часу в день – у 3 из 5 (Irimia et al., 2018). Управление ИМК, основанным на воображении движений рук, со зрительной и сенсомоторной (движения ортеза кисти) обратной связью в течение 3–8 недель от 13 до 22 раз было успешно у 6 из 8 постинсультных пациентов (Buch et al., 2008).
Таким образом, эффективность управления ИМК – успешность воображения движений кистей, стоп или локомоции – зависит от длительности обучения, изменения ее при обучении носят индивидуальный характер. В связи с этим в следующих исследованиях будет проведен анализ личностных характеристик, оптимальных для различимости сигналов мозга при воображении этих движений в процессе обучения.
ВЫВОДЫ
1. Эффективность управления ИМК в разные дни эксперимента зависит от типа воображаемого движения. Ни в один из дней воображаемые движения кисти не распознавались лучше движений стоп.
2. В ходе обучения воображению движений средняя по всем испытуемым точность классификации воображаемых движений кистей и стоп увеличивается к 3-му дню эксперимента, затем точность классификации уменьшается и вновь растет. При обучении воображению локомоции точность классификации значимо не меняется.
Список литературы
Бернштейн Н.А. О ловкости и ее развитии. М.: Медицина, 1996. 229 с.
Бобров П., Коршаков А., Рощин В., Фролов А. Байесовский подход к реализации интерфейса мозг-компьютер, основанного на представлении движений. Журнал высш. нервн. деят. им. И.П. Павлова. 2012. 62 (1): 89–89.
Боброва Е.В., Решетникова В.В., Фролов А.А., Герасименко Ю.П. Воображение движений нижних конечностей для управления системами “интерфейс мозг–компьютер”. Журнал высш. нервн. деят. им. И.П. Павлова. 2019. 69(5): 529–540.
Боброва Е.В., Решетникова В.В., Вершинина Е.А., Гришин А.А., Фролов А.А., Герасименко Ю.П. Межполушарная асимметрия и личностные характеристики пользователя мозг-компьютерного интерфейса при воображении движений рук. ДАН. 2020. 495 (1): 558–561.
Решетникова В.В., Боброва Е.В., Вершинина Е.А., Гришин А.А., Фролов А.А., Герасименко Ю.П. Зависимость успешности воображения движений правой и левой руки от личностных характеристик пользователей. Журнал высш. нервн. деят. им. И.П. Павлова. 2021. 71 (6): 830–839.
Столбков Ю.К., Герасименко Ю.П. Когнитивная двигательная реабилитация: воображение и наблюдение моторных действий. Физиология человека. 2021. 47 (1): 123–132.
Столбков Ю.К., Мошонкина Т.Р., Орлов И.В., Козловская И.Б., Герасименко Ю.П. Воображаемые движения как средство совершенствования и реабилитации моторных функций. Успехи физиологических наук. 2018. 49 (2): 45–59.
Batula A.M., Mark J.A., Kim Y.E., Ayaz H. Comparison of Brain Activation during Motor Imagery and Motor Movement Using fNIRS. Comput Intell Neurosci. 2017. 2017: 5491296.
Bobrov P.D., Biryukova E.V., Polyaev B.A., Lajsheva O.A., Usachjova E.L., Sokolova A.V., Mikhailova D.I., Dement’eva K.N., Fedotova I.R. Rehabilitation of patients with cerebral palsy using hand exoskeleton controlled by brain-computer interface. Bulletin of RSMU. 2020. 4: 33–40.
Bobrova E.V., Reshetnikova V.V., Vershinina E.A., Grishin A.A., Bobrov P.D., Frolov A.A., Gerasimenko Y.P. Success of Hand Movement Imagination Depends on Personality Traits, Brain Asymmetry, and Degree of Handedness. Brain Sciences. 2021. 11: 853.
Bobrova E.V., Reshetnikova V.V., Vershinina E.A., Grishina A.A., Frolov A.A., Gerasimenko Yu.P. Interhemispheric Asymmetry and Personality Traits of Brain–Computer Interface Users in Hand Movement Imagination. Doklady Biological Sciences. 2020. 495: 265–267.
Buch E., Weber C., Cohen L.G., Braun C., Dimyan M.A., Ard T., Mellinger J., Caria A., Soekadar S., Fourkas A., Birbaumer N. Think to Move: a Neuromagnetic Brain-Computer Interface (BCI) System for Chronic Stroke. 2008. 39: 910–917.
Dornhege G., Blankertz B., Curio G., Müller K.-R. Increase information transfer rates in BCI by CSP extension to multi-class. Advances in neural information processing systems. 2003. 4: 733-740.
Corsi M.-C., Chavez M., Schwartz D., George N., Hugueville L., Kahn A., Dupont S., Bassett D., Fallani F.D.V. Looking for cortical patterns of successful motor imagery-based BCI learning. 8th Graz Brain-Computer Interface Conference 2019.
Doyon J. Skill learning. The cerebellum and cognition. Ed. Schmahmann J.D. San Diego: Academic Press, 1997. 273–294 pp.
Doyon J., Ungerleider L.G. Functional anatomy of motor skill learning. Neuropsychology of Memory. Eds. Squire L.R., Schacter D.L. Guilford: New York, 2002. 225–238 pp.
Floyer-Lea A., Matthews P. Changing brain networks for visuomotor control with increased movement automaticity. J. Neuro- physiol. 2004. 92: 2405–2412.
Frolov A.A., Mokienko O., Lyukmanov R., Biryukova E., Kotov S., Turbina L., Nadareyshvily G., Bushkova Y. Post-stroke Rehabilitation Training with a Motor-Imagery-Based Brain-Computer Interface (BCI)-Controlled Hand Exoskeleton: A Randomized Controlled Multicenter Trial. Front Neurosci. 2017. 11: 400.
Guillot A., Rienzo F.D., Collet C. The Neurofunctional Architecture of Motor Imagery. Advanced Brain Neuroimaging Topics in Health and Disease. Eds. Papageorgiou T.D., Christopoulos G.I., Smirnakis S.M. London: IntechOpen, 2014. Chapter 16.
Irimia D.C., Ortner R., Poboroniuc M.S., Ignat B.E., Guger C. High Classification Accuracy of a Motor Imagery Based Brain-Computer Interface for Stroke Rehabilitation Training. Front. Robot. AI. 2018. 5: 130.
Jeunet C., N’Kaoua B., Subramanian S., Hachet M., Lotte F. Predicting Mental Imagery-Based BCI Performance from Personality, Cognitive Profile and Neurophysiological Patterns. PLOS ONE. 2015. 10 (12): e0143962.
Karni A. The acquisition of perceptual and motor skills: A memory system in the adult human cortex. Cognitive Brain Research. 1996. 5: 39–48.
Khan M.A., Das R., Iversen H.K., Puthusserypady S. Review on motor imagery based BCI systems for upper limb post-stroke neurorehabilitation: From designing to application. Computers in Biology and Medicine. 2020. 123: 103843.
Krakauer J., Hadjiosif A., Xu J, Wong A., Haith A. Motor Learning. Compr Physiol. 2019. 9 (2): 613–663.
Kruse A., Suica Z., Taeymans J., Schuster-Amft C. Effect of brain-computer interface training based on non-invasive electroencephalography using motor imagery on functional recovery after stroke – a systematic review and meta-analysis. BMC Neurol. 2020. 20: 385.
la Fougère C., Zwergal A., Rominger A., Förster S., Fesl G., Dieterich M., Brandt T., Strupp M., Bartenstein P., Jahn K. Real versus imagined locomotion: a [18F]-FDG PET-fMRI comparison. Neuroimage. 2010. 50 (4):1589-98.
Lafleur M.F., Jackson P.L., Malouin F., Richards C.L., Evans A.C., Doyon J. Motor Learning Produces Parallel Dynamic Functional Changes during the Execution and Imagination of Sequential Foot Movements. NeuroImage. 2020. 16 (1): 142–157.
Lotte F., Bougrain L., Cichocki A., Clerc M., Congedo M., Rakotomamonjy A., Yger F. A review of classification algorithms for EEG-based brain–computer interfaces: a 10 year update. Journal of neural engineering. 2018. 15 (3): 1–54.
Mrachacz-Kersting N., Jiang N., Stevenson A.J.T., Niazi I.K., Kostic V., Pavlovic A., Radovanovic S., Djuric-Jovicic M., Agosta F., Dremstrup K. Efficient neuroplasticity induction in chronic stroke patients by an associative brain-computer interface. Journal of Neurophysiology. 2016. 115 (3): 1410–1421.
Middleton F.A., Strick P.L. Cerebellar output channels. International Review of Neurobiology. 1997. 41: 61–82.
Müller-Putz G.R., Pokorny C., Klobassa D.S., Horki P. A single-switch BCI based on passive and imagined movements: toward restoring communication in minimally conscious patients. International Journal of Neural Systems. 2013. 23 (02): 1250037.
Perdikis S., Tonin L., Saeedi S., Schneider C., Millán Jd.R. The Cybathlon BCI race: Successful longitudinal mutual learning with two tetraplegic users. PLOS Biology. 2018. 16 (5): e2003787.
Prasad G., Herman P., Coyle D., McDonough S., Crosbie J. Applying a brain-computer interface to support motor imagery practice in people with stroke for upper limb recovery: a feasibility study. J NeuroEngineering Rehabil. 2010. 7: 60.
Qiu Z., Chen S., Daly I., Jia J., Wang X., Jin J. BCI-Based Strategies on Stroke Rehabilitation with Avatar and FES Feedback. ArXiv. 2018. abs/1805.04986.
Ritter F.E., Schooler L.J. The learning curve. In International encyclopedia of the social and behavioral sciences. Eds. Kintch W., Smelser N., Baltes P. Amsterdam: Pergamon, 2001. 8602–8605 pp.
Sanes J.N., Donoghue J.P. Plasticity and primary motor cortex. Annual Review of Neuroscience. 2000. 23: 393–415.
Stieger J.R., Engel S., Jiang H., Cline C.C., Kreitzer M.J., He B. Mindfulness Improves Brain Computer Interface Performance by Increasing Control over Neural Activity in the Alpha Band. bioRxiv. 2020. 04.13.039081
Yi W., Qiu S., Qi H., Zhang L., Wan B., Ming D. EEG feature comparison and classification of simple and compound limb motor imagery. J NeuroEngineering Rehabil. 2013. 10: 106.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


