Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 94-101
Влияние подавления гликолиза на ультраструктуру гигантских синапсов гиппокампа
З. Н. Журавлева 1, *, А. Е. Мальков 1, И. Ю. Попова 1
1 Лаб. системной организации нейронов, Федеральное государственное бюджетное учреждение науки
Институт теоретической и экспериментальной биофизики РАН
Пущино, Московской обл., Россия
* E-mail: zina_zhur@mail.ru
Поступила в редакцию 26.05.2021
После доработки 09.06.2022
Принята к публикации 27.06.2022
- EDN: GJVGFJ
- DOI: 10.31857/S0044467723010124
Аннотация
Подавление гликолиза в гиппокамповой формации крыс вызывали ежедневным введением 2-деокси-D-глюкозы в боковые желудочки мозга в течение 10 сут. С помощью электронной микроскопии обнаружено нарушение морфологических взаимоотношений аксональных терминалей гранулярных нейронов с перисинаптическими астроцитарными отростками. Однако детерминантные ультраструктурные характеристики гигантских синапсов и два типа функциональных контактов (асимметричные химические активные зоны с дендритными шипиками и симметричные адгезивные соединения с дендритами) были сохранены. В то же время в них было выявлено ослабление синаптических процессов, что выражалось в снижении числа внутритерминальных активных зон, кластеризации синаптических везикул и их отстранении от мест высвобождения нейротрансмиттера. По сравнению с нормой в гигантских терминалях обнаружено увеличение количества мелких митохондрий с электронно-плотным матриксом и морфологические признаки инициации синтеза гликогена в форме гликосом. Полученные данные свидетельствуют о том, что гигантские синапсы мшистых волокон гиппокампа являются пластичной, самокорректирующейся системой, которая способна функционировать при подавлении в мозге гликолиза, адаптируя свой биоэнергетический метаболизм.
Гигантские синапсы гиппокампа являются окончаниями аксонов гранулярных клеток зубчатой извилины, которые классиками морфологических исследований гиппокамповой формации были названы мшистыми волокнами. Тонкие немиелинизированные аксоны после контактов с полиморфными нейронами хилуса собираются в пучки и следуют вдоль проксимальных отделов апикальных дендритов пирамидных нейронов поля СА3 гиппокампа, образуя четко выраженную зону (stratum lucidum). Каждое мшистое волокно дает до 15–20 гигантских бутонов, которые поочередно заканчиваются на дендритах пирамидных нейронов. Их синаптические окончания характеризуются уникально большими размерами пресинаптических терминалей, внутри которых формируются множественные синаптические контакты с разветвленными дендритными шипиками апикальных дендритов. Кроме возбуждающих асимметричных контактов с головками дендритных шипиков, гигантские терминали образуют симметричные адгезивные соединения с поверхностью самих дендритов (Журавлева и др., 2011; Blackstad, Kjarcheim, 1961). В патологических ситуациях, сопровождающихся гибелью нейронов-мишеней мшистых волокон в хилусе, их строго упорядоченная проекционная система нарушается. Особенно это выражено при эпилептизации ткани, когда аксоны гранулярных нейронов активно образуют коллатеральные ветвления и аберрантные синаптические связи во внутреннем молекулярном слое зубчатой извилины и также на пирамидных нейронах поля СА2 и СА1 гиппокампа, с которыми в норме не контактируют (Freiman et al., 2021). Известно, что гиперактивация нейронов и эпилептические события в мозге сопровождаются метаболическими нарушениями, приводящими к повышенному расходу глюкозы и снижению её запасов в виде гликогена. И наоборот, хронический гипометаболизм глюкозы может быть причиной развития эпилепсии (Samokhina et al., 2017; 2020; Zilberter, Zilberter, 2017; Dienel et al., 2019). В то же время удивительно, что на фоне падения уровня глюкозы в мозговой ткани усиливается процесс спрутирования мшистых волокон и проецирование их к несвойственным им в норме нейрональным мишеням. Такая патологическая активность аксонов гранулярных нейронов предполагает существование в этой функциональной системе особых биомеханизмов, которые способны поддерживать высокий уровень энергетических затрат.
Целью настоящей работы было изучение ультраструктурной реорганизации гигантских синапсов мшистых волокон на начальной стадии подавления гликолиза и идентификация субмикроскопических органелл, участвующих в компенсаторных биоэнергетических процессах. Для ингибирования гликолиза в гиппокамповой формации применяли синтетический аналог глюкозы 2-деокси-D-глюкозу (2-ДГ), которая использует те же мембранные транспортеры, что и глюкоза, но не может подвергаться дальнейшему окислительному фосфорилированию для производства АТФ.
МЕТОДИКА
Эксперименты выполнены на крысах породы Вистар с соблюдением требований к работе на лабораторных животных (Директивы 2010/63/EU и ГОСТ Р ИСО 10993-2-2009/РФ). Животные (n = 5) содержались в стандартных условиях вивария и получали обычное питание. Для моделирования локального энергетического гипометаболизма животным (n = 3) через имплантированную в боковые желудочки мозга канюлю ежедневно в течение 10 дней вводили малые концентрации 2-ДГ (5.0 mM в 2 µл физиологического раствора). Ранее мы показали, что незначительные количества введенного физиологического раствора не оказывают влияния на клетки мозга (Samokhina et al., 2020). Контрольные крысы (n = 2) не получали инъекций 2-ДГ. Введение 2-ДГ в боковые желудочки было произведено с использованием стереотаксического аппарата к.б.н. А.Е. Мальковым. Такая экспериментальная парадигма создает дефицит глюкозы в мозге при отсутствии системной гипогликемии.
Для электронно-микроскопических исследований животных анестезировали нембуталом (40 мг/кг веса) и перфузировали через восходящую аорту сердца сначала физиологическим раствором и затем 2.5%-м раствором глутарового альдегида на 0.1 М фосфатном буфере при рН 7.4. Затем мозг выделяли из черепа, целиком оставляли в том же фиксирующем растворе на ночь в холодильнике и на следующий день с помощью вибратома разрезали на фронтальные срезы толщиной 500 мкм. Для дальнейших манипуляций использовали по 5 срезов из области дорсального отдела гиппокамповой формации, из каждого среза вырезали по 4 блока, содержащих поле СА3 гиппокампа, и дофиксировали 1.0%-м раствором четырехокиси осмия на том же буфере. Далее материал обезвоживали в ряду спиртов восходящей крепости и абсолютном ацетоне и заключали в эпоксидную смолу Эпон 812. Точный выбор участка для ультрамикротомирования (str. lucidum поля СА3), где аксоны гранулярных нейронов образуют синаптические контакты на проксимальной части апикальных дендритов пирамидных клеток, проводили под световым микроскопом на полутонких 1 мкм срезах, окрашенных смесью метиленовой сини и буры. Ультратонкие срезы, приготовленные на микротоме фирмы LKB (Швеция), контрастировали насыщенным раствором уранилацетата и цитратом свинца по Рейнольдсу и просматривали в электронном микроскопе JEOL JEM-100B (Япония). Ориентируясь на собственный опыт и известные из литературы (Blackstad, Kjaerheim, 1961) морфологические критерии гигантских синапсов, выбирали по 30–40 синаптических комплексов из экспериментальных и контрольных образцов, которые фотографировали и сохраняли на фотопластинах.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
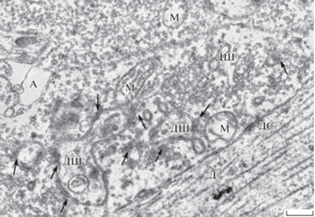
Гигантские синаптические окончания мшистых волокон гиппокамповой формации в контрольных образцах представляли собой огромные аксональные расширения до 5–6 мкм в диаметре. Они широко распластывались по поверхности апикальных дендритов пирамидных нейронов поля СА3 гиппокампа, разветвленные дендритные шипики которых внедрялись в пресинаптические терминали для формирования интратерминальных активных зон. Гигантские терминальные бутоны плотно прилегали друг к другу, оставляя небольшие пространства для перисинаптических астроцитарных отростков. Терминали были равномерно и достаточно густо заполнены синаптическими пузырьками, образуя скопления около активных зон, сформированных с головками разветвленных дендритных шипиков (рис. 1). Около постсинаптических мембран наблюдались выраженные постсинаптические осмиофильные уплотнения, характерные для возбуждающих синапсов. Протяженность активных зон варьировала, а некоторые из них имели прерывистый характер. Популяция везикул в гигантских терминалях была неоднородна: кроме обычных сферических (30–40 нм в диаметре) присутствовали более крупные (60–80 нм) гранулярные пузырьки, содержащие нейропептиды. На поперечных срезах через гигантские терминали, кроме везикул и сечений головок дендритных шипиков, всегда присутствовали 2–4 профиля митохондрий размером от 0.3–0.5 мкм до 0.8–1.0 мкм. С поверхностью дендритов пирамидных нейронов аксональные терминали образовывали преимущественно короткие десмосомоподобные адгезивные соединения типа puncta adherentia.
Рис. 1.
Ультраструктура гигантского синаптического окончания в контрольном гиппокампе. Синаптические контакты указаны стрелками. А – перисинаптические отростки астроцитов; Д – апикальный дендрит пирамидного нейрона поля СА3 гиппокампа; ДШ – дендритные шипики; ДС – десмосомоподобные соединения; М – митохондрии. Масштаб: 0.5 мкм. Fig. 1. Ultrastructure of giant synaptic ending in the control hippocampus. Synaptic contacts are marked with arrows. A – perisynaptic astrocytic processes; Д – apical dendrite of the hippocampal CA3 pyramidal neuron; ДШ – dendritic spines; ДС – desmosome-like contacts; M – mitochondria. Bar: 0.5 µm.
При электронно-микроскопическом исследовании гиппокампа животных с ежедневным внутрижелудочковым введением 2-ДГ были обнаружены признаки отека ткани, выражающиеся в расширении отростков астроцитов. Особенно заметно это было в астроцитарных ножках стенки кровеносных капилляров. Вместе с тем зона расположения гигантских окончаний мшистых волокон (str. lucidum) выглядела достаточно компактно. Отростки астроцитов внутри слоя, как правило, имели узко-пластинчатую форму, частично окружали аксональные бутоны и даже внедрялись в них. В некоторых терминалях такие пластинчатые отростки объединялись в несколько слоев и окружали группы синаптических пузырьков, изолируя их от постсинаптических элементов. По сравнению с нормой гигантские бутоны имели более извитые контуры, не очень плотно прилегали друг к другу и на микрофото их индивидуальные сечения занимали меньшие размеры. Они содержали обычный набор везикул. Однако значительные отличия от нормы наблюдались в характере распределения малых сферических синаптических везикул, которые были сгруппированы в кластеры разного размера, оставляя большие пространства без везикул (рис. 2, 3). При визуальном анализе складывалось впечатление, что в экспериментальном материале многие сечения гигантских терминалей содержали меньше синаптических везикул, чем в норме. Кроме того, их внутритерминальные активные зоны с дендритными шипиками были более короткими, а головки шипиков имели простые, мало разветвленные формы. В таких активных зонах никогда не было обширного окружения постсинаптических элементов синаптическими везикулами, а около некоторых из них синаптические пузырьки вообще отсутствовали. Однако некоторые гигантские бутоны формировали химические синапсы с дендритными шипиками, расположенными рядом и, по-видимому, принадлежащими другим типам нейронов (рис. 3). Такие контакты не характерны для гигантских синапсов в норме. Кроме того, в отличие от контроля гигантские синаптические окончания в экспериментальном материале имели более осмиофильные и протяженные десмосомоподобные адгезивные соединения с поверхностью дендритов (рис. 3).
Рис. 2.
Гигантские синаптические окончания в гиппокампе после введения 2-деоксиглюкозы. Обратите внимание на то, что митохондрии в гигантских терминалях имеют плотный матрикс, а митохондрия в дендрите (в правом верхнем углу) имеет светлый матрикс. Звездочками обозначены гликосомы. Остальные обозначения те же, что на рис. 1. Масштаб: 0.5 мкм. Fig. 2. Giant synaptic endings in the hippocampus after injection of 2-deoxy-D-glucose. Note that mitochondria in the giant terminals have a dense matrix, while mitochondrion in the dendrite (in the upper right corner) has a light matrix. Glycosomes are marked with asterisks. The other marks are the same as in Fig. 1. Bar: 0.5 µm.
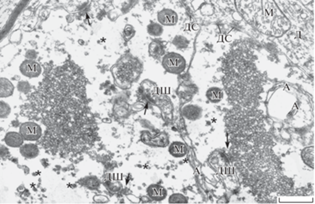
Рис. 3.
Разные типы везикул и гликосомы в терминалях гигантских синапсов после введения 2-деоксиглюкозы. Нейропептидные везикулы обозначены головками стрелок. СВ – синаптические везикулы. Остальные обозначения те же, что на рис. 1 и рис. 2. Масштаб: 0.2 мкм. Fig. 3. Different types of vesicles and glycosomes in the giant synapse terminals after injection of 2-deoxy-D-glucose. Neuropeptide vesicles are marked with arrowheads. СВ – synaptic vesicles. The other marks are the same as in Fig. 1 and Fig. 2. Bar: 0.2 µm.
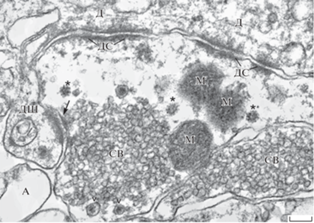
В пространствах гигантских пресинаптических бутонов, в которых отсутствовали синаптические пузырьки, на фоне филаментозно-зернистого материала выделялись округлые или слегка вытянутые митохондрии диаметром 0.15–0.25 мкм. От митохондрий в контроле они отличались не только меньшими размерами, но и плотным матриксом с множеством густо расположенных крист. В некоторых сечениях через гигантские бутоны число мелких электронно-плотных пресинаптических митохондрий достигало 20 и более. При этом митохондрии в соседних аксональных и дендритных профилях, принадлежащих другим клеточным элементам, сохраняли типичные для контроля размеры и электронную плотность (рис. 2).
Важной особенностью гигантских терминалей мшистых волокон после введения 2-ДГ являлось присутствие внутри них органеллоподобных микроструктур в виде сферических розеток, большинство которых имело диаметр порядка 60–70 нм (рис. 3). Реже встречались аналогичные включения меньшего размера, которые, возможно, являлись их сечениями на других уровнях. Они не были окружены мембраной, а заполнены неоднородным по электронной плотности содержимым: плотные частички порядка 3 нм были как бы залиты в менее осмиофильный гомогенный матрикс. Особенно отчетливо они распознавались в участках терминалей, которые не содержали синаптические везикулы (рис. 3). Такие розеткоподобные включения были приблизительно соразмерны с большими гранулярными везикулами, однако их внутренняя структура имела явные различия с ними. В то же время эти необычные для нервных клеток микроорганеллы очень напоминали гликоген-белковые комплексы, обнаруженные в скелетных мышцах при высокой нагрузке и названные гликосомы (“glycosomes”) (Rybicka, 1996; Prats et al., 2018; Brewer, Gentry, 2019). В астроцитарных отростках, окружающих гигантские терминали, такие ультраструктурные аналоги гликосом отсутствовали.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сравнение общей ультраструктуры ткани в зоне окончания аксонов гранулярных нейронов гиппокамповой формации в экспериментальном и контрольном материале показало, что при энергодефиците происходит значительная реорганизация ткани с участием астроцитов. Обнаруженное нами расширение астроцитарных отростков согласуется с данными, полученными на других аксональных системах гиппокампа, где авторы отмечали, что на нарушение энергетического метаболизма первыми реагируют астроциты, увеличивая свой объем, и тем самым контролируют эффективность мозговой деятельности (Lee et al., 2016). В наших экспериментах большое влияние на функционирование системы мшистых волокон, несомненно, должно было оказывать не только разрастание глиоцитов, но и преобразование их перисинаптических астроцитарных концевых веточек в узкие пластинчатые формы, которые внедрялись внутрь гигантских терминалей, иногда окружали группы везикул и, по-видимому, участвовали в разделении терминалей на более мелкие аксональные бутоны. Подобную реакцию астроцитов и увеличение степени окружения их отростками аксо-дендритных синаптических окончаний мы ранее видели в изолированных от мозга нейротрансплантатах, нейроны которых формировали преимущественно аномальные функциональные связи (Журавлева, 2020). По-видимому, в условиях биоэнергетической патологии так же снижается строгая специфичность нейронных связей в гиппокамповой формации.
Несмотря на значительную перестройку цитоархитектоники str. lucidum при ингибировании процесса гликолиза, детерминантные ультраструктурные характеристики самих гигантских синапсов сильно не изменялись. Об этом свидетельствует сохранение, хоть и в несколько трансформированном виде, двух типов функциональных контактов с постсинаптическими нейронными элементами: внутритерминальных синаптических активных зон с дендритными шипиками и адгезивных десмосомоподобных соединений с поверхностью дендритов. При этом визуальный анализ микроизображений демонстрировал увеличение выраженности зон адгезии между аксональными бутонами и постсинаптическими дендритами, что свидетельствует об усилении их функциональной эффективности в условиях сниженного энергетического метаболизма. На это указывала также концентрация около них пресинаптических митохондрий. Известно, что адгезивные контакты типа puncta adherentia в гигантских синаптических окончаниях гиппокампа координируют структурные и нейрохимические процессы при формировании аксо-дендритных синапсов, а также управляют эффективностью нейропередачи (Yamada et al., 2003). Мы ранее в экспериментах по гетеротопической нейротрансплантации демонстрировали их участие в адаптации врастающих из трансплантатов аксонов гранулярных нейронов зубчатой фасции к чужеродным пирамидным нейронам-мишеням в неокортексе реципиента (Журавлева и др., 2011). Возможно, при глюкозной депривации увеличение эффективности адгезивных специализаций также означает готовность гигантских бутонов к формированию синаптических активных зон с несвойственными им в норме постсинаптическими структурами. Неадекватные синаптические связи могут вызывать существенные изменения электрофизиологических параметров системы мшистых волокон гиппокампа по эпилептическому типу. Наблюдаемая нами аномалия в характере распределения синаптических пузырьков и образование компактных кластеров из них после введения 2-ДГ также подтверждает такое предположение. Аналогичное перестраивание везикулярного аппарата было обнаружено в гигантских синапсах крыс и песчанок с генетически детерминированными эпилептическими припадками (Akakin et al., 2011). Более того, эксперименты с введением в головной мозг неметаболизируемого аналога глюкозы 2-ДГ показали, что хроническое угнетение гликолиза в нервной ткани является одним из триггеров инициации эпилептиформной активности у здоровых животных (Samokhina et al., 2017; Zilberter, Zilberter, 2017).
В то же время сравнительный ультраструктурный анализ, проведенный в настоящем исследовании, показал, что гигантские терминали мшистых волокон имели не только деструктивные изменения синаптического аппарата, вызванные процессом эпилептогенеза, но и морфологические свидетельства противодействия развитию гипервозбуждения. Так, в условиях ингибирования метаболизма глюкозы были обнаружены признаки ослабления синаптической передачи, что выражалось не только в уменьшении размеров терминалей и наполняемости их синаптическими везикулами, но и в количестве аксо-шипиковых активных зон.
Структурные изменения системы мшистых волокон гиппокампа при функционировании в условиях дефицита глюкозы проявились также в трансформации их биоэнергетических механизмов. Во-первых, значительные преобразования произошли с пресинаптическими митохондриями. Возрастание численности митохондрий сопровождалось заметным уменьшением их индивидуальных размеров, увеличением числа крист и повышением электронной плотности матрикса. Кроме того, после воздействия 2-ДГ было нарушено равномерное распределение митохондрий внутри аксональных бутонов; они концентрировались в свободных от синаптических везикул цитоплазматических доменах. Известно, что пресинаптические митохондрии представляют собой особую популяцию и тесно связаны с пластичностью и эффективностью синаптической передачи (Pathak et al., 2015). Имеющиеся литературные данные не позволяют однозначно предположить, какому функциональному состоянию гигантских терминалей соответствует перестройка их митохондриального аппарата при дефиците глюкозы, так как большинство известных исследований касаются соматических митохондрий. В одних исследованиях появление мелких митохондрий связывают с фрагментацией более крупных органелл и рассматривают этот процесс как прелюдию к поcледующей митофагии. Фрагментация митохондрий вовлекается в патогенез многих нейродегенеративных заболеваний, включая болезнь Альцгеймера и болезнь Паркинсона (Reddy, Oliver, 2019; Shields et al., 2021). В других работах, наоборот, усиление биогенеза и увеличение числа мелких митохондрий рассматривают как показатель возрастания их функциональной активности. Так, обнаружено, что при гипоксическом стрессе именно в малых митохондриях с плотным расположением крист и конденсированным внутренним матриксом синтез ключевых ферментов дыхательной цепи переключается на более эффективный путь окисления субстратов (Mironova et al., 2019).
Мы обнаружили, что в условиях энергодефицита, вызванного введением 2-ДГ, кроме структурно-функциональной перестройки пресинаптических митохондрий существует другой субклеточный механизм поддержания энергетических потребностей в гигантских терминалях. Морфологическим выражением такого механизма, на наш взгляд, является появление в синаптоплазме частиц гликогена в форме гликосом, которые отсутствуют в гигантских терминалях из контрольной группы животных. Хотя особенности гликогенового метаболизма и организация разных частиц гликогена преимущественно исследованы на печени и мышцах, считается, что многие полученные данные можно экстраполировать на клетки мозга (Prats et al., 2018; Brewer, Gentry, 2019).
Большинство данных литературы свидетельствуют о том, что в головном мозге гликоген в виде цитоплазматических агрегатов существует прежде всего в астроцитах и их отростках. Астроцитарный гликоген играет важную роль в ключевых физиологических процессах, поддерживает нейроны и аксоны при недостатке глюкозы, при гипоксии и ишемии, а также во время интенсивных периодов активации (Dalsgaard et al., 2007; Hertz, Chen, 2018; Wu et al., 2019). Проведенный нами ультраструктурный анализ не обнаружил типичных гранул гликогена в перисинаптических астроцитарных отростках гигантских синапсов как в контрольном гиппокампе, так и в экспериментальном материале. Это, по-видимому, объясняется тем, что гликоген очень быстро деградирует в посмертных условиях и при гистологической обработке даже перфузионно фиксированной ткани (Hertz, Chen, 2018; Duran et al., 2019). Возможно, в условиях хронического гипометаболизма его запасы в астроцитах расходуются еще более интенсивно или полностью истощаются.
Наличие гликогена в нервных клетках до сих пор дискутируется. Ранее присутствие гликогена в нейронах и синаптических бутонах обнаруживали только в эмбриогенезе и в течение первой постнатальной недели (Vaughn, Grieshaber, 1972). В течение долгого времени предполагали, что зрелые нервные клетки в нормальных физиологических условиях не содержат гликоген, так как в них отсутствуют или находятся в неактивном состоянии ферменты для его синтеза и расщепления. Более того, активацию ферментов и последующее накопление гликогена рассматривали как метаболический путь к нейродегенерации и апоптозу (Dienel, Carlson, 2019). Однако при использовании более точных методов идентификации частиц гликогена и ферментов его метаболизма было обнаружено, что нервные клетки неокортекса и гиппокампа и в норме синтезируют небольшие количества гликогена, что защищает их от гибели при гипоксическом стрессе (Saez et al., 2014). Кроме того, ключевую роль нейронального гликогена показали при формировании моторных и когнитивных перестроек (Duran et al., 2019). В настоящей работе, благодаря ультраструктурной идентификации, частицы гликогена в виде гликосом были обнаружены в гигантских терминалях мшистых волокон гиппокампа после хронического введения 2-ДГ. Мы полагаем, что присутствие гликосом в гигантских терминалях гиппокампа свидетельствует о том, что при хронической депривации глюкозы в них включается автономный процесс синтеза гликогена, который используется в качестве дополнительного источника энергии.
ЗАКЛЮЧЕНИЕ
Сравнение ультраструктуры гигантских синаптических окончаний гранулярных нейронов зубчатой извилины в контроле и в условиях частичного подавления гликолиза показал, что в целом система мшистых волокон устойчива к долговременному дефициту глюкозы. Обнаруженное нарушение коммуникации гигантских бутонов с перисинаптическими астроцитарными отростками не отражалось на сохранении детерминантных ультраструктурных характеристик гигантских синапсов и двух способов функциональных специализаций (химических активных зон и адгезивных соединений). В то же время были выявлены морфологические свидетельства ослабления силы синаптических взаимодействий с дендритными шипиками, отстранение кластеров везикул от активных зон и, наоборот, усиление адгезивных десмосомоподобных соединений с поверхностью дендритов. Подавление гликолиза приводило к возрастанию значимости синаптических органелл, ответственных за энергетический метаболизм. Это выражалось в увеличении численности пресинаптических митохондрий и их реорганизации в более энергоэффективные формы с электронно-плотным матриксом и обилием крист. Кроме того, показателем адаптации биоэнергетических процессов к глюкозной депривации в гигантских синапсах было появление в их синаптоплазме особых микроструктур, аналогичных гликоген-белковым органеллам гликосомам. Важно, что мелкие электронно-плотные митохондрии и гликосомы в гигантских бутонах располагались поблизости и формировали общие клеточные домены для производства энергии.
Таким образом, полученные данные показали, что мшистые волокна и их синапсы являются пластичной, самокорректирующейся системой, которая при подавлении гликолиза способна адаптироваться и изменять свой биоэнергетический метаболизм. По-видимому, это свойство гигантских синапсов способствует устойчивости гранулярных клеток при нейродегенеративных заболеваниях и эпилептических состояниях.
Список литературы
Журавлева З.Н. Сравнение трехчастной организации синаптических окончаний в интраокулярных септальных трансплантатах и в септальной области мозга. Журн. высш. нерв. деят. им. И.П. Павлова. 2020. 70 (3): 376–383.
Журавлева З.Н., Журавлев Г.И., Ермаков А.А. Участие адгезивных соединений типа Puncta Adherentia в образовании синаптических связей между трансплантатом зубчатой фасции и мозгом реципиента. Журн. высш. нерв. деят. им. И.П. Павлова. 2011. 61 (2): 236–241.
Akakin D., Sirvanci S., Gurbanova A., Rezzan Aker R., Onat F., San T. Ultrastructural GABA immunocytochemistry in the mossy fiber terminals of Wistar and genetic absence epileptic rats receiving amygdaloid kindling stimulations. Brain Res. 2011. 1377: 101–108.
Blackstad T.W., Kjaerheim A. Special axo-dendritic synapses in the hippocampal cortex: electron and light microscopic studies on the layer of mossy fibers. J. Comp. Neurol. 1961. 117 (2): 133–159.
Brewer M.K., Gentry M.S. Brain glycogen structure and its associated proteins: past, present and future Adv. Neurobiol. 2019. 23: 17–81.
Dalsgaard M.K., Madsen F.F., Secher N.H., Laursen H., Quistorff B. High glycogen levels in the hippocampus of patients with epilepsy. J. Cereb. Blood Flow Metab. 2007. 27: 1137–1141.
Dienel G.A., Carlson G.M. Major advances in brain glycogen research: understanding of the roles of glycogen have evolved from emergency fuel reserve to dynamic, regulated participant in diverse brain functions. Adv. Neurobiol. 2019. 23: 1–16.
Duran J., Gruart A., Varea O., Lopez-Soldado I., Delgado-Garcia J.M. Guinovart J.J. Lack of neuronal glycogen impairs memory formation and learning-dependent synaptic plasticity in mice. Front. Cell. Neurosci. 2019. 13: 374.
Hertz L., Chen Y. Glycogenolysis, an astrocyte-specific reaction, is essential for both astrocytic and neuronal activities involved in learning. Neurosci. 2018. 370: 27–36.
Freiman T.M., Häussler U., Zentner J., Doostkam S., Beck J., Scheiwe C., Brandt A, Haas C.A., Puhahn-Schmeiser B. Mossy fiber sprouting into the hippocampal region CA2 in patients with temporal lobe epilepsy. Hippocampus. 2021. 31 (6): 580–592.
Lee C.-Y., Dallerac G., Ezan P., Anderova M., Rouach N. Glucose tightly controls morphological and functional properties of astrocytes. Front. Aging Neurosci. 2016. 8: 82. https://doi.org/10.3389/fnagi.2016.00082
Mironova G.D., Pavlik L.L., Kirova Y.I., Belosludtseva N.V., Mosentsov A.A., Khmil N.V., Germanova E.L., Lukyanova L.D. Effect of hypoxia on mitochondrial enzymes and ultrastructure in the brain cortex of rats with different tolerance to oxygen shortage. J. Bioenerg. Biomembr. 2019. 51: 329–340.
Pathak D., Shields L.Y., Mendelsohn B.A., Haddad D., Lin W., Gerencser A. A., Kim H., Brand M.D., Edwards R.H., Nakamura K. The role of mitochondrially derived ATP in synaptic vesicle recycling. J. Biol. Chem. 2015. 290: 22325–22336.
Prats C., Graham T.E., Shearer J. The dynamic life of the glycogen granule. J. Biol. Chem. 2018. 293 (19): 7089–7098.
Reddy P.H., Oliver D.M.A. Amyloid beta and phosphorylated tau-induced defective autophagy and mitophagy in Alzheimer’s disease. Cells. 2019. 8: 488–509.
Rybicka K.K. Glycosomes: the organelles of glycogen metabolism. Tissue Cell. 1996. 28: 253–265.
Saez I., Duran J., Sinadinos C., Beltran A., Yanes O., Tevy M.F., Martinez-Pons C., Milan M., Guinovart J. Neurons have an active glycogen metabolism that contributes to tolerance to hypoxia. J. Cereb. Blood Flow Metab. 2014. 34: 945–955.
Samokhina E., Malkov A., Samokhin A., Popova I. Selective hippocampal cell damage and mossy fiber sprouting induced by chronic intracerebral injections of 2-deoxy-D-glucose. Gen. Physiol. Biophys. 2020. 39: 99–106.
Samokhina E., Popova I., Malkov A., Ivanov A.I., Papadia D., Osypov A., Molchanov M., Paskevich S., Fisahn A., Zilberter M., Zilberter Y. Chronic inhibition of brain glycolysis initiates epileptogenesis. J. Neurosci. Res. 2017. 95: 2195–2206.
Shields L.Y., Li H., Nguyen K., Kim H., Doric Z., Garcia J.H., Gill T.M., Haddad D., Vossel K., Calvert M., Nakamura K. Mitochondrial fission is a critical modulator of mutant APP-induced neural toxicity. J. Biol. Chem. 2021. 296: 100469.
Vaughn J.E., Grieshaber J.A. An electron microscopic investigation of glycogen and mitochondria in developing and adult rat spinal motor neuropil. J. Neurocytol. 1972. 1 (4): 397–412.
Wu L., Wong C.P., Swanson R.A. Methodological considerations for studies of brain glycogen. J. Neurosci. Res. 2019. 97 (8): 914–922.
Yamada A., Irie K., Deguchi-Tawarada M., Ohtsuka T., Takai Y. Nectin-dependent localization of synaptic scaffolding molecule (S-SCAM) at the puncta adherentia junctions formed between the mossy fibre terminals and the dendrites of pyramidal cells in the CA3 area of the mouse hippocampus. Genes Cells. 2003. 8 (12): 985–994.
Zilberter Y., Zilberter M. The vicious circle of hypometabolism in neurodegenerative diseases: ways and mechanisms of metabolic correction. J. Neurosci. Res. 2017. 95: 2217–2223.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


