Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 88-93
Эффект таурина на проявление аудиогенной эпилепсии у крыс с маятникообразными движениями
Т. А. Алехина *
ФГБНУ, Федеральный исследовательский центр Институт цитологии и генетики
Новосибирск, Россия
* E-mail: alek@bionet.nsc.ru
Поступила в редакцию 28.03.2022
После доработки 24.05.2022
Принята к публикации 31.10.2022
- EDN: GIWJJK
- DOI: 10.31857/S0044467723010033
Аннотация
В линии крыс с маятникообразными движениями (МД), предрасположенными к аудиогенной эпилепсии, показано снижение уровня таурина в гиппокампе. Известно, что таурин (аминоэтансульфоновая кислота) является антисудорожным препаратом. Целью этого эксперимента было проверить прогностическую валидность этого препарата на животных линии МД в разных возрастах. Введение таурина в неонатальном периоде не повлияло на судорожную активность в пролонгированном периоде в 1.5 и в 3 мес. у крыс МД. В адолесцентном периоде (1.5 мес.) при остром введении таурина было обнаружено увеличение числа стереотипных прыжков и рост выраженности аудиогенных припадков. В дефинитивном возрасте у крыс линии МД при остром введении препарата выявлено снижение абортивных приступов, однако при долгосрочном тестировании (в 4 мес.) произошло восстановление прежнего уровня иктальных и постиктальных показателей. Полученные результаты указывают на отсутствие влияния действия таурина, введенного крысятам в неонатальном периоде через длительный период времени, выявлено повышение уровня судорожной активности после введения таурина в адолесцентном периоде и была подтверждена прогностическая валидность по влиянию этого препарата во взрослом возрасте у крыс линии МД.
В серии экспериментальных исследований показано, что нейротрансмиттеры являются ключевыми регуляторами в развитии центральной нервной системы, влияя на такие онтогенетические события, как нейрогенез, нейронная миграция, апоптоз и дифференциация клеток (Avanzini, Franceschetti, 2003; Avoli et al., 2005; Holmes, Ben-Ari, 2001; Kilb, Fukuda, 2017). Роль классических нейротрансмиттеров, таких как глутамат и ГАМК (гамма-аминомасляная кислота) в нейрональном развитии достаточно хорошо изучена, включая участие аминоэтансульфоновой кислоты – таурина, как возможного нейромодулятора баланса аминокислот в онтогенезе. В литературе имеются данные, по которым таурин влияет на вызванную глутаматом возбудимость нейронов, снижая внеклеточный уровень свободного кальция, тем самым уменьшая ответную возбудимую реакцию клетки (Chen et al., 2001, Idrissi, 2019). Показано, что таурин может играть терапевтическую роль в регуляции эпилептиформных расстройств у животных и человека (Loscher, Kohling, 2010; Ripps, Shen, 2012; Oja, Saransaari, 2013; Schaffer, Kim, 2018).
Линейные крысы с маятникообразными движениями (МД) могут служить моделью приступов с типичными автоматизмами. Под действием аудиогенного раздражителя крысы МД дают припадки в 90% случаев в отличие от исходной популяции Вистар, в которой развиваются аналогичные припадки у 25–30% животных (Алехина и др., 2007; Алехина и др., 2021). Увеличение доли приступов идет за счет повышения числа абортивных припадков, не заканчивающихся клонико-тоническими судорогами и не являющимися генерализованными. По общей поведенческой картине абортивные припадки напоминают фокальные приступы с типичными автоматизмами (по классификации 1981 г., Киото, Япония). У крыс МД показано снижение тормозного медиатора таурина в гиппокампе (Акулов и др., 2014). В литературе имеются данные о нестабильном проявлении судорожной активности в неонатальном и адолесцентном периодах развития, что связано, в частности, с изменением соотношений возбуждающих и тормозных нейротрансмиттеров в раннем онтогенезе у животных (Семиохина и др., 2006; Kohling, 2014).
Линия МД является новой и малоизученной селекционной моделью фокальных приступов. В настоящей работе была поставлена задача проследить влияние введения таурина крысам как антисудорожного препарата при остром введении и при пролонгированном действии на эпилептическую активность в неонатальном, адолесцентном и дефинитивном возрастах.
МЕТОДИКА
Экспериментальные животные. Исследования выполнены на крысах линии МД (n = 72) 47-го поколения селекции. Животных содержали в виварии ИЦиГ СО РАН при свободном доступе к воде и корму. Условия содержания и протоколы работы с животными утверждены Комиссией по биоэтике ИЦиГ СО РАН, все процедуры на крысах проведены в соответствии с рекомендациями Европейского парламента и Совета Европейского Союза (директива 2010/63/EU от 22 сентября 2010 г.).
Тестирование аудиогенной эпилепсии. Использовали камеру из оргстекла с пластиковым полом размером 50 × 50 × 50 см и с закрепленным с внутренней стороны камеры электрическим звонком силой звука 110 дБ и частотой 60 Гц. Время тестирования с включенным звуком – в пределах 1 мин. Оценку реакции проводили по фиксации латентного времени (сек), начиная с включения звонка и до первого стереотипного прыжка. Регистрация эпилептических припадков проводилась по балльной системе: 0 баллов – отсутствие двигательного возбуждения; 1 балл – “дикий” бег; 2 балла – абортивный припадок; 3 балла – клонико-тонические судороги. Длительность постиктальной каталепсии (сек) регистрировалась с момента выключения звукового сигнала и до первого движения головой.
Введение таурина. Последовательность опытов
I серия (рис. 1). Крысам-матерям МД (n = = 12) давали ежедневно раствор таурина (ООО “Пик-Фарма Лек”, Россия) (в дозе 0.2 г/кг) на сухариках в течение двух месяцев до родов. Контрольным животным давали сухарики с каплей воды.
Рис. 1.
Схема опыта: (1) – прием таурина самками МД; (2) – тестирование в камере с звуковым раздражителем; (3) – подсадка самца на 3 дня; (4) – прием таурина до родов; (5) – инъекции таурина крысятам в 1, 7, 10 и 14 день. Fig. 1. Scheme of experiment: (1) – intake of taurine by MD females; (2) – testing in a chamber with a sound stimulus; (3) – replanting a male for 3 days; (4) – taking taurine before delivery; (5) – injections of taurine to rat pups on days 1, 7, 10 and 14.

Родившимся детенышам вводили в/б раствор таурина (в дозе 0.2 г/кг) на 1-й, 7-й, 10-й и 14-й день. В 1.5 и 3 мес. (10 контрольных самцов МД, 10 опытных самцов МД) тестировали крыс в камере со звуковым раздражителем. Использовали видеокамеру Panasonic HDC-SD40.
II серия. Интактным самцам МД (10 контрольных, 10 опытных самцов) в возрасте 1.5 мес. инъецировали в/б раствор таурина (в дозе 0.8 г/кг) в течение 3-х дней. Через 1 ч после введения препарата начинали тестировать крыс в камере со звуковым раздражителем. Регистрировали показатели: длительность латентного времени (сек), количество прыжков (n), число припадков (n), характер припадков (баллы), время постиктальной каталепсии (сек).
III серия. Интактным 3-месячным самцам МД (10 контрольных, 10 опытных самцов) вводили в/б таурин (в дозе 0.8 г/кг) в течение 3-х дней. Через 1 ч после введения препарата начинали тестировать крыс в камере со звуковым раздражителем. Регистрировали показатели: длительность латентного времени (сек), количество прыжков (n), число припадков (n), характер припадков (баллы), время постиктальной каталепсии (сек).
Статистическую обработку проводили с использованием пакета программ “Stastistica 10.0”. Различия по иктальным и постиктальным показателям оценивали при помощи однофакторного анализа (таурин и контроль) в программе ANOVA по LSD-критерию. Для каждого параметра вычислялось среднее арифметическое (M) и ошибка среднего (±m). Сравнение долей (в %) проводилось по критерию Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В I серии после 2х-месячного кормления сухариками с раствором таурина (0.2 мг/г) у самок МД были получены следующие результаты (табл. 1). Эпилептическая активность у них измерялась по следующим параметрам: латентное время до первых стереотипных прыжков увеличилось более, чем в 2 раза, в то время как доля клонико-тонических припадков снизилась наполовину, общее количество припадков уменьшилось на одну треть. Можно предположить, что при значительном и однонаправленном снижения эпилептических показателей у самок-матерей МД уровень спокойствия у них повысился. Однако достоверных результатов не было получено из-за небольшого количества животных в группах и высокого уровня ошибки среднего по латентному времени. При тестировании доросшего потомства до полутора- и трехмесячного возраста не было обнаружено различий между группами, принимавшими таурин и воду (рис. 2).
Таблица 1.
Влияние введения таурина на судорожную активность у самок-матерей крыс МД, получавших таурин (0.2 г/кг) в течение 2-х месяцев Table 1. Effect of taurine on convulsive activity in female mothers of rats PM treated with taurine (0.2 g/kg) during two months
| Условия опыта | Латентное время, сек | Клонико-тонические припадки | Общее количество припадков |
|---|---|---|---|
| Контроль (без таурина) (n = 5) | 11.8 ± 2.6 | 60% | 100% |
| Введение таурина (n = 7) | 26.3 ± 8.9 | 29% | 71% |
| Достоверность | p > 0.05 | p > 0.05 | p > 0.05 |
Рис. 2.
Показатели судорожной активности и продолжительность постиктальной каталепсии в пролонгированном периоде (в 1.5 и 3 мес.) у крыс МД, принимавших таурин в неонатальном периоде. За 100% приняты показатели в контроле в 1.5 мес. Fig. 2. Indicators of seizure activity and duration of postictal catalepsy in long-term period (1.5 and 3 months) in rats MD treated with taurine at neonatal age. Respective indices at 1.5 months were taken as 100%.
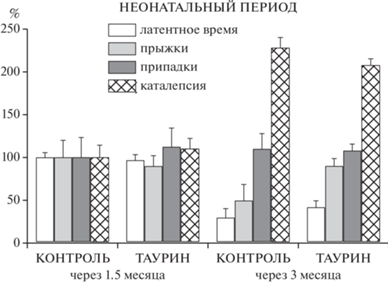
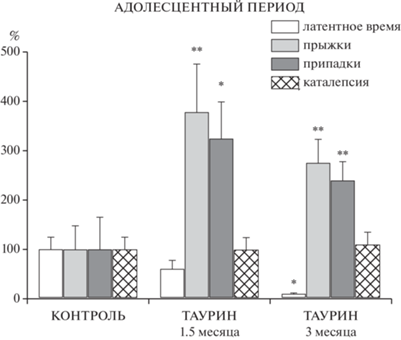
Во II серии в 1.5-месячном возрасте обнаружили противоположный ожидаемому результат при введении таурина. Инъекция этой аминокислоты как препарата, снижающего судорожную активность, вызвала повышение числа и силы судорожных припадков, как в возрасте 1.5 мес., так и в возрасте 3 мес. (рис. 3). Похожий эффект на введение стимулятора эпилептических припадков – кофеина в раннем периоде развития проявился в увеличении латентного периода приступов у взрослых крыс линии Крушинского-Молодкиной (КМ) (Семиохина и др., 2006), т.е. введение стимулятора судорожных припадков в раннем онтогенезе привело к увеличению латентного времени возникновения судорог у взрослых крыс-эпилептиков. Таким образом, судорожная активность снизилась в пролонгированном периоде у крыс КМ, тогда как у особей КМ в дефинитивном периоде введенный кофеин всегда усиливал припадки (Крушинский, 1960; Семиохина и др., 2006). Мы предполагаем, что эффект таурина в адолесцентном возрасте связан с развитием проводящих путей в ЦНС и с изменчивостью нейротрансмиттерных механизмов при эпилептической патологии (Kubova, Mares, 1995). Этот эффект также может быть последствием влияния вектора селекции у крыс с маятникообразными движениями, который вызывает дестабилизирующее действие как на прямой селекционируемый признак, так и на организм в целом (Алехина, Кожемякина, 2019).
Рис. 3.
Влияние введения таурина (0.8 г/кг) на судорожную активность и продолжительность постиктальной каталепсии в 1.5 и 3 мес. За 100% приняты показатели в контроле. *, ** (p < 0.05; p < 0.01) различия по сравнению с контролем. Fig. 3. Effect of taurine injections (0.8 g/kg) on convulsive activity and duration of postictal catalepsy in 1.5 and 3 months. Respective indices were taken as 100%. * p = 0.05; ** p < 0.01 differences compared to control.
В III партии была подтверждена прогностическая валидность по введению таурина во взрослом возрасте на модели животных с МД (рис. 4). Показано, что при остром введении таурина на третий день после его инъекции крысам МД было снижено число прыжков и припадков на предъявление аудиогенного раздражителя (рис. 4). Однако через месяц (в 4 мес.) на этих животных выявлена реакция восстановления уровня иктальных показателей.
Рис. 4.
Влияние введения таурина (0.8 г/кг) на показатели судорожной активности у взрослых крыс МД. * p = 0.05; ** p < 0.01 различия достоверны по LSD-критерию. За 100% приняты показатели в контроле. Fig. 4. Effect of taurine (0.8 g/kg) on convulsive activity in adult PM rats. * p = 0.05; ** p < 0.01 differences compared on LSD-criteria. Respective indices were taken as 100%.

Таким образом, таурин как нейромодулятор возбудимых и тормозных аминокислот может по-разному влиять на протекание эпилептогенеза в разные периоды развития. В неонатальном периоде, когда мозг находится на стадии созревания проводящей нервной системы, долгосрочный эффект таурина не проявился на крысах линии МД. В адолесцентном периоде, характеризующемся быстрыми темпами развития мозговых структур и стресс-зависимых систем, наблюдался стимулирующий эффект исследуемого препарата на проявление судорожной активности. В дефинитивном возрасте у крыс МД с предрасположенностью к проявлению аудиогенных припадков был выявлен эффект таурина как противосудорожного препарата. Модель крыс с маятникообразными движениями может быть использована для дальнейших пробных исследований известных и новых препаратов, ассоциированных с эпилептогенными проявлениями.
ВЫВОДЫ
1. В неонатальном периоде при введении таурина крысятам из линии МД не было обнаружено влияния этого препарата в пролонгированном периоде ни в 1.5, ни в 3 мес на проявление эпилептогенной активности.
2. При остром введении таурина в 1.5 мес. крысам МД показано увеличение количества и интенсивность эпилептических приступов.
3. При остром введении таурина в 3-месячном возрасте у крыс линии МД выявлено снижение уровней иктальных показателей при развитии аудиогенной эпилепсии. Этот факт подтверждает прогностическую валидность при введении таурина крысам МД в условиях предъявления аудиогенного раздражителя.
Исследования поддержаны бюджетным проектом FWNR-2022-0019 и выполнены с использованием оборудования ЦКП “Центр генетических ресурсов лабораторных животных” ФИЦ ИЦиГ СО РАН, поддержанного Минобрнауки России (Уникальный идентификатор проекта RFMEFI62119X0023).
Список литературы
Акулов А.Е., Алехина Т.А., Мешков И.О., Петровский Е.Д., Прокудина О.И., Коптюг И.В., Савелов А.А., Мошкин М.П. Отбор на кататонический тип реагирования у крыс: исследование межлинейных различий методом магнитно-резонансной томографии. Журнал высш. нервн. деят. им. И.П. Павлова. 2014. 64 (4): 439–447.
Алехина Т.А., Кожемякина Р.В. Моделирование фокальных приступов с автоматизмами на крысах с маятникообразными движениями. Бюлл. эксп. биол. мед. 2019. 168 (8): 300–303.
Алехина Т.А., Плеканчук В.С., Осадчук Л.В. Продромальные характеристики эпилепсии у крыс с маятникообразными движениями. Ж. эволюц. биохим. физиол. 2021. 57 (3): 240–249. https://doi.org/10.31857/S0044452921030025
Алехина Т.А., Прокудина О.И., Рязанова М.А., Уколова Т.Н., Барыкина Н.Н., Колпаков В.Г. Проявление типологических свойств поведения у линий крыс, селекционированных на усиление и отсутствие маятникообразных движений. Связь с моноаминами мозга. Журнал высш. нервн. деят. им. И.П. Павлова. 2007. 57 (3): 336–343.
Семиохина А.Ф., Федотова И.Б., Полетаева И.И. Крысы линии Крушинского-Молодкиной: исследования аудиогенной эпилепсии, сосудистой патологии и поведения. Журнал высш. нервн. деят. им. И.П. Павлова. 2006. 56 (3): 298–316.
Avanzini C., Franceschetti S. Cellular biology of epileptogenesis. Lanset Neurol. 2003. 2: 33–42.
Avoli M., Louvel J., Pumain R., Kohling R. Cellular and molecular mechanisms of epilepsy in the human brain. Prog Neurobiol. 2005. 77: 166–200.
Chen W.G., Jin H., Nguyen M., Carr J., Lee Y.J., Hsu C.C., Faiman M.D., Schloss J.W., Wu J.Y. Role of taurine in regulation of intracellular calcium level and neuroprotective function in cultured neurons. J. Neurpsci. Res. 2001. 66: 612–619.
Idrissi A. Taurine Regulation of Neuroendocrine Function. Adv Exp Med Biol. 2019;1155:977-985. https://doi.org/10.1007/978-981-13-8023-5_81
Holmes G.L., Ben-Ari Y. The neurobiology and consequences of epilepsy in the development brain. Pediatr Res. 2001. 49: 320–325.
Loscher W., Kohling R. Functional, metabolic and synaptic changes after seizures as potential targets for antiepileptic therapy. Epilepsy Behav. 2010. 19: 105–113.
Kilb W., Fukuda A. Taurine as an essential neuromodulator during perinatal cortical development. Front. Cell. Neurosci. 2017. 11: 328. https://doi.org/10.3389/frcel.2017.00328
Kohling R. Prolong seizures: what are the mechanism that predisposed or cease to be protective? A review of animal data. Epileptic disorg. 2014. 16 (Suppl. 1): S23–S36.
Kubova H., Mares P. Suppression of cortical epileptic after discharges by ketamine is not stable during ontogenesis in rats. Pharmacol Biochem Behav. 1995. 52 (3): 489–492.
Oja S.S., Saransaari P. Taurine and epilepsy. Epilepsy Res. 2013. 104: 187–194.
Ripps H., Shen W. Review: Taurine: a “very essential” amino acid. Molecular vision. 2012. 18: 2673–2686. http://www.molvis.org/molvis/v18/a275
Schaffer S., Kim H.W. Effects and Mechanisms of Taurine as a Therapeutic Agent. Biomol Ther (Seoul). 2018. 1; 26 (3): 225–241. https://doi.org/10.4062/biomolther.2017.251
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


