Химическая физика, 2019, T. 38, № 10, стр. 17-21
Особенности внутримолекулярного спинового обмена в новом нитроксильном трирадикале
А. И. Кокорин 1, 2, *, О. И. Громов 3, T. Kálai 4, 5, K. Hideg 5, А. Е. Путников 2
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Institute of Organic and Medicinal Chemistry, Medical School, University of Pécs
Pécs, Hungary
5 Szentбgothai Research Center
Pécs, Hungary
* E-mail: kokorin@yandex.ru
Поступила в редакцию 25.02.2019
После доработки 06.03.2019
Принята к публикации 20.03.2019
Аннотация
Методом ЭПР X-диапазона исследована температурная зависимость динамики внутримолекулярного электронного спинового обмена в трирадикале, в котором радикальные кольца связаны ацетиленовыми группами –C≡C–. Получена термодинамическая характеристика конформационного перехода в трирадикале между конформерами с “трирадикальным” и “бирадикальным” типами спинового обмена. Расчетами методом функционала плотности (DFT) установлена геометрическая структура нового стабильного нитроксильного трирадикала.
ВВЕДЕНИЕ
Многие органические, металлорганические и радикальные соединения, содержащие несколько парамагнитных центров в своей структуре (радикалы и/или ионы переходных металлов), представляют большой интерес для создания на их основе новых молекулярных магнетиков и ферромагнетиков [1–5]. Значительное число систем этого типа могут быть созданы на основе стабильных нитроксильных олиго- и полирадикалов, синтез которых хорошо разработан [6–9]. Важную роль в реализации магнитных и ферромагнитных свойств играет внутри- и межмолекулярный спиновый обмен между спинами неспаренных электронов, подробно изученный в работах [10–12].
Значительный интерес представляет исследование внутримолекулярного спинового обмена в нитроксильных полирадикалах, которое может осуществляться путем прямых соударений парамагнитных центров (прямой обмен) либо при взаимодействии спинов через мостик из атомов и связей (непрямой обмен) [10, 11]. К таким многоспиновым системам относятся в первую очередь стабильные трирадикалы различного строения, например P(OR6)3, Se=P(OR6)3, 1,3,5-C6H3(COOR6)3, 1,3,5-C6H3(OCOR5)3, 1,2,3-C6H3(OCOR5)3 и другие, тетрарадикалы Si(OR6)4, 1,2,4,5-C6H2(COOR6)4 и другие [6, 8, 12–19], содержащие фрагменты 2,2,6,6-тетраметилпиперидин-1-оксила, 2,2,5,5-тетраметилпирролидин-1-оксила или 2,2,5,5-тетраметилимидазолин-1-оксила. Синтез новых нитроксильных полирадикалов и исследование их особенностей в растворе представляет несомненный интерес в плане получения органических магнетиков с новыми свойствами.
Основной целью данной работы было детальное исследование методом электронного парамагнитного резонанса (ЭПР) строения, динамических свойств и механизма спинового обмена в новом стабильном трирадикале, в котором радикальные кольца соединены между собой ацетиленовыми мостиками.
МЕТОДИКА ЭКСПЕРИМЕНТА
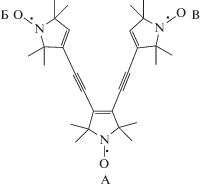
В работе использовали 3,3'-((1-оксил-2,2,5,5-тетраметил-2,5-дигидро-1H-пиррол-3,4-диил)-бис(этино-2,1-диил))-бис(2,2,5,5-тетрамнтил-2,5-дигидро-1H-пиррол-1-илоксил)-трирадикал (ТР, R5(–C≡C–R5)2), синтезированный по методике, подробно изложенной в работе [20]. Схематическое строение ТР приведено на рис. 1, где центральный радикал А есть 1-оксил-2,2,5,5-тетраметил-2,5-дигидро-1H-пиррол-3,4-диил, а концевые радикальные группы Б и В – 3-этинил-2,2,5,5-тетраметил-2,5-дигидро-1H-пиррол-1-илоксил. Трирадикал выделен в виде оранжевого порошка с Rf = 0.54 (в смеси гексан/этилацетат в соотношении 2 : 1) и температурой плавления 85–86 °C.
В качестве растворителя был выбран толуол марки “ч.д.а” (Fluka), который дополнительно очищали и сушили над молекулярными ситами в соответствии с рекомендациями из [21]. Растворы ТР в концентрации не более 2 ⋅ 10−4 моль/л, чтобы исключить межмолекулярный спиновый обмен [10], в объеме 0.4 мл раствора помещали в тонкую кварцевую ампулу диаметром 3.5 мм, а затем три раза вакуумировали (10–3 Торр), замораживая при 77 K и размораживая ампулу для удаления кислорода, а затем отпаивали под вакуумом.
Спектры ЭПР регистрировали на спектрометре X-диапазона Varian E3 (частота модуляции – 100 кГц), оборудованном термостатирующим блоком ER 4131VT (точность термостабилизации составляет ±0.5 K). Температуру варьировали в диапазоне 200–350 K. Для каждого спектра ЭПР определяли величину константы а сверхтонкого взаимодействия (СТВ), измеряли положение линий спектра в магнитном поле, ширины и амплитуды индивидуальных линий. Для точности измерений градуировали магнитное поле, используя эталон, содержащий примесные ионы Mn2+ в матрице MgO. Обработку экспериментальных и расчет теоретических спектров ЭПР проводили, используя пакет компьютерных программ, разработанный проф. А.Х. Воробьёвым (Химический факультет Московского государственного университета им. М.В. Ломоносова) [22].
Геометрические параметры нитроксильного ТР в квартетном состоянии были расчитаны на уровне UDFT/B3LYP с базисом def2-TZVP [23]. Стационарные точки определяли как минимумы на поверхности потенциальной энергии из расчета частот нормальных мод. Равновесные геометрии рассчитывали и в вакууме, и с учетом сольватационного эффекта в толуоле, используя модель COSMO [24]. Расчеты проводили с использованием пакета программ ORCA 4.1 [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
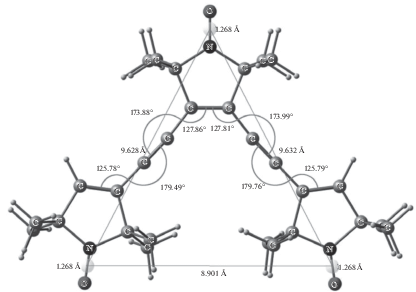
Геометрическое строение ТР, полученное посредством квантовохимических расчетов по
методу функционала плотности (DFT), показано на рис. 2, где приведены значения длин связей, величины валентных углов и расстояния между
неспаренными электронами групп 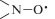 нитроксильных фрагментов. Значительное отклонение величин углов от 180° у атомов
углерода ацетиленовых мостиков (173.88° и 173.99°) указывает на существенную напряженность
структуры трирадикала.
нитроксильных фрагментов. Значительное отклонение величин углов от 180° у атомов
углерода ацетиленовых мостиков (173.88° и 173.99°) указывает на существенную напряженность
структуры трирадикала.
Строение и свойства ТР в толуольных растворах изучали методом ЭПР в широком интервале температур (рис. 3). Отметим, что все изменения спектров ЭПР при варьировании температуры были полностью обратимы, что контролировалось во всех экспериментах. При температурах ниже 260 K спектр представляет собой типичный септет с соотношением линий, близким к 1 : 3 : 6 : 7 : 6 : 3 : 1, что свидетельствует о сильном электронном спиновом обмене с участием всех трех неспаренных электронов нитроксильных колец. При температурах выше 260 K в спектре ЭПР появляются новые линии, соответствующие обменным компонентам квинтетного спектра ЭПР бирадикала с сильным обменным взаимодействием: |J/a| $ \gg $ 1, где J – величина обменного интеграла, a – изотропная константа СТВ неспаренного электрона с ядром азота 14N. Измеренная величина a = (14.8 ± ± 0.05) Гс, что согласуется с данными, известными из литературы [12, 26, 27]. При температурах выше 260 K значения a не измеряли ввиду того, что экспериментальный спектр ЭПР есть суперпозиция спектров трирадикала и бирадикала с разными соотношениями между ними, а близкое положение их крайних линий не позволяет точно измерить величину, имеющую физический смысл.
Рис. 3.
Спектры ЭПР раствора трирадикала в толуоле при 210 (1), 260 (2), 300 (3) и 350 K (4). Стрелки показывают положение бирадикальных линий.
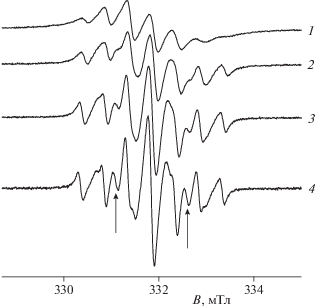
Стрелки на рис. 3 показывают положение бирадикальных компонент в спектре ЭПР, амплитуда dбир которых увеличивается с ростом температуры. Это указывает на существование молекулы
ТР в растворе в виде двух конформаций: А и Б, различающихся характером взаимодействия
неспаренных электронов. В конформации А все три неспаренных электрона в ТР эффективно
делокализованы между всеми тремя группами 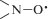 , что проявляется в виде септетного спектра ЭПР и свидетельствует о сильном спиновом
обмене в системе. В случае конформации Б в процессе спинового обмена участвуют только
два электрона (“бирадикал”) с каноническим соотношением интенсивностей линий 1 : 2
: 3 : 2 : 1, причем положение 2-й и 4-й компонент спектра точно соответствует серединам
между основными линиями триплетного спектра нитроксильного радикала.
, что проявляется в виде септетного спектра ЭПР и свидетельствует о сильном спиновом
обмене в системе. В случае конформации Б в процессе спинового обмена участвуют только
два электрона (“бирадикал”) с каноническим соотношением интенсивностей линий 1 : 2
: 3 : 2 : 1, причем положение 2-й и 4-й компонент спектра точно соответствует серединам
между основными линиями триплетного спектра нитроксильного радикала.
В общем случае магнитно-разбавленных жидких маловязких растворов трирадикальная система может быть описана спин-гамильтонианом $\hat {H},$ учитывающим только изотропное сверхтонкое, зеемановское и спинобменное взаимодействия [11]:
(1)
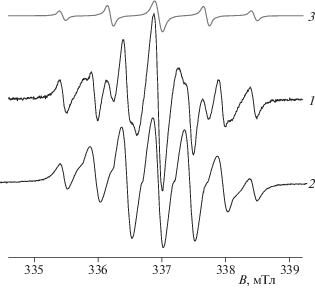
$\begin{gathered} \hat {H} = g{{\beta }_{e}}{{H}_{0}}\left( {\sum {S_{z}^{{\left( k \right)}}} } \right) + \\ + \,\,a\left( {\sum {S_{z}^{{\left( k \right)}}I_{z}^{{\left( k \right)}}} } \right) + \sum {{{J}_{{km}}}} {{S}^{{\left( k \right)}}}{{S}^{{\left( m \right)}}}, \\ \end{gathered} $Такую интерпретацию наблюдаемых изменений в спектрах ЭПР подтверждает их компьютерное моделирование. На рис. 4 представлены экспериментальный спектр ЭПР ТР при 350 K и теоретические спектры трирадикала и бирадикала. Из этого рисунка видно, что, действительно, спектр 1 является суперпозицией спектров ЭПР три- и бирадикала. Доля последнего в суммарном спектре не превышает 5%. При повышении температуры возрастает внутримолекулярная подвижность отдельных радикальных фрагментов в ТР, например в виде почти свободного вращения радикалов Б и В (рис. 1) вокруг главной оси линейной группы –C≡C–, как это было показано в работах [29, 30] для бирадикалов R6–C≡C–R6, R6–C≡C–C≡C–R6 и R6–C≡C–p-C6H4–C≡C–R6, где R6 – радикальный фрагмент 1-оксил-2,2,6,6-тетраметил-3,4-ен-пиперидин.
Рис. 4.
Экспериментальный спектр ЭПР трирадикала в толуоле при 350 K (1) и теоретические спектры трирадикала (2) и бирадикала (3).
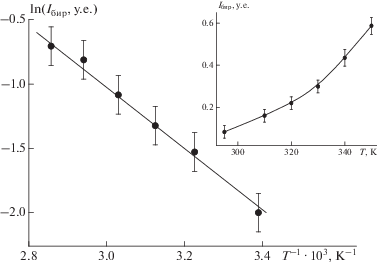
C ростом температуры доля конформера с бирадикальным типом обмена увеличивается (рис. 3, спектры 3 и 4). Механизм этого процесса, вероятно, связан с вращательной подвижностью концевых радикалов Б и В вокруг осей мостиков –C≡C–, связывающих их с центральным радикалом А, что может приводить к реализации “бирадикального” типа обмена. Переход между конформациями “трирадикал” ↔ “бирадикал” описывается уравнением
(2)
${{d}_{{{\text{бир}}}}} = {{d}_{0}}{\text{exp}}\left( { - {{\Delta {{G}_{{{\text{эф}}}}}} \mathord{\left/ {\vphantom {{\Delta {{G}_{{{\text{эф}}}}}} {RT}}} \right. \kern-0em} {RT}}} \right),$ЗАКЛЮЧЕНИЕ
Таким образом, в изученном трирадикале, в котором радикальные фрагменты связаны линейными мостиками –C≡C–, установлено существование двух конформаций с трирадикальным и бирадикальным типами электронного спинового обмена, в которых они находятся в растворе в широком интервале температур. Охарактеризована динамика переходов между этими конформациями и измерена величина изменения свободной энергии системы ΔGэф в результате этого конформационного перехода. Имеющиеся данные, к сожалению, не позволяют сделать однозначный вывод о том, какой именно процесс реализует бирадикальный тип спинового обмена – Б ↔ В или А ↔ Б и А ↔ В. Мы надеемся, что дальнейшие исследования позволят дать ответ на этот вопрос.
Авторы благодарят проф. А.Х. Воробьёва (Химический факультет Московского государственного университета им. М.В. Ломоносова) за предоставление пакета программ для расчета спектров ЭПР. Один из авторов (T. Kálai) благодарен Европейскому союзу за финансовую поддержку (грант GINOP-2.3.2-15-2016-00049).
Список литературы
Miller J.S., Epstein A.J., Reiff W.M. // Science. 1988. V. 240. P. 40; https://www.ncbi.nlm.nih.gov/pubmed/17748820
Овчаренко В.И., Сагдеев Р.З. // Успехи химии. 1999. Т. 68. № 5. С. 381.
Yang B., Xiao Z., Yuan Y., Jayaraman T.V., Shield J.E. et al. // Polymer. 2013. V. 54. № 2. P. 490.
Miller J.S. // Mater. Today. 2014. V. 17. № 5. P. 224.
Tuček J., Holá K., Bourlinos A.B., Błoński P., Bakandritsos A. et al. // Nat. Commun. 2017. V. 8; https://doi.org/10.1038/ncomms14525
Розанцев Э.Г. Свободные иминоксильные радикалы. М.: Химия, 1970.
Имидазолиновые нитроксильные радикалы / Под ред. Молина Ю.Н. Новосибирск: Наука, 1988.
Rassat A. // Pure Appl. Chem. 1990. V. 62. № 2. P. 223.
Volodarskii L.B., Reznikov V.A., Ovcharenko V.I. Synthetic Chemistry of Stable Nitroxides. Boca Raton, FL: CRC Press, 1994.
Замараев К.И., Молин Ю.Н., Салихов К.М. Спиновый обмен. Теория и физико-химические приложения. Новосибирск: Наука, 1977.
Пармон В.Н., Кокорин А.И., Жидомиров Г.М. Стабильные бирадикалы. М.: Наука, 1980.
Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. Электронное строение, реакционная способность и применение. М.: Химия, 1973.
Konieczny M., Sosnovsky G. // Z. Naturforsch, B. 1978. V. 33b. P. 1040.
Corvaja C., De Marchi M., Toffoletti A. // Appl. Magn. Reson. 1997. V. 12. № 1. P. 1.
Baskett M., Lahti P.M., Palacio F. // Polyhedron. 2003. V. 22. № 14–17. P. 2363.
Caproiu M.T., Ionita G., Draghici C., Ionita P. // Arkivok. 2008. V. 14. № 1. P. 158.
Ottaviani M.F., Modelli A., Zeika O., Jockusch S., Moscatelli A. et al. // J. Phys. Chem. A. 2012. V. 116. № 1. P. 174.
Liao Y., Baskett M., Lahti P.M., Palacio F. // Chem. Commun. 2002. V. 3. P. 252.
Кокорин А.И., Grampp G., Шапиро А.Б., Хрусталев В.Н., Tran V.A. // Хим. физика. 2013. Т. 32. № 11. С. 41.
Úr G., Kálai T., Balog M., Bognár B., Gulyás-Fekete G. et al. // Synth. Commun. 2015. V. 45. P. 2122.
Riddick J.A., Bunger W.B., Sakano T.K. Techniques of Chemistry. V. II: Organic Solvents, Physical Chemistry and Methods of Purification. New York: Wiley, 1986.
Vorobiev A.Kh., Chumakova N.A. // Nitroxides – Theory, Experiment and Applications / Ed. Kokorin A.I. Riecka: InTech Publ., 2012. P. 57.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys. 2005. V. 7. P. 3297.
Sinnecker S., Rajendran A., Klamt A., Diedenhofen M., Neese F. // J. Phys. Chem. A. 2006. V. 110. P. 2235.
Neese F. // Interdiscip. Rev.: Comput. Mol. Sci. 2017. V. 8. P. e1327.
Lebedev Ya.S., Grinberg O.Ya., Dubinsky A.A., Poluektov O.G. // Bioactive Spin Labels / Ed. Zhdanov R.I. Berlin: Springer, 1992. P. 228.
Kokorin A.I. // Appl. Magn. Reson. 2004. V. 26. P. 253.
Цукерблат Б.С., Белинский М.И. Магнетохимия и радиоспектроскопия обменных кластеров. Кишинев: Штиинца, 1983.
Gromov O.I., Golubeva E.N., Khrustalev V.N., Kalai T., Hideg K., Kokorin A.I. // Appl. Magn. Reson. 2014. V. 45. № 10. P. 981.
Kokorin A.I., Gromov O.I., Kalai T., Hideg K. // Ibid. 2016. V. 47. № 11. P. 1283.
Наберухин Ю.И., Рогов В.А. // Успехи химии. 1971. Т. 40. № 3. С. 369.
Бучаченко А.Л. Комплексы радикалов и молекулярного кислорода с органическими молекулами. М.: Наука, 1984.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика