Химическая физика, 2019, T. 38, № 5, стр. 81-87
О теории цепных процессов озоносферы
И. К. Ларин *
Институт энергетических проблем химической физики им. В.Л. Тальрозе
Российской академии наук
Москва, Россия
* E-mail: iklarin@narod.ru
Поступила в редакцию 15.08.2018
После доработки 05.09.2018
Принята к публикации 20.09.2018
Аннотация
Выполнен критический анализ современного состояния теоретических исследований процессов разрушения стратосферного озона. В работе излагаются основные положения теории цепных процессов озоносферы, предлагаемые автором статьи, и проводится сравнение этих положений с работами других авторов. Цель работы – доказательство справедливости развитых положений теории путем критического сопоставления полученных результатов с известными литературными данными. Показано, в частности, что существующие методы определения скорости гибели озона в каталитических циклах и их длины цепи зачастую не учитывают цепной характер процессов разрушения стратосферного озона, что ведет к существенным ошибкам в результатах расчетов. В работе приводятся алгоритмы корректного определения указанных выше величин, основанные на законах химической кинетики и теории цепных процессов.
АВТОРСКАЯ КОНЦЕПЦИЯ ТЕОРИИ
Основные положения теории газофазных цепных реакций были изложены в монографии лауреата Нобелевской премии Н.Н. Семёнова “Цепные реакции” [1]. Цепные процессы, протекающие в естественных условиях земной атмосферы, обладают своей спецификой, которая была раскрыта в каталитических циклах разрушения стратосферного озона, подробно описанных в работе [2]. Вместе с тем в тех немногих работах, в которых обсуждаются общие вопросы цепной теории гибели озона в стратосфере, высказываются соображения, отличные от изложенных в [2]. Имея в виду, что эти мнения принадлежат высокоавторитетным специалистам в области атмосферной химии, а также широкую цитируемость этих работ, имеет смысл критически проанализировать все точки зрения и выбрать одну, наиболее верную, что и является основной задачей настоящей публикации. Будем исходить из того, что основная задача теории цепных процессов озоносферы заключается в том, чтобы наиболее полно и верно описать химические процессы с участием озона, происходящие в стратосфере, что позволит определить общее содержание атмосферного озона как сегодня, так и в будущем, а также определить те атмосферные компоненты, которые способны оказать на озон наибольшее влияние.
Напомним, что в настоящее время содержание озона контролируется главным образом стратосферными каталитическими циклами, включающими циклы OX, HOX, NOX, ClOX и BrOX (см. [2]), поэтому авторская концепция теории цепных процессов озоносферы включает в себя следующие элементы: скорость разрушения озона в каталитическом цикле, длину цепи цикла и скорость обрыва цепи. Помимо этого, обсуждаются свойства химических семейств, компоненты которых участвуют в названных выше циклах.
Вопросы разрушения озона в циклах никогда ранее не обсуждались (на исключениях мы остановимся ниже), и при открытии нового каталитического цикла его реакции включали в химический блок соответствующей атмосферной модели вместе с реакциями уже известных циклов и проводили расчеты суммарного эффекта всех учтенных циклов. Для признания важности нового цикла достаточно было убедиться, что суммарный эффект воздействия на озон с учетом нового цикла превосходит эффект известных циклов. В качестве примера можно привести работу [3], в которой впервые был предложен азотно-окисный цикл, реакции которого затем были включены в атмосферную модель наряду с реакциями кислородного и водородного циклов [4], и было показано, что это увеличивает скорость разрушения стратосферного озона.
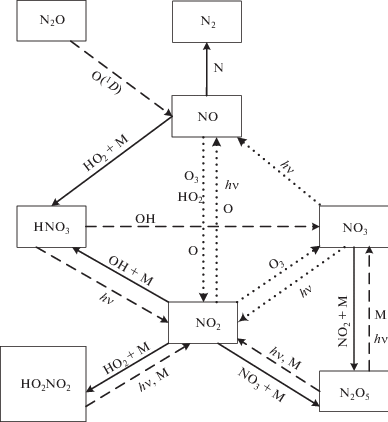
На основании сказанного выше можно было предположить, что задачу разрушения озона в конкретном цикле можно решить, включив в химический блок модели только реакции интересующего нас цикла и рассчитав его эффект. Оказалось, однако, что таким образом задачу решить невозможно из-за тесного взаимодействия циклов, в результате чего азотно-окисный цикл, например, включает реакции не только собственно NOx-цикла, но и реакции кислородного и водородного циклов, как это показано на рис. 1. Кислородный цикл представлен здесь компонентами O(1D), O и O3, водородный цикл – компонентами OH и HO2. Причем реакции с участием O(1D) – ключевые, поскольку в результате возникает основная компонента цикла – радикал NO. Отсюда следует, что циклы могут работать только все вместе, а следовательно, решить проблему машинным путем нельзя.
Рис. 1.
Взаимные превращения частиц в азотно-окисном цикле. Штриховые стрелки показывают источники, сплошные – стоки, точечные – взаимные превращения, которые приводят к разрушению стратосферного озона и нулевым циклам.
Переходим к изложению авторской концепции теории, полученной аналитическим путем. Согласно этой концепции скорость разрушения озона в каталитическом цикле X, WX(–O3), определяется через лимитирующую стадию реакций продолжения цепи, которая, как впервые показано в работе [2], рассчитывается через сумму обратных скоростей всех реакций продолжения цепи, взятую в минус первой степени:
(1)
${{W}_{{\text{X}}}}\left( { - {{{\text{O}}}_{3}}} \right) = 2\sum\limits_{i = 2}^{i = n} {{{{\left( {\frac{1}{{{{W}_{i}}\left( {\text{X}} \right)}}} \right)}}^{{ - 1}}}} ,$Длина цепи, νX, в цикле X, согласно [2], определяется по формуле
(2)
${{\nu }_{{\text{X}}}} = {{\sum\limits_{i = 2}^{i = n} {{{{\left( {\frac{1}{{{{W}_{i}}\left( {\text{X}} \right)}}} \right)}}^{{ - 1}}}} } \mathord{\left/ {\vphantom {{\sum\limits_{i = 2}^{i = n} {{{{\left( {\frac{1}{{{{W}_{i}}\left( {\text{X}} \right)}}} \right)}}^{{ - 1}}}} } {{{W}_{d}}\left( {\text{X}} \right)}}} \right. \kern-0em} {{{W}_{d}}\left( {\text{X}} \right)}},$Физический обрыв связан с процессами турбулентной диффузии, которые обуславливают вывод центров цепи из стратосферы. Скорость физического обрыва в цикле X, $W_{d}^{{phys}}\left( {\text{X}} \right),$ определяется по формуле
где [X] – сумма компонент семейства X, а τd – характеристическое время турбулентной диффузии, определяемое по формуле Здесь H – высота однородной атмосферы, равная ${{RT} \mathord{\left/ {\vphantom {{RT} {mg}}} \right. \kern-0em} {mg}}$ (R – универсальная газовая постоянная, T – абсолютная температура, m – средний молекулярный вес воздуха, g – ускорение свободного падения), а kzz – коэффициент турбулентной диффузии по высоте.Выше было сказано, что скорость обрыва цепи есть сумма скоростей химического и физического обрывов. Но это верно только в том случае, когда время жизни продуктов химического обрыва больше характеристического времени τd турбулентного переноса. В противном случае, т.е. когда продукты химического обрыва живут меньше, чем τd, никакого обрыва не получается, поскольку эти продукты могут распасться на исходные составляющие, вернув активные компоненты в цепь. Таким образом, прежде чем складывать скорости обрывов, необходимо рассчитать время жизни продуктов химического обрыва и сравнить его с τd. Если окажется, что продукты живут меньше τd, то обрыв будет определяться главным образом динамическими процессами и можно положитьв (2), что
(5)
${{W}_{d}}\left( {\text{X}} \right) = W_{d}^{{phys}}\left( {\text{X}} \right) = \frac{{[{\text{X}}]}}{{{{\tau }_{d}}}}.$Приведенные выше алгоритмы расчета полностью решают задачи теории цепных процессов озоносферы, поскольку знание скоростей гибели озона в циклах позволяет определить состояние озонового слоя как в настоящее время, так и в будущем, а знание длины цепи циклов – определить те химические компоненты, которые обладают наибольшей эффективностью по отношению к стратосферному озону.
ДРУГИЕ КОНЦЕПЦИИ ТЕОРИИ
Наиболее полно рассмотренные выше вопросы изучались в упоминавшийся выше работе [6]. В качестве основных элементов теории, определяющих эффективность каталитических циклов (по-видимому, по отношению к озону), в [6] рассматриваются длина цепи каталитических циклов и концентрация радикалов, ведущих цепь (так называемые центры цепи). В терминах из [6] длина цепи, N, определяется как отношение скорости продолжения цепи, ρ, к скорости ее обрыва, δ:
где ρ – скорость лимитирующей стадии. В работе [6] в качестве лимитирующей стадии рассматривается одна из реакций продолжения цепи (в отличие от [2]), обладающая наименьшей скоростью. Для разных высот, как правило, выбираются разные реакции. При этом указывается граничная высота, выше которой действительна одна лимитирующая реакция, а ниже – другая. Помимо этого, вводится еще один элемент теории, который называется эффективностью цепи и определяется как произведение скорости продолжения цепи и ее длины:Понятие эффективности цепи вводится в работе [6] на том основании, что возможны случаи, когда при большой длине цепи концентрация центров цепи оказывается маленькой, что ограничивает эффективность циклов. Указывается также на то, что это понятие особенно полезно при сравнении циклов HOX, NOX, ClOX и BrOX, в которых концентрации центров цепи существенно различны. В порядке комментария укажем, что введение понятия эффективности цепи представляется совершенно неоправданным, поскольку оно ни в малейшей степени не облегчает получение сведений об основных характеристиках цепного процесса, к которым относится скорость гибели озона в цикле и длина цепи цикла. Более того, введение этого понятия запутывает вопрос, поскольку циклы с большой скоростью продолжения цепи получают преимущество перед циклами с большой длиной цепи, что затрудняет их объективное сравнение. Неоправданным представляется и выбор концентрации центров цепи в качестве основного элемента теории, поскольку сама по себе эта концентрация ничего не определяет.
Анализ циклов из работы [6] рассмотрим на примере одного из хлорных подциклов (ClOX-цикл № 4), реакции которого приводятся ниже:
В работе [6] cообщается, что максимальная скорость продолжения цепи в этом цикле достигается на высотах 20–25 км и составляет 104 молекула ⋅ см–3 ⋅ с–1, а длина цепи составляет 1–10 на высотах 15–35 км. Между 10-тым и 45-тым километрами лимитирующей стадией является реакция фотолиза NO3 (т.е. ρ = ${{j}_{{{\text{N}}{{{\text{O}}}_{3}}}}}$[NO3]), где ${{j}_{{{\text{N}}{{{\text{O}}}_{3}}}}}$ – коэффициент фотодиссоциации), а выше 45 км – реакция образования ClONO2 (т.е. ρ = ${{k}_{{{\text{ClO + N}}{{{\text{O}}}_{2}}}}}$ [ClO][NO2]), где k – константа химической реакции ClO + + NO2. На рис. 2 показаны рассчитанные автором статьи высотные профили всех реакций приведенного цикла для условий, указанных в [6], а также рассчитанная по формуле (1) скорость продолжения цепи (без коэффициента “2” в правой части, поскольку в [6] его нет).
Рис. 2.
Высотные профили хлорного цикла № 4 для условий весеннего равноденствия 1995 г. на широте 50° с. ш.
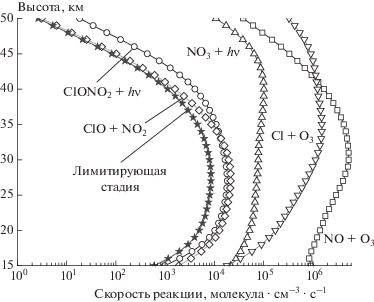
Отметим, что согласие представленных на рис. 2 данных и данных из работы [6] ограничивается тем, что скорость продолжения цепи на высоте ≈25 км составляет около 104 молекула ⋅ см–3 ⋅ с–1. В то же время на высотах 15–35 км реакции ClONO2 + + hν и ClO + NO2 + M имеют практически одинаковую скорость, что не позволяет выбрать здесь лимитирующую стадию по правилам [6] и сделать это можно только способом, описанным в первой части статьи.
Рассчитаем теперь длину цепи в приведенном цикле и сравним ее с данными из [6]. Согласно [6], химический обрыв цепи в этом цикле связан с образованием HCl по реакциям Cl + H2, Cl + CH4, Cl + H2O, Cl + HO2, Cl + CH2O, Cl + CH3OOH. Мы не будем рассчитывать скорость обрыва по этим реакциям, а рассчитаем время жизни HCl для условий, указанных в [6], и сравним его с временем турбулентного переноса. Поскольку, как сказано выше, химический обрыв работает только в том случае, если время жизни его продуктов (в данном случае HCl) больше характеристического времени переноса τd. В соответствии с [2] время жизни HCl, τ(HCl), можно рассчитать по формуле
(8)
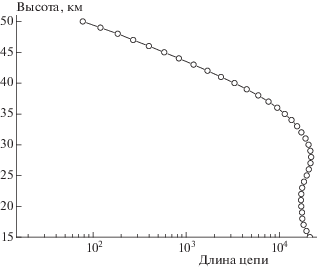
$\begin{gathered} \tau ({\text{HCl}}) = \\ = {1 \mathord{\left/ {\vphantom {1 {\left( {{{k}_{{{\text{OH + HCl}}}}}[{\text{OH}}] + {{k}_{{{\text{O + HCl}}}}}[{\text{O}}] + {{J}_{{{\text{HCl}} \to {\text{Cl}}}}}} \right)}}} \right. \kern-0em} {\left( {{{k}_{{{\text{OH + HCl}}}}}[{\text{OH}}] + {{k}_{{{\text{O + HCl}}}}}[{\text{O}}] + {{J}_{{{\text{HCl}} \to {\text{Cl}}}}}} \right)}}. \\ \end{gathered} $Данные расчета представлены на рис. 3. Можно видеть, что время жизни HCl существенно меньше характеристического времени переноса τd. Это означает, что химический обрыв “не работает”, и поэтому для расчета длины цепи следует воспользоваться правилами, сформулированными в авторской концепции теории. В нижней стратосфере это приводит к увеличению длины цепи в ClOX-циклe № 4 более чем на три порядка (см. рис. 4). Отсюда можно заключить, что игнорирование учета физического обрыва при расчетах длины цепи в каталитических циклах без соответствующего обоснования может привести к существенным ошибкам в расчетах.
Рис. 3.
Рассчитанные для условий [6] время жизни HCl, τ(HCl), и характеристическое время турбулентного переноса τd.
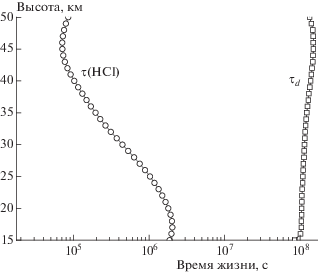
Рис. 4.
Длина цепи хлорного цикла № 4, рассчитанная для условий, указанных в [6], по правилам, изложенным в первой части статьи.
Резюмируя сказанное выше, отметим, что несомненным достоинством работы [6] является то, что ее автор впервые рассмотрел вопрос о длине цепи каталитических циклов, чего никто не делал ни до, ни после него. Вместе с тем подход с использованием в качестве лимитирующей стадии реакции продолжения цепи, идущей с наименьшей скоростью, нельзя считать удачным. Поскольку часто реакции продолжения цепи идут с близкими скоростями и выбор наиболее медленной реакции представляется весьма затруднительным, а в том случае, когда “лимитирующие” реакции идут на разных высотах, нужно “сшивать” их скорости, когда они близки. Концепция автора, представленная выше, позволяет решить все эти вопросы.
Проблемы, связанные с каталитическими циклами гибели стратосферного озона, рассматривались также в широко известной монографии [7], переведенной на русский язык и имеющейся в свободном доступе в интернете. В [7] приводятся реакции основных каталитических циклов, включая циклы OX, HOX, NOX, ClOX и BrOX. Приводятся также формула для расчета скорости гибели озона, ${{d[{{{\text{O}}}_{x}}]} \mathord{\left/ {\vphantom {{d[{{{\text{O}}}_{x}}]} {dt}}} \right. \kern-0em} {dt}}$ (в [7] это формула (5.344) на стр. 414) и высотные профили реакций, в которых, по мнению авторов [7], разрушается озон (в [7] это рис. 6.1 на стр. 445). Справа в формуле (5.344) из [7] стоят члены, ответственные за образование нечетного кислорода OX, включающего O(3P) и O3. Заметим, что члены ${{J}_{{{\text{N}}{{{\text{O}}}_{2}}}}}$ [NO2] и $J_{{{\text{N}}{{{\text{O}}}_{3}}}}^{a}$ [NO3] здесь лишние, поскольку, как впервые показал Чепмен [5], единственным источником нечетного кислорода является фотодиссоциация O2 на атомы (уже не говоря о том, что сами NO2 и NO3 образовались из озона по реакциям NO + O3 → → NO2 + O2 и NO2 + O3 → NO3 + O2). Слева в формуле (5.344) из [7], помимо ${{d\left[ {{{{\text{O}}}_{x}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{{{\text{O}}}_{x}}} \right]} {dt}}} \right. \kern-0em} {dt}},$ стоят члены, ответственные за гибель озона в цепных процессах (иначе – скорости реакций продолжения цепи в циклах), а имеено: 2k1[M][O]2 + + 2k3[O][O3] – в цикле Чепмена, a2[H][O3] + + (a5[OH] + a7[HO2])[O] + (a6[OH] + a6b[HO2])[O3] – в HOX-цикле, b3[NO2][O] + b4[NO][O3] + b9[NO2][O3] – в NOX-цикле, d3[ClO][O] + d2[Br][O3] – в ClOX-цикле и e3[BrO][O] + e2[Br][O3] – в BrOX-цикле (здесь ki, ai, bi и di – константы скорости соответствующих реакций). Обратите внимание на то, что в формуле (5.344) скорости реакций продолжения цепи суммируются, что противоречит законам химической кинетики, согласно которым суммировать можно только скорости параллельно идущих реакций, а в каталитических циклах реакции протекают последовательно. Другими словами, формула (5.344) из работы [7] является ошибочной и, следовательно, ошибочными являются и другие результаты, полученные с ее помощью. В частности, данные об относительном вкладе циклов в суммарную гибель озона, также представленные в работе [7].
Помимо формулы (5.344) в работе [7] представлены высотные профили реакций разрушения озона, которые имеет смысл прокомментировать. Соответствующий рисунок был перестроен автором представленной статьи для условий декабря 1995 года и широты 50° с. ш. (рис. 5) с сохранением всех реакций, учтенных в [7].
Рис. 5.
Перестроенный автором статьи рисунок из работы [7], на котором представлены высотные профили реакций, разрушающих озон (см. текст).
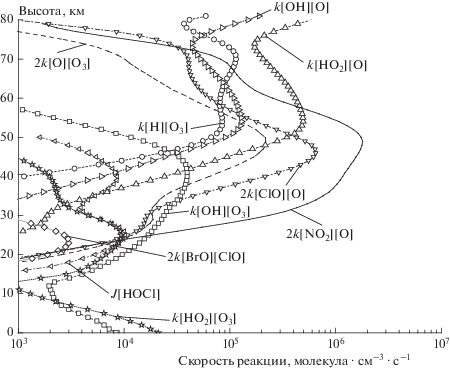
В работе [7] сообщается, что на этом рисунке представлены скорости лимитирующих стадий каталитических циклов разрушения озона. В действительности это не так, поскольку наряду с лимитирующими стадиями (2kClO + O[ClO][O], $2{{k}_{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{ + O}}}}}$[NO2][O]) на рисунке показаны скорости всех реакций HOX-цикла, которые сами по себе разрушить озон не могут, поскольку в каждой такой реакции погибает только одна частица нечетного кислорода, что, согласно Чепмену, не приводит к гибели OX. Что касается высотных профилей лимитирующих стадий ClO + O и NO2 + O, то, как показано в [2], эти реакции лимитируют процесс только на высотах менее ≈40 км. На высотах более 50 км лимитирующими стадиями становятся соответственно реакции Cl + O3 и NO + O3.
Из сказанного следует, что при анализе каталитических циклов разрушения стратосферного озона в работе [7] были допущены серьезные ошибки, которые стали следствием игнорирования как законов химической кинетики, так и законов теории цепных процессов.
ВЫВОДЫ
1. Выполнен критический анализ современного состояния теории цепных процессов озоносферы.
2. Показано, что предлагаемые в литературе методы расчета скорости гибели озона в циклах и длины их цепей являются ошибочными.
3. Теория дополнена алгоритмами корректного расчета скорости гибели стратосферного озона в каталитических циклах и длины их цепей.
Работа выполнена на средства при поддержке грантом Российского фонда фундаментальных исследований № 19-05-00080.
Список литературы
Семёнов Н.Н. Цепные реакции. М.: Наука, 1986.
Ларин И.К. Химическая физика озонового слоя. М.: ГЕОС, 2013.
Crutzen P.J. // J. Geophys. Res. 1971. V. 76. Issue 30.
Hunt B.G. // J. Atmos. Sci. 1966. V. 23. P. 88.
Chapman S. // Mem. Roy. Met. Soc. 1930. V. 3. P. 103.
Lary D.J. // J. Geophys. Res. 1997. V. 102. P. 21515.
Brasseur G., Solomon S. Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Third revised and enlarged edition. Montreal: Canada. Springer, 2005.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


