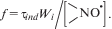Химическая физика, 2020, T. 39, № 11, стр. 3-6
Влияние цистеина на антиоксидантную активность нитроксильных радикалов при окислении метиллинолеата в мицеллах
И. В. Тихонов 1, *, Л. И. Бородин 1, Е. М. Плисс 1
1 Ярославский государственный университет им. П.Г. Демидова
Ярославль, Россия
* E-mail: tikhonoviv.ysu@gmail.com
Поступила в редакцию 16.03.2020
После доработки 15.04.2020
Принята к публикации 20.04.2020
Аннотация
На модели окисления метиллинолеата в мицеллах исследовано влияние цистеина на антиоксидантную активность нитроксильных радикалов в мицеллах. Установлено, что цистеин усиливает антиоксидантное действие нитроксильных радикалов с низким потенциалом восстановления пары оксоаммониевый катион/нитроксильный радикал, что обусловлено образованием соответствующих гидроксиламинов.
ВВЕДЕНИЕ
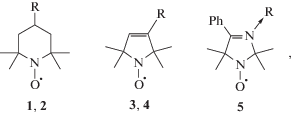
Нитроксильные радикалы  (HP) являются перспективными антиоксидантами в условиях окислительного стресса, которые
защищают от воздействия радикалов молекулы липидов [1–3] и ДНК [4]. Ранее на модели окисления метиллинолеата (LH) в мицеллах мы показали, что HP нестехиометрически
обрывают цепи окисления [5, 6], что обусловлено регенерацией НР радикалом ${\text{HO}}_{2}^{\centerdot }{\text{,}}$ образующимся в ходе процесса [7]. В реальных биологических системах необходимо учитывать возможные взаимодействия
антиоксидантов с другими компонентами, в частности с окислителями (различными активными
формами кислорода) и восстановителями (тиолами, аскорбатами). Так, цистеин (RSH) в
присутствии радикалов ${{{\text{O}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{O}}_{2}^{{\centerdot - }}} {{\text{HO}}_{2}^{\centerdot }}}} \right. \kern-0em} {{\text{HO}}_{2}^{\centerdot }}}$ восстанавливает HP пиперидинового ряда до соответствующих гидроксиламинов
(HP) являются перспективными антиоксидантами в условиях окислительного стресса, которые
защищают от воздействия радикалов молекулы липидов [1–3] и ДНК [4]. Ранее на модели окисления метиллинолеата (LH) в мицеллах мы показали, что HP нестехиометрически
обрывают цепи окисления [5, 6], что обусловлено регенерацией НР радикалом ${\text{HO}}_{2}^{\centerdot }{\text{,}}$ образующимся в ходе процесса [7]. В реальных биологических системах необходимо учитывать возможные взаимодействия
антиоксидантов с другими компонентами, в частности с окислителями (различными активными
формами кислорода) и восстановителями (тиолами, аскорбатами). Так, цистеин (RSH) в
присутствии радикалов ${{{\text{O}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{O}}_{2}^{{\centerdot - }}} {{\text{HO}}_{2}^{\centerdot }}}} \right. \kern-0em} {{\text{HO}}_{2}^{\centerdot }}}$ восстанавливает HP пиперидинового ряда до соответствующих гидроксиламинов 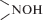 (ГА) [8]. Поскольку ГА являются более сильными антиоксидантами по сравнению с НР [5, 6], цистеин может повышать антиоксидантную активность последних. Поэтому в настоящей
работе нами исследовано влияние цистеина на кинетику ингибированного нитроксильными
радикалами окисления LH в мицеллах.
(ГА) [8]. Поскольку ГА являются более сильными антиоксидантами по сравнению с НР [5, 6], цистеин может повышать антиоксидантную активность последних. Поэтому в настоящей
работе нами исследовано влияние цистеина на кинетику ингибированного нитроксильными
радикалами окисления LH в мицеллах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались следующие реактивы компании Sigma-Aldrich: азоинициатор 2,2'-азо-бис(2-амидинопропан)дигидрохлорид (AAPH), мицеллообразователь Triton X-100, метиллинолеат, цистеин. Буферный раствор готовили путем смешения индивидуальных растворов NaH2PO4 и Na2HPO4 компании Merck с концентрацией 0.05 моль ⋅ л–1, которые дополнительно очищали от следов переходных металлов с помощью ионообменной смолы Chelex-100 компании Bio-Rad. Нитроксильные радикалы
где
были синтезированы В.Д. Сенем (ИПХФ РАН), за что авторы выражают ему благодарность.
Окисление LH (0.01 моль ⋅ л–1) исследовали в мицеллах Triton X-100 (концентрация – 0.05 моль ⋅ л–1) в фосфатном буфере (0.05 моль ⋅ л–1, pH 7.4) при 310 K. Кинетику поглощения кислорода при окислении LH изучали с использованием кислородного биологического монитора YSI 5300A (США). Скорость инициирования Wi определяли методом ингибиторов по времени окончания периода индукции τind с помощью соотношения Wi = 2[InH]0/τind. В качестве ингибитора (InH) при этом использовали 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту компании Sigma-Aldrich. Величины τind определяли интегральным методом [9] по уравнению
(I)
${{\tau }_{{ind}}} = \int\limits_0^\infty {\left( {1 - {{{\left( {\frac{W}{{{{W}_{0}}}}} \right)}}^{2}}} \right)} dt,$где W0 и W – скорость окисления без и в присутствии ингибитора соответственно. Под антиоксидантной активностью нитроксильных радикалов понимали интегральную характеристику, включающую силу и емкость ингибирующего действия. Количественной характеристикой силы антиоксидантного действия является отношение скоростей неингибированного и ингибированного окисления, W0/W, при выбранной концентрации HP. Емкость антиоксиданта характеризовали коэффициентом ингибирования f [9], который определяли по формуле (2).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследовано влияние цистеина на антиоксидантную активность нитроксильных радикалов
при окислении LH в мицеллах Triton X-100. В ходе предварительных экспериментов установлено,
что в отсутствие HP цистеин вплоть до концентраций 10–3 моль · л–1 не изменяет скорость окисления LH, т.е. не обладает антиоксидантным или прооксидантным
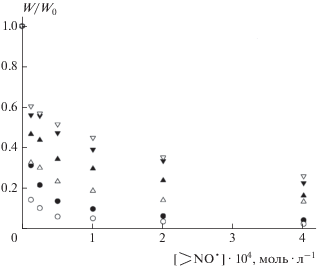
действием. Типичные зависимости начальной скорости окисления от концентрации HP представлены
на рис. 1. Введение RSH снижает скорость окисления (усиливает антиоксидантное действие) для
пиперидиновых НР 1, 2, но не для пирролинового HP 3. Отсутствие влияния RSH на силу антиоксидантного действия наблюдалось также для пирролинового
НР 4 и имидазолинового НР 5. Количественной характеристикой влияния RSH на силу антиоксидантного действия HP
является отношение скоростей ингибированного окисления в отсутствие и в присутствии
RSH (W/WRSH), поскольку значения W0 в обоих случаях одинаковы. Наибольшее влияние RSH оказывает на силу антиоксидантного
действия НР 1: во всем диапазоне  = (0.1÷4.0) · 10–4 моль · л–1 отношение W/WRSH при [RSH] = 1.0 · 10–4 моль · л–1 составляет 1.8–2.2; для НР 2 это отношение равно 1.2–1.5 (рис. 1).
= (0.1÷4.0) · 10–4 моль · л–1 отношение W/WRSH при [RSH] = 1.0 · 10–4 моль · л–1 составляет 1.8–2.2; для НР 2 это отношение равно 1.2–1.5 (рис. 1).
Рис. 1.
Зависимость скорости окисления LH в мицеллах от концентрации нитроксильных радикалов 1–3 в отсутствие и в присутствии RSH в концентрации 1.0 · 10–4 моль · л–1; Wi = 3.8 · 10–9 моль · л–1 · с–1, T = = 310 K; ⚫, ▲, ▼ – 1, 2, 3; ⚪, △, ▽ – 1 + RSH, 2 + RSH, 3 + RSH.
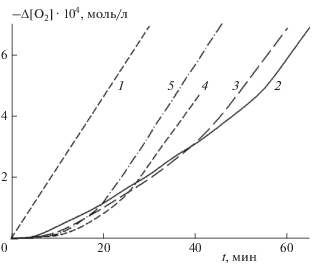
Влияние RSH на ингибирующую емкость НР исследовали по изменению коэффициента ингибирования f, рассчитываемого из периода индукции ингибированного окисления. На рис. 2 представлены кинетические кривые ингибированного НР 1 окисления в присутствии RSH в различных концентрациях. Добавление RSH приводит к выраженному периоду индукции на кинетических кривых, однако его продолжительность с ростом [RSH] снижается. Рассчитанные по данным рис. 2 с использованием уравнений (I) и (II) значения f при различных значениях [RSH] (в скобках) составляют: 3.3 (0 моль · л–1), 2.7 (1 ⋅ 10–5 моль · л–1), 1.6 (1 ⋅ 10–4 моль · л–1), 1.4 (5 ⋅ 10–4 моль · л–1). В аналогичных условиях в присутствии RSH в концентрации 1 ⋅ 10–4 моль · л–1 значение f для HP 2 снижается с 4.5 до 3.0. Таким образом, введение RSH усиливает антиоксидантное действие пиперидиновых НР в начальный момент времени, но снижает емкость ингибирования. При этом RSH не снижает значение f для НР 3–5.
Рис. 2.
Кинетические кривые поглощения кислорода при окислении LH в мицеллах без ингибитора
(1) и в присутствии нитроксильного радикала 1 при различных концентрациях RSH, моль · л–1: 0 (2), 1 ⋅ 10–5 (3), 1 ⋅ 10–4 (4), 5 ⋅ 10–4 (5);  = 3.2 · 10–6 моль · л–1, Wi = 3.8 · 10–9 моль · л–1 · с–1, T = 310 К.
= 3.2 · 10–6 моль · л–1, Wi = 3.8 · 10–9 моль · л–1 · с–1, T = 310 К.
Предполагаемой причиной усиления антиоксидантного действия пиперидиновых НР в присутствии RSH является образование гидроксиламина по схеме:
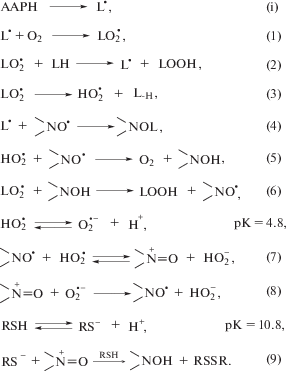
В отсутствие RSH механизм антиоксидантного действия действия HP описывается реакциями
(1)–(8) [5, 6]. При окислении LH в мицеллах образуются радикалы ${\text{HO}}_{2}^{\centerdot }$ по реакции (3) [10], что, в частности, обуславливает линейный обрыв цепей в данном процессе [11, 12]. Нитроксильные радикалы обрывают цепи окисления, реагируя как с алкильными радикалами
${{{\text{L}}}^{\centerdot }}$ по реакции (4), так и с радикалами ${\text{HO}}_{2}^{\centerdot }$ в мицеллах (реакции (5), (6)) или в водной среде (реакции (7), (8)). Циклические
реакции (5)–(8) обуславливают регенерацию 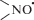 в данной системе [7, 13]. Известно, что в присутствии радикалов ${{{\text{O}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{O}}_{2}^{{\centerdot - }}} {{\text{HO}}_{2}^{\centerdot }}}} \right. \kern-0em} {{\text{HO}}_{2}^{\centerdot }}}$ цистеин восстанавливает пиперидиновые HP до ГА [8]: радикал ${\text{HO}}_{2}^{\centerdot }$ по реакции (7) обратимо окисляет НР до оксоаммониевого катиона
в данной системе [7, 13]. Известно, что в присутствии радикалов ${{{\text{O}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{O}}_{2}^{{\centerdot - }}} {{\text{HO}}_{2}^{\centerdot }}}} \right. \kern-0em} {{\text{HO}}_{2}^{\centerdot }}}$ цистеин восстанавливает пиперидиновые HP до ГА [8]: радикал ${\text{HO}}_{2}^{\centerdot }$ по реакции (7) обратимо окисляет НР до оксоаммониевого катиона 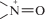 , который далее под действием RSH по реакции (9) восстанавливается до ГА. Гидроксиламины
являются существенно более сильными антиоксидантами по сравнению с соответствующими
НР, вступая в реакцию (6) с пероксидными радикалами субстрата ${\text{LO}}_{2}^{\centerdot }$ [5, 6].
, который далее под действием RSH по реакции (9) восстанавливается до ГА. Гидроксиламины
являются существенно более сильными антиоксидантами по сравнению с соответствующими
НР, вступая в реакцию (6) с пероксидными радикалами субстрата ${\text{LO}}_{2}^{\centerdot }$ [5, 6].
Из кривых 2–4 на рис. 2 по уравнению [5]
были оценены константы скорости kInH взаимодействия антиоксиданта с ${\text{LO}}_{2}^{\centerdot },$ которые составили (1.1÷1.4) ⋅ 105 л · моль–1 · c–1. Для аналогичных по структуре липофильных пиперидиновых ГА значения kInH находятся в диапазоне (1÷3) ⋅ 105 л · · моль–1 · c–1 [5]. Близость расчетных значений kInH к литературным данным является дополнительным свидетельством образования ГА при ингибированном HP 1 окислении LH в присутствии RSH.
Представленный механизм объясняет различное влияние RSH на антиоксидантную активность
исследованных НР. Лимитирующей стадией процесса взаимодействия НР с RSH является реакция
(7), поэтому вероятность образования ГА (и усиления антиоксидантного действия НР в
присутствии RSH) определяется потенциалом восстановления E пары 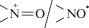 . Наименьшее значение E (0.734 В) имеет HP 1 [14], поэтому эффект синергизма для него выражен в большей степени (рис. 1, 2). Высокие значения E для пирролиновых и имидазолиновых HP 3–5 (∼1.0 В) [14] смещают равновесие в реакции (7) влево, вследствие чего образования ГА не происходит,
и влияние RSH на антиоксидантное действие HP отсутствует (рис. 1). Причины антагонизма в отношении емкости ингибирования неясны. Возможно, имеют место
побочные реакции с участием цистеина, приводящие к расходованию ингибитора.
. Наименьшее значение E (0.734 В) имеет HP 1 [14], поэтому эффект синергизма для него выражен в большей степени (рис. 1, 2). Высокие значения E для пирролиновых и имидазолиновых HP 3–5 (∼1.0 В) [14] смещают равновесие в реакции (7) влево, вследствие чего образования ГА не происходит,
и влияние RSH на антиоксидантное действие HP отсутствует (рис. 1). Причины антагонизма в отношении емкости ингибирования неясны. Возможно, имеют место
побочные реакции с участием цистеина, приводящие к расходованию ингибитора.
Обнаруженные закономерности имеют значение в свете потенциального применения нитроксильных радикалов как антиоксидантов против окислительного стресса. Тиолы клетки (прежде всего глутатион) могут повышать антиоксидантную активность HP. Наиболее перспективными в этом отношении являются HP с низкими значениями E, прежде всего TEMPO (HP 1).
ЗАКЛЮЧЕНИЕ
Обнаружено, что цистеин усиливает антиоксидантное действие пиперидиновых нитроксильных радикалов при окислении метиллинолеата в мицеллах. Причиной данного эффекта является восстановление нитроксильных радикалов цистеином в присутствии радикалов ${{{\text{O}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{O}}_{2}^{{\centerdot - }}} {{\text{HO}}_{2}^{\centerdot }}}} \right. \kern-0em} {{\text{HO}}_{2}^{\centerdot }}}$ до соответствующих гидроксиламинов, которые эффективно обрывают цепи окисления. Наиболее сильно эффект выражен для TEMPO (НР 1), обладающего самым низким потенциалом восстановления пары оксоаммониевый катион/нитроксильный радикал.
Результаты получены в рамках научно-исследовательской работы ЯрГУ № ОП-2Г-02-2019.
Список литературы
Damiani E., Paganga G., Greci L., Rice-Evans C. // Biochem. Pharmacol. 1994. V. 48. № 6. P. 1155.
Nilsson U.A., Carlin G., Bylund-Fellenius A.C. // Chem.-Biol. Interact. 1990. V. 74. № 3. P. 325.
Antosiewicz J., Popinigis J., Wozniak M. et al. // Free Radic. Biol. Med. 1995. V. 18. № 5. P. 913.
Offer T., Samuni A. // Free Radic. Biol. Med. 2002. V. 32. № 9. P. 872.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Сень В.Д., Кузнецова Т.С. // Изв. АН. Сер. хим. 2015. № 10. С. 2438.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Сень В.Д. // Изв. АН. Сер. хим. 2015. № 12. С. 2869.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Сень В.Д. // Изв. АН. Сер. хим. 2016. № 12. С. 2985.
Takeshita K., Saito K., Ueda J., Anzai K., Ozawa T. // Biochim. Biophys. Acta. 2002. V. 1573. № 2. P. 156.
Loshadkin D., Roginsky V., Pliss E. // Intern. J. Chem. Kinet. 2002. V. 34. № 2. P. 162.
Roginsky V., Barsukova T. // Chem. Phys. Lipids. 2001. V. 111. № 1. P. 87.
Плисс Е.М., Лошадкин Д.В., Гробов А.М., Кузнецова Т.С., Русаков А.И. // Хим. физика. 2015. Т. 34. № 1. С. 68.
Москаленко И.В., Петрова С.Ю., Плисс Е.М., Русаков А.И., Бучаченко А.Л. // Хим. физика. 2016. Т. 35. № 4. С. 36.
Тихонов И.В., Плисс Е.М., Бородин Л.И., Сень В.Д. // Хим. физика. 2017. Т. 36. № 6. С. 20.
Tikhonov I.V., Sen’ V.D., Borodin L.I. et al. // J. Phys. Org. Chem. 2015. V. 28. № 1. P. 17.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика