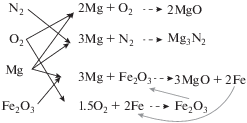Химическая физика, 2020, T. 39, № 12, стр. 53-59
Горение порошка магния с добавками оксида железа на воздухе
В. Г. Крупкин 1, *, В. М. Шмелев 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: krupkin49@mail.ru
Поступила в редакцию 07.05.2020
После доработки 07.05.2020
Принята к публикации 20.05.2020
Аннотация
Проведено исследование особенностей горения в воздушной атмосфере цилиндрических образцов из порошка магния насыпной плотности. В отличие от горения одиночных частиц магния в воздухе, где основным продуктом реакции является оксид магния, в наших экспериментах в продуктах реакции обнаружено значительное количество нитрида магния. При увеличении диаметра образца существенно возрастает степень недогорания магния. Показано, что введение в состав образца от 1 до 15% мелкодисперсного порошка оксида железа приводит к возрастанию степени химического превращения магния. Процесс превращения при этом проходит в две стадии с характерными температурами 650° и 1050 °С. Предложен механизм действия добавки оксида железа, основанный на многократном повторении реакций замещения железа на магний в оксиде с образованием свободного железа и окислением этого железа с образованием новой порции оксида железа.
ВВЕДЕНИЕ
Интерес к исследованию особенностей воспламенения и горения магния связан с его широким применением в качестве конструкционного материала, как в чистом виде, так и в виде сплавов с другими металлами, как энергетической добавки в ракетное топливо, как одного их основных компонентов пиротехнических составов. Также работа с взрыво- и пожароопасным мелкодисперсным порошком Mg при его производстве и хранении требует знания специальных правил безопасности. В работе [1] горение порошка магния насыпной плотности в воздухе было предложено использовать в качестве источника энергии для термоэлектрических преобразователей закрытого типа.
Особенности горения образцов из порошка магния насыпной плотности исследовались: в атмосфере азота при давлении от 1 до 100 атм в работе [2], в азотно-кислородной атмосфере при давлениях выше атмосферного [3], при субатмосферном давлении [4] и на воздухе [5]. В работах [6–8] проведено исследование ячеистых волновых режимов фильтрационного горения плоских слоев порошков металлов насыпной плотности. В работах [1, 3–5] показано, что при горении на воздухе порошка магния без добавок наблюдается значительная степень его недогорания, а остаток после сгорания образца диаметром более 10 мм представляет собой плотную цилиндрическую трубку из нитрида магния с толщиной стенок ~3–5 мм, заполненную практически несгоревшим исходным порошком. Для увеличения при горении на воздухе степени превращения магния в работах [1, 5] предложено вводить в его состав 5% оксида железа.
Следует отметить, что горение магниевого термита – стехиометрической смеси порошков магния и оксида железа изучено достаточно подробно, например, в работе [9]. В настоящей работе исследуется влияние небольшого процентного содержания добавки оксида железа в составе образца на температуру, характер и состав продуктов горения и обсуждается возможный механизм ее действия.
МЕТОДИКА ЭКСПЕРИМЕНТА
В экспериментах использовали порошок магния марки МПФ-4 (средний размер частиц – 80 мкм, удельная поверхность ~1000 см2/г, содержание активного магния ~99%) и, как добавку, мелкодисперсный порошок оксида железа (средний размер частиц ~10 мкм). Порошок магния или тщательно перемешанную смесь порошков магния и оксида железа помещали в стаканчик диаметром 10–30 мм и высотой 40 мм из тонкой сгорающей бумажной оболочки. Плотность насыпки составляла 0.53 г/см3. Горение на верхней поверхности образца инициировали раскаленной нихромовой спиралью.
При измерениях температуры образца использовали гибкие термопары типа “К” (хромель–алюмель) толщиной 100 мкм фирмы EARUELETRIC с рабочей температурой до 1350 °С в оболочке из нержавеющей стали диаметром 1 мм и внутренней изоляцией из стекловолокна. Пустой бумажный стаканчик устанавливали на подставку, а закрепленные в специальном приспособлении на необходимой высоте термопары прокалывали боковую поверхность стаканчика и фиксировались в нужной точке (на оси гильзы или вблизи ее внутренней поверхности). Затем проводили засыпку в гильзу предварительно подготовленного порошка. Сигналы термопар записывались на цифровом осциллографе Velleman. Киносъемка процесса горения проводилась с помощью высокоскоростной USB камеры KYT-U400-MCS0660R01 с переменным фокусным расстоянием от 6 до 60 мм и скоростью до 300 кадр/c. Для определения полноты сгорания образца использовали волюметрический метод, основанный на реакции несгоревшего магния с разбавленной соляной кислотой. Навеску конденсированных продуктов сгорания помещали в небольшую реторту с раствором HCl и с помощью бюретки измеряли объем выделившегося водорода, свидетельствующий о количестве несгоревшего металла. Химический состав исходного образца Mg + 5% Fe2O3 и остатка после его сгорания определяли методом количественного рентгенофазового анализа с помощью рентгеновского дифрактометра Bruker D8.
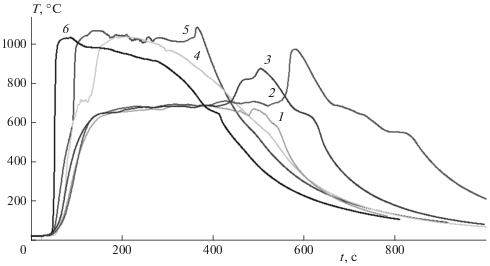
Типичные записи термопар, расположенных в центральной части по высоте на оси цилиндрических образцов в случае горения образца Mg в атмосфере воздуха показаны на рис. 1 в зависимости от весового содержания добавки (сверх 100%) мелкодисперсного оксида железа к порошку магния. Диаметр образца – 22 мм, высота гильзы – 30 мм; масса магния в образце – 8 г.
Рис. 1.
Временные зависимости температуры горения на оси образца (Mg + Fe2O3) при различном содержании добавок Fe2O3: 1 – 0% 2 – 1%, 3 – 2%, 4 – 5%, 5 – 10%, 6 – 15%.
В отсутствие добавки оксида железа после воспламенения образца фронт пламени равномерно распространялся вниз по поверхности гильзы и имел вид кольцевой обугленной зоны, над которой перемещались яркие точки, представляющие из себя горящие отдельные частицы магния. Вся зона образца над фронтом распространения пламени имела темно-красный оттенок за счет реакций нитрования магния, которые протекали внутри образца. На поверхности, по которой уже прошел фронт пламени, периодически возникали яркие сполохи от сгорания (окисления) отдельных частиц магния.
После распространения фронта горения до конца образца весь образец оставался темно-красным еще в течение нескольких минут, затем начиналось постепенное затухание горения и последующее охлаждение образца. Изменение температуры внутри образца показано на рис. 1 (кривая 1). После подхода фронта распространения пламени к термопаре температура плавно повышалась до величины примерно 650°С и выходила на плато, удерживаясь на протяжении 6–7 мин на этом уровне с колебаниями в диапазоне 650–680 °С, (возможно, за счет объемной реакции нитрования, протекающей внутри образца), затем медленно падала из-за остывания образца. Момент выхода температуры на плато практически совпал в данном эксперименте с выходом волны распространения пламени на основание образца.
Диаметр остатка после сгорания образца практически не менялся и оставался равным диаметру исходного образца. На поперечном сечении остатка после сгорания образца четко различаются три зоны: внешняя светлая зона – оксид магния, промежуточная темная – нитрид магния, внутренняя – практически не прореагировавший магний. Степень превращения магния была весьма низкая и не превышала 50%. Следует отметить, что температура плавления магния составляет 650 °С. Можно предположить, что именно за счет частичного расплавления магния в центральной части образца и расходования некоторого количества тепла, выделяющегося в реакции нитрования в периферийной области образца, на теплоту плавления магния температура в области плато поддерживается на этом уровне.
Добавление в состав образца магния небольшого весового количества ~1–2% оксида железа приводило к существенному изменению зависимости температуры внутри образца от времени горения. На начальном этапе при распространении пламени по поверхности и выходу температуры на плато образец с малым содержанием добавки оксида железа вел себя так же, как и без добавки ${\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}$. Однако по мере приближения к моменту времени, когда чисто магниевый состав начинал охлаждаться, в образцах с добавками оксида железа формировалась повторная волна объемной реакции: температура вновь повышалась, проходила через максимальное значение порядка 850–1000 °С и только затем образец начинал остывать (рис. 1, кривые 2 и 3). Визуально вторая волна реакции реализовывалась в виде повторного разогрева и темно-красного свечения поверхности образца. Степень превращения магния в этих опытах оставалась невысокой и поперечное сечение остатка после сгорания выглядело так же, как и после сгорания образца из магния без добавок.
Увеличение содержания добавки ${\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}$ до 5% приводило: к незначительному увеличению скорости распространения пламени по поверхности, выходу температуры на плато и через малую временную задержку – к формированию повторной волны объемной реакции с дальнейшим повышением температуры до величины 1050 °С и выходом на плато. Далее проходило остывание образца (рис. 1, кривая 4). Исследование остатка после сгорания показало, что в этом случае поперечный разрез представлял из себя однородную плотную структуру, состоящую преимущественно из нитрида магния. Аналогичные результаты с 5%-ной добавкой оксида железа были получены нами ранее в работах [4, 5]. Дальнейшее повышение количества добавки оксида железа до 10 или 15% в образце приводило к полному вырождению плато на уровне значения 650 °С и формированию его при температуре 1050 °С (рис. 1, кривые 5 и 6); степень превращения магния при этом оставалась высокой. Отметим, что температура кипения магния (1090 °С) весьма близка к уровню высокотемпературного плато. По-видимому, кипение – это процесс, регулирующий высокотемпературное плато. Кипение магния также должно было способствовать разрушению поверхностных пленок из нитрида магния и приводить к интенсификации процесса превращения магния.
Распространение пламени по поверхности образца с добавкой 15% оксида железа (рис. 2) сопровождалось формированием вертикальных ярко светящихся треков (при меньшем количестве добавки оксида железа это были отдельные светящиеся блуждающие точки). Вторичная волна объемного распространения пламени в этом случае была намного ярче, а время полного сгорания значительно короче, чем при меньшем содержании оксида железа, что свидетельствовало о более интенсивном протекании реакций окисления и нитрования магния.
Следует отметить, что сразу после сгорания на воздухе и остывания образца образовавшийся нитрид магния начинал реагировать при комнатной температуре с влагой из атмосферы воздуха с выделением аммиака и образованием рыхлой структуры оксидов и гидроксидов магния. В течение недели практически весь нитрид магния переходил в окисел.
Методом количественного рентгенофазового анализа определяли исходный состав образца, состоящего из смеси порошков Mg + 5% Fe2O3 и состав этого же образца после сгорания и перехода нитрида магния в оксид. Согласно результатам анализа: исходный образец содержал 95.5% Mg и 4.5% оксида железа (рис. 3а); образец после сгорания содержал в своем составе оксид магния, ферропериклаз Fe0.3Mg0.7O и магнезиоферрит MgFe2O4 (рис. 3б) – это минералы, представляющие собой твердые растворы оксидов железа и оксида магния. Весовое содержание реагентов в исходном образце и в его остатке после сгорания представлено в табл. 1. Металлическое железо в остатке после сгорания образца не обнаружено.
Рис. 3.
Сравнительные дифрактограммы исходного (а) образца состава Mg + 5% Fe2O3 и остатка после его сгорания (б).
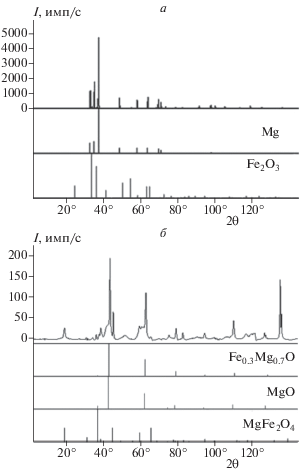
Таблица 1.
Весовое содержание реагентов в исходном образце Mg + 5% Fe2O3 (сверх 100%) и в его остатке после сгорания и перехода нитрида магния в оксид
| Вещество | Формула | Весовое содержание, % |
|---|---|---|
| Исходный образец | ||
| Магний | Mg | 95.50 |
| Оксид железа | α-Fe2O3 | 4.50 |
| Остаток после сгорания | ||
| Оксид магния | MgO | 79.21 |
| Ферропериклаз | Fe0.3 Mg0.7O | 10.89 |
| Магнезиоферрит | MgFe2O4 | 9.90 |
Для оценки влияния процессов окисления магния на закономерности горения составов с добавками оксида железа были проведены контрольные эксперименты, в ходе которых образец обдувался потоком азота. В таких условиях чистый порошок магния и его смесь с добавками оксида железа в количестве до 10% раскаленной нихромовой спиралью поджечь не удалось. В случае воспламенения таких составов на воздухе и после выхода режима горения на стационарный режим включение обдува горящего образца потоком азота приводило к затуханию горения. Отметим что, как показано в работе [3], существует критическое давление газовой среды, выше которого становится возможным самостоятельное горение образцов в азоте.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работах [10–12] показано, что горение одиночной частицы магния в воздухе проходит в газовой фазе за счет испарения с поверхности частицы и диффузии паров магния, при этом продукт реакции – оксид магния – конденсируется на горящей поверхности. Если горит одиночная частица малого размера, то процесс может продолжаться до полного выгорания исходного магния. Окисная пленка на поверхности частицы металлического магния пористая и не препятствует парам магния проходить сквозь нее и взаимодействовать в газовой фазе с кислородом атмосферы. В случае горения одиночных частиц магния в кислородсодержащей атмосфере микроструктура остатка после сгорания представляет собой полые сферы из оксида магния [11]. В работе [13] проводилось термогравиметрическое исследование высокотемпературного окисления небольшой (25 мг) навески порошка магния в воздушной атмосфере и было показано, что продуктами реакции являются оксид и гидроксид магния. В работе [14] проводили экспериментальное исследование влияние дисперсности порошка магния на скорость распространения пламени по плоскому слою. В этой работе также было обнаружено, что после прохождения фронта пламени поверхность покрыта слоем оксида магния. В то же время, эксперименты по высокотемпературному окислению порошка магния в термогравиметрических установках показывают, что в обедненной кислородом (по сравнению с воздушной) атмосфере в продуктах реакции оказывается значительное количество нитрида магния [15].
Исследования кинетики нитрования магния показывают, что пленка нитрида магния непроницаема для паров магния [16, 17]; после формирования такой пленки, окисление (горение) магния в газовой фазе прекращается. Дальнейшее реагирование магния возможно либо в конденсированной фазе за счет диффузии газов (азота и (или) кислорода) через нитридную пленку (в случае, если она сохраняет свою целостность), либо при ее разрушении по каким-либо причинам (например, деформация частицы, повышение внутреннего давления за счет роста температуры) и появлении свежей металлической поверхности магния, которая может снова испаряться, реагируя в газовой фазе, либо нитроваться и снова стать непроницаемой для паров магния.
В случае горения образца, состоящего из порошка магния без добавок, после воспламенения верхнего торца зона пламени начинает распространяться вниз по боковой поверхности образца. На первой стадии процесса горения испаряющийся с поверхности периферийных частиц магний окисляется в газовой фазе кислородом воздуха. Образующийся в результате реакции оксид магния конденсируется на поверхности образца; пористая структура его не препятствует прохождению новых порций испаряющегося магния, его окислению и нарастанию по этой причине слоя оксида. Выделяющаяся в результате реакции окисления магния энергия разогревает образец. При достижении температуры периферийных слоев образца $ \sim $500 °С на поверхности частиц магния начинается реакция нитрования [16]. Нарастающая нитридная пленка на поверхности металлических частиц, непроницаемая для паров магния, препятствует протеканию газофазных реакций окисления магния. Похожий механизм нитрования алюминия описан в работе [18] применительно к случаю самораспространяющегося высокотемпературного синтеза порошка алюминиево-магниевого сплава в атмосфере азота при давлении 10 атм.
После погасания газофазного пламени выделение энергии в зоне, расположенной выше фронта распространения пламени, осуществляется в основном в конденсированной фазе за счет диффузии азота (и, возможно, кислорода) через нитридную пленку вглубь раскаленных частиц магния. На этой стадии горения температура образца слабо меняется в диапазоне 620–680 °С, близкой к температуре плавления магния (650 °С), по-видимому, за счет стабилизации скрытой теплоты плавления магния и установления баланса между теплоприходом от объемной реакции нитрования магния и суммарными теплопотерями (теплопроводностью, конвекцией и излучением) с боковых поверхностей образца. Разрушение нитридной пленки на отдельных частицах магния вследствие их деформации, дефектов нитридной пленки или увеличения давления внутри расплавленной частицы магния за счет испарения магния может приводить к появлению свободной жидкой поверхности магния и сгоранию (окислению) в газовой фазе в виде отдельных ярких вспышек на относительно темной поверхности. После прохождения фронта горения по всей высоте образца процесс твердофазного нитрования охватывает всю поверхность образца, поддерживая его температуру в течение длительного времени на уровне ~650 °C.
По мере нарастания нитридной пленки на периферийных частицах магния диффундирующего потока азота сквозь нитридную пленку становится недостаточно для выработки энергии, компенсирующей теплопотери с поверхности; температура образца уменьшается и процесс твердофазного нитрования магния постепенно прекращается. Погасший образец представляет собой плотный цилиндр, состоящий преимущественно из нитрида магния, сверху прикрытый рыхлой белой оболочкой из оксида магния и заполненный практически не прореагировавшим порошком магния.
Добавка к порошку магния небольшого количества мелкодисперсного оксида железа, не меняя значительно время полного сгорания, повышает максимальную температуру до 1050 °С и приводит к практически полному выгоранию исходного образца. Рентгенофазовый анализ остатка после сгорания образца состава Mg + 5% Fe2O3 показал полное отсутствие в продуктах реакции железа и наличия в нем в небольших количествах ферропериклазы и магнезиоферрита. Рассмотрим подробнее возможный механизм влияния оксида железа на горение магния.
Следует отметить, что добавление оксида железа к магнию и его реакция замещения по схеме 3Mg + Fe2O3 → 2Fe + 3MgO по энергетике хуже, чем реакция нитрования такого же количества Mg (тепловые эффекты реакций в этом случае составляют 4.4 и 6.3 кДж на грамм Mg соответственно) и не может объяснить наблюдаемое увеличение температуры с 650 до 1050 °С.
Для объяснения полученного эффекта можно предложить следующую схему (рис. 4): образующееся в результате реакции замещения железо в условиях высокой температуры окисляется кислородом воздуха до оксида железа с выделением дополнительного количества тепла (в данном случае 7.34 кДж на грамм железа); вновь образовавшийся оксид железа опять взаимодействует с магнием, образуя новую порцию активного железа и выделяя дополнительное тепло. Этот цикл может повторяться многократно, до практически полного израсходования Mg в составе образца. Вызванное предпологаемым механизмом локальное повышение температуры может приводить, в свою очередь, к интенсификации реакции нитрования. Тепловое равновесие между теплоприходом и теплопотерями устанавливается на новом более высоком уровне ~1050 °C. Визуально переход с одного режима на второй выглядит как повторная высокотемпературная волна, распространяющаяся по реагирующему образцу. Отметим, что повторная волна разогрева наблюдалась ранее в работе [19] при исследовании самовоспламенения и горения в струе горячего газа образцов малого размера (~1 мм), спрессованного из порошка чистого магния при атмосферном давлении, но только при 1%-ном содержании кислорода в составе атмосферы. У нас повторная волна нитрования появляется при горении образцов магния с добавками оксида железа при атмосферном давлении в воздухе. За счет повышения температуры степень превращения магния увеличивается. Период индукции перехода режима горения с температурным плато в 650 °С на 1050 °С существенно зависит от содержания оксида железа в составе образца: при малом содержании (1–3%) оксида железа вторая волна появляется с большой задержкой; при 5%-ной добавке оксида железа плато с температурой в 650 °С значительно сокращается, но еще заметно; при 10%-ном и большем содержании Fe2O3 в составе образца горение сразу переходит на режим с высокотемпературным плато. После выработки в образце значительной части магния реакции прекращаются, образец начинает остывать, а находящиеся в образце оксиды железа и соответствующая часть оксидов магния переходят в ферропериклаз и магнезиоферрит.
Таким образом, введение в состав магния оксида железа через механизм обратной связи вовлекает в процесс горения дополнительное количество кислорода, что приводит к возрастанию температуры горения, возрастанию скорости нитрования магния и увеличению степени его превращения. Эксперименты по обдуву образцов с 5%-ной добавкой оксида железа потоком азота, при котором происходило затухание горения образца, подтверждают данный механизм, так как в отсутствие кислорода он работать не может.
Следует отметить, что основным каналом превращения магния в составах с добавками оксида железа в воздушной атмосфере остается нитрование. Роль привлеченного дополнительного кислорода в процесс горения таких составов заключается в производстве дополнительного тепла за счет вовлечения части магния и образующегося железа в реакции окисления и дополнительного разогрева образца за счет этого тепла до температуры ~1050 °C, что приводит в свою очередь к интенсификации реакции нитрования.
ЗАКЛЮЧЕНИЕ
Проведено исследование влияния добавок оксида железа на горение на воздухе образцов из порошка магния насыпной плотности. Показано, что введение в состав исходного образца оксида железа (в количестве от 1 до 15%) влияет на характер горения. Если в случае чистого магния по образцу распространяется одна волна горения при характерной температуре ~650 °C, то добавление оксида железа приводит к формированию повторной волны с характерной температурой ~1050 °C и значительному увеличению степени превращения магния. Предложен механизм влияния добавки оксида железа на характер горения магниевого образца, основанный на предположении о многократном повторении реакции замещения железа в оксиде железа на магний, образовании при этом свободного железа и его повторном окислении кислородом воздуха с образованием новой порции оксида железа.
Работа выполнена за счет субсидии, выделенной ФИЦ ХФ РАН на выполнение государственного задания по теме 44.8 “Фундаментальные исследования процессов превращения энергоемких материалов и разработка научных основ управления этими процессам” (номер госрегистрации АААА-А17-117040610346-5).
Список литературы
Шмелев В.М., Крупкин В.Г. // Горение и взрыв. 2019. Т. 12. № 4. С. 127; https://doi.org/10.30826/CE19120414
Шмелев В.М., Крупкин В.Г., Николаев В.М., Финяков С.В. // Ibid. 2019. Т. 12. № 3. С. 127; https://doi.org/10.30826/CE19120314
Шмелев В.М., Крупкин В.Г., Николаев В.М., Финяков С.В. // Ibid. 2019. Т. 12. № 2. С. 85; https://doi.org/10.30826/CE19120211
Крупкин В.Г., Шмелев В.М., Николаев В.М., Финяков С.В. // Хим. физика. 2019. Т. 38. № 8. С. 24; https://doi.org/10.1134/S0207401X19080077
Николаев В.М., Шмелев В.М. // Горение и взрыв. 2020. Т. 13. № 1. С. 105;https://doi.org/10.30826/CE20130110
Костин С.В., Кришеник П.М., Шкадинский К.Г. // Хим. физика. 2015. Т. 34. № 5. С. 58.
Костин С.В., Кришеник П.М., Шкадинский К.Г. // Хим. физика. 2016. Т. 35. № 8. С. 52.
Кришеник П.М., Костин С.В., Озерковская Н.И., Шкадинский К.Г. // Хим. физика. 2019. Т. 38. № 2. С. 45.
Моногаров К.А., Мееров Д.Б., Фролов Ю.В., Пивкина А.Н. // Хим. физика. 2019. Т. 38. № 8. С. 40.
Деревяга М.Е., Стесик Л.Н., Федорин Э.А. // Физика горения и взрыва. 1978. Т. 14. № 5. С. 3.
Dreizin E.L., Berman C.H., Vicenzi E.P. // Combust. Flame. 2000. V. 122. P. 30.
Feng Y.-Ch., Xia Zh.-X., Huang L.-Y., Ma L.-K., Yang D.-L. // Физика горения и взрыва. 2019. Т. 55. № 2. С. 97;https://doi.org/10.15372/FGV20190210
Karimpour M., Eatezadi S.R., Hasani S., Ghaei A. // Metall. Mater. Trans. 2019. V. 50B. P. 1597; https://doi.org/10.1007/s11663-019-01588-y
Kudo Y., Kudo Y., Torikai H., Ito A. // Fire Saf. J. 2010. V. 45. P. 122.
Chunmiaoa Y., Lifua Y., Chang L., Gang L., Shengjuna Z. // J. Hazard. Mater. 2013. V. 260. P. 707.
Bickley R.I., Gregg S.J. // J. Chem. Soc. A. 1966. P. 1849; https://doi.org/10.1039/j19660001849
Szabó Z.G., Perczel S., Gábor M., Zsolt G., Galwey A.K. // Thermochim. Acta. 1983. V. 64. № 1–2. P. 167; https://doi.org/10.1016/0040-6031(83)80140-3
Xie X., Yan C.-G., Wang Y.-K., Xu J.-R., Zhu C.-G. // Ceram. Intern. 2019. V. 45. P. 18721; https://doi.org/10.1016/j.ceramint.2019.06.098
Озеров Е.С., Скворцов И.И. // Физика горения и взрыва. 1971. Т. 7. № 2. С. 227.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика