Химическая физика, 2020, T. 39, № 6, стр. 36-40
Экстремальная кинетика хемилюминесценции при инициированном окислении липидов растительного происхождения
Р. Ф. Васильев 1, В. Д. Кънчева 2, В. В. Наумов 1, А. К. Славова-Казакова 2, А. В. Трофимов 1, 3, *, Г. Ф. Федорова 1, О. И. Яблонская 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт органической химии с центром фитохимии Болгарской академии наук
София, Болгария
3 Московский физико-технический институт
Долгопрудный, Россия
* E-mail: avt_2003@mail.ru
Поступила в редакцию 23.10.2019
После доработки 23.10.2019
Принята к публикации 20.11.2019
Аннотация
При инициированном 2,2'-азо-диизобутиронитрилом окислении подсолнечного масла, используемого в настоящей работе в качестве модельной липидной системы растительного происхождения, обнаружена ненаблюдаемая ранее форма кинетических кривых хемилюминесценции. По окончании периода индукции, в течение которого хемилюминесценция была подавлена присутствующими в подсолнечном масле антиоксидантами, вместо ожидавшегося плавного S-образного выхода интенсивности свечения на значительно более высокий стационарный уровень наблюдался резкий всплеск интенсивности с последующим ее снижением до стационарного уровня. Стандартная кинетическая схема, использовавшаяся в большинстве работ по влиянию антиоксидантов на хемилюминесценцию при цепном свободнорадикальном окислении углеводородов, оказалась неспособна объяснить форму полученных кинетических кривых. Для объяснения обнаруженного явления предложена расширенная кинетическая схема, учитывающая реакции изобутиронитрил-перекисных радикалов инициатора и их превращение в метил-перекисные радикалы. Показано, что наблюдаемая экстремальная кинетика возможна лишь в случае квантовых выходов хемилюминесценции реакции изобутиронитрил-перекисных радикалов инициатора с перекисными радикалами субстрата, на 1–2 порядка превышающих квантовые выходы других хемилюминесцентных реакций.
ВВЕДЕНИЕ
Липидосодержащие препараты, выделенные из природных источников, содержат в своем составе как липидную массу, так и антиоксиданты, препятствующие цепному свободнорадикальному окислению липидного субстрата вследствие связывания свободных радикалов, образующихся в системе под действием молекулярного кислорода. Расход антиоксиданта тем больше, чем больше скорость зарождения свободных радикалов. Препарат остается стабильным в течение периода индукции, пока в системе присутствует антиоксидант. Экспресс-методы определения устойчивости липидов к окислению основаны на введении в исследуемую систему дополнительных источников свободных радикалов – инициаторов. При этом скорость окисления возрастает за счет увеличения скорости зарождения свободных радикалов (скорости инициирования), а период индукции сокращается до значений, приемлемых для сравнения в лабораторных условиях.
Хемилюминесцентный метод представляется весьма удобным для проведения подобных исследований, поскольку реакции окисления сопровождаются образованием электронно-возбужденных продуктов – эмиттеров света [1–4]. В основе метода лежит мониторинг изменения интенсивности свечения при введении антиоксиданта или препарата, его содержащего, в модельную систему, состоящую из синтетического углеводородного субстрата и инициатора [4–14]. Инициаторы подбирают таким образом, чтобы в отсутствие антиоксиданта при умеренных температурах субстрат окислялся практически с постоянной скоростью и интенсивность свечения за время опыта изменялась незначительно. Введение антиоксиданта, связывающего свободные радикалы, вызывает резкое снижение интенсивности свечения. Затем в течение периода индукции интенсивность хемилюминесценции остается на уровне, близком к минимальному, до тех пор пока не израсходуется антиоксидант (ингибитор). После этого на кинетической кривой хемилюминесценции наблюдается S-образный участок при выходе интенсивности свечения на стационарный уровень, близкий к исходному (в отсутствие антиоксиданта) [4–12]. Характер кинетических кривых хемилюминесценции может меняться в зависимости от свойств антиоксиданта и его концентрации, но наличие S-образного участка типично для всех наблюдавшихся кривых хемилюминесценции [4–14].
Логично было предположить, что хемилюминесцентная кривая подобной S-образной формы получится и при введении инициатора в смесь антиоксиданта и субстрата в случае липидов растительного происхождения. Были проведены эксперименты, в которых инициатор добавляли в раствор подсолнечного масла (2% или 4% по объему) в хлорбензоле. Однако форма полученной кинетической кривой оказалась неожиданной: по окончании периода индукции на кривой наблюдался резкий максимум с последующим снижением до некоторого стационарного уровня. Цели данной работы – объяснение и анализ возможных причин возникновения столь необычной кинетики хемилюминесцентного процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе было использовано подсолнечное масло “Калиакра” болгарского производства. Жирнокислотный состав масла определяли методом газожидкостной хроматографии [15]. Исследуемая система содержала 2%- или 4%-ный раствор масла в хлорбензоле. Окисление проводили при температуре 60 °С. В качестве источника свободных радиалов использовали инициатор 2,2'-азо-диизобутиронитрил (АИБН) [5, 8, 9, 12]. Полученная при этом скорость зарождения свободных радикалов (скорость инициирования) составляла 1 ∙ 10–7 M ⋅ с–1. Описание хемилюминометра и методики измерений приведены в работах [5, 8, 9, 12].
Математическое моделирование кинетики проводили по методике, представленной в работах [16–19]. Константы скорости элементарных реакций, использованные в расчетах, были взяты из работ [19–25] и пересчитаны для значений температур, при которых проводили эксперименты. В случае отсутствия литературных данных были использованы аналогичные оценки для других процессов и данные по реакционной способности реагирующих частиц.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
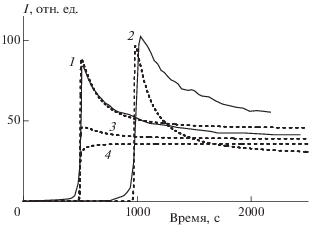
Экспериментально полученные при инициированном окислении подсолнечного масла кинетические кривые хемилюминесценции приведены на рис. 1 и 2. По окончании периодов индукции наблюдаются характерные всплески интенсивности с последующим ее снижением до стационарного уровня.
Рис. 1.
Кинетические кривые интенсивности хемилюминесценции (I), полученные при введении инициатора АИБН в раствор подсолнечного масла с объемной концентрацией 2% (1) и 4% (2) в хлорбензоле. Сплошные линии – эксперимент, штриховые – результат математического моделирования (модель 1).
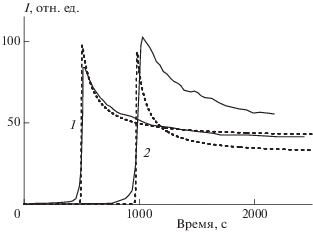
Рис. 2.
Кинетические кривые интенсивности хемилюминесценции (I), полученные при введении инициатора АИБН в раствор подсолнечного масла с объемной концентрацией 2% (1, 3, 4) и 4% (2) в хлорбензоле. Сплошные линии – эксперимент, штриховые – результат моделирования (модель 2). Квантовые выходы реакций (7), (8), (18), (19) и (20) соотносились как 300 : 1 : 1 : 1 : 1 (1, 2), 20 : 1 : 1 : 1 : 1 (3), 4 : 1 : 1 : 1 : 1 (4).
Типичная кинетическая схема, обычно применяемая для описания кинетики хемилюминесценции при ингибированном окислении углеводородов (RH), строится в предположении, что свободные радикалы (YOO•), образовавшиеся в присутствии кислорода при термическом распаде инициатора, быстро “вымениваются” на перекисные радикалы субстрата (ROO•) при достаточно больших концентрациях кислорода и углеводорода [2, 4–9]. Поэтому анализ кинетики хемилюминесценции проводят по кинетической схеме, основанной на превращениях радикала ROO•:
где NRP – нереакционноспособный продукт, звездочка – электронно-возбужденное состояние, hν – квант света. Кинетические кривые, рассчитанные по такой схеме, имеют S-образную форму [2, 4–9]. Такие кривые удовлетворительно совпадали с экспериментальными кривыми, получаемыми в предыдущих работах, и давали возможность оценивать параметры антиоксидантов [2, 4–9]. Однако для описания полученной нами экстремальной кинетики хемилюминесценции (рис. 1 и 2) такой кинетической схемы оказалось явно недостаточно.
Мы предположили, что в момент окончания периода индукции в системе происходят быстрые изменения состава свободных радикалов, участвующих в образовании продуктов, находящихся в электронновозбужденном состоянии (эмиттеров хемилюминесценции). В результате образуются несколько эмиттеров с различными квантовыми выходами хемилюминесценции. Для моделирования такой ситуации кинетическая схема процесса была расширена представленным ниже образом.
Стадия зарождения свободных радикалов:
Продолжение цепей окисления и превращения свободных радикалов представлено реакциями
(1)
${\text{YO}}{{{\text{O}}}^{ \bullet }}~ + {\text{RH}} \to ~{\text{YOOH}} + {{{\text{R}}}^{ \bullet }}\xrightarrow{{{\text{OO}}}}{\text{RO}}{{{\text{O}}}^{\centerdot }},$(2)
${\text{RO}}{{{\text{O}}}^{ \bullet }} + {\text{RH}} \to {\text{ ROOH}} + {{{\text{R}}}^{ \bullet }}\xrightarrow{{{\text{OO}}}}{\text{RO}}{{{\text{O}}}^{\centerdot }},$(3)
${\text{YO}}{{{\text{O}}}^{ \bullet }} + {\text{ROOH}} \leftrightarrow {\text{YOOH}} + {\text{RO}}{{{\text{O}}}^{ \bullet }}.$Участие антиоксидантов в процессе окисления отражено реакциями
(4)
${\text{YO}}{{{\text{O}}}^{ \bullet }} + {\text{AOH}} \to {\text{YOOH}} + {\text{A}}{{{\text{O}}}^{ \bullet }},$(5)
${\text{RO}}{{{\text{O}}}^{ \bullet }} + {\text{AOH}} \to {\text{ROOH}} + {\text{A}}{{{\text{O}}}^{ \bullet }}.$Обрыв цепей окисления происходит по реакциям
(6)
${\text{YO}}{{{\text{O}}}^{ \bullet }} + {\text{YO}}{{{\text{O}}}^{ \bullet }} \to {\text{YOOY}} + {\text{OO}},$(7)
${\text{YO}}{{{\text{O}}}^{ \bullet }} + {\text{RO}}{{{\text{O}}}^{ \bullet }} \to {\text{YOH}} + R{\kern 1pt} ' = {\text{O}} + {\text{OO}} + h\nu ,$(8)
${\text{RO}}{{{\text{O}}}^{ \bullet }} + {\text{RO}}{{{\text{O}}}^{ \bullet }} \to {\text{ROH}} + {\text{R}}{\kern 1pt} ' = {\text{O}} + {\text{OO}} + h\nu ,$(10)
${\text{RO}}{{{\text{O}}}^{ \bullet }} + {\text{A}}{{{\text{O}}}^{ \bullet }} \to {\text{NRP}},$Как показал газохроматографический анализ, в состав исследованного образца подсолнечного масла входили остатки следующих жирных кислот: пальмитиновой – 5.8%, стеариновой – 3.7%, олеиновой – 25.7%, линолевой – 63.4%, арахиновой – 0.3%, эйнозовой – 0.2%, бехеновой – 0.7%. В целях моделирования было сделано предположение, что основными окисляющимися компонентами в подсолнечном масле являются триглицериды, содержащие остатки линолевой кислоты, поскольку именно эти вещества наиболее подвержены окислению [22, 26]. Так как они содержатся в масле, в качестве исходной концентрации субстрата окисления RH были приняты значения 0.0134 и 0.0268 M для 2%- и 4%-ных растворов масла соответственно. Константы скорости реакций имели следующие базовые значения (М–1 ⋅ с–1): 100 для реакции (1), 300 – (2), 100 000 – (3), 50 000 – (–3), 5 ∙ 106 – (4); 3 ∙ 106 – (5), 1 ∙ 106 – (6), 1 ∙ 106 – (7), 5 ⋅ 106 – (8), 1 ∙ 108 – (9), 1 ∙ 108 – (10), 1 ∙ 103 – (11). Соотношение квантовых выходов реакций (7) и (8) было принято равным 30. Данный набор параметров обозначили как модель 1. Параметры варьировали в пределах одного порядка. Исходя из величины периодов индукции, было подобрано исходное соотношение концентраций антиоксиданта и субстрата, равное 1.87 ∙ 10–3. Наилучшие результаты представлены на рис. 1.
Как видно из рис. 1, использованная модель удовлетворительно объясняет образование острых максимумов на кинетических кривых хемилюминесценции. Однако соотношение высот максимумов, полученных при разных концентрациях на модельных кривых, оказалось обратным аналогичному соотношению, полученному на экспериментальных кривых. Обратное соотношение высот пиков сохранялось и при изменении значений констант скорости и квантовых выходов на порядок. Поэтому при дальнейшем моделировании была проведена детализация процесса инициирования. В кинетическую схему были введены реакции, учитывающие образование радикала H3COO• [25] (модель 2),
(12)
${\text{YO}}{{{\text{O}}}^{ \bullet }} + {\text{YO}}{{{\text{O}}}^{ \bullet }} \to 2{{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{NRP}},$и его взаимодействие с другими компонентами реакционной смеси:
(13)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{RH}} \to {{{\text{H}}}_{{\text{3}}}}{\text{COOH}} + {{{\text{R}}}^{ \bullet }}\xrightarrow{{{\text{OO}}}}{\text{RO}}{{{\text{O}}}^{\centerdot }},$(14)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{YOOH}} \leftrightarrow {{{\text{H}}}_{{\text{3}}}}{\text{COOH}} + {\text{YO}}{{{\text{O}}}^{ \bullet }},$(15)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{ROOH}} \leftrightarrow {{{\text{H}}}_{{\text{3}}}}{\text{COOH}} + {\text{RO}}{{{\text{O}}}^{ \bullet }},$(16)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{AOH}} \leftrightarrow {{{\text{H}}}_{{\text{3}}}}{\text{COOH}} + {\text{A}}{{{\text{O}}}^{ \bullet }},$(17)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{A}}{{{\text{O}}}^{ \bullet }} \to {\text{NRP}},$(18)
$\begin{gathered} {{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{{ \bullet }}} \to \\ \to {{{\text{H}}}_{{\text{3}}}}{\text{COH}} + {{{\text{H}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{O}} + {\text{OO}} + h\nu , \\ \end{gathered} $(19)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{RO}}{{{\text{O}}}^{ \bullet }} \to {\text{ROH}} + {{{\text{H}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{O}} + {\text{OO}} + h\nu ,$(20)
${{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ \bullet }} + {\text{YO}}{{{\text{O}}}^{ \bullet }} \to {\text{YOH}} + {\text{R}}{\kern 1pt} '{\kern 1pt} = {\kern 1pt} {\text{O}} + {\text{OO}} + h\nu .$Базовые значения констант скорости реакций были следующими (М–1 ⋅ с–1): 100 для реакции (1), 350 – (2), 1 ∙ 105 – (3), 1 ∙ 105 – (–3), 5 ∙ 106 – (4); 3 · 106 – (5), 3 ∙ 106 – (6), 5 ∙ 105 – (7), 5 ⋅ 106 – (8), 1 ∙ 108 – (9), 1 ∙ 108 – (10), 1 ∙ 103 – (11), 1 ∙ 107 – (12), 200 – (13), 1 ∙ 105 – (14), 1 ∙ 105 – (–14), 1 ∙ 105 – (15), 1 ∙ 105 – (–15), 3 ∙ 106 – (16), 1 ∙ 103 – (–16), 1 ∙ 108 – (17), 5 ∙ 106 – (18), 5 ∙ 106 – (19), 5 ∙ 106 – (20). Параметры варьировали в пределах одного порядка. Исследовали также зависимость формы кинетических кривых от соотношения квантовых выходов хемилюминесцентных реакций. Результаты проиллюстрированы на рис. 2.
Как показывает сравнение рис. 1 и 2, детальное рассмотрение процесса инициирования, выраженное в учете превращений радикалов инициатора и их участия в цепных превращениях, позволило смоделировать изменение высоты пиков при различных концентрациях субстрата. Сопоставление модельных кинетических кривых, полученных при разных соотношениях квантовых выходов хемилюминесценции в реакциях (7), (8), (18), (19), (20), показывает, что необходимым условием образования пиков является значительно больший квантовый выход η в реакции (7) по сравнению с выходами других хемилюминесцентных реакций: η(7)$ \gg $ η(8), (18)–(20). Образование всплесков интенсивности хемилюминесценции на кинетических кривых происходило синхронно с изменениями концентрации изобутиронитрилперекисных радикалов.
Несмотря на то, что условия модели 2 позволили смоделировать образование пиков на кинетических кривых и их соотношение, следующий за образованием пиков спад интенсивности хемилюминесценции в эксперименте происходит значительно медленнее, чем на модельных кинетических кривых. Мы полагаем, что это обусловлено побочными, неучтенными кинетической схемой, реакциями компонентов реакционной смеси, входящих в состав растительного масла, образованием димеров токоферолов, разложением перекисных соединений и возможным образованием диоксетанов [12]. Рассмотрение влияния таких реакций будет предметом дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Детальное рассмотрение возможных реакций свободных радикалов, образующихся при термическом распаде АИБН, позволило создать кинетическую схему из 20 реакций, адекватно описывающую образование экстремумов на кинетических кривых хемилюминесценции, полученных при введении инициатора в раствор подсолнечного масла. Ключевое значение при этом играет реакция изобутиронитрилперекисных радикалов с перекисными радикалами субстрата при условии η(7) $ \gg $ η(8), (18)–(20). Соотношение высот максимумов на кинетических кривых хемилюминесценции, полученных при разных концентрациях, определяется образованием метилперекисных радикалов по реакции (12) и их участием в процессе окисления.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (грант № 19-53-18019 Болг_а) и Национальным научным фондом Болгарии (грант № КП-06-Русия-28).
Список литературы
Vassil’ev R.F. // Nature. 1962. V. 196. № 4855. P. 668.
Vassil’ev R.F. // Progr. React. Kinet. 1967. V. 4. P. 305.
Беляков В.А., Васильев Р.Ф., Трофимов А.В. // Хим. физика. 1994. Т. 13. № 11. С. 74.
Монахова Т.В., Недорезова П.М., Польщиков С.В. и др. // Хим. физика. 2014. Т. 33. № 11. С. 74.
Шляпинтох В.Я., Карпухин О.Н., Постников Л.М. и др. Хемилюминесцентные методы исследования медленных химических процессов. М.: Наука, 1966.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Analyst. 2009. V. 134. № 10. P. 2128.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Жигачева И.В., Русина И.Ф., Генерозова и др. // Хим. физика. 2018. Т. 37. № 11. С. 68.
Васильев Р.Ф., Вепринцев Т.Л., Долматова Л.С. и др. // Кинетика и катализ. 2014. Т. 55. № 2. С. 157.
Slavova-Kazakova A.K., Angelova S.E., Denev P. et al. // Beilstein J. Org. Chem. 2015. V. 11. P. 1398.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Photochem. Photobiol. 2017. V. 93. № 2. C. 579.
Fedorova G.F., Menshov V.A., Naumov V.V. et al. // Photochem. Photobiol. 2019. V. 95. № 3. P. 780.
Fedorova G.F., Trofimov A.V., Vasil’ev R.F. et al. // ARKIVOC. 2007. № 8. P. 163.
Наумов В.В., Храпова Н.Г. // Биофизика. 1983. Т. 28. № 5. С. 730.
Наумов В.В. // Кинетика и катализ. 2008. Т. 49. № 2. С. 239.
Беляков В.А., Кортенска В.Д., Рафикова В.С., Янишлиева Н.В. // Кинетика и катализ. 1992. Т. 33. № 4. С. 765.
Mendes P. // Comput. Appl. Biosci. 1993. V. 9. № 5. P. 563.
Mendes P. // Trends Biochem. Sci. 1997. V. 22. № 9. P. 361.
Mendes P., Kell D.B. // Bioinformatics. 1998. V. 14. №. 10. P. 869.
Hoops S., Sahle S., Gauges R. et al. // Bioinformatics. 2006. V. 22. № 24. P. 3067.
Howard J.A., Ingold K.U. // Can. J. Chem. 1966. V. 44. № 10. P. 1119.
Howard J.A., Ingold K.U. // Ibid. 1967. V. 45. № 8. P. 793.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology. Boca Raton: CRC Press, 2005.
Howard J.A., Robb J.C. // Trans. Faraday Soc. 1963. V. 59. P. 1590.
Vasvari G., Kuramshin E.M., Holly S. et al. // J. Phys. Chem. 1988. V. 92. № 13. P. 3810.
Yanishlieva N., Popov A. // Rev. Franc. Corps Gras. 1973. V. 20. № 1. P. 11.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


