Химическая физика, 2020, T. 39, № 7, стр. 63-71
Морфология и адсорбционные свойства биметаллических наноструктурированных покрытий на пиролитическом графите
М. В. Гришин 1, *, А. К. Гатин 1, С. Ю. Сарвадий 1, В. Г. Слуцкий 1, Б. Р. Шуб 1, А. И. Кулак 2, Т. Н. Ростовщикова 3, С. А. Гуревич 4, В. М. Кожевин 4, Д. А Явсин 4
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт общей и неорганической химии Национальной академии наук Беларуси
Минск, Республика Беларусь
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Физико-технический институт им. А.Ф. Иоффе Российской академии наук
Санкт-Петербург, Россия
* E-mail: mvgrishin68@yandex.ru
Поступила в редакцию 26.04.2019
После доработки 19.05.2019
Принята к публикации 20.05.2019
Аннотация
В работе представлены результаты исследований покрытий, образованных наночастицами золота, меди, никеля и палладия в различных сочетаниях на поверхности высокоориентированного пиролитического графита. Показано, что на структуру биметаллических покрытий и процессы адсорбции на них водорода, кислорода и монооксида углерода оказывает влияние взаимодействие между разнородными наночастицами.
ВВЕДЕНИЕ
Биметаллические катализаторы проявляют высокую каталитическую активность в различных химических реакциях [1]. Широко используются катализаторы на основе наночастиц золота и меди, например, в процессах окисления различных углеводородов – бензилового спирта, пропилена, метанола и других [2–9], а также в низкотемпературном окислении СО [10–12]. Показано, что композиты, состоящие из смеси наночастиц золота и никеля, превосходят по активности однокомпонентные золотые и никелевые наноструктурированные катализаторы в паровой конверсии и окислении СО [13], в реакциях кросс-конденсации спиртов [14]. Использование Au–Ni катализаторов увеличивает выход продуктов изомеризации аллилбензола [15]. Такие катализаторы характеризуются повышенной активностью и устойчивостью в процессах гидродехлорирования [16].
Никель-палладиевые катализаторы характеризуются высокой активностью, селективностью и стабильностью во многих окислительно-восстановительных процессах [17, 18]. Катализаторы состава Ni0.4Pd0.6 участвуют в реакции прямого синтеза Н2О2 и превосходят монометаллический палладиевый катализатор по стабильности и селективности [19]. Добавление палладия к никелю в соотношении 3 : 7 позволяет синтезировать эффективный катализатор для разложения гидразина на простые вещества [20]. Наночастицы NiPd обладают повышенной каталитической активностью по сравнению с частицами Pd, например, в реакциях кросс-сочетания винил- и арилгалогенидов с терминальными алкинами [21], гидрирования ряда нитрозамещенных ароматических углеводородов в мягких условиях [22], процессах водородной энергетики [23], а также в гидродехлорировании хлоруглеводородов [24]. Таким образом, биметаллические покрытия могут стать основой новых, более эффективных систем. В то же время факторы, обуславливающие уникальные свойства биметаллических катализаторов, остаются не известными, хотя для ряда покрытий эта задача, по-видимому, решена [25].
Для выяснения причин различий физико-химических свойств биметаллических систем и монометаллических аналогов, состоящих из отдельных компонентов системы, а также поиска условий их эффективного использования в катализе необходимо знание структуры и электронного строения таких материалов. Обычно для этого применяют методы просвечивающей электронной микроскопии (ПЭМ), рентгенофазового анализа (РФА), рентгеновской фотоэлектронной спектроскопии (РФЭС), ИК-спектроскопии и спектроскопии в видимой области [13, 26–28]. Однако информация, получаемая этими методами, оказывается усредненной по различным наночастицам, что затрудняет определение механизмов химических реакций. Благодаря использованию методов сканирующей туннельной микроскопии в сочетании с туннельной спектроскопией (СТМ/СТС) можно определять не только размеры и форму отдельных наночастиц, но также получать информацию об их электронном строении, идентифицировать адсорбированные на них молекулы и выявлять эффекты межчастичного взаимодействия (синергизм) [29–32]. Цель данной работы – установление морфологии и особенностей локального электронного строения золото-медных, золото-никелевых и никель-палладиевых наноструктурированных покрытий на графите, а также закономерностей взаимодействия таких покрытий с газами – Н2, О2, и СО.
МЕТОДИКА ЭКСПЕРИМЕНТА
Наночастицы Au и Cu, а также Au и Ni осаждали методом пропитки. Водные растворы HAuCl4, Ni(NO3)2 или Cu(NO3)2 с концентрацией металла 2.4 ⋅ 10–8 г/л в разных сочетаниях одновременно наносили на поверхность высокоориентированного пиролитического графита (ВОПГ), сушили и прогревали в течение нескольких часов при Т = = 500–750 К в условиях сверхвысокого вакуума. Получение NiPd покрытия на поверхности ВОПГ осуществляли методом лазерного электродиспергирования (ЛЭД) [34] сплава, содержавшего 65 вес.% никеля и 35 вес.% палладия, аналогичного исследуемому в работе [24].
Для анализа локальной структуры и электронного строения наноструктурированных покрытий применяли сверхвысоковакуумный сканирующий туннельный микроскоп (СТМ). Измерение вольтамперных характеристик наноконтактов СТМ, содержащих нанесенные на подложку наночастицы (далее – ВАХ наночастиц), позволяет анализировать результаты воздействия адсорбированных молекул на поверхность наночастиц. Например, ВАХ беспримесных наночастиц золота имеют S-образную форму, типичную для туннельного контакта двух металлов, с отличной от нуля производной в окрестности нуля напряжений. После экспозиции в водороде на ВАХ этих наночастиц появляется участок с нулевой проводимостью [35]. В некоторых случаях после экспозиции в газах происходили другие значительные изменения формы ВАХ – появление локальных максимумов, причем интервалы по напряжению между ними, dU, численно равны энергии характерного колебательного кванта адсорбированной частицы, hν: edU = hν, где e – элементарный заряд [31]. Для определения локальных характеристик покрытий проводили топографические и спектроскопические измерения на 4–5 удаленных друг от друга участках поверхности образца размером 150–500 нм, которые содержали несколько десятков наночастиц. Для корректной интерпретации результаты измерений ВАХ наночастиц соотносили с данными оже-спектроскопии.
Давление остаточных газов в камере СТМ не превышало P = 2 ⋅ 10–10 Торр, что позволило исключить неконтролируемое изменение химического состава образцов и обеспечило достоверность получаемой информации. При определении адсорбционных характеристик образцы, содержащие наночастицы, экспонировали в Н2, О2, СО при Р = 1 ⋅ 10–6 Торр и Т = 300 К в течение времени, необходимого для достижения требуемой экспозиции. Экспозицию измеряли в Ленгмюрах (1 Л = 1 ⋅ 10–6 Торр ⋅ с). Все дальнейшие топографические и спектроскопические измерения проводили после удаления газа из установки. Элементный состав образцов также определяли методом оже-спектроскопии. Контроль химического состава газовой среды сверхвысоковакуумной камеры на всех этапах работы осуществляли с помощью квадрупольного масс-спектрометра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Золото-медное покрытие
На поверхности ВОПГ находятся скопления сферических наночастиц (диаметр 2–6 нм), расположенные преимущественно на краях графеновых листов (рис. 1а). Наночастицами покрыто до 15% поверхности образца. По результатам измерений ВАХ выявлено три типа наночастиц, существенно различающихся своим электронным строением (рис. 1б, кривые 2–4). Количественный анализ ВАХ разных типов показал, что в золото-медном покрытии преобладают наночастицы, которым соответствуют ВАХ типа кривой 3 на рис. 1б (тип 3). Они составляют около 40% от общего количества наночастиц. Число наночастиц, которым соответствуют ВАХ типа кривой 2 на рис. 1б (тип 2) и ВАХ типа кривой 4 на рис. 1б (тип 4), примерно одинаково и равно ≈30%, (см. табл. 1). Сравнение данных по типам и количеству наблюдавшихся кривых с результатами экспериментов с монометаллическими золотыми или медными покрытиями, [36], а также то, что в условиях нашего эксперимента наночастицы практически не образуют многослойных скоплений, позволило предположить, что кривые типа 2, скорее всего, соответствуют наночастицам золота, кривые типа 3 – наночастицам меди, не содержащим на своей поверхности атомов кислорода, кривые типа 4 – окисленным наночастицам меди. Действительно, результаты исследований методом рентгеновской фотоэлектронной спектроскопии [37] показали, что в золото-медных системах, подобных изучаемым в настоящей работе, золото находится в состоянии Au0, а медь – в состояниях Cu0 и Cu2+, что соответствует нашим данным.
Рис. 1.
Скопления наночастиц Au и Cu на ВОПГ: а – топографическое изображение участка поверхности образца, б – примеры ВАХ ВОПГ (кривая 1) и наночастиц (кривые 2–4).
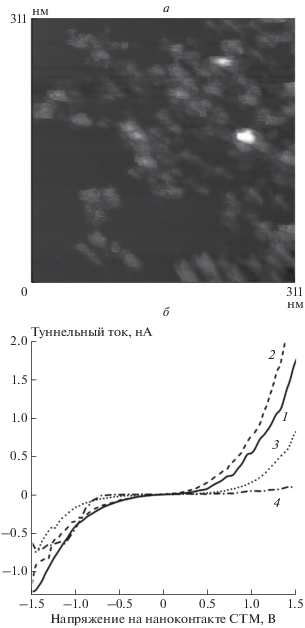
Таблица 1.
Влияние адсорбции на электронное строение наночастиц из золото-медного покрытия пленки
| Воздействие | Количество наночастиц с различными типами ВАХ, % | ||
|---|---|---|---|
| тип 2 | тип 3 | тип 4 | |
| Исходное состояние | 27 | 42 | 31 |
| Экспозиция в СО | 20 | 57 | 23 |
| Экспозиция в Н | 4 | 39 | 37 |
| Экспозиция в О2 | 24 | 22 | 53 |
Выраженную асимметрию ВАХ с запиранием тока в области положительных смещений (кривая 4) можно объяснить тем, что оксиды меди являются типичными полупроводниками р-типа с шириной запрещенной зоны 2.1–2.2 эВ для Cu2O и 1.0–1.4 эВ для CuO [38, 39]. Наличие оксидов меди наряду с восстановленной медью Cu0 обусловлено, вероятно, особенностями процесса ее осаждения термическим разложением нитрата меди на поверхности ВОПГ. В этом процессе первоначально образуются частицы оксида меди CuO [40], которые затем в результате потери кислорода в условиях сверхвысокого вакуума восстанавливаются до Cu0. При этом, учитывая относительно низкую температуру прогрева (500–750 К), явно недостаточную для формирования стабильной кристаллической решетки, присущей “металлургической” меди либо высокотемпературному оксиду меди, следует ожидать проявления эффектов топотаксии, обусловливающих высокую дефектность и, соответственно, реакционную способность формирующихся частиц. В работах [41, 42] установлено, что в условиях, когда один из компонентов системы окислен, смешанные частицы (сплавы) не образуются, т.е. образование наночастиц состава AuCu в присутствии кислорода маловероятно. Кроме того, возможность существования на поверхности восстановленного оксида графена беспримесных золотых и медных наночастиц установлена в работах [11] и [43].
Экспозиция в СО золото-медного наноструктурированного покрытия привела к изменению соотношения между наночастицами с различным электронным строением, т.е. различающихся формой ВАХ. Резко возросло количество наночастиц с ВАХ типа 3 (беспримесная медь) и уменьшилось количество наноночастиц с ВАХ типа 4 (окисленная медь) (см. табл. 1), т.е. наблюдалось восстановление оксида. В результате взаимодействия поверхностного кислорода с адсорбированными молекулами СО с образованием и последующей десорбцией молекул СО2 происходит трансформация электронного строения поверхности от полупроводникового типа к металлическому. Аналогичные результаты получены в работе [43] для каталитических систем, включающих наночастицы состава AuCu/CuO. Авторы этой работы отметили, что присутствие оксида меди (CuO) благоприятно для окисления СО, в то время как система AuCu в данной реакции неактивна.
Воздействие водорода на электронное строение наночастиц проявляется двояко. Как видно из табл. 1, произошел резкий рост количества наночастиц с ВАХ типа 4, т.е. наночастиц, имеющих полупроводниковое электронное строение поверхности, и уменьшение количества наночастиц беспримесного золота (кривые типа 2) и беспримесной меди (кривые типа 3). Результаты, приведенные в работе [35], показали, что водород не только восстанавливал окисленные наночастицы меди, но и, адсорбируясь на золоте и свободных от окисла наночастицах меди, вызывал трансформацию их электронного строения от металлического типа к полупроводниковому. Эту трансформацию можно связать с полупроводниковой природой гидридов меди и AuH, образующихся вследствие высокой реакционной способности частиц меди и золота. Известно, что гидрид меди CuH со структурой вюрцита характеризуется p-типом проводимости и по данным разных авторов имеет ширину запрещенной зоны, Eg, равную 0.53–0.64 и 1.26 эВ [45] (расчеты с использованием PBE и PBE0 функционалов соответственно); 0.65–0.68 [46], 0.74 эВ [47]. Несмотря на неустойчивость гидридов меди, и, особенно, золота, их образование представляется вполне возможным ввиду высокой активности исходных наночастиц меди и золота. Таким образом, после экспозиции в водороде в группу частиц с ВАХ типа 4 вошли не только оставшиеся окисленными наночастицы меди, но и наночастицы меди и золота, поверхность которых содержит адатомы водорода. Последовательная экспозиция образца в Н2 и СО (и наоборот) при комнатной температуре практически не приводила к взаимодействию этих газов между собой на поверхности наночастиц: следов адсорбции молекул со связями С–Н и С–О методами СТМ обнаружено не было.
Результаты, полученные после экспозиции в кислороде золото-медного покрытия, которое предварительно выдерживали в оксиде углерода, а затем в водороде, также представлены в табл. 1. С одной стороны, произошло увеличение количества частиц с ВАХ типа 4, но с другой стороны, и количество частиц с ВАХ типа 2 также резко возросло. Очевидно, это связано с двумя процессами, протекающими одновременно на покрытых адатомами водорода наночастицах Au и беспримесных наночастицах Cu. Во-первых, наночастицы Au освободились от адсорбированного водорода, и, во-вторых, произошло окисление наночастиц меди с ВАХ типа 3. Заметим также, что при освобождении поверхности наночастиц Au от атомов водорода последний десорбируется преимущественно в составе молекул Н2О. Это означает, что в присутствии меди (или оксида меди), как и в присутствии окисленных наночастиц никеля [48], реализуется двухэтапный процесс синтеза воды при адсорбции водорода и кислорода. В отличие от этого, образование воды на наночастицах золота на ВОПГ требует предварительной активации образца водородом, т.е. образование воды происходит в три этапа только при последовательной адсорбции водорода, кислорода и снова водорода [35].
Золото-никелевое покрытие
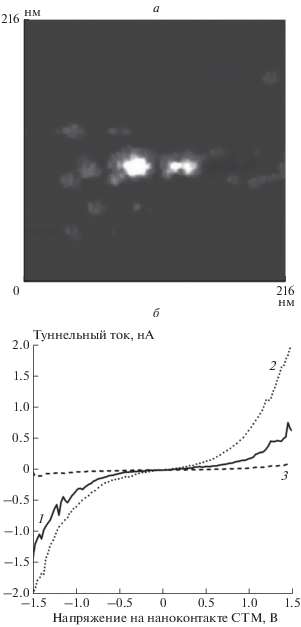
На рис. 2а дано изображение участка поверхности ВОПГ с почти сферическими наночастицами с диаметрами 2–3 и 4–6 нм, которые покрывали 5–7% его поверхности. Бóльшая часть наночастиц входит в состав скоплений, состоявших как из близких по диаметру наночастиц (гомогенные скопления), так и из различающихся своими диаметрами наночастиц (гетерогенные скопления). Измерения ВАХ на наночастицах разного размера показали, что частицам с диаметрами 4–6 нм соответствовали ВАХ S-образной формы (см. кривую 2 на рис. 2б), а частицам с диаметрами 2–3 нм – Z-образные ВАХ c областью нулевого тока шириной 2 В (см. кривую 3 рис. 2б). Ранее [49] нами установлено, что наночастицы золота не содержали примесей, а их электронное строение имело металлический тип. В то же время наночастицы никеля окислены, и, соответственно, являются полупроводниковыми (ширина запрещенной зоны оксида никеля p-типа, p-NiO, Eg = 3.4–3.6 эВ [50, 51]). Это позволяет предположить, что наночастицы большего диаметра состояли из золота, а наночастицы меньшего диаметра – из никеля в сочетании с оксидом никеля. Как и в процессе формирования частиц меди, вначале, при термическом разложении Ni(NO3)2 никелевые наночастицы образуются в виде оксида NiO (при 573 К согласно данным работы [52]) и далее он может трансформироваться в Ni0. В этом процессе можно ожидать проявления топотаксических эффектов [53] еще более выраженных, чем в процессе восстановления оксида меди ввиду большей термической устойчивости оксида никеля.
Рис. 2.
Изображение скоплений наночастиц на ВОПГ (а) и спектроскопические характеристики ВОПГ (кривая 1) и наночастиц (кривые 2 и 3), образующих биметаллические покрытия AuNi (б).
Таким образом, применение спектроскопических измерений в СТМ позволило разделить близкие по размерам, но различные по элементному составу наночастицы, входившие в состав одного и того же покрытия.
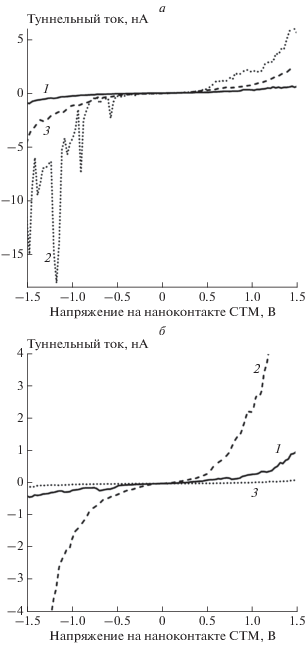
Адсорбционные свойства золото-никелевого наноструктурированного покрытия определены по отношению к Н2, СО и О2. Экспозиция биметаллического покрытия в водороде привела к тем же результатам, что и в случае золотых и никелевых наночастиц по отдельности. Электронное строение наночастиц Au трансформировалось от металлического к полупроводниковому, а оксид никеля частично восстановился (кривые 1 на рис. 3а и 3б). В результате последующей экспозиции золото-никелевого покрытия, предварительно выдержанного в Н2, в СО на ВАХ наночастиц Au появилось довольно большое число серий локальных максимумов с интервалами по напряжению dU1 = 0.2 В и dU2 = 0.3 В (см. кривая 2 на рис. 3а). Совпадение результатов настоящих измерений с данными ИК-спектроскопии [54] позволило установить, что наблюдавшиеся особенности вызваны электронно-колебательным возбуждением связей С–О и С–Н соответственно. По аналогии с данными работы [55] можно предположить, что, как и на наноструктурированном Au покрытии [49], на золоте произошло образование частиц формил-радикала (HCO•). В то же время экспозиция в СО привела к полному восстановлению окисленной поверхности подавляющего большинства наночастиц никеля (кривая 2 на рис. 3б). Действительно, энергетический барьер реакции CO + NiO → Ni + CO2 составляет всего 0.4 эВ, поэтому она могла проходить в условиях нашего эксперимента. Экспозиция образца в О2 привела к почти полному исчезновению серий локальных максимумов с интервалами dU1 = 0.3 В с одновременным значительным увеличением числа подобных кривых с dU2 = 0.2 В (см. кривая 3 на рис. 3а). В соответствии с данными работы [56] такая величина электронно-колебательного кванта могла относиться также к возбуждению связей С=О в молекуле СО2. Помимо описанных выше ВАХ наночастиц, имевших особенности, вызванные электронно-колебательным возбуждением СО2, наблюдались также кривые с сериями локальных максимумов, интервалы по напряжению между которыми равны 0.2 и 0.4 В. Эти ВАХ соответствуют электронно-колебательному возбуждению адсорбированных молекул Н2О [35]. Следовательно, можно заключить, что при воздействии О2 частицы НСО окислились с образованием молекул Н2О, которые затем почти полностью десорбировались, и СО2, часть молекул которых адсорбировалась на поверхности наночастиц. Экспозиция образца в кислороде также привела к окислению никеля, что проявилось в увеличении запрещенной зоны на ВАХ наночастиц до ∼2.6 эВ (кривая 3 на рис. 3б). На некоторых наночастицах Ni регистрировались ВАХ, особенности которых отвечали адсорбированным частицам формил-радикала.
Рис. 3.
Эволюция электронного строения наночастиц Au (а) и Ni (б) в результате взаимодействия с газами. На обеих частях этого рисунка кривая 1 измерена после экспозиции в Н2, кривая 2 ‑ после экспозиции в СО, кривая 3 – после экспозиции в О2.
Таким образом, эффект от взаимодействия никелевых и золотых наночастиц проявился в том, что, во-первых, на биметаллическом покрытии в заметном количестве синтезируется вода и, во-вторых, частично предотвращается окисление формил-радикала, что не наблюдалось для гомогенного покрытия на основе золотых наночастиц.
Никель-палладиевое покрытие
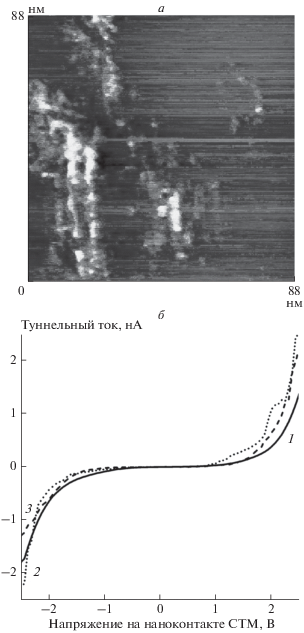
Пример изображения поверхности ВОПГ с наноструктрированным покрытием, образованным методом ЛЭД с использованием никель-палладиевой Ni0.65Pd0.35 мишени, представлен на рис. 4. Из этого рисунка видно, что на подложке находилось большое количество почти сферических наночастиц, входивших в состав скоплений. Характерный диаметр скопления – около 60 нм, степень заполнения подложки – 12–15%, что близко к расчетному значению. При исследовании скопления наночастиц был определен их средний диаметр – 2–3 нм. Именно в этих пределах находятся диаметры наночастиц изученных нами ранее [16, 30] монометаллических Ni и Pd покрытий, полученных этим методом. Анализ изображений биметаллических NiPd наночастиц, осажденных лазерным электродиспергированием из сплава аналогичного состава на сетки для ПЭМ, дал несколько меньшее значение – около 1 нм [24]. Такое расхождение может быть связано с тем, что при сканировании размеры поверхностных нанообъектов могут увеличиваться приблизительно на радиус сферического кончика острия СТМ. Поверхность более чем 90% наночастиц покрыта полупроводниковым слоем с шириной запрещенной зоны около 1.5–2 эВ. Учитывая, что данное покрытие взаимодействовало с воздухом, полупроводниковый слой, наиболее вероятно, включает оксиды никеля и палладия. Примеры ВАХ наночастиц и ВОПГ показаны на рис. 4б. Следует отметить, что значения Eg оксида палладия PdO сильно зависят от способа его приготовления и стехиометрии и варьируются от 2.13 эВ [57] до 0.8 эВ [58]; для покрытий с толщиной, возрастающей от 5 до 40 нм, значения Eg снижаются от 2.3 до 2.15 эВ [59].
Рис. 4.
Никель-палладиевое покрытие на ВОПГ: а – топографическое изображение участка поверхности, б – ВАХ ВОПГ (кривая 1) и примеры ВАХ наночастиц (кривые 2 и 3).
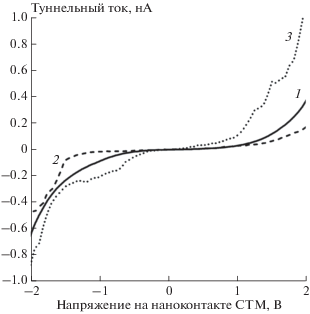
Адсорбционные свойства никель-палладиевого наноструктурированного покрытия определялись по отношению к СО и Н2. Экспозиция в СО привела к значительному сокращению ширины запрещенной зоны до 0.6–0.8 практически на всех наночастицах (кривая 2 на рис. 5). При последующей экспозиции в Н2 на подавляющем большинстве ВАХ наночастиц (более 85%) запрещенная зона исчезла (кривая 3 на рис. 5). Таким образом, воздействие СО и водорода в значительной степени освободило поверхность наночастиц от оксидов. Однако примерно на 15% кривых запрещенная зона шириной около 1 эВ сохранилась даже после длительного прогрева образца в водороде при Т ≈ 500 К. Ранние исследования [30] осажденных ЛЭД на ВОПГ наночастиц Ni показали, что оксид никеля при этих условиях восстанавливается. Эти различия могут быть обусловлены взаимодействием компонентов биметаллического покрытия как между собой, так и с углеродным носителем, что нуждается в дальнейших исследованиях.
Рис. 5.
Влияние адсорбции на электронное строение наночастиц из состава никель-палладиевого покрытия: кривая 1 – ВАХ ВОПГ, кривая 2 – ВАХ наночастиц после экспозиции в СО, кривая 3 – ВАХ наночастиц после экспозиции в Н2.
Проведенные эксперименты не позволили нам разделить обнаруженные наночастицы по элементному составу. Нельзя исключить, что частицы образованы сплавом никеля и палладия, как предполагали авторы работы [24] на основании энергодисперсного анализа, выполненного с помощью ПЭМ. Это подтверждают и результаты работы [60], где показано, что при использовании аналогичного метода синтеза формируются именно наночастицы сплава никеля с палладием.
ЗАКЛЮЧЕНИЕ
Установлены физико-химические свойства наноструктурированных покрытий, состоящих из золота и меди, золота и никеля, никеля и палладия. Использование методов сканирующей туннельной микроскопии в сочетании с туннельной спектроскопией позволило установить, что AuCu и AuNi покрытия состоят из наночастиц золота, меди и никеля; существования наночастиц смешанного состава не обнаружено. В то же время NiPd-покрытие, возможно, образовано наночастицами, состоявшими из этих двух элементов. Определены адсорбционные свойства перечисленных выше покрытий по отношению к водороду, монооксиду углерода и кислороду. Показано, что первые два из перечисленных газов восстанавливали окисленную (в результате взаимодействия с кислородом воздуха) поверхность наночастиц. Адсорбция водорода на беспримесных наночастицах золота и меди приводила к трансформации их электронного строения от металлического к полупроводниковому. Экспозиция в кислороде входивших в состав гетерогенных покрытий наночастиц золота и меди после адсорбции водорода приводила к частичному удалению последнего в составе молекул воды.
Работа выполнена в рамках государственного задания № 0082-2019-00 “Нанохимия”. Научные основы создания новых материалов с заданными свойствами и функциями, в том числе высокочистотных и наноматериалов (АААА-А20-120013190076-0), а также частичного финансирования РФФИ (гранты №№ 18-53-00013 и 18-03-00060).
Список литературы
Эллерт О.Г., Цодиков М.В., Николаев С.А. и др. // Успехи химии. 2014. Т. 83. С. 718.
Kim D., Resasco J., Yu Y. et al. // Nat. Commun. 2014. V. 5. P. 4948.
Neatu S., Macia-Agullo J.A., Concepcion P. et al. // J. Amer. Chem. Soc. 2014. V. 136. P. 15969.
He R., Wang Y.C., Wang X.Y. et al. // Nat. Commun. 2014. V. 5. P. 4327.
Bracey C.L., Ellis P.R., Hutchings G.J. // Chem. Soc. Rev. 2009. V. 38. P. 2231.
Pasini T., Piccinini M., Blosi M. et al. // Green Chem. 2011. V. 13. P. 2091.
Della Pina C., Falletta E., Rossi M. // J. Catal. 2008. V. 260. P. 384.
Bauer J.C., Veith G.M., Allard L.F. et al. // ACS Catal. 2012. V. 2. P. 2537.
Llorca J., Dominguez M., Ledesma C. et al. // J. Catal. 2008. V. 258. P. 187.
Wang L., Zhong Y., Jin H. et al. // Beilstein J. Nanotechnol. 2013. V. 4. P. 128.
Liu X., Wang A., Li L. et al. // J. Catal. 2011. V. 278. P. 288.
Nikolaev S.A., Golubina E.V., Krotova I.N. et al. // Appl. Catal., B. 2015. V. 168. P. 303.
Николаев С.А., Голубина Е.В., Кустов Л.М. и др. // Кинетика и катализ. 2014. Т. 55. № 3. С. 326.
Chistyakov A.V., Zharova P.A., Nikolaev S.A. et al. // Catal. Today. 2017. V. 279. P. 124.
Смирнов В.В., Ланин С.Н., Васильков А.Ю. и др. // Изв. АН. Сер. хим. 2005. Т. 54. № 10. С. 2215.
Lokteva E. S., Peristyy A. A., Kavalerskaya N. E. et al. // Pure Appl. Chem. 2012. V. 84. P. 495.
Hou R., Yu W., Porosoff M.D. et al. // Catalysis. 2014. V. 316. P. 1.
Ahmed M.S., Jeon S. // ACS Catal. 2014. V. 4. P. 1830.
Maity S., Eswaramoorthy M. // Mater. Chem. A. 2016. V. 4. P. 3233.
Ben Aziza W., Petit J.F., Demirci U.B. et al. // Int. J. Hydrogen Energy. 2014. V. 39. P. 16919.
Son S.U., Jang Y., Park J. et al. // J. Amer. Chem. Soc. 2004. V. 126. P. 5026.
Raja R., Golovko V.B., Thomas J.M. et al. // Chem. Commun. 2005. P. 2026.
Shang N., Zhou X., Feng C. et al. // Int. J. Hydrogen Energy. 2017. V. 42. P. 5733.
Golubina E.V., Rostovshchikova T.N., Lokteva E.S. et al. // Pure Appl. Chem. 2018. V. 90(11). P. 1685; https://doi.org/10.1515/pac-2018-0207
Gerasimov G.N., Gromov V.F., Ikim M.I. et al. // Sens. Actuators, B. 2019. V. 279. P. 22.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. № 2. С. 167.
Ростовщикова Т.Н., Шилина М.И., Голубина Е.В. и др. // Изв. АН. Сер. хим. 2015. № 4. С. 812.
Chistyakov A.V., Zharova P.A., Nikolaev S.A. et al. // Catal. Today. 2017. V. 279. P. 124.
Белышева Т В., Гатин А.К., Гришин М.В. и др. // Хим. физика. 2015. Т. 34. № 9. С. 56.
Гатин А.К., Гришин М.В., Гуревич С.А. и др. // Рос. нанотехнол. 2015. Т. 10. № 11–12. С. 18.
Гатин А.К., Гришин М.В., Гуревич С.А. и др. // Изв. АН. Сер. хим. 2014. № 8. С. 1696.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2015. Т. 34. № 7. С. 3.
Дохликова Н.В., Гришин М.В., Сарвадий С.Ю., Шуб Б.Р. // Хим. физика. 2019. Т. 38. № 6. С. 7.
Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М. и др. // Рос. нанотехнол. 2007. Т. 2. № 1–2. С. 47.
Гришин М.В., Гатин А.К., Дохликова Н.В.и др. // Кинетика и катализ. 2015. Т. 56. № 4. С. 539.
Гатин А.А., Гришин М.В., Дохликова Н.В. и др. // Рос. нанотехнол. 2018. Т. 13. № 9–10. С. 4.
Wang L., Zhong Y., Jin H. et al. // Beilstein J. Nanotechnol. 2013. V. 4. P. 111.
Tahir D., Tougaard S. // J. Phys.: Condens. Mater. 2012. V. 24. P. 175002.
Koffyberg F.P., Benko F.A. // J. Appl. Phys. 1982. V. 53. № 2. P. 1173.
Morozov I.V., Znamenkov K.O., Korenev Y.M. et al. // Thermochim. Acta. 2003. V. 403. № 2. P. 173.
Han J., Zahou Y., Chai Y.-Q. et al. // Talanta. 2011. V. 85. № 1. P. 130.
Wang J., Li J., Baca A.J. et al. // Anal. Chem. 2003. V. 75. № 15. P. 3941.
Rout L., Kumar A., Dhaka R.S. et al. // Appl. Catal., A. 2017. V. 538. P. 107.
Zhan W., Wang J., Wang H. et al. // J. Amer. Chem. Soc. 2017. V. 139. P. 8846.
Li Y., Korzhavyi P.A. //Dalton Transactions. 2017. V. 46. № 2. P. 529.
Maurya V., Sharma G., Paliwal U. et al. // Comput. Mater. Sci. 2018. V. 150. P. 329.
Bennett E., Wilson T., Murphy P.J. et al. // Inorg. Chem. 2015.V. 54. № 5. P. 2213.
Гатин А.К., Гришин М.В., Сарвадий С.Ю. и др. // Хим. физика. 2018. Т. 37. № 3. С. 47.
Гатин А.К., Гришин М.В., Сарвадий С.Ю. и др. // Рос. нанотехнол. 2017. Т. 12. № 11–12. С. 15.
Patil P.S., Kadam L.D. // Appl. Surf. Sci. 2002. V. 199. № 1–4. P. 211.
Boschloo G., Hagfeldt A. // J. Phys. Chem. B. 2001. V. 105. № 15. P. 3039.
Brockner W., Ehrhardt C., Gjikaj M. // Thermochim. Acta. 2007. V. 456. P. 64.
Ostyn K.M., Carter C.B. // Surf. Sci. 1982. V. 121. P. 360.
Wohar M.M., Jagodzinski P.W. // J. Mol. Spectrosc. 1991. V. 148. P. 13.
Rothaemel M., Zanthoff H.W., Baerns M. // Catal. Lett. 1994. V. 28. P. 321.
Fastow M., Kosirovski Y., Folman M. // J. Electron Spectrosc. Relat. Phenom. 1993. V. 64–65. P. 643.
Rey E., Kamal M.R., Miles R.B. et al. // J. Mater. Sci. 1978. V. 13. P. 812.
Nilsson P.O., Shivaraman M.S. // J. Phys. C. 1979. V. 12. P. 1423.
Ryabtsev S.V., Ievlev V.M., Samoylov A.M. et al. // Thin Solid Films. 2017. V. 636. P. 751.
Mahfouz R., Cadete Santos Aires F., Brenier A. et al. // J. Nanopart. Res. 2010. V. 12. P. 3123.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


