Химическая физика, 2020, T. 39, № 7, стр. 9-16
Кинетическое моделирование процесса взаимодействия доноров оксида азота с эритроцитами
Б. Л. Психа 1, *, Н. И. Нешев 1, Е. М. Соколова 1, Н. А. Санина 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: psi@icp.ac.ru
Поступила в редакцию 24.04.2019
После доработки 09.09.2019
Принята к публикации 20.12.2019
Аннотация
Исследован механизм взаимодействия с суспензией эритроцитов шести сера-нитрозильных комплексов железа, способных выделять оксид азота в результате спонтанного гидролитического разложения. Предложена кинетическая модель процесса, которая включает в себя реакции выделения NO из комплекса в раствор, взаимодействие NO с оксигемоглобином внутри эритроцита и растворенным кислородом, а также адсорбцию комплексов на поверхности эритроцитов. Определены значения кинетических параметров. Разработанная модель количественно описывает экспериментальные данные по накоплению метгемоглобина – продукта взаимодействия оксигемоглобина с оксидом азота, полученные при разных концентрациях исследуемых комплексов и эритроцитов в системе.
ВВЕДЕНИЕ
Открытие роли оксида азота в качестве сигнальной молекулы, регулирующей многие физиологические процессы в организме, обозначило одновременно фармакологический потенциал химических соединений, способных разлагаться с выделением молекул оксида азота – доноров оксида азота [1–3]. В частности, в качестве перспективной NO-донорной субстанции для создания кардиотропных и противоопухолевых фармакологических препаратов рассматриваются биядерные нитрозильные комплексы железа с тиолсодержащими лигандами – сера-нитрозильные комплексы железа (СНКЖ) [4–6]. К настоящему времени разработаны методы синтеза, которые позволили создать широкое разнообразие СНКЖ на основе меркаптопроизводных ароматических азотистых гетероциклов, а также алифатических сульфгидрильных соединений на основе аминокислот [7, 8].
Выделение оксида азота указанными комплексами происходит в ходе спонтанной гидролитической диссоциации в водной среде [8]. Вместе с тем реализация такой NO-донорной активности в условиях организма имеет определенную специфику, связанную с взаимодействием экзогенных NO-доноров с биосубстратами. Как известно, физиологическая активность оксида азота проявляется в первую очередь в крови, которая по своему клеточному составу на 90% состоит из эритроцитов. В связи с этим было предложено использовать суспензию эритроцитов в качестве модели внутреннего содержимого кровеносного сосуда, где реализуется фармакологический эффект доноров оксида азота в отношении сердечно-сосудистой системы [9, 10].
Экспериментальной основой настоящей работы послужили выполненные ранее исследования кинетики образования внутриэритроцитарного метгемоглобина в реакции оксигемоглобина с оксидом азота, выделяющимся при разложении СНКЖ [11, 12]. В качестве СНКЖ были использованы:
– нейтральные комплексы состава [Fe2(SR)2(NO)4], где R – бензотиазол-2-ил (БТЗ) [13], 1-метил-имидазол-2-ил (МИМ) [14] и пиримидин-2-ил (ПИМ) [15];
– неорганический анионный тиосульфатсодержащий комплекс ТНК состава Na2[Fe2(S2O3)2(NO)4] ∙ · 4H2O [16];
– катионные комплексы, содержащие в качестве S-лигандов цистеамин, [Fe2(S(CH2)2NH3)2(NO)4]SO4 ∙ · 2.5H2O (ЦАК) [17], и пеницилламин, [Fe2(S(C(CH3)2CH(NH3)COOH))2(NO)4]SO4 ∙ 5H2O (ПЕН) [18].
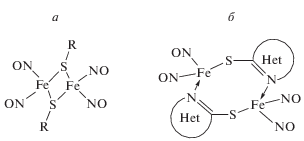
Для комплексов ТНК, ПИМ, ЦАК, ПЕН характерна структура µ-S-типа, включающая два атома железа (расстояние между ними ~2.7 Å), несущие по две NO-группы каждый и связанные между собой мостиковыми атомами серы, принадлежащими соответствующему тиоловому лиганду – R (рис. 1а). Данные комплексы являются структурными аналогами Fe2S2-кластеров в активных центрах негемовых ферментов. Для комплексов БТЗ и МИМ характерна структура µ-S–C–N-типа (рис. 1б). В этих комплексах атомы железа (расстояние между ними ~4.0 Å) связаны через мостики из цепочки атомов –S–С–N– атомов тиолсодержащего азотистого гетероцикла: бензтиазола и метилимидазола соответственно.
Рис. 1.
Структура биядерных сера-нитрозильных комплексов железа: а – ТНК, ПИМ, ЦАК, ПЕН; б – БТЗ, МИМ.
В экспериментах использовали суспензию эритроцитов в изотоническом растворе NaCl, содержащем 5 мМ Na-фосфатного буфера, pH 7.4. Суспензия содержала 1.6% клеток по объему, чему соответствовала концентрация внутриэритроцитарного гемоглобина ~2 · 10–4 мол · л–1 в расчете на один гем. Сера-нитрозильные комплексы железа вводили в суспензию эритроцитов в виде растворов в воде (ТНК, ЦАК, ПЕН) или в ДМСО (ПИМ, МИМ, БТЗ). Эксперимент проводили при 37 °С и непрерывном перемешивании на воздухе.
Количество образовавшегося метгемоглобина определяли в предварительно гемолизированных аликвотах суспензии по оптическому поглощению при 630 нм с учетом поправки на светорассеяние. Концентрацию метгемоглобина рассчитывали по формуле
С каждым комплексом были проведены две серии кинетических экспериментов. В первой серии варьировали концентрацию СНКЖ, сохраняя неизменным гематокрит суспензии (объемное процентное содержание клеток). Во второй серии варьировали гематокрит, сохраняя неизменной концентрацию комплекса. Типичные экспериментальные данные приведены в виде точек на рис. 2–6.
Рис. 2.
Кинетические кривые образования метгемоглобина под действием нитрозильного комплекса железа БТЗ в суспензиях эритроцитов различного гематокрита. Концентрация комплекса [БТЗ]0 = 1.2 ∙ 10–4 моль/л. Исходная концентрация гемоглобина в суспензиях [Hb]0 ∙ 104 = 1.5 (1), 2 (2), 3 (3), 5 моль/л (4). Температура– 37 °С. Точки – эксперимент, линии – расчет по схеме реакций (1')–(4) и найденным значениям кинетических параметров.
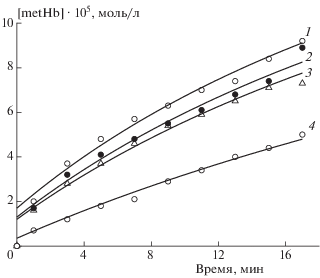
Рис. 3.
Кинетические кривые образования метгемоглобина в суспензии эритроцитов под действием нитрозильного комплекса железа БТЗ. Концентрация комплекса [БТЗ]0 ∙ 104 = 0.8 (1), 1.2 (2), 2.4 моль/л (3). Исходная концентрация гемоглобина в суспензии [Hb]0 = 2 ∙ 10–4 моль/л. Температура – 37 °С. Точки – эксперимент, линии – расчет по схеме реакций (1')–(4) и найденным значениям кинетических параметров.
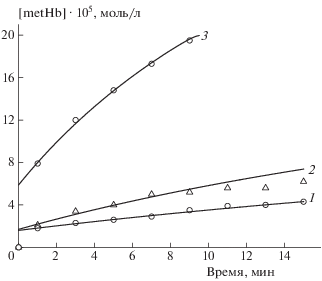
Рис. 4.
Зависимости эффективной константы скорости донирования NO от концентрации комплексов БТЗ (1), МИМ (2) и ПИМ (3).
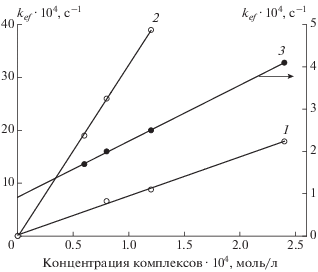
Рис. 5.
Кинетические кривые образования метгемоглобина под действием нитрозильного комплекса ПЕН в суспензиях эритроцитов различного гематокрита. Концентрация комплекса [ПЕН]0 = 0.2 ∙ 10–4 моль/л. Исходная концентрация гемоглобина в суспензиях [Hb]0 ∙ 104 = 1.0 (1), 2.0 (2), 3.0 моль/л (3). Температура – 37 °С. Точки – эксперимент, линии – расчет по схеме реакций (1)–(3) и найденным значениям кинетических параметров.
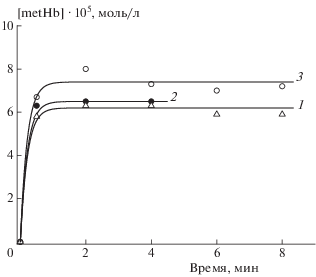
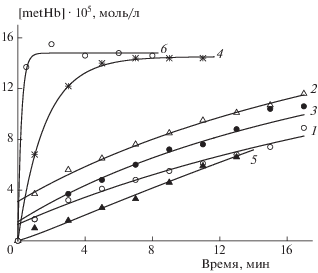
Рис. 6.
Кинетические кривые образования метгемоглобина в суспензиях эритроцитов под действием нитрозильных комплексов железа: БТЗ (1), МИМ (2), ПИМ (3), ТНК (4), ЦАК (5), ПЕН (6). Концентрация комплексов – 1.2 ∙ 10–4 (1–5) и 0.4 ∙ 10–4 моль/л (6). Концентрация гемоглобина – 2 ∙ 10–4 моль/л. Температура – 37 °С. Точки – эксперимент, линии – расчет по найденным значениям кинетических параметров.
Целью данной работы была разработка кинетической модели, количественно описывающей образование метгемоглобина в процессе взаимодействия СНКЖ с суспензией эритроцитов.
ПОСТАНОВКА ЗАДАЧИ
Образование метгемоглобина в системе “нитрозильный комплекс железа – суспензия эритроцитов” происходит в результате следующих последовательно протекающих процессов:
1. Распад комплекса с выделением NO. Распад нитрозильных комплексов железа в водной среде – сложный, многостадийный процесс, механизм которого зависит от химического строения комплекса. Поэтому в первом приближении для исследуемых комплексов мы рассмотрим в качестве общей модели следующую реакцию:
Здесь A – исследуемый комплекс, Product – продукт его превращения, β – стехиометрический коэффициент образования NO (значение β = 4 соответствует полному выходу в раствор всех NO-групп биядерного СНКЖ). Константа скорости реакции k1 и коэффициент β являются эффективными параметрами распада комплекса.2. Диффузия NO из раствора внутрь эритроцита. Эта стадия не является лимитирующей, поскольку малый размер молекулы оксида азота в сочетании с ее липофильностью определяет высокую диффузионную способность NO в биологических тканях [19]. По этой причине мембрана эритроцита не может рассматриваться в качестве серьезного барьера для диффузии NO внутрь клетки. Поэтому в данном случае мы рассматриваем суспензию эритроцитов как гомогенную среду, в которой средняя концентрация оксигемоглобина [(HbFe2+)O2] определяется процентным содержанием эритроцитов (гематокрит суспензии).
3. Взаимодействие NO с оксигемоглобином. Внутри клетки оксид азота вступает с оксигемоглобином в реакцию, продуктами которой являются метгемоглобин и нитрат-анион:
(2)
$\left( {{\text{HbF}}{{{\text{e}}}^{{{\text{2}} + }}}} \right){{{\text{O}}}_{{\text{2}}}} + {\text{NO}} \to {\text{HbF}}{{{\text{e}}}^{{{\text{3}} + }}} + {\text{NO}}_{{\text{3}}}^{--}.$В хорошо перемешиваемой аэробной суспензии эритроцитов, которая использовалась для проведения экспериментов [11, 12], практически весь внутриэритрицитарный гемоглобин присутствует в виде комплекса с кислородом, (HbFe2+)O2, – оксигемоглобина, содержание которого в рассматриваемых условиях составляет 97–98%. Константа скорости реакции (2) весьма высока и составляет по имеющимся данным (3÷5) ∙ 107 M–1 c–1 [20]. Если в растворе содержится не собственно оксигемоглобин, а суспензия эритроцитов, оксид азота поглощается с меньшей, но все же значительной константой скорости, составляющей 5.2 ∙ 104 M–1 c–1 [21].
Реакции (1), (2) являются основными в процессе образования метгемоглобина в системе “нитрозильный комплекс железа – суспензия эритроцитов”. Однако для количественного описания экспериментальных данных эти стадии необходимо дополнить другими реакциями. Поскольку эксперимент проводится в открытой системе на воздухе и в ней содержится определенное количество растворенного кислорода, необходимо учитывать процесс окисления NO. Содержание кислорода в системе в условиях эксперимента (37 °С, атмосферное давление) при непрерывном перемешивании составляет ~2 ∙ 10–4 моль/л [22]. Согласно [23], взаимодействие оксида азота с кислородом включает несколько стадий и расходование NO в этом процессе может быть описано суммарной реакцией:
с эффективной константой скорости 2k3 = 8.8 ∙ ∙ 106 М–2 ⋅ с–1.
Кроме того, для всех рассмотренных комплексов (кроме комплекса ПЕН) наблюдается характерная закономерность: в сериях опытов с разным гематокритом (рис. 2) с увеличением концентрации эритроцитов количество образовавшегося метгемоглобина уменьшается, что указывает на снижение NO-донирующей способности комплексов в присутствии эритроцитов. Было высказано предположение, что причиной указанного явления может быть адсорбция части комплексов на поверхности эритроцитов, в результате чего в системе образуется дополнительный равновесный пул мембраносвязанного комплекса, характеризующийся пониженной скоростью гидролитической диссоциации из-за ограничения контакта с водной средой [11]. Как показал анализ, поведение системы в этом случае качественно согласуется с представлениями теории мономолекулярной адсорбции Лэнгмюра [12]. В связи с этим схема превращений была дополнена следующей реакцией:
Здесь Er – центры адсорбции на поверхности эритроцитов, Er–A – нитрозильный комплекс, адсорбированный на мембране эритроцита. Количественно процесс характеризуется константой равновесия K4. В настоящей работе по результатам численных исследований с целью количественного описания экспериментальных данных были оценены значения константы равновесия K4 и концентрации центров связывания на поверхности эритроцитов [Er], выраженной через концентрацию оксигемоглобина в системе:
(5)
${{K}_{4}} = 5 \cdot {{10}^{3}}\,\,{{{\text{М}}}^{{--1}}},\,\,\,\,[{\text{Er]}} = 0.3[({\text{HbF}}{{{\text{e}}}^{{2 + }}}){{{\text{O}}}_{2}}].$Расчеты проводились в предположении, что в результате адсорбции на мембране эритроцита нитрозильные комплексы полностью теряют способность выделять NO.
Схему реакций (1)–(4) с соотношениями (5) следует рассматривать как начальное приближение для механизма превращения исследуемых нитрозильных комплексов в суспензии эритроцитов. В ходе исследований конкретных комплексов эта схема может претерпевать определенные изменения: она может дополняться новыми реакциями или, наоборот, некоторые реакции в ней могут оказаться несущественными в рассматриваемых условиях.
Система уравнений, соответствующая схеме реакций (1)–(4), с учетом детального равновесия в реакции (4) и уравнений материального баланса имеет вид
(6)
${{d[{\text{A}}]} \mathord{\left/ {\vphantom {{d[{\text{A}}]} {dt}}} \right. \kern-0em} {dt}} = {{--{{k}_{1}}[{\text{A}}]} \mathord{\left/ {\vphantom {{--{{k}_{1}}[{\text{A}}]} {(1 + f([{\text{A}}])}}} \right. \kern-0em} {(1 + f([{\text{A}}])}},$(7)
$\begin{gathered} {{d[{\text{NO}}]} \mathord{\left/ {\vphantom {{d[{\text{NO}}]} {dt}}} \right. \kern-0em} {dt}} = \beta {{k}_{1}}[{\text{A}}]-- \\ - \,\,{{k}_{2}}[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}][{\text{NO}}]--2{{k}_{3}}[{{{\text{O}}}_{2}}]{{[{\text{NO}}]}^{2}}, \\ \end{gathered} $(8)
${{d[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}]} \mathord{\left/ {\vphantom {{d[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}]} {dt}}} \right. \kern-0em} {dt}} = --{{k}_{2}}[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}][{\text{NO}}],$(9)
$[{\text{metHb}}](t) = {{[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}]}_{0}}--[{\text{Hb}}{{{\text{O}}}_{{\text{2}}}}](t),$(10)
$[{\text{Er}}](t) = {{{{{[{\text{Er}}]}}_{0}}} \mathord{\left/ {\vphantom {{{{{[{\text{Er}}]}}_{0}}} {(1{\text{ }} + {{K}_{4}}[{\text{A}}](t))}}} \right. \kern-0em} {(1{\text{ }} + {{K}_{4}}[{\text{A}}](t))}},$(11)
$[{\text{Er}}{\kern 1pt} --{\kern 1pt} {\text{A}}](t) = {{{{K}_{4}}[{\text{A}}](t){{{[{\text{Er}}]}}_{0}}} \mathord{\left/ {\vphantom {{{{K}_{4}}[{\text{A}}](t){{{[{\text{Er}}]}}_{0}}} {(1{\text{ }} + {{K}_{4}}[{\text{A}}](t))}}} \right. \kern-0em} {(1{\text{ }} + {{K}_{4}}[{\text{A}}](t))}}.$Здесь введены следующие обозначения:
f([A]) = K4[Er]0/(1 + K4[A])2, [HbO2] – концентрация оксигемоглобина (HbFe2+)O2, [metHb] – концентрация метгемоглобина HbFe3+.
Концентрации конечных продуктов, [P], $\left[ {{\text{NO}}_{{\text{3}}}^{--}} \right],$ [NO2], могут быть также выражены из соответствующих уравнений материального баланса через основные переменные: [A], [NO], [HbO2]. Уравнение для кислорода не рассматривается, поскольку по условиям эксперимента его концентрация в системе постоянна: [O2] = const.
Начальные условия с учетом равновесности реакции (4) имеют вид
Здесь [A]0, [HbO2]0, [Er]0 = 0.3[HbO2]0 – концентрации исходных веществ.
Как было сказано выше, значения констант скорости реакций k2, k3 и константы равновесия K4 считаются известными. Ставится задача определить по экспериментальным данным параметры донирования NO – константу скорости k1 и стехиометрический коэффициент β – для каждого из рассматриваемых комплексов.
ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Нитрозильный комплекс БТЗ
Кинетические кривые образования метгемоглобина в суспензии эритроцитов под действием комплекса БТЗ приведены на рис. 2, 3. Исследование серии опытов с разными концентрациями комплекса (рис. 3) показало, что схема реакций (1)–(4) и соответствующая ей система уравнений (6)–(11) позволяют количественно описать каждую экспериментальную кривую этой серии. При этом в опытах с разными начальными концентрациями [БТЗ] = (0.8, 1.2, 2.4) ∙ 10–4 моль/л были получены соответствующие значения константы скорости k1 = (6.6, 8.0, 17.9) ∙ 10–4 с–1 (при значении стехиометрического коэффициента β = 1 для всех опытов серии). Полученная зависимость k1 от [БТЗ] является прямо пропорциональной (рис. 4, кривая 1). Это означает, что скорость выделения NO при разложении комплекса БТЗ зависит от концентрации комплекса квадратично, и этот процесс следует моделировать реакцией второго порядка:
с константой скорости $k_{1}^{'}.$
Обе серии опытов с комплексом БТЗ были обработаны, исходя из схемы реакций (1'), (2)–(4). Методом наименьших квадратов определены значения кинетических параметров $k_{1}^{'}$ и β. При проведении расчетов учитывалось, что к моменту начала регистрации экспериментальных данных в системе уже образовалось некоторое количество метгемоглобина, поэтому в качестве дополнительного параметра оценивали также значение [metHb](0). Результаты расчетов приведены в табл. 1, 2. Из этих таблиц видно, что для всех опытов удалось получить одинаковое значение стехиометрического коэффициента: β ≈ 2. Наблюдается некоторый разброс значений константы $k_{1}^{'},$ но явная зависимость $k_{1}^{'}$ от концентрации исходных веществ отсутствует. Найденные значения параметров удовлетворительно описывают экспериментальные данные (рис. 2, 3).
Таблица 1.
Кинетические параметры разложения нитрозильного комплекса железа БТЗ в суспензии эритроцитов. Серия опытов при разных концентрациях комплекса. Концентрация оксигемоглобина [HbO2] = 2 ∙ 10–4 М
| [БТЗ] ∙ 104 М | [metHb](0) ∙ 105 М | $k_{1}^{'}$ М–1 ⋅ с–1 | β |
|---|---|---|---|
| 0.8 | 1.6 | 4.5 | 1.9 |
| 1.2 | 1.7 | 4.5 | 1.9 |
| 2.4 | 5.9 | 4.5 | 1.9 |
Таблица 2.
Кинетические параметры разложения нитрозильного комплекса железа БТЗ в суспензии эритроцитов. Серия опытов при разных концентрациях эритроцитов. Концентрация комплекса [БТЗ] = 1.2 ∙ 10–4 М
| [HbO2] ∙ 104 М | [metHb](0) ∙ 105 М | $k_{1}^{'}$ М–1 ⋅ с–1 | β |
|---|---|---|---|
| 1.5 | 1.7 | 4.9 | 2.0 |
| 2.0 | 1.3 | 4.9 | 2.0 |
| 3.0 | 1.2 | 5.4 | 2.0 |
| 5.0 | 0.35 | 4.5 | 2.0 |
Нитрозильный комплекс МИМ
Результат обработки экспериментальных данных для комплекса МИМ в основном аналогичен результату для БТЗ. Комплексы принадлежат к структурному типу µ-N–C–S (расстояние между атомами железа в структуре составляет ∼4 Å). При попытке описать исходной схемой реакций (1)–(4) серию опытов с разными начальными концентрациями комплекса [МИМ]0 была тоже получена прямо пропорциональная зависимость константы скорости k1 от [МИМ]0 (рис. 4, кривая 2). Поэтому вместо реакции (1) в схему была включена реакция второго порядка (1'). Значения кинетических параметров $k_{1}^{'}$ и β, полученные в результате обработки экспериментальных данных для комплекса МИМ в соответствии со схемой реакций (1'), (2)–(4), представлены в табл. 3.
Таблица 3.
Кинетические параметры разложения нитроксильных комплексов железа в суспензии эритроцитов
| Комплекс | k1 ∙ 104, с–1 | $k_{1}^{'},$ М–1 ⋅ с–1 | β |
|---|---|---|---|
| БТЗ | – | 4.7 ± 0.4 | 2.0 ± 0.1 |
| МИМ | – | 7.0 ± 0.5 | 2.0 ± 0.1 |
| ПИМ | 0.92 ± 0.02 | 1.8 ± 0.2 | 3.0 ± 0.2 |
| ТНК | 69 ± 1 | – | 0.48 ± 0.05 |
| ЦАК | 4.7 ± 0.3 | – | 3 ± 1 |
| ПЕН | ≈800 | – | 3.4 ± 0.3 |
Нитрозильный комплекс ПИМ
Обработка отдельных опытов серии с разными начальными концентрациями комплекса [ПИМ]0 (структурный тип µ-S, расстояние между атомами железа в структуре составляет ∼2.7 Å) в рамках исходной схемы реакций (1)–(4) также дает зависимость константы скорости k1 от начальной концентрации комплекса [ПИМ]0. Однако в отличие от предыдущих двух комплексов эта зависимость не прямо пропорциональная, а линейная (рис. 4, кривая 3): ее можно представить в виде kef = = k1 + $k_{1}^{'}$[ПИМ]0. Следовательно, в механизме распада комплекса ПИМ следует учитывать обе реакции: (1) и (1'). Поэтому экспериментальные данные, полученные для комплекса ПИМ, были обработаны в соответствии со схемой реакций (1), (1'), (2)–(4). Расчеты проводили при разных значениях β. Для заданного β использовали соответствующее значение k1 – отсечение на оси ординат (рис. 4, кривая 3) и в каждом опыте определяли значение $k_{1}^{'}.$ В результате находили оптимальное для обеих серий опытов значение β и соответствующие величины k1 и $k_{1}^{'}.$ Результат расчета параметров представлен в табл. 3.
Нитрозильный комплекс ТНК
В отличие от трех предыдущих комплексов, обработка экспериментальных данных для комплекса ТНК в рамках схемы реакций (1)–(4) не дает зависимости константы скорости k1 от начальной концентрации комплекса [ТНК]0. В результате обработки экспериментальных данных в соответствии со схемой реакций (1), (2)–(4) были получены следующие значения параметров: k1 = 7.0 ∙ 10–3 с–1, β = = 0.48 (табл. 3).
Из табл. 3 видно, что значение β у ТНК намного меньше, чем у БТЗ, МИМ и ПИМ. Это существенно меняет характер выделения NO. Оценим начальную скорость расходования комплексов. Для БТЗ и МИМ эта скорость равна $k_{1}^{'}$[X]2, для ПИМ – (k1[X] + $k_{1}^{'}$[X]2), а для ТНК – k1[X], где [X] – концентрация комплексов. При [X] ~ 10–4 М скорость расходования комплексов V1 ∙ 107 (М ∙ с–1) равна: ≈0.4 для БТЗ, 0.7 для МИМ, 0.3 для ПИМ и 7.0 для ТНК. Таким образом, начальная скорость расходования ТНК на порядок больше, чем у остальных комплексов. Скорость выделения оксида азота V2 = βV1 отличается хотя и не так сильно, но тоже значительно: V2 ∙ 107 равно ∼0.8 для БТЗ, 1.4 для МИМ, 0.9 для ПИМ и 3.5 М ⋅ с–1 для ТНК. Это приводит к тому, что процесс выделения NO из ТНК, который начинается с большой скоростью, в результате быстрого расходования комплекса вскоре затухает (рис. 6, кривая 4).
Нитрозильный комплекс ЦАК
Обработка экспериментальных данных для комплекса ЦАК в соответствии со схемой реакций (1)–(4), так же как и у ТНК, не выявила роста константы скорости k1 с увеличением концентрации комплекса. Поэтому обе серии опытов были обработаны в предположении, что распад комплекса и образование NO происходят по реакции (1). Результаты расчета приведены в табл. 3.
Кинетические кривые образования метгемоглобина под действием нитрозильного комплекса железа ЦАК имеют особенность: они представляют собой практически прямые линии (рис. 6, кривая 5). Это возможно только при достаточно большом значении стехиометрического коэффициента β и сравнительно небольшой величины константы скорости распада комплекса k1 (ситуация противоположная той, что была при рассмотрении комплекса ТНК). Численные исследования показали, что удовлетворительное описание эксперимента можно получить при 2 ≤ β ≤ 4. То есть определить точное значение коэффициента β из имеющихся экспериментальных данных нельзя, приближенная оценка: β = 3 ± 1. В табл. 3 приведено значение константы скорости k1, найденное при заданном значении β = 3.
Нитрозильный комплекс ПЕН
Комплекс ПЕН качественно отличается от всех рассмотренных выше нитрозильных комплексов: в серии опытов с разным гематокритом с увеличением концентрации эритроцитов количество образовавшегося метгемоглобина не уменьшается, а увеличивается (рис. 5). Этот экспериментальный факт говорит о том, что адсорбция комплекса ПЕН на мембране эритроцитов не происходит. Причиной этого является, по-видимому, большая гидрофильность пеницилламиновых лигандов [11]. Таким образом, реакцию (4) из механизма образования метгемоглобина в системе “ПЕН – суспензия эритроцитов” следует исключить. Поэтому экспериментальные данные для ПЕН были обработаны в соответствии с реакциями (1)–(3). Результаты расчета представлены в табл. 3.
Как видно из табл. 3, значение константы скорости k1 у ПЕН на 1–2 порядка больше, чем у рассмотренных ранее комплексов. Это значительно осложняет ее точное экспериментальное определение. Хотя в эксперименте были существенно уменьшены начальные концентрации [ПЕН]0, провести надежные измерения на начальном участке из-за большой скорости процесса не удалось (рис. 5). В результате была получена лишь приблизительная оценка: k1 ≈ 8 ∙ 10–2 с–1.
Значение стехиометрического коэффициента β определяется гораздо точнее. В результате быстрого расходования комплекса кинетическая кривая накопления метгемоглобина выходит на стационарное значение, которое полностью определяется значением коэффициента β.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что основным путем химической трансформации оксида азота в кровяном русле является его окисление в бимолекулярной реакции с оксигемоглобином с образованием нитрата и метгемоглобина [24, 25]. Результаты проведенного исследования показывают, что образование метгемоглобина в системе “донор NO – эритроциты” может информативно характеризовать кинетические особенности процесса донирования оксида азота.
В табл. 3 приведены средние значения кинетических параметров, полученные по двум сериям опытов для каждого из исследованных комплексов. По результатам исследования все рассмотренные комплексы можно разбить на две группы. К первой группе следует отнести комплексы БТЗ, МИМ и ПИМ, в механизме разложения которых присутствует реакция второго порядка (1'). Найденные значения параметров $k_{1}^{'}$ и β позволяют расположить эти комплексы по скорости разложения и образования NO в следующий ряд: БТЗ < < ПИМ < МИМ (рис. 6, кривые 1–3). Из рис. 6 видно, что эти скорости сравнительно малы и не сильно отличаются друг от друга. Следует отметить, что вследствие малости скоростей разложения комплексов в эксперименте измерена концентрация метгемоглобина лишь на небольших начальных участках процесса.
Разложение трех других комплексов – ТНК, ЦАК и ПЕН происходит по реакции первого порядка (1). Из табл. 3 видно, что имеет место большое различие в значениях константы скорости k1 у этих комплексов: значение этой константы у ПЕН на порядок больше, чем у ТНК, и на два порядка больше, чем у ЦАК. В результате у этих комплексов наблюдается различный характер выделения NO – от медленного и плавного у ЦАК до почти мгновенного у ПЕН (рис. 6, кривые 4–6).
Следует подчеркнуть, что реакции (1) и (1') представляют собой брутто-стадии, моделирующие процесс генерации NO исследованными комплексами. Тот факт, что у комплексов БТЗ, МИМ, ПИМ этот процесс описывается реакцией второго порядка (1') относительно их концентраций, а у ТНК, ЦАК, ПЕН – реакцией первого порядка (1), связан, по-видимому, с природой комплексов. Анионный комплекс ТНК и катионные комплексы ЦАК и ПЕН присутствуют в растворе в виде отдельных заряженных частиц, гидролитическое разложение которых представляет собой процесс постепенного замещения лигандов молекулами воды [26]. В отличие от этого, БТЗ, МИМ, ПИМ – нейтральные комплексы, способные к агрегации, что и приводит к более сложному механизму их распада.
Как следует из постановки задачи, значения искомых параметров получены для всех рассмотренных комплексов (кроме комплекса ПЕН) при одном и том же значении константы равновесия K4 = 5 ∙ 103 М–1. Это связано с тем, что из экспериментальных данных для отдельно взятого комплекса (две серии опытов по накоплению метгемоглобина) нельзя однозначно определить и константу равновесия K4, и искомые параметры донирования NO – k1, $k_{1}^{'}$ и β.
С другой стороны, способность адсорбироваться на поверхности эритроцитов у исследованных комплексов может быть разной, а значит, и значения K4 могут различаться. При изменении величины K4 изменятся и значения параметров донирования NO, которые были определены по экспериментальным данным. Чтобы оценить масштаб этих изменений, была проделана следующая работа:
1. Считая липофильность лигандов одним из основных факторов, определяющих способность комплексов адсорбироваться на поверхности эритроцитов, мы теоретически рассчитали для них коэффициенты распределения в системе октанол–вода, используя программу ALOGPS 2.1 [27, 28]. Соотношение этих коэффициентов, например для лигандов ЦАК, ПИМ и МИМ, равно 1 : 2.8 : 3.2. Приняв для ЦАК исходное значение K4 = 5 ∙ 103 М–1, получим для комплексов ПИМ и МИМ значения этой константы, равные 14 ∙ 103 и 16 ∙ 103 соответственно.
2. С вновь полученными значениями K4 для комплексов ПИМ и МИМ по экспериментальным данным рассчитали параметры донирования NO. Получили k1 = (1.44 ± 0.01) ∙ 10–4 с–1, $k_{1}^{'}$ = 1.9 ± ± 0.3 М–1 ⋅ с–1 для ПИМ и $k_{1}^{'}$ = 10.4 ± 1.5 М–1 ⋅ с–1 для МИМ. Сравнение с данными табл. 2 показывает, что увеличение константы равновесия K4 в три раза привело к увеличению констант скорости k1 и $k_{1}^{'}$ менее чем в полтора раза. При этом значения стехиометрического коэффициента β не изменились.
Для более точного определения параметров донирования NO нитрозильными комплексами железа по кинетическим кривым накопления метгемоглобина необходимо предварительно определить значение константы равновесия K из независимого эксперимента.
ЗАКЛЮЧЕНИЕ
Разработанная в результате проведенного исследования кинетическая модель характеризует особенности распада сера-нитрозильных комплексов железа и их взаимодействия с эритроцитами. Она количественно описывает экспериментальные данные по накоплению метгемоглобина в системе и позволяет сопоставить NO-донорную активность комплексов в рассматриваемых условиях.
Работа выполнена по теме государственного задания (№ государственной регистрации 01201361859).
Список литературы
Граник В.Г., Григорьев Н.Б. Оксид азота (NO). Новый путь к поиску лекарств. М.: Вузовская книга, 2004.
Nitric Oxide Donors for Pharmaceutical and Biological Applications / Eds. Wang P.G., Cai T.B., Taniguchi N. Weinheim, Germany: Wiley-VCH Verlag, 2005.
Nitric oxide donors: Novel Biomedical Applications and Perspectives / Ed. Amedea Barozzi Seabra. London: Acad. press, 2017.
Алдошин С.М., Санина Н.А. // Фундаментальные науки – медицине: Биофизические и медицинские технологии / Под ред. Григорьева А.И., Владимирова Ю.В. Т. 1. M.: МАКС Пресс, 2015. С. 72.
Ванин А.Ф. Динитрозильные комплексы железа с тиолсодержащими лигандами: физико-химия, биология, медицина. М.–Ижевск: Институт компьютерных исследований, 2015.
Алдошин С.М., Санина Н.А., Давыдов М.И., Чазов Е.И. // Вестник РАН. 2016. Т. 86. С. 495.
Санина Н.А., Алдошин С.М. // Изв. АН. Сер. хим. 2004. №11. С. 2326.
Санина Н.А., Алдошин С.М. // Изв. АН. Сер. хим. 2011. № 7. С. 1199.
Нешев Н.И., Психа Б.Л., Соколова Е.М. и др. // Изв. АН. Сер. хим. 2010. № 12. С. 2160.
Соколова Е.М. Дис. … канд. биол. наук. Черноголовка: ИПХФ РАН, 2016.
Нешев Н.И., Психа Б.Л., Соколова Е.М. Санина Н.А., Руднева Т.Н. // Изв. АН. Сер. хим. 2014. № 9. С. 2020.
Нешев Н.И., Психа Б.Л., Соколова Е.М., Санина Н.А., Руднева Т.Н. // Изв. АН. Сер. хим. 2016. № 3. С. 779.
Санина Н.А., Шилов Г.В., Алдошин С.М. и др. // Изв. АН. Сер. хим. 2009. № 3. С. 560.
Sanina N.A., Rudneva T.N., Aldoshin S.M. и дp. // Inorg. Chim. Acta. 2006. V. 359. P. 570.
Санина Н.А., Жукова О.С., Смирнова З.С. и др. Биядерные нитрозильные комплексы железа с бензазагетероциклическими производными, способ их получения. Патент РФ № 2441872 // Б.И. 2012. № 4.
Санина Н.А., Ракова О.А., Алдошин С.М. и др. // Координац. химия. 2001. Т. 27. № 3. С. 198.
Rudneva T.N., Sanina N.A., Lysenko K.A. и дp. // Mend. Comm. 2009. V. 19. P. 253.
Санина Н.А., Серебрякова Л.И., Шульженко В.С. и др. Применение биядерного сера-нитрозильного комплекса железа катионного типа в качестве вазодилататорного лекарственного средства. Патент РФ № 2460531 // Б.И. 2012. № 25.
Shaw A.W., Vosper A.J. // J. Chem. Soc. Faraday Trans. 1977. V. 8. P. 1239.
Eich R.F., Li T., Lemon D.D. et al. // Biochemistry. 1996. V. 35. P. 6976.
Liu X., Miller M.J.S., Joshi M.S. et al. // J. Biol. Chem. 1998. V. 273. P. 18709.
Weiss R.F. // Deep-Sea Res. Oceanogr. Abstr. 1970. V.17. P.721.
Погребная В.Л., Усов А.П., Баранов А.В., Нестеренко А.И., Безъязычный А.П. // ЖПХ. 1975. Т. 48. С. 954.
Butler A.R., Megson I.L., Wright P.G. // Biochim. Biophys. Acta. 1998. V. 1425. P. 168.
Joshi M.S., Ferguson T.B.J., Han T.H. et al. // PNAS. 2002. V. 99. P. 10341.
Sanina N.A., Syrtsova L.A., Shkondina N.I. et al. // Nitric oxide: biology & chemistry. 2007. V. 16. P. 181.
Tetko I.V., Gasteiger J., Todeschini R. et al. // J. Comput. Aid. Mol. Des. 2005. V. 19. P. 453.
VCCLAB, Virtual Computational Chemistry Laboratory: электронный ресурс. 2005; http://www.vcclab.org
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


