Химическая физика, 2020, T. 39, № 9, стр. 31-38
Распад пероксида водорода, катализированный нанесенным на целлюлозу гидроксидом железа
Л. М. Писаренко 1, О. Т. Касаикина 1, В. Б. Иванов 1, *
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: ivb@chph.ras.ru
Поступила в редакцию 09.10.2019
После доработки 09.01.2020
Принята к публикации 20.01.2020
Аннотация
Коллоидные частицы гидроксида железа, полученные путем гидролиза раствора хлорида железа(III) в горячей воде, резко ускоряют расходование пероксида водорода и инициируют окислительное разложение примесей, присутствующих в технической целлюлозе. Это приводит к отбеливанию целлюлозы, степень которого зависит от концентраций реагентов и условий проведения процесса. Основными продуктами протекающей параллельно окислительной деструкции самой целлюлозы является муравьиная кислота и другие карбоновые кислоты. Проанализированы закономерности и особенности процессов, определены кинетические параметры распада пероксида и образования кислот.
ВВЕДЕНИЕ
Микро- и наноразмерные катализаторы, обеспечивающие высокую скорость и селективность процессов, активно разрабатываются и исследуются в последние десятилетия во многих лабораториях [1, 2]. При этом особое внимание уделяется анализу закономерностей процессов окисления в газовой и жидкой фазе [3–6], что в значительной мере связано с их потенциальной значимостью для решения экологических проблем.
Коллоидные катализаторы на основе золя Fe(OH)3, благодаря низкой токсичности и невысокой стоимости, находят широкое применение во многих химических процессах в водных системах, особенно в процессах очистки воды с использованием экологически безопасного окислителя – пероксида водорода [7–9]. Ранее был выполнен цикл работ по окислительной переработке большого числа биоматериалов (соломы, торфа, листьев, отходов производства пиломатериалов и льняного волокна и др.) путем активации H2O2 под действием золя Fe(OH)3, в которых установлена возможность получения таким образом, наряду с чистой целлюлозой, ряда полезных веществ, в том числе биологически активных продуктов сельскохозяйственного назначения [10–17]. В этих работах, направленных на достижение практических результатов, недостаточно освещена проблема влияния дополнительных компонентов на ключевой процесс каталитического превращения H2O2. Мало данных и по воспроизводимости выявленных закономерностей из-за потенциальной неоднозначности источников материалов, используемых для переработки. Также необходима и разработка методов получения катализатора с точно заданными, воспроизводимыми характеристиками.
Детальные исследования свидетельствуют о том, что состав золя Fe(OH)3 и его активность зависят от способа получения. При добавлении небольшого количества соли FeCl3 ⋅ 6H2O в горячую воду, в результате гидролиза образуется однородный золь красного цвета, являющийся высокодисперсной коллоидной системой с жидкой дисперсной средой [18]. При полном гидролизе частицы золя Fe(OH)3 стабилизированы FeCl3, а при неполном – FeOCl [18]. Процесс гидролиза и состав золя зависят от качества воды. Водопроводная вода из-за непостоянного состава содержащихся в ней солей и других примесей в большинстве случаев мало пригодна для получения наиболее активных частиц золя, образующихся при полном гидролизе. Еще один нежелательный эффект снижения активности может быть связан с наличием в составе частиц катализатора посторонних элементов (серы, натрия, калия, кальция, магния и др.), в концентрациях порядка 0.01–3% [12].
Поэтому одной из важных целей работы было получение частиц катализатора в воспроизводимых условиях, что предполагало использование дистиллированной воды и дополнительных реагентов, обеспечивающих полный гидролиз FeCl3 ⋅ 6H2O. Решение этой задачи необходимо для выполнения основной цели данного исследования – выявления кинетических закономерностей каталитического разложения H2O2 и окислительных процессов с участием полимерного компонента с точно определенными и воспроизводимыми характеристиками. Прикладная цель исследования – оценка влияния условий процесса на отбеливание технической целлюлозы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения коллоидного катализатора использовали соль FeCl3 ⋅ 6H2O марки “ч. д. а” (Merck KGaA, Германия). Образующуюся в результате гидролиза соляную кислоту нейтрализовали путем добавления карбоната натрия марки “х. ч”; необходимое количество этого реагента контролировали по значению рН раствора, оцениваемого индикаторным методом. В качестве основного окислителя применяли 30%-ный раствор H2O2 марки “ч. д. а”, содержащий стабилизатор дигидропирофосфат натрия в концентрации 0.5 г/л (ООО “АО Реахим”).
Промышленную сульфитную целлюлозу (ТУ 5411-021-43508418-2007) предварительно выдерживали в дистиллированной воде (однократная перегонка) при непрерывном или периодическом перемешивании в течение времени, достаточного для набухания и равномерного диспергирования, (контроль – по отсутствию непрозрачных комков) и отфильтровывали на воронке Бюхнера. При такой обработке цвет целлюлозы, а также рН воды не меняется и вода остается бесцветной. Процесс окисления целлюлозы проводили при постоянном перемешивании в стеклянном реакторе с водяной рубашкой, позволяющей поддерживать температуру с точностью до 0.1 °С.
Изменение концентрации H2O2 определяли иодометрическим методом, а количественное определение образующихся кислот проводили титрованием стандартным раствором щелочи KOH. Количество муравьиной кислоты определяли отдельно – титрованием отгона, полученного после отделения ее смеси с водой с помощью роторного испарителя при пониженном давлении и температуре ∼40–47 °С. Идентификацию муравьиной кислоты проводили методом ЯМР по характерным резонансным линиям протонов и 13C.
Количество ионов железа в водной фазе определяли спектрофотометрическим методом после обработки пробы избытком роданида калия в 0.2 н соляной кислоте по величине оптической плотности при λ = 480 нм, значение коэффициент экстинкции – 5.5 ⋅ 104 л/моль ⋅ см. Для оценки содержания соединений железа, адсорбированных целлюлозой, их экстрагировали после завершения процесса 0.1 н раствором HCl.
Содержание функциональных групп в целлюлозе до и после обработки качественно контролировали по ИК-спектрам НПВО. Спектры поглощения растворов в УФ- и видимой областях регистрировали с использованием спектрофотометров Shimadzu mini-1240 и MultiSpec-1501 (Япония).
ИК-спектры регистрировали с использованием фурье-спектрометра Nicolet 6700 (США) с приставкой НПВО iTR (Thermo Nicolet, США): диапазон – 400–4000 см–1, разрешение – 2 см–1, режим накопления сигнала – 32 скана. Анализ и обработка данных выполнены с использованием программного обеспечения OMNIC (США).
Определение цветовых характеристик и белизны проводили с помощью спектрофотометра ColorFlex (США) по стандартной процедуре обработки спектров отражения с помощью программного обеспечения прибора ColorFlex. Спектры ПМР и ЯМР регистрировали с использованием ЯМР-спектрометра Bruker AM 300 (Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
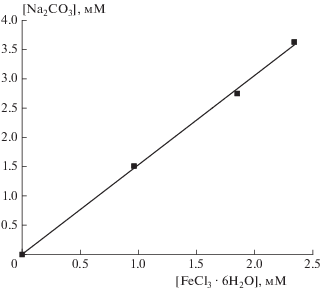
Коллоидный катализатор получали путем введения необходимого количества соли FeCl3 ⋅ 6H2O в дистиллированную воду, нагретую до температуры 70 °С. После охлаждения и выдерживания прозрачного коллоидного раствора красного цвета в течение 18 ч при 19 °С в него добавляли Na2CO3 для нейтрализации выделяющегося при гидролизе хлористого водорода HCl. В серии экспериментов при одинаковых или варьируемых концентрациях хлорида железа установлено, что образование красно-бурого осадка золя происходит строго при значениях рН ≥ 6.2. Это правило выполняется в широком интервале концентраций хлорида железа, и количество Na2CO3, используемого для нейтрализации HCl, прямо пропорционально количеству введенной соли FeCl3 ⋅ 6H2O (рис. 1).
Рис. 1.
Соотношение концентраций хлорида железа, используемого для получения катализатора, и карбоната натрия, добавляемого для нейтрализации выделяющегося хлористого водорода. Точки для концентрации хлорида железа 1.85 мМ соответствуют серии из шести независимых экспериментов.
В соответствии с брутто-схемой реакции
наклон кривой зависимости концентрации Na2CO3 от концентрации FeCl3 ⋅ 6H2O должен составлять 1.50, а определяемое по рис. 1 значение составляет 1.53 (R2 = 0.998), что свидетельствует о количественном превращении хлорида железа в гидроксид. Дополнительным доказательством является отсутствие солей железа в растворе после образования красно-бурого осадка золя Fe(OH)3. В соответствии с существующими представлениями двойной электрический слой частиц катализатора при полном гидролизе состоит из ионов Fe(III) и Cl– [18], а их диаметр составляет ≈20 нм [12].
Отметим, что в водопроводной воде, по данным работы [19], образование красно-бурого осадка происходит уже при значении pH ≥ 4, и количество добавляемого Na2CO3, необходимое для завершения этого процесса, существенно снижается. В этих условиях соотношение концентраций Na2CO3 и FeCl3 ⋅ 6H2O составляет лишь 0.97 и оценка степени превращения хлорида железа в гидроксид в данном случае нуждается в дополнительном анализе. Как отмечено выше, это связано с наличием в водопроводной воде значительного количества солей и других веществ, влияющих на гидролиз FeCl3 ⋅ 6H2O и коагуляцию золя Fe(OH)3.
Полученный катализатор и техническую целлюлозу диспергировали при перемешивании в заданном объеме дистиллированной воды. Так как коллоидные частицы катализатора имеют положительный заряд, а макромолекулы целлюлозы из-за наличия карбоксильных групп заряжены отрицательно, катализатор располагается на поверхности частиц целлюлозы. После перемешивания к содержимому реактора добавляли расчетное количество 30%-ного пероксида водорода и сразу после этого быстро поднимали температуру до 70 °С. Периодически с интервалом 1 ч, из реакционной смеси отбирали пробы объемом 1 мл, в которых определяли концентрации H2O2 (иодометрическим методом) или содержание кислот (титрованием с помощью раствора KOH).
Как видно из рис. 2–4, кинетические закономерности расходования H2O2 существенно, а часто и критически, зависят от его концентрации, а также от соотношения пероксид/катализатор. При большой концентрации H2O2 его расходование соответствует зависимости, описываемой кинетическим уравнением нулевого порядка (рис. 2, кривая 1), или с небольшими отклонениями от этой простой зависимости в тех случаях, когда предварительное перемешивание целлюлозы в воде было недостаточно длительным (рис. 2, кривые 2 и 3). Скорость процесса может снижаться лишь при больших глубинах превращения (≥85%). Нулевой (или близкий к нулевому) порядок реакции по концентрации H2O2 представляется естественным, так как скорость каталитической реакции определяется числом активных центров на поверхности катализатора (при гетерогенном катализе) или концентрацией комплексов катализатор–субстрат (при гомогенном катализе).
Рис. 2.
Кинетические кривые расходования H2O2 (1–3) и накопления кислот (1'–3 ') при высоких (0.23–0.25 М) концентрациях H2O2; содержание катализатора – 1.85 мМ, содержание целлюлозы – 16.3 г/л (кривые 2, 3 и 2', 3') или 23.0 г/л (кривые 1 и 1'). Номера кривых соответствуют номерам экспериментов в табл. 1 и 2.
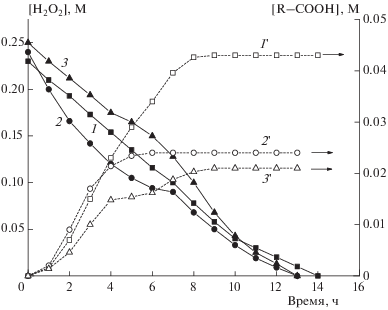
Рис. 3.
Кинетические кривые расходования H2O2 (кривые 4–5) и накопления кислот (4 '–5') при средних (0.14–0.19 М) концентрациях H2O2; содержание катализатора – 1.85 мМ, содержание целлюлозы – 16.3 г/л (кривые 4, 5 и 4', 5'). Для сравнения на этом же рисунке приведены кинетические кривые расходования H2O2 и накопления кислот при высокой (0.25 М) концентрации пероксида (кривые 3 и 3 ').
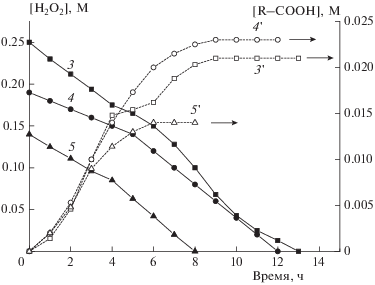
Рис. 4.
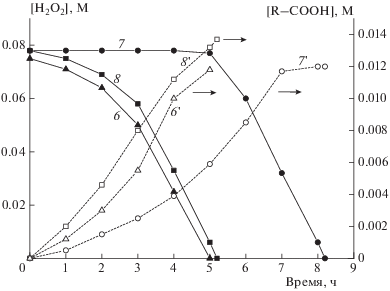
Кинетические кривые расходования H2O2 (кривые 6–8) и накопления кислот (кривые 6'–8 ') при низкой (0.075–0.078 М) концентрации H2O2; содержание катализатора: 2.34 мМ (кривые 8, 8 '), 1.85 мМ (кривые 6, 6') или 0.96 мМ (кривые 7, 7 '); содержание целлюлозы – 16.3 г/л.
Однако выявленные в данной работе кинетические закономерности расходования H2O2 принципиально отличаются от результатов работы [19], в которой установлено, что в спиртовом растворе в присутствии катализатора процесс описывается кинетическим уравнением первого порядка. Можно полагать, что в последнем случае химические и физические характеристики катализатора практически не изменяются и первый порядок реакции обусловлен последовательным уменьшением концентрации H2O2. Таким образом, нулевой порядок по концентрации пероксида водорода, обнаруженный в нашей работе, нуждается в дополнительном объяснении. Вероятный механизм этого явления рассмотрен ниже.
Накопление кислот в исследованной нами системе описывается существенно более сложной, S-образной зависимостью (рис. 2, кривые 1'–3'). Видно, что при не слишком больших степенях конверсии H2O2 (~60%) концентрации кислот достигают предельных значений. Значение предельной концентрации кислот тем больше, чем выше содержание целлюлозы, а величины индукционных периодов и максимальные скорости накопления кислот почти не зависят от этого параметра (рис. 2, табл. 1).
Таблица 1.
Скорости (V(H2O2)), индукционные периоды (τ) распада пероксида водорода и максимальные скорости накопления кислот (Vmax) в каталитическом процессе в присутствии золя Fe(OH)3, нанесенного на целлюлозу
| Номер эксперимента | [H2O2], М | Fe(OH)3, мМ | V(H2O2), 10–6 М ⋅ с–1 | τ, ч | Vmax, 10–6 М ⋅ с–1 |
|---|---|---|---|---|---|
| 1 | 0.23 | 1.85 | 5.3 | – | 2.28 |
| 2 | 0.24 | 1.85 | 5.1* | – | 2.40 |
| 3 | 0.25 | 1.85 | 5.2* | – | 1.67 |
| 4 | 0.19 | 1.85 | 5.5** | – | 1.18 |
| 5 | 0.14 | 1.85 | 5.8** | – | 1.10 |
| 6 | 0.075 | 1.85 | 7.1** | 2.5 | 1.66 |
| 7 | 0.078 | 0.96 | 7.2** | 5.3 | 0.98 |
| 8 | 0.078 | 2.34 | 6.8** | 2.5 | 1.11 |
Анализ состава продуктов после завершения процесса позволил выделить три главных компонента. Основным компонентом является переработанная целлюлоза, количество которой составляет 75–94% от первоначальной навески (значительные потери связаны со стадией выделения, условия которой не позволяли в нашем случае уловить мелкие (≤1 мм) частицы). Вторым компонентом является зеленая вязкая масса, остающаяся после отгона жидкости с помощью роторного испарителя (6.0–7.5%). Ее основными составными частями являются: водорастворимые соли двух- и трехвалентного железа, которые остаются на старте хроматографической пластинки (элюент – метанол/вода в соотношении 1 : 6) и два продукта с Rf = 0.61 и 0.79 (Rf – фактор удерживания), являющиеся смесью карбоновых кислот и других веществ сложного строения. Третий компонент – муравьиная кислота, идентифицированная в отогнанном растворе методом ЯМР (резонансная частота – 75.47 МГц для 13С карбонильной группы и 300.13 МГц – для протонов карбоксильной группы). Доля муравьиной кислоты в общем количестве кислот, образовавшихся после завершения процесса, существенно больше при более высоком содержании целлюлозы в реакционной системе (табл. 2) и достигает 40%.
Таблица 2.
Влияние условий обработки на отбеливание целлюлозы, предельные концентрации кислот и выходы водорастворимых продуктов (ВРП) окислительной деструкции целлюлозы
| Номер эксперимента | [H2O2], М | Fe(OH)3, мМ | Выделено целлюлозы, % | ВРП, % | Предельные концентрации кислот, мМ | HCOOH, мМ | Белизна, % |
|---|---|---|---|---|---|---|---|
| 1 | 0.23 | 1.85 | 87 | 6.2 | 43 | 17 | 82 |
| 2 | 0.24 | 1.85 | 80 | 6.3 | 24 | 5.0 | 75 |
| 3 | 0.25 | 1.85 | 81 | 7.0 | 21 | 5.0 | 70 |
| 4 | 0.19 | 1.85 | 75 | 7.5 | 23 | – | 58 |
| 5 | 0.14 | 1.85 | 84 | 7.2 | 14 | – | 40 |
| 6 | 0.075 | 1.85 | 89 | 7.0 | 12 | – | – |
| 7 | 0.078 | 0.96 | 89 | 7.3 | 12 | – | – |
| 8 | 0.078 | 2.34 | 94 | 6.0 | 14 | – | 10.4 |
Количественный анализ жидкой фазы после отделения целлюлозы и мелких твердых частиц свидетельствует о том, что основная часть атомов железа катализатора после завершения процесса находится в растворе в виде солей Fe(III) (1.03 ⋅ 10–3 М, 55.7% от исходного). Содержание железа, адсорбированного на целлюлозе, – на порядок ниже. После первой экстракции 0.1 н раствором HCl выделено 8.2 ⋅ 10–5 М соединений Fe(III) (4.4% от исходного), а после второй – лишь 1.2 ⋅ 10–5 М (0.6%). Полученные данные показывают, что значительная часть железа находится в восстановленной форме, т.е. в виде соединений Fe(II), как и следует из теории окислительно-восстановительного катализа комплексов металлов переменной валентности.
При уменьшении начальной концентрации H2O2 вид кинетических кривых расходования меняется: практически постоянная скорость на начальном участке (при конверсии ~25–40%) почти в 2 раза меньше скорости на более глубоких стадиях, причем и в этом случае кинетика процесса описывается кинетическим уравнением реакции нулевого порядка (рис. 3, табл. 1). Важно, что на глубоких стадиях превращение H2O2 протекает со скоростью, характерной для процесса при его больших начальных концентрациях (ср. рис. 2 и 3).
Кривая накопления кислот при меньших концентрациях H2O2 также имеет S-образный характер. Однако при начальной концентрации пероксида водорода 0.14 М максимальная скорость накопления кислот и их предельная концентрация существенно ниже, чем при концентрации H2O2 0.25 М (см. табл. 1).
Дальнейшее снижение начальной концентрации H2O2 до 0.075–0.078 М приводит к еще более резкому изменению формы кинетических кривых его расходования (рис. 4). Из рисунка видны четко выраженные индукционные периоды – при более низком содержании катализатора (полученного из 9.6 ⋅ 10–4 М соли FeCl3 ⋅ 6H2O) величина индукционного периода почти в 2 раза больше, чем при более высоком (полученного из 1.85 ⋅ 10–3 М FeCl3 ⋅ 6H2O, см. рис. 4, табл. 1). При низком содержании катализатора индукционный период практически “идеальный”, так как в течение длительного времени (4–5 ч) концентрация H2O2 остается постоянной; после его окончания превращение H2O2 протекает с постоянной скоростью вплоть до очень глубоких степеней превращения (~90%). Скорость реакции на данном участке не зависит от содержания катализатора (ср. кривые 6, 7 и 8 на рис. 4) и почти не отличается от начальной скорости распада H2O2 при больших его концентрациях (см. табл. 1). Кривая накопления кислот и в этом случае имеет S-образный характер, однако при высоких содержаниях катализатора эта особенность выражена в существенно меньшей степени, чем при более низких (ср. кривые 6, 7 и 8 на рис. 4).
При сопоставлении данных, представленных на рис. 2–4, хорошо прослеживается важная закономерность: при уменьшении исходной концентрации H2O2 начальная скорость его расходования значительно снижается. Эффект резко усиливается при дополнительном уменьшении концентрации катализатора. Но и в этом случае скорости процесса после окончания начальной медленной стадии (или индукционного периода) почти не зависят от исходных концентраций H2O2.
Эффект усиления каталитической активности можно объяснить двумя способами: первый – ускорение распада H2O2 может быть связано с физическими или химическими изменениями в каталитической системе; второй предполагает наличие в исследуемой системе ингибиторов, способных, как это известно, резко тормозить протекание химических реакций, особенно на начальных стадиях процесса. Этот второй механизм, однако, представляется маловероятным, так как и растворитель (вода), и H2O2, и даже техническая целлюлоза не содержат каких-либо примесей или функциональных групп, способных препятствовать образованию свободных радикалов при распаде H2O2 или реакциям с участием радикалов •ОН, образующихся из H2O2.
Более обоснованным представляется механизм, в котором ускорение распада H2O2 обусловлено химическими изменениями катализатора. Главным аргументом в пользу этого предположения является наличие основного количества железа в растворенном виде после завершения процесса. Переход железа с целлюлозы в водную фазу вполне естественен, так как в результате окисления целлюлозы и продуктов ее превращения образуются кислоты, в том числе и сильная муравьиная кислота. В нейтральных и слабокислых растворах, т.е. на начальных стадиях процесса, железо находится в исходной форме Fe(OH)3 и число активных центров на поверхности такого микрогетерогенного катализатора невелико – это ограничивает скорость распада H2O2. В кислых растворах появляются свободные ионы Fe(III), часть из которых находится в жидкой фазе, а часть – на макромолекулах целлюлозы. Эти ионы и обеспечивают увеличение скорости распада H2O2: чем выше начальное содержание исходной формы, тем менее выражен этот эффект, так как при большом содержании катализатора процесс уже с самого начала протекает с высокой скоростью.
Таким образом, изученная нами каталитическая система способна “самонастраиваться”, обеспечивая высокую и практически постоянную скорость после завершения начальной стадии “самонастройки”. Активную роль в этом процессе играет полисахарид (целлюлоза), являющийся восстановителем, первичными продуктами окисления которого оказываются альдегидные группы. На более глубоких стадиях образуются и карбоксильные группы. Именно целлюлоза обеспечивает высокую скорость восстановления Fe(OH)3, и переход ионов железа в жидкую фазу. Этанол, в котором проводились исследования в работе [19], в отличие от полисахаридов, устойчив к окислению и является плохим восстановителем, в связи с чем такие эффекты не наблюдались ранее.
При обработке целлюлозы пероксидом водорода в присутствии катализатора отмечается увеличение белизны, количественно оцениваемое по изменению спектров диффузного отражения (стандарт ГОСТ Р ИСО 11475-2010) выделенных фильтрованием и высушенных образцов целлюлозы после обработки H2O2 (табл. 2). Из полученных данных следует, что высокая степень отбеливания достигается только при значительных концентрациях H2O2 (≥0.1 М); потери целлюлозы, оцениваемые по массе ее остатка и массе водорастворимых продуктов после завершения процесса, мало зависят от условий его проведения (табл. 2).
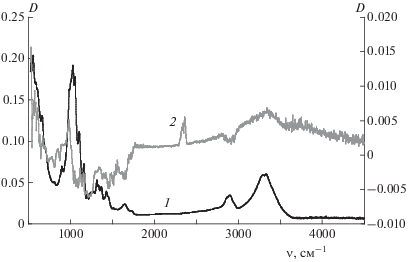
Увеличение белизны товарной целлюлозы после обработки вызвано уменьшением желтизны, которая количественно определена по величине цветовой координаты b* [20, 21]. Значение b* в процессе обработки целлюлозы снижается с 12.45 (для товарной целлюлозы) до ∼3–4, в зависимости от режима процесса. Можно предположить, что ответственными за желтизну являются остатки лигнина и продуктов его превращения при переработке древесной массы для получения технической целлюлозы, в которой этих веществ немного. Основные полосы в ИК-спектре этого продукта (рис. 5, спектр 1) практически не отличаются от аналогичных полос в спектре целлюлозы после переработки, а сам ИК-спектр совпадает с литературными данными для “чистой” целлюлозы [22]. Однако в разностном спектре, полученном в результате вычитания из спектра образца очищенной целлюлозы спектра промышленного продукта, видны небольшие, но воспроизводимые изменения (рис. 5, кривая 2). Уменьшение поглощения в области длин волн 1000–1750 см–1, характерной для технического лигнина, свидетельствует о его расходовании, чем объясняется увеличение белизны.
ВЫВОДЫ
1. С использованием усовершенствованной методики получены микрочастицы Fe(OH)3 обладающие высокой эффективностью и улучшенной воспроизводимостью кинетических характеристик в процессах каталитического разложения H2O2 и инициирования окисления органических веществ в водных системах.
2. Выявлены кинетические особенности процессов каталитического превращения H2O2 и образования кислот в присутствии целлюлозы. Нулевой порядок реакции превращения H2O2 объяснен “самонастраиванием” катализатора в результате окислительно-восстановительных процессов с участием целлюлозы и продуктов ее окисления.
3. Обнаружено увеличение белизны технической целлюлозы при ее обработке в воде в присутствии H2O2 и золя Fe(OH)3 при проведении процесса в мягких условиях (70 °С). Показано, что при содержании H2O2 не менее 0.1 М удается достигнуть степени белизны более 80%.
Авторы выражают благодарность Н.Б. Полянскому (ИБХФ РАН) за помощь в анализе Fe(III) и О.В. Староверовой в регистрации и анализе ИК-спектров.
Работа выполнена в соответствии с госзаданием № 0082-18-006 (№ AAAA-A18-118020890097-1).
Список литературы
Nanocatalysis: Synthesis and application / Eds. Polshettiwar V., Asefa T. N.Y.: Wiley, 2013.
Крюков А.И., Строюк А.Л., Кучмий С.Я., Походенко В.Д. Нанофотокатализ. Киев: Академпериодика, 2013.
Кумпаненко И.В., Рощин А.В., Иванова Н.А. и др. // Хим. физика. 2018. Т. 37. № 2. С. 25.
Москаленко И.В., Тихонов И.В., Плисс Е.М. и др. // Хим. физика. 2018. Т. 37. № 11. С. 25.
Тихонов И.В., Плисс Е.М., Бородин Л.И. и др. // Хим. физика. 2017. Т. 36. № 6. С. 20.
Тихонов И.В., Москаленко И.В., Плисс Е.М. и др. // Хим. физика. 2017. Т. 36. № 5. С. 14.
Zelmanov G., Semit R. // Water Res. 2008. V. 42. P. 492.
Michel H. // Angew. Chem. Int. Ed. 2012. V. 51. P. 2516.
Кузнецов А.Е., Градова Н.Б. Научные основы экобиотехнологии. М.: Мир, 2006.
Писаренко Л.М., Лесин В.И., Касаикина О.Т. // Изв. РАН. Сер. хим. 2014. № 3. С. 688.
Лесин В.И., Писаренко Л.М., Касаикина О.Т. Синтез многофункционального самонастраивающегося катализатора окислительного крекинга органического сырья и его применение. Патент РФ 2425715 // Б.И. 2011. № 22. С. 14.
Лесин В.И., Писаренко Л.М., Касаикина О.Т. // Коллоид. журн. 2012. Т. 74. № 1. С. 90.
Касаикина О.Т., Писаренко Л.М., Лесин В.И. // Там же. № 4. С. 483.
Касаикина О.Т., Писаренко Л.М., Зиновьев И.В. Синтез многофункционального катализатора окислительного крекинга органического сырья и способ жидкофазного окислительного крекинга органического сырья (варианты). Патент РФ 2488445 // Б.И. 2013. № 21.
Касаикина О.Т., Писаренко Л.М., Зиновьев И.В. Способ переработки биомассы в целлюлозу и раствор низкомолекулярных продуктов окисления (варианты). Патент РФ 2515319 // Б.И. 2014. № 13.
Kasaikina O.T., Lesin V.I., Pisarenko L.M. // Catal. Sustain Energy. 2014. № 1. P. 21.
Писаренко Л.М., Касаикина О.Т., Зиновьев И.В. и др. // Сб. тр. IV Междунар. науч. экол. конф. “Проблемы рекультивации отходов быта, промышленности и сельскохозяйственного производства”. Краснодар: Кубанский госагроуниверситет, 2015. Ч. 1. С. 419.
Воютский С.С. Курс коллоидной химии. М.: Химия, 1964.
Писаренко Л.М. // Изв. РАН. Сер. хим. 2018. № 6. С. 1026.
Иванов В.Б., Солина Е.В., Староверова О.В. и др. // Хим. физика. 2017. Т. 36. № 11. С. 72.
Ivanov V.B., Bitt V.V., Solina E.V., Samoryadov A.V. // Polymers (Basel). 2019. V. 11. P. 1579.
Kuptsov A.Y., Zhizhin G.N. Handbook of Fourier Transform Raman and Infrared Spectra of Polymers. V. 45. Amsterdam: Elsevier, 1998.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика