Химическая физика, 2021, T. 40, № 11, стр. 78-86
Влияние ДНК на флуоресценцию композитных пленок ZnO, содержащих наноразмерные алмазы
Е. А. Борулева 1, 2, *, И. А. Наговицын 2, 3, Г. К. Чудинова 1, 3, А. В. Лобанов 2, 4, 5
1 Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
2 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Москва, Россия
3 Институт общей физики им. А.М. Прохорова Российской академии наук
Москва, Россия
4 Московский педагогический государственный университет
Москва, Россия
5 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: katrinboruleva@gmail.com
Поступила в редакцию 19.03.2021
После доработки 13.04.2021
Принята к публикации 20.04.2021
Аннотация
Золь-гель методом получены двуслойные пленки ZnO, включающие наноразмерные алмазы, полученные методом детонационного синтеза (далее – ДНА) со средним размером частиц 10 нм. Затравочный слой на стеклянной подложке не содержал ДНА, второй – получали из смеси Zn(NO3)2 ⋅ 6H2O, гексаметилентетрамина, поливинилпирролидона (12 600 г/моль) и 10–80 г/л ДНА. Структуру и свойства пленок контролировали методами сканирующей электронной и атомно-силовой микроскопии. Обнаружено, что рост количества ДНА в пленке приводит к тушению люминесценции ZnO (λex = = 260 нм, λem = 363 нм) в 2.7–25.1 раз. При концентрации ДНА 80 г/л наблюдали уменьшение ширины оптической запрещенной зоны от 3.324 до 3.298 эВ. Установлено, что на люминесценцию пленок оказывают влияние малые концентрации ДНК, нанесенные на поверхность методом спин-коатинга.
ВВЕДЕНИЕ
Оксид цинка (ZnO), как прямозонный полупроводник с большой шириной запрещенной зоны (Eg = 3.37 эВ), обладает специфическими оптическими и люминесцентными свойствами, например, фотолюминесценцией в ультрафиолетовом диапазоне спектра, большой энергией связи экситонов (60 эВ при комнатной температуре) [1]. Материалы на основе ZnO используются в оптоэлектронике и люминесцентной биосенсорике [2]. Фотолюминесценция ZnO характеризуется узкой интенсивной полосой в ультрафиолетовой области (360–380 нм) и широкой полосой в видимом диапазоне спектра (480–530 нм).
Низкоразмерные структуры на основе оксида цинка могут быть использованы в качестве носителей биологических матриц благодаря высокой химической стабильности и биосовместимости. Токсическое действие наночастиц ZnO было зарегистрировано лишь при высоких концентрациях (более 100 мкг/мл), что дает возможность использовать малые количества этих структур для биоаналитических измерений in vivo [3–5]. Основными преимуществами ZnO по сравнению с аналогами, которые используются в биоаналитических устройствах, являются: простота, дешевый синтез и возможность низкоразмерного масштабирования с различной морфологией.
Отмечено, что в материалах оксида цинка, включающих различные допанты, наблюдается изменение оптических, электрических, физико-химических свойств [6]. Композитные структуры ZnO с наноразмерными алмазами, полученные методом детонационного синтеза (далее – ДНА), по сравнению с однокомпонентными структурами самого ZnO обладают большей площадью удельной поверхности, значительными изменениями структуры и электрических свойств [7]. Так, недавно получены композитные системы с повышенной устойчивостью к фотокоррозии [8]. Усиление фотоотклика при взаимодействии ZnO и наноалмазов позволяет использовать такие системы для разработки эмиссионных катодов, фотодетекторов и биосенсоров [3, 9]. Пленки наноалмазов за счет высокой степени упорядоченности, развитой поверхности и наличия на поверхности активных химических групп (разных в зависимости от типа наноструктуры) используются в качестве биосенсорных элементов для детектирования белков, ДНК, вирусов. Кроме того, наноалмазы обладают низкой цитотоксичностью [4].
Исследование люминесцентных свойств ДНА при взаимодействии с различными биологическими компонентами позволяет проводить визуализацию внутриклеточных процессов in vivo. Наноразмерным алмазам свойственно отсутствие заметного поглощения в диапазоне от ультрафиолетовой до инфракрасной области спектра [10–12], что позволяет точно регистрировать значения маломасштабного оптического поглощения и интенсивности люминесценции при взаимодействии с биообъектами. Установлено, что взаимодействие ДНА с биообъектами может существенно влиять на степень их агрегации и оптические характеристики [13].
Частицы ДНА имеют высокую удельную поверхность (250–350 м2/г), сверхмалый размер первичных частиц (4–6 нм), лабильный функциональный покров и инертное ядро. Наличие этих свойств делает ДНА перспективными для создания систем определения и доставки биологически активных и лекарственных веществ, люминесцентных маркеров, в частности, для изучения клеточных взаимодействий. Иммобилизацию биологически активных и лекарственных веществ осуществляют химическим связыванием или с помощью адсорбции. Частицы ДНА с их уникальными свойствами перспективны для создания новых композитных материалов, например, для допирования ими материалов на основе ZnO.
В настоящее время проводятся многочисленные работы по исследованию процессов самосборки ДНК, в частности, при взаимодействии с различными наноразмерными структурами. Таким образом, возможно получение широкого спектра наноматериалов. Активно исследуются как собственные проводящие свойства ДНК, так и ее комплексов с наноразмерными объектами [14–18]. Такие комплексы, полученные на “платформе” ДНК, могут применяться в оптоэлектронных устройствах (химические датчики), использоваться для доставки лекарственных препаратов [19]. Цель настоящей работы – получение золь-гель методом двуслойных пленок ZnO c добавлением ДНА, определение влияния ДНА на структуру и оптические свойства композитных пленок, а также отклика на малые количества ДНК, нанесенных на поверхность пленок.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы наноразмерные алмазы, полученные детонационным синтезом в компании Adamas Nanotechnologies (США). Характерный размер наночастиц составляет в среднем 10 нм.
Тонкие пленки оксида цинка были получены двухстадийным способом. На первом этапе слои затравки-золя наносили на стеклянные подложки (15 × 15 мм) методом спин-коатинга на центрифуге “Элекон” ЦЛМН-P10-02 (Россия) при скорости вращения подложки в горизонтальной плоскости в 2500 об/мин. Для этого использована смесь 1 M ацетата цинка Zn(CH3COO)2 ⋅ 2H2O и моноэтаноламина (MЭA) в 2-этоксиэтаноле.
Мольное соотношение МЭА : Zn(CH3COO)2 ⋅ ⋅ 2H2O составляло 5 : 2. Полученный раствор перемешивали при комнатной температуре в течение 1 ч и выдерживали в течение 48 ч. Перед нанесением золя стеклянные подложки кипятили в течение 20 мин в смеси дистиллированной воды, H2O2 (37 мас.%) и NH3 ⋅ H2O (25 мас.%), взятых в соотношении 4 : 1 : 1. Затем подложки тщательно промывали горячей дистиллированной водой и сушили на воздухе при комнатной температуре. Полученную затравочную пленку высушивали в течение 60 мин при 180 °С и отжигали в муфельной печи ЭКПС-10 (Россия) в течение 3 ч при 380 °С.
На втором этапе для формирования структурированной на наноразмерном уровне пленки ZnO готовили 10 мл смеси водного раствора Zn(NO3)2 ⋅ 6H2O, гексаметилентетрамина (ГМТ), поливинилпирролидона (ПВП, средняя молекулярная масса – 12 600 г/моль) и различного объема (1–16 мл) наноалмазов (2 мг/мл). Раствор аммиака добавляли для корректировки значения pH раствора (10.5). Концентрация нитрата цинка составляла 0.025 М. В приготовленную смесь погружали подложки с затравочным слоем и выдерживали на водяной бане (85 °С, 60 мин). Затем подложки промывали деионизованной водой и сушили на воздухе при комнатной температуре.
На композитные пленки ZnO/ДНА наносили растворы ДНК (10–10 и 10–12 мг/мл) методом спин-коатинга, скорость вращения основы центрифуги составляла 2000 об/мин, объем осажденного раствора – 50 мкл. Исходную навеску ДНК тимуса теленка (Sigma-Aldrich) разводили в водно-солевом растворе NaCl (0.09%) до концентрации 2 мг/мл и обрабатывали ультразвуком (42 кГц) на установке Branson 1510 (США) в течение 40 мин. Затем методом последовательного разбавления получали растворы с концентрациями ДНК, равным 10–10 и 10–12 мг/мл.
Спектры пропускания измеряли на спектрофотометре UV-1800 (Shimadzu), спектры флуоресценции образцов – с помощью спектрофлуориметра RF-5300pc (Shimadzu). Интенсивность флуоресценции регистрировали с интервалами 0.2 нм, щели возбуждения и регистрации – 3 и 5 нм соответственно. Для обработки данных применили программу Origin 8.1. Для расчета максимумов флуоресцентных полос использовались спектры, обработанные методом сглаживания кривой “усреднения по соседству” (количество пикселей для усреднения составляло 20). Интегральную флуоресценцию оценивали как площадь под кривой зависимости интенсивности флуоресценции от длины волны в диапазоне длин волн 340–400 нм. Использование интегральной интенсивности удобно для унификации результатов, в том числе для ситуаций, когда использовались различные устройства с разными оптическими характеристиками. Структуру пленок изучали на микроскопе Р4-SPM-MDT (NT-MDT, Россия) в режиме силового сканирования с использованием программы P7-SPM.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры оптического пропускания пленок оксида цинка, допированных разными количествами ДНА, в диапазоне 300–1000 нм представлены на рис. 1. Допирование пленок ZnO наноалмазами приводит к увеличению коэффициента пропускания в УФ-диапазоне (350 нм) от значений, близких к 0, для пленок с 8 мл ДНА, 4% – для пленок с 2 и 6 мл ДНА и 12 и 20% – для пленок с 1 и 4 мл ДНА соответственно. В видимом диапазоне спектра прозрачность растет от 40 до 80%.
Рис. 1.
Спектры пропускания композитных материалов ZnO/ДНА с разными объемами раствора ДНА, добавленного в реакционную смесь: 1 – 4 мл (зеленый), 2 – 1 мл (черный), 3 – 8 мл (голубой), 4 – 2 мл (красный), 5 – 6 мл (синий).

Величина оптической запрещенной зоны (Eg) образцов подсчитывалась из производной коэффициента пропускания (Т) по энергии (Е), с учетом того, что оксид цинка – прямозонный полупроводник. Величина Eg для ZnO по литературным данным составляет 3.37 эВ [1]. При добавлении в реакционную смесь для приготовления пленок от 1 до 6 мл ДНА величина Eg в пленках ZnO/ДНА составляет 3.324 эВ. График зависимости коэффициента пропускания от энергии для пленки ZnO, допированной ДНА, приведен на рис. 2. Увеличение объема вводимого раствора ДНА до 8 мл приводит к уменьшению Eg на 0.026 эВ.
Рис. 2.
Зависимость коэффициента пропускания (T) от энергии (E) для пленки ZnO, легированной разными объемами ДНА: 1 – 4 мл, 2 – 1 мл, 3 – 8 мл, 4 – 2 мл, 5 – 6 мл.
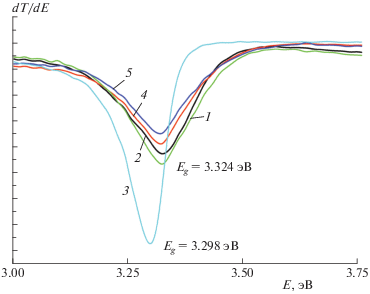
Известен ряд причин, приводящих к снижению ширины запрещенной зоны. Прежде всего, это увеличение концентрации собственных носителей заряда. Уменьшение ширины запрещенной зоны приводит также к тому, что оксид цинка кристаллизуется в другой кристаллической решетке за счет сильного влияния кристаллического поля алмазной наночастицы [20].
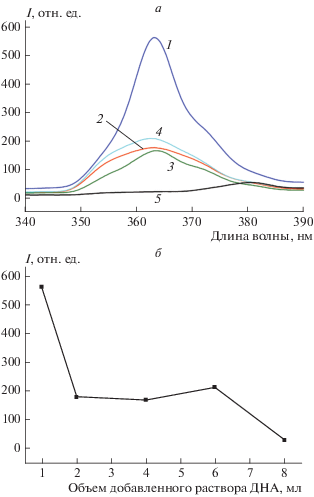
Спектры флуоресценции – фотолюминесценции (ФЛ) – пленок оксида цинка, допированных разными количествами ДНА, в интервале 340–390 нм приведены на рис. 3. Положение максимума полосы зависит от добавленного количества наноалмазов. При добавлении к исходной смеси 1 мл ДНА наблюдается максимальная интенсивность (I = 590 отн. ед.) ФЛ при λmax = 363 нм; добавка 2 мл ДНА приводит к падению интенсивности ФЛ в 3.3 раз (I = 177 отн. ед.) по сравнению с добавкой в 1 мл ДНА. Добавление 4 и 6 мл ДНА приводит к тушению ФЛ оксида цинка в 3.5 и 2.75 раз соответственно. Добавление 8 мл ДНА приводит к исчезновению полосы при 363 нм и образованию пика на длине волны 380.6 нм с интенсивностью I = 56 отн. ед. Таким образом, по мере увеличения количества допанта интенсивность ФЛ снижается на 62–68% (2–6 мл ДНА), а при максимальном количестве добавленного допанта (8 мл) – на 96% (рис. 3б).
Рис. 3.
Спектры фотолюминесценции пленок ZnO, легированных ДНА, на стеклянных подложках в УФ-диапазоне. Объем добавленного раствора ДНА в реакционной смеси для подготовки пленки (а): 1 – 1 мл, 2 – 2 мл, 3 – 4 мл, 4 – 6 мл, 5 – 8 мл; зависимость интенсивности ФЛ в максимуме полосы при 363 нм.
Известно, что наноалмазы, подобные тем, которые использовались в настоящей работе, не обладают собственной люминесценцией, но оказывают влияние на люминесцентные свойства при взаимодействии с другими объектами [21]. Как видно из рис. 3, зависимость интенсивности ФЛ от количества допанта нелинейна, причем увеличение количества ДНА в пленке заметно влияет на интенсивность флуоресценции. Фотолюминесцентные свойства оксида цинка сильно зависят от способа получения, а также от дефектов кристаллической решетки. Так, при избытке кислорода оксид цинка люминесцирует с максимумом полосы при 527 нм, при избытке цинка этот максимум располагается при 490 нм [22, 23].
В нашей работе мы получали оксид цинка, который находится в непосредственном окружении агрегатов ДНА. Они оказывают влияние на фотолюминисцентные свойства оксида цинка, поэтому мы предположили, что пики, которые хорошо разрешаются в области 400–500 нм (рис. 4а), могут различаться за счет взаимодействия кристаллической решетки оксида цинка с разными по количеству входящих в агрегат ДНА. Во всех случаях наблюдали полосы с максимумами при 452, 471 и 484 нм (рис. 4б). Можно предположить, что это – флуоресценция комплексов оксида цинка с ДНА.
Рис. 4.
Спектры фотолюминесценции пленок ZnO, легированных ДНА, на стеклянных подложках в видимой области спектра 400–500 нм. Объем раствора ДНА в реакционной смеси для подготовки пленки (а): 1 – 1 мл, 2 – 2 мл, 3 – 4 мл, 4 – 6 мл; общий вид спектра ФЛ пленок ZnO, легированных ДНА (б).
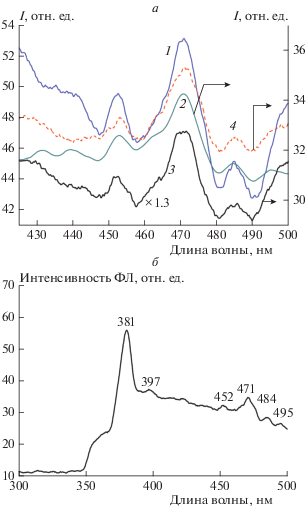
Известно, что положение максимума полосы ФЛ оксида цинка в области 400–500 нм зависит от дефектов в его кристаллической решетке, в частности от избытка кислорода и цинка в ней (λmax = 490 нм) [22, 23]. Оксид цинка, выращенный гидротермальным методом, имеет несколько полос ФЛ с максимумами при 502, 510, 525 и 540 нм [24–27]. Не обладая собственной ФЛ, наноалмазы при взаимодействии с другими объектами, обладающими люминесценцией, могут оказывать влияние на флуоресцентные свойства объекта.
Было выявлено, что отклик композитных пленок на присутствие биомолекул, таких как ДНК, показывает как взаимодействие их с ДНК влияет на фотолюминесценцию допированного наноалмазами оксида цинка. Так, например, интенсивность фотолюминесценции пленок оксида цинка, приготовленных из смесей с 1 мл ДНА, равна 730 отн. ед. Нанесение на поверхность таких пленок ДНК в концентрации 10–10 г/л приводит к снижению интенсивности ФЛ в 1.7 раз (420 отн. ед.), а нанесение ДНК в концентрации 10–12 г/л приводит к дальнейшему падению интенсивности в 3.2 раз (230 отн. ед.) и батохромному сдвигу полосы ФЛ на 9 нм (от 363 до 372 нм). На рис. 5 видно, что для пленок из смесей с 2 мл ДНА интенсивность ФЛ для концентрации ДНК 10–10 г/л равна 200 отн. ед., что в 1.2 раз больше ФЛ без ДНК (170 отн. ед.). ДНК в концентрации 10–12 г/л, напротив, приводит к тушению ФЛ до 79 отн. ед. (в 2.2 раз) для той же концентрации допанта с батохромным смещением полосы на 10 нм (от 362 до 372 нм).
Рис. 5.
Спектры фотолюминесценции пленок ZnO, легированных ДНА (черные (3), без ДНК) на стеклянных подложках, и пленки ZnO/ДНА с ДНК на поверхности. Концентрации ДНК – 10–10 г/л (1, красный), 10–12 г/л (2, синий). Объем раствора ДНА в реакционной смеси для подготовки пленки: a – 2 мл, б – 4 мл, в – 6 мл, г – 8 мл.
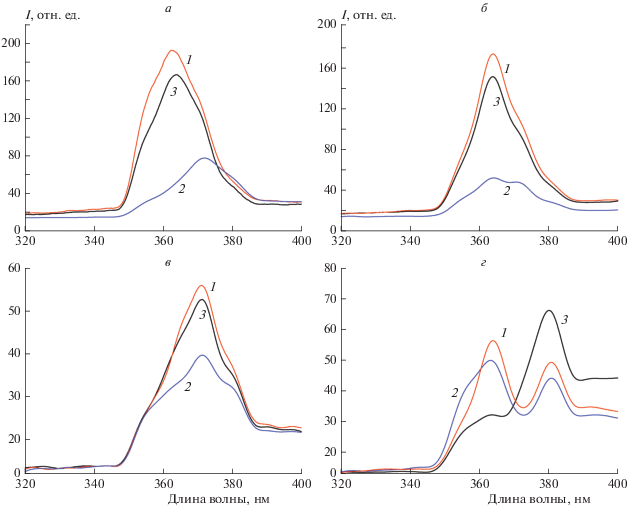
Для пленок из смесей оксида цинка с ДНА в количестве 4 и 6 мл нанесение 10–10 г/л ДНК увеличивает ФЛ в 1.2 и 1.1 раз соответственно, тогда как нанесение ДНК в концентрации 10–12 г/л увеличивает ФЛ в 3.3 и 1.3 раз соответственно. Как отмечено выше, при добавлении 8 мл ДНА в реакционную смесь происходит исчезновение пика ФЛ пленок при 363 нм. Добавка ДНК в обеих концентрациях приводит к восстановлению этого пика. Плечо при 363 нм у пленок из смесей с 8 мл ДНА (30 отн. ед.) при добавлении ДНК превращается в пики при 363 нм с интенсивностью ФЛ 60 отн. ед. для 10–10 г/л и 50 отн. ед. для 10–12 г/л. Пик интенсивности ФЛ при 380 нм в присутствии ДНК уменьшается в 1.4 и 1.6 раз соответственно.
Зависимости интегральной интенсивности ФЛ (площади под кривой спектра ФЛ в области 400–500 нм) оксида цинка от количества ДНА в пленке, в том числе под действием ДНК, приведены на рис. 6. Зависимость интегральной ФЛ (рис. 6) незначительно, но отличается от зависимости интенсивности в максимуме полосы (рис. 3б). Интересно, что меньшая концентрация ДНК в растворе, наносимом на поверхность пленок, приводит к наибольшим изменениям величины ФЛ, причем величина тушения или возгорания ФЛ под действием ДНК снижается с ростом количества ДНА в пленке.
Рис. 6.
Зависимость интегральной интенсивности (400–500 нм) ФЛ оксида цинка от количества ДНА в пленках при разных концентрациях ДНК: 1 (красная) – 10–10 г/л; 2 (черная) – 10–12 г/л; 3 (синяя) – без ДНК.

Результаты исследования пленок методом атомно-силовой микроскопии (АСМ) приведены на рис. 7 и 8. Пленки, хотя и содержат некоторое количество микрокристаллов, обладают удовлетворительной равномерностью и поверхностью, структурированной на наноразмерном уровне (табл. 1). Нанесение малых количеств ДНА на поверхность заметно влияет на морфологию образца. На рис. 8б показаны эллиптические структуры, которые, по-видимому, являются агрегатами ДНА. Сворачивание ДНК в “клубок” зависит от многих причин, самой простой из которых является полярность полученной поверхности (подобные же агрегаты были описаны в работе [28]).
Рис. 7.
АСМ-изображение пленки ZnO/ДНА (а); профиль поверхности по центру выделенной области по горизонтали (б).
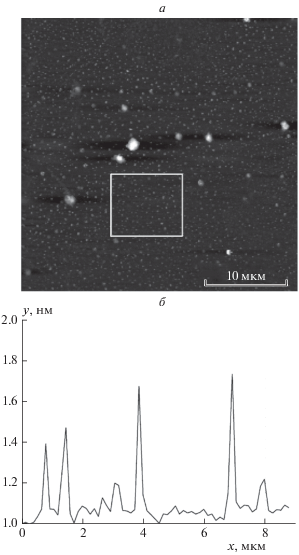
Рис. 8.
АСМ-изображение пленки ZnO/ДНА c нанесенной на поверхность ДНК (а, б); профиль поверхности по центру выделенной области по горизонтали (в).

ЗАКЛЮЧЕНИЕ
В настоящей работе были получены пленки ZnO, допированные детонационными наноалмазами, изучена фотолюминесценция пленок и влияние на них малых количеств ДНК. Включение ДНА в пленки заметно влияет на их оптические характеристики и структуру ZnO. Для разработки чувствительных элементов в большей степени пригодны пленки с малым содержанием ДНА из-за наиболее интенсивной люминесценции в ультрафиолетовой области и значительного ее изменения под действием ДНК.
Отметим, что необходимы более детальные исследования влияния различных концентраций ДНК на ультрафиолетовую ФЛ пленок ZnO/ДНА. Пленки с большим содержанием ДНА перспективны для разработки оптоэлектронных устройств из-за возможности уменьшения величины оптической запрещенной зоны.
Подобные материалы с развитой поверхностью представляют интерес для создания и использования их в области фундаментальных исследований, например, для установления механизмов формирования наноразмерных супрамолекулярных комплексов [29, 30], создания поверхностей для селективного образования и стабилизации структур определенного типа [31, 32]. Фундаментальные исследования изменения люминесцентных свойств композитных материалов на основе ZnO при взаимодействии с биомакромолекулами, биоорганическими соединениями перспективны в области моделирования процессов переноса энергии в природных биофизических системах, определения фотофизических свойств наноразмерных агрегатов спектральными методами.
Работа выполнена в рамках гранта УМНИК-19 15262ГУ/2020.
Список литературы
Rodnyi P.A., Chernenko K.A., Venevtsev I.D. // Opt. Spectrosc. 2018. V. 125. P. 372; https://doi.org/10.1134/S0030400X18090205
Shanmugam N.R., Muthukumar S., Prasad S. // Future Sci. OA. 2017. V. 3(4). P. FSO196; https://doi.org/10.4155/fsoa-2017-0006
Lin J.-C., Huang B.-R., Lin T.-C. // J. Electrochem. Soc. 2013. V. 160. P. 509.
Siddiqui S., Dai Z., Stavis C.J. et al. // Biosens. Bioelectron. 2012. V. 35. P. 284.
Belorus A., Moshnikov V.A., Pastukhov A. et al. // IEEE Conference of Russian Young Researchers in Electrical and Electronic Engineering (EIConRus). Moscow: IEEE, 2019; https://doi.org/10.1109/EIConRus.2019.8657149
Mangalam V., Pita K. // Materials. 2019. V. 12. P. 1997; https://doi.org/10.3390/ma12121997
Jiang H., Li L., Feng S., Lu W. // Physica E: Low-dimensional Systems and Nanostructures. 2018. V. 104. P. 314; https://doi.org/10.1016/j.physe.2018.07.041
Liu J., Wang P., Qu W. et al. // Appl. Catal. B. 2019. V. 257. P. 117880; https://doi.org/10.1016/j.apcatb.2019.117880
Nahlik J., Laposa A., Voves J. et al. // IEEE Sens. J. 2019. V. 19. P. 5587; https://doi.org/10.1109/JSEN.2019.2893572
Yang W., Auciello O., Butler J.E. et al. // Nat. Mater. 2002. V. 1. P. 253; https://doi.org/10.1038/nmat779
Härtl A., Schmich E., Garrido J.A. et al. // Nat. Mater. 2004. V. 3. P. 736; https://doi.org/10.1038/nmat1204
Долматов В.Ю. // Успехи химии. 2007. Т. 76. С. 375.
Nebel C., Shin D., Rezek B. // J. R. Soc. Interface. 2007. V. 4. P. 439; https://doi.org/10.1098/rsif.2006.0196
Shenderova O., McGuire G. // Biointerphases. 2015. V. 10. P. 030802; https://doi.org/10.1116/1.4927679
Jiménez-Monroy K.L., Renaud N., Drijkoningen J. et al. // J. Phys. Chem. A. 2017. V. 121. P. 1182; https://doi.org/10.1021/acs.jpca.7b00348
Ponomarev O.A., Shigaev A.S., Zhukov A.I., Lakhno V.D. // Mat. Biol. Bioinform. 2013. V. 8. P. 135.
Fink H., Schönenberger C. // Nature. 1999. V. 398. P. 407; https://doi.org/10.1038/18855
Bayrak T., Jagtap N.S., Erbe A. // Intern. J. Mol. Sci. 2018. V. 19. P. 3019; https://doi.org/10.3390/ijms19103019
Yoo S., Dugasani S.R., Chopade P. et al. // ACS Omega. 2019. V. 4. P. 6530; https://doi.org/10.1021/acsomega.9b00319
Yakovlev R.Yu., Dogadkin N.N., Kulakova I.I. et al. // Diamond Relat. Mater. 2015. V. 55. P. 77; https://doi.org/10.1016/j.diamond.2015.03.010
Boruleva E.A., Nagovitsin I.A., Chudinova G.K. // Laser Phys. Lett. 2019. V. 16. V. 055601; https://doi.org/10.1088/1612-202X/ab13b4
Rodnyi P.A., Khodyuk I.V. // Opt. Spectrosc. 2011. V. 111. P. 776; https://doi.org/10.1134/S0030400X11120216
Denisov N.M., Chubenko E.B., Bondarenko V.P., Bori-senko V.E. // Semiconductors. 2018. V. 52. P. 723.
Hassanpour A., Guo P., Shen S., Bianucci P. // Nanotechnology. 2017. V. 28. P. 435707; https://doi.org/10.1088/1361-6528/aa849d
Yim K.G., Kim M.S., Jae-Young Leem J.-Y. // J. Nanosci. Nanotechnol. 2013. V. 13. P. 3586; https://doi.org/10.1166/jnn.2013.7321
Kasumov M. // Tech. Phys. 2012. V. 57. P. 1304; https://doi.org/10.1134/S1063784212090137
Djurisić A.B., Leung Y.-H. // Small. 2006. V. 2(8–9). P. 944; https://doi.org/10.1002/smll.200600134
Chudinova G.K., Nagovitsyn I.A., Kononov M.A. et al. // Bull. Lebedev Phys. Inst. 2007. V. 34. P. 366; https://doi.org/10.3103/S1068335607120068
Бердникова Н.Г., Донцов А.Е., Ерохина М.В. и др. // Хим. физика. 2019. Т. 38. № 12. С. 48; https://doi.org/10.1134/S0207401X19120045
Матиенко Л.И., Миль Е.М., Бинюков В.И. // Хим. физика. 2020. Т. 39. № 6. С. 87; https://doi.org/10.31857/S0207401X20060084
Костров А.Н., Айбуш А.В., Гостев Ф.Е. и др. // Хим. физика. 2019. Т. 38. № 5. С. 71; https://doi.org/10.1134/S0207401X19050054
Гришин М.В., Гатин А.К., Сарвадий С.Ю. и др. // Хим. физика. 2020. Т. 39. № 7. С. 63; https://doi.org/10.31857/S0207401X20070067
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


