Химическая физика, 2021, T. 40, № 11, стр. 48-58
Миграция 4-гексилрезорцина через клеточные мембраны Escherichia coli
Э. В. Терешкин 1, *, Н. Г. Лойко 1, 2, К. Б. Терешкина 1, Ю. Ф. Крупянский 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
Москва, Россия
* E-mail: ramm@mail.ru
Поступила в редакцию 22.04.2021
После доработки 11.05.2021
Принята к публикации 20.05.2021
Аннотация
В работе продемонстрировано действие фенольного липида 4-гексилрезорцина (4ГР) на грамотрицательные бактерии Escherichia coli K12, приводящее к цитодифференцировке и влияющее на морфологию и жизнеспособность клеток. Показано, что эффект действия 4ГР на клетки является дозозависимым и развивается во времени. Методами молекулярной динамики в полноатомном приближении исследована диффузия 4ГР через внешнюю и внутреннюю мембраны E. coli. Методами управляемой молекулярной динамики и зонтичной выборки изучен процесс транспорта 4ГР через липидный бислой и канал белка порина. Показано, что 4ГР оказывает влияние на плотность мембран. Он свободно проникает внутрь бислоя, располагаясь параллельно молекулам липидов в области соединения гидрофильных полярных головок и гидрофобных хвостов. Диффузия 4ГР внутрь клетки с большей вероятностью происходит непосредственно через липидный бислой, а не канал порина: 4ГР и его кластеры могут связываться с петлей L6 порина, переводя канал в закрытое состояние.
1. ВВЕДЕНИЕ
Важным адаптивным свойством всех микроорганизмов является формирование покоящихся форм, помогающих им выживать в неблагоприятных (стрессовых) условиях [1]. Стратегии адаптации направлены на защиту генетического материала клетки (ДНК). Формирование покоящихся форм мешает разработке эффективных антимикробных препаратов, так как после перехода в покоящееся состояние микроорганизмы становятся устойчивыми к действию антибиотиков и дезинфицирующих средств [2, 3]. Знание закономерностей формирования адаптивных механизмов позволит эффективно влиять не только на лечение инфекционных заболеваний [4], но и управлять метаболической активностью клеток в производственных микробиологических процессах.
Наиболее изученным к настоящему времени является стресс голодания [1]. Структурным адаптивным ответом на стресс голодания является образование упорядоченных конденсированных внутриклеточных структур ДНК в нуклеоиде покоящихся бактерий (подробнее см. [5, 6]).
Ранее было показано, что в процессе формирования покоящихся бактериальных клеток участвуют аутоиндукторы анабиоза, по химической структуре относящиеся к фенольным липидам, производным алкилрезорцинов (АР) [1, 7, 8]. Механизмы действия аутоиндукторов анабиоза связаны с их способностью к комплексообразованию с мембранными липидами и клеточными биополимерами [9–13]. Алкилрезорцины изменяют структурное состояние и функциональную активность мембран, снижают активность ферментов электрон-транспортной цепи, повышают в клетках уровень ионов кальция и уменьшают уровень калия [14]. При повышении уровня аутоиндукторов анабиоза в клетках наблюдаются дегидратация клеточного протопласта, а также изменение каталитической активности ферментных белков и топологии ДНК [6, 9–12].
Аналоги микробных аутоиндукторов анабиоза, в частности 4-гексилрезорцин (4ГР), также способны приводить к цитодифференцировке бактерий [15]. Действие 4ГР является видонеспецифичным [7, 15]. Повышение его концентрации в развивающейся бактериальной культуре до уровня 10–4 М приводит к остановке деления клеток и переходу их в стационарную фазу. Дальнейший рост концентрации индуцирует переход части клеток популяции в анабиотическое покоящееся состояние. При сверхпороговых концентрациях (>5 · 10–4 М) действие 4ГР вызывает полную потерю жизнеспособности бактерий и образование так называемых мумифицированных клеток [16].
Несмотря на то, что механизмы действия 4ГР на бактериальные клетки изучаются в течение длительного времени, многие вопросы остаются открытыми. В частности, вызывает интерес молекулярный механизм проникновения 4ГР в клетку грамотрицательных бактерий, имеющих в качестве барьера внешнюю мембрану, периплазматическое пространство, содержащее пептидогликан, и внутреннюю мембрану [17]. Существует большое количество работ по структурным особенностям и проницаемости клеточных покровов грамотрицательных бактерий [18–20]. Можно предположить, что пути проникновения 4ГР через мембрану во многом сходны с проникновением антибиотиков и могут осуществляться двумя основными путями: с помощью свободной диффузии через бислои [21] или с использованием каналов белка порина [21, 22] во внешней мембране, которые обеспечивают прохождение небольших гидрофильных молекул в клетку, таких как сахара, аминокислоты, витамины, металлы и некоторые антибиотики.
Использование методов молекулярной динамики [23], позволяющих получить представление о поведении реальной физической системы или процесса, может служить инструментом в исследовании молекулярных механизмов указанных процессов. Методы молекулярной динамики направлены на исследование структурных, динамических и термодинамических свойств молекулярной системы. Многие свойства системы могут быть определены экспериментально, так что ее моделирование может дать объяснение получаемым экспериментальным данным [10–12, 24, 25]. Важным преимуществом метода молекулярной динамики является то, что можно также наблюдать динамическое поведение систем, недоступное для экспериментального изучения [26–28]. Также возможно проводить исследования при изменении физико-химических параметров и состава систем. Таким образом, метод молекулярной динамики может дать ответы на многие вопросы миграции 4ГР через внешнюю и внутреннюю мембраны клеток грамотрицательных бактерий.
Целью данной работы стало исследование молекулярных механизмов и свободной энергии миграции 4ГР через мембраны E. coli методами классической и управляемой молекулярной динамики и зонтичной выборки. В задачи работы входило изучение диффузии 4ГР через внешнюю и внутреннюю мембраны E. coli для определения возможных путей проникновения 4ГР в клетку: через липидный бислой или канал белка порина во внешней мембране.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Микробиологические исследования
Объектом исследования являлись грамотрицательные бактерии E. coli штамма К12 из коллекции ФИЦ “Фундаментальные основы биотехнологии” РАН. Бактерии выращивали на среде LB по Миллеру следующего состава (г/л): дрожжевой автолизат – 10.0; пептон – 5.0; NaCl – 5.0; pH среды – 7.0. Культивирование осуществляли в колбах объемом 250 мл с 50 мл питательной среды при перемешивании (160 об/мин) и температуре 28 °С в течение заданного времени. Инокулят – культуру начала стационарной фазы роста (ночная культура) – вносили в количестве 0.5 мл на 50 мл среды (1%), что обеспечивало начальную оптическую плотность (ОП), равную 0.2 (λ = 450 нм, длина оптического пути l = 10 мм; спектрофотометр Jenway, модель 7315, Великобритания).
Для изучения влияния 4ГР на бактериальные клетки спиртовые (1% этанола) растворы препарата вносили в культуры E. coli предстационарной фазы роста до конечных концентраций 10–3; 2 · 10–4; 10–4; 10–5; 10–6 М и инкубировали при температуре 23 °С в течение 1 мес, периодически исследуя жизнеспособность клеток.
Жизнеспособность клеток определяли по числу колониеобразующих единиц (КОЕ) при высеве клеточных суспензий из соответствующих разведений на агаризованную среду LA следующего состава (г/л): дрожжевой автолизат – 10.0; пептон – 5.0; NaCl – 5.0; агар-агар – 3.0, pH среды – 7.0.
Микроскопические наблюдения проводили с использованием микроскопа “ZEISS Axio Imager M2” (Германия) с фазово-контрастным устройством.
2.2. Сборка компьютерных моделей мембран
Полноатомные модели были созданы для обеих мембран E. coli – внутренней и внешней. Для сравнительного изучения во внешнюю мембрану встраивались тримеры белка порина. Все мембраны были периодическими, чтобы избежать краевых эффектов из-за экспонированных наружу гидрофобных липидных хвостов.
2.2.1. Внутренняя мембрана
Оба слоя внутренней мембраны были смоделированы как смешанные слои, состоящие из 75% 1-пальмитоил-2-олеоип-sn-глицеро-3-фосфоэтаноламина (ПОФЭ) и 25% 1-пальмитоил-2-олеоил-sn-глицерин-3-фосфоглицерина (ПОФГ). Модель внутренней мембраны содержала 126 молекул ПОФЭ и 42 молекулы ПОФГ. Таким образом, в каждом слое содержалось по 84 липида. Полная система состояла из 50 тыс. атомов, включая воду. Концентрации ионов были приближены к физиологическим показателям в клетке E. coli [29]: 220 · 10–3 М Na+, 40 · 10–3 М K+, 120 · 10–3 М Cl–. Увеличенное количество ионов натрия по сравнению с хлором необходимо для нейтрализации отрицательного заряда системы. В ячейку было добавлено 20 молекул 4ГР. Площадь бислоя – 7 нм × 7 нм, высота расчетной ячейки – 8.5 нм. Для сборки мембран был использован пакет для комплексного биологического моделирования мембран CHARMM-GUI [30].
2.2.2. Внешняя мембрана и порин
Модель внешней мембраны была построена как асимметричная. Внутренний бислой внешней мембраны смоделирован идентично слоям внутренней мембраны и содержал 75% ПОФЭ и 25% ПОФГ. Внешний бислой внешней мембраны состоял из 100% липополисахаридов. Все липополисахариды имели одинаковую структуру, соответствующую одной из модификаций, характерной для E. coli. Липополисахарид включал в себя липид А (рис. 1), центральный олигосахарид и пять повторяющихся О-антигенов типа О1B [31]. Каждая из двух фосфатных групп липида А имела заряд q2–. Все углеводородные остатки были насыщены, их структура также приведена на рис. 1.
Для моделирования каналов в мембраны в процессе сборки встраивался тримерный интегральный белок порин OmpF (PDB ID: 1OPF) [32]. Также была собрана система, не содержащая порин (далее – в скобках указано количество молекул для системы без порина). Внешний слой содержал 96 (119) молекул липополисахаридов. Каждая молекула липополисахарида состояла из 1110 атомов. Внутренний слой содержал 236 (285) молекул ПОФЭ и 79 (95) молекул ПОФГ. Таким образом, соотношение числа молекул фосфолипидов к липополисахаридам составило 3.28. Полная система состояла из 420.2 тыс. атомов и содержала 404 (369) иона Na+, 64(79) – Ca2+, 368 (456) – Mg2+, 193 (154) – Cl–, 110 молекул 4ГР. Площадь бислоя – 15 нм × 15 нм, высота расчетной ячейки – 19.4 нм.
Такой состав липидов и их соотношения во внутренней и внешней мембранах позволяют создать простейшие модели ровных участков (не изгибов, где еще обязательно содержится кардиолипин) бактериальных мембран, которые хорошо согласуются с имеющимися экспериментальными данными [33]. Структура липополисахаридов отличается у разных серотипов E. coli, на данный момент известно 188 разных типов О-антигенов. Несмотря на то, что штамм K12 не продуцирует О-антигены [34], они были добавлены в модель внешней мембраны для исследования молекулярных механизмов их взаимодействия с 4ГР.
2.2.3. Молекулы 4-гексилрезорцина
Для определения структурных и энергетических характеристик молекулы 4ГР (рис. 1) были проведены ab initio расчеты с использованием универсального пакета квантовохимических программ FIREFLY [35]. Основные расчеты проводили неограниченным методом Хартри–Фока. Для аппроксимации электростатического потенциала с целью нахождения парциальных атомных зарядов использовали расширенный базисный набор, содержащий поляризационные и диффузные функции, 6-311++G(d,p), и алгоритм поиска электростатического потенциала GEODESIC [36]. Далее проводили процедуру усреднения зарядов для симметричных атомов и их параметризацию для молекулярно-динамического силового поля AMBER99–PARMBSC1 [37].
Количество молекул в расчетных ячейках определялось как среднее количество молекул 4ГР, приходящееся на единицу площади мембран в экспериментальной системе. Средние диаметр и длина клетки E. coli предстационарной фазы роста были равны 1.5 и 3–3.5 мкм соответственно. Если аппроксимировать форму клетки как цилиндр, ограниченный двумя полусферами радиуса r = 0.75 мкм, то площадь мембраны составит 14–16.5 мкм2. С учетом количества клеток E. coli и концентрации 4ГР получено 13.3 молекулы 4ГР на 1 нм2 мембраны в случае концентрации 4ГР в растворе, равной 10–3 М и его полной адсорбции на клетках.
Таким образом, экспериментальным концентрациям 10–3; 2 · 10–4; 10–4; 10–5; 10–6 М соответствуют 2250 (660); 450 (130); 225 (66); 23 (7); 3 (1) молекулы 4ГР в расчетной ячейке внешней (в скобках – внутренней) мембраны соответственно. На основании наших предыдущих расчетов биосистем с АР [12] при высоких концентрациях 4ГР можно было ожидать образования массивных комплексов между молекулами 4ГР и липидами, которые могут полностью изменить свойства систем. Низкие концентрации, напротив, не произведут видимого эффекта. Поэтому для расчетов были выбраны средние концентрации 4ГР, которые, как предполагалось, позволят наблюдать миграцию молекул в бислоях, но не приведут к их разрушению.
Количество молекул в расчетах выбрано следующим образом: 110 молекул 4ГР в расчетной ячейке модели внешней мембраны соответствовали концентрации 75 · 10–3 М в расчетной ячейке и эффективной концентрации 4.8 · 10–5 М в экспериментальной системе. Для модели внутренней мембраны была взята меньшая концентрация 4ГР с учетом не полного проникновения 4ГР через внешнюю мембрану. В системе, содержащей 20 молекул 4ГР, концентрация в ячейке составляла 44 · · 10–3 М, что соответствовало 3 · 10–5 М эффективной концентрации в экспериментальной системе.
2.3.1. Молекулярная динамика мембран
Молекулярная динамика полученных систем изучалась в программном комплексе Gromacs 2018 [38]. Расчеты проводили в периодических ячейках указанных выше размеров. Силовое поле AMBER99–PARMBSC1 было дополнено параметрами липидов и липополисахаридов [39, 40] и 4ГР. Использована модель воды SPC/E. Постоянная температура в 310 K поддерживалась с помощью стохастического (ланжевеновского) термостата (см. ниже уравнение (1)) с постоянной трения 0.5 пс–1. Давление поддерживалось с помощью баростата Парринелло–Рамана полуизотропным способом: в направлениях x и y независимо от направления z. Во всех направлениях величина давления составляла 1 атм, постоянная времени – 2 пс. Взаимодействия связанных атомов и ближние взаимодействия рассчитывались для каждого временного шага. Электростатические взаимодействия на больших расстояниях рассчитывались методом суммирования по Эвальду (PME). Радиусы обрезания для всех типов взаимодействия брались равными 1.5 нм. Список соседних атомов поддерживался с помощью схемы отсечки Верле и обновлялся каждые 10 фс. Быстрые степени свободы ограничивались с помощью алгоритма LINCS. Временной шаг интегрирования составлял 2 фс, “длина” рассчитываемых траекторий – 0.1 мкс.
(1)
${{m}_{i}}\frac{{{{d}^{2}}{{{\mathbf{r}}}_{i}}}}{{d{{t}^{2}}}} = - {{m}_{i}}{{\gamma }_{i}}\frac{{d{{{\mathbf{r}}}_{i}}}}{{dt}} + {{{\mathbf{F}}}_{i}}\left( {\mathbf{r}} \right) + {{{\mathbf{\dot {r}}}}_{i}}.$(2)
$\left\langle {{{{\dot {r}}}_{i}}\left( t \right){{{{\mathbf{\dot {r}}}}}_{j}}\left( {t + s} \right)} \right\rangle = 2{{m}_{i}}{{\gamma }_{i}}{{k}_{B}}T\delta \left( s \right){{\delta }_{{ij}}},$Перед началом расчета динамики проводилась следующая подготовка систем. На первом этапе проведена минимизация энергии методом наискорейшего спуска; затем – поэтапная релаксация систем в NPT-ансамбле. Для удержания липидов в правильных положениях релаксация проводилась в четыре этапа с постепенным уменьшением удерживающих потенциалов, суммарное время – 2 нс. Затем рассчитывалась динамика систем до выхода на плато средней площади, приходящейся на одну молекулу липида [41]. В отрелаксированные мембраны добавлялись молекулы 4ГР путем замены молекул воды. В качестве контроля рассчитывались системы наружной и внутренней мембран: 1) со встроенным белком порином, но без добавления 4ГР; 2) без встраивания порина, но с добавлением 4ГР; 3) не содержащие ни порина, ни 4ГР. При построении систем, анализе результатов и визуализации использовались программные комплексы Chimera [42] и VMD [43].
2.3.2. Управляемая молекулярная динамика и метод зонтичной выборки
Миграция малых молекул путем пассивного транспорта через мембраны происходит за большие по длительности промежутки времени. При этом диффузия молекул неоднородна. Миграция через некоторые участки мембраны сопровождается преодолением достаточно высоких энергетических барьеров, т.е. вероятность посещения соответствующих участков фазового пространства приближается к нулю. В то время как для получения усредненных макроскопических характеристик процесса необходимы данные динамики спонтанной диффузии на большом количестве молекул. Этого невозможно достигнуть в расчетах классической молекулярной динамики за доступные по длительности промежутки времени. Поэтому для получения данных о свободной энергии миграции 4ГР через бислой использовались подходы управляемой молекулярной динамики и зонтичной выборки.
Расчеты методом классической молекулярной динамики показали, что внешние участки липополисахаридов не препятствуют проникновению 4ГР к мембране, поэтому они не рассматривались. Для расчетов был подготовлен специальный бислой, совпадающий с моделью внутренней мембраны по содержанию липидов, в который встроен мономер белка порина. Перед исследованием свободной энергии была проведена предварительная релаксация модельной мембраны в течение 50 нс в NPT-ансамбле при температуре 310 K.
Проницаемость мембран для молекул, диффундирующих вдоль оси нормали к мембране (оси z), описывается в рамках одномерного уравнения Смолуховского с использованием модели неравновесной диффузии:
(3)
${{P}^{{ - 1}}} = \int {dz\frac{{\exp \left\{ {\beta G\left( z \right)} \right\}}}{{D\left( z \right)}}} .$В методе зонтичной выборки проводится модификация исходной функции потенциальной энергии путем добавления гармонического потенциала, удерживающего молекулу в заданном “окне” на координате реакции:
(4)
$G\left( z \right) = - kT\ln \left( {p\left( z \right)} \right) - N\left( z \right) + {\text{const}}{\text{.}}$С помощью метода управляемой молекулярной динамики к молекуле 4ГР прикладывалась постоянная сила, “протаскивающая” молекулу вдоль оси, перпендикулярной к мембране, через слой воды и мембрану. На полученной траектории были выбраны 200 точек (центров “окон” зонтичной выборки), равномерно распределяющих 4ГР вдоль оси z с шагом 0.045 нм. Для эффективного использования машинного времени одновременно перемещались две молекулы 4ГР, движущиеся с разных сторон бислоя: одна – через бислой, другая – через канал порина. Расчеты проводились при постоянном давлении, т.е. находили свободную энергию Гиббса. Координата z рассчитывалась как координата центра масс молекулы 4ГР.
Каждая из двухсот систем, отобранных на предыдущем этапе, релаксировалась в NPT-ансамбле в течение 100 пс. Затем проводился расчет 10 наносекундных траекторий. Молекула 4ГР удерживалась в каждом из “окон” при релаксации и расчете динамики с помощью гармонического потенциала с силовой константой 1000 кДж/моль · нм2. Вид профиля свободной энергии реконструировали из множества полученных вокруг каждой начальной точки распределений методом анализа взвешенных гистограмм (WHAM) [44]. Стандартная ошибка оценивалась с помощью бутстреп-выборки в 100 бутстрепов [45].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Действие 4ГР на клетки E. coli
Эффект от внесения 4ГР в клеточную культуру E. coli, находящуюся на предстационарной стадии роста, оказался дозозависимым и развивался во времени. Добавление 4ГР в концентрациях 10–5 и 10–6 М повышало стрессоустойчивость клеток и их способность к сохранению жизнеспособности. При этом изменений во внешнем виде бактерий E. coli при фазово-контрастной микроскопии не наблюдалось (рис. 2а, б). Титр жизнеспособных клеток (по КОЕ/мл) через месяц инкубации был выше контрольного в 3.8 и 5.1 раз соответственно (табл. 1).
Рис. 2.
Вид клеток E. coli при микроскопировании в фазовом контрасте: а – контрольные стационарные клетки (48 ч); клетки, подвергшиеся воздействию добавленного 4ГР (8 сут), в разных концентрациях: б – 10–4 М; в – 2 ⋅ 10–4 М; г – 10–3 М. Масштабная метка – 5 мкм.
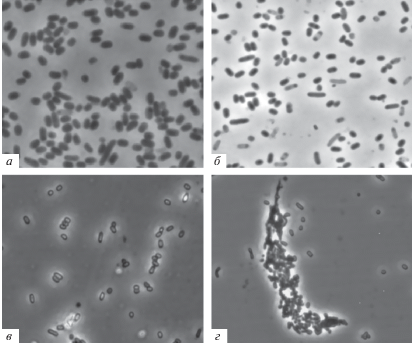
Таблица 1.
Изменение титра жизнеспособных клеток E. coli K12 в популяциях с разным содержанием 4ГР при длительном хранении
| Концентрация 4ГР в популяции, М | Титр жизнеспособных клеток (по КОЕ/мл) при инкубации | |||
|---|---|---|---|---|
| 30 мин | 1 сут | 8 сут | 1 мес | |
| Контроль | 3.0 · 109 | 2.5 · 109 | 9.6 · 108 | 1.5 · 107 |
| 10–3 | 0 | 0 | 0 | 0 |
| 2 · 10–4 | 2.5 · 109 | 6.7 · 107 | 4.3 · 107 | 0 |
| 10–4 | 2.9 · 109 | 3.1 · 109 | 2.8 · 108 | 2.8 · 106 |
| 10–5 | 3.0 · 109 | 3.5 · 109 | 1.3 · 109 | 5.7 · 107 |
| 10–6 | 3.1 · 109 | 3.9 · 109 | 1.7 · 109 | 7.6 · 107 |
Внесение более высоких концентраций 4ГР (10–4–2 ⋅ 10–4 М) вызывало переход большей части популяции E. coli в анабиотическое покоящееся состояние, также характеризующееся изменением клеточной ультраструктуры. Бактериальные клетки постепенно (эффект развивался в течение суток и более) становились более мелкими, округлыми, с резко очерченными клеточными стенками, у большинства из них развивалась повышенная способность преломлять свет (рис. 2в). При этом бактерии оставались жизнеспособными, несмотря на снижение клеточного титра при хранении в течение месяца, выявляемого рассевом на плотные среды (табл. 1). Процедуры реанимации, заключающиеся в отмывке клеток от 4ГР, позволяли восстановить их титр до 50% от первоначального. Такие бактерии обладали и другими признаками покоящихся форм: снижением уровня эндогенного дыхания и повышенной способностью к переживанию стрессовых факторов.
Высокая концентрация препарата 10–3 М очень быстро (в течение 30 мин) приводила к лизису части бактериальной популяции. Оставшиеся клетки округлялись и уменьшались в размерах в 2 и более раз (до 0.4–0.5 мкм), а также приобретали способность сильно преломлять свет, отчего становились похожими на споры. Клеточные оболочки таких бактерий утолщались, поэтому становились более заметными при фазово-контрастной микроскопии (рис. 2г). По-видимому, это происходит из-за кардинального изменения ультраструктурной организации клеток под действием проникающих внутрь молекул 4ГР, которые взаимодействуют со всеми ее компонентами, а также вызывает ее обезвоживание. Такие бактерии сохраняли свою форму и содержание (не лизировались в дальнейшем), но уже не были жизнеспособны (табл. 1). Вернуть их к жизни путем отмывки от воздействия фактора анабиоза не удавалось. Это состояние клеток было описано ранее как мумифицированное [16].
3.2. Молекулярная динамика мембран в присутствии 4ГР
Молекулярно-динамические расчеты показали, что из-за низкой растворимости в воде 4ГР начинает быстро (уже на первой–второй наносекунде) образовывать кластеры из нескольких молекул за счет сильных гидрофобных эффектов. Фенольные кольца резорцина проявляют гидрофильные свойства и экспонируются наружу кластеров. Боковые углеводородные хвосты оказываются экспонированы внутрь.
На рис. 3 (слева) показана относительная плотность распределения атомов (по массе) различных молекул внутри расчетной ячейки по оси z (нормаль к плоскости мембраны) для модели внутренней мембраны E. coli. Относительная плотность найдена как частное от абсолютной плотности конкретного вещества в данной точке, разделенное на максимальное значение плотности этого вещества на всем протяжении оси z. Видно, что молекулы 4ГР проникают внутрь мембраны и находят наиболее выгодные положения у липидных хвостов. 4ГР – фенольный липид с достаточно длинным хвостом, поэтому он легко встраивается в мембрану. Фенольное кольцо располагается наиболее близко к головкам липидов, углеводородные хвосты располагаются параллельно липидным хвостам.
Рис. 3.
Относительная массовая плотность распределения (ρ) атомов липидов, 4ГР, воды и ионов во внутренней мембране (слева), суммированная по траектории за 100 нс, и структура системы (справа) в момент времени, соответствующий 57-й наносекунде. Показаны: адсорбированый кластер 4ГР (вверху), вышедшая из мембраны одиночная молекула 4ГР и две встроившиеся в мембрану молекулы 4ГР. Мелкими шариками изображены атомы липидов, крупными шарами – атомы 4ГР. Молекулы воды и ионы не показаны.
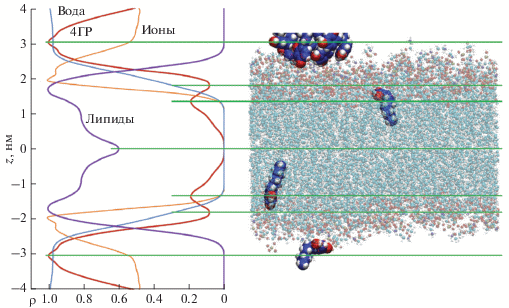
Во временном интервале 10–20 нс кластеры 4ГР адсорбируются на поверхности мембраны, где наблюдаются на протяжении всего расчета траектории. При этом кластеры динамически изменяются – часть молекул 4ГР отрываются от них и проникают в липидный бислой, другие молекулы присоединяются. На рис. 3 (справа) показана структура модельной мембраны в момент времени, соответствующий 57-й наносекунде траектории, на которой виден массивный кластер молекул 4ГР (вверху), две встроившиеся в мембрану молекулы 4ГР и одна молекула, вышедшая из мембраны. Вода и ионы не показаны, чтобы не загромождать рисунок. Одиночные молекулы 4ГР могут как встраиваться внутрь мембраны, так и проходить через нее. Кластеры 4ГР приводят к локальному выпячиванию мембраны в местах связывания (рассчитанный радиус кривизны r = 10.7 нм). Встраивание молекул 4ГР в мембрану приводит к разупорядочиванию алкильных цепей липидов c уменьшением параметра порядка на 10%.
Одним из критериев влияния 4ГР на мембрану может служить возможное изменение средней площади, приходящейся на одну молекулу липида в рассчитываемых системах, напрямую связанное с другими структурными и динамическими свойствами бислоя. Точное экспериментальное определение средней площади на одну молекулу липида в биологически значимых бислоях затруднено, поэтому в литературных данных встречаются значительные расхождения [46–48]. В расчетах уменьшение площади возникает из-за того, что электростатическое отталкивание в липидах бактериальных мембран ослабляется за счет возникновения внутри- и межмолекулярных водородных связей и сильных ион-липидных взаимодействий. Наличие больших ионно-липидных кластеров обеспечивает потенциальный молекулярный механизм для низкой проницаемости бактериальных мембран для органических растворителей [49]. В наших расчетах для бислоя ПОФЭ/ПОФГ c соотношением липидов 3 : 1 средняя площадь на одну молекулу липида при 310 К составляла 55 Å2. При добавлении 4ГР это значение увеличивалось до 57 Å2. Для модели внешней мембраны средняя площадь на одну молекулу липида при той же температуре составляла 60.7 Å2 и увеличивалась до 61.8 Å2 при добавлении 4ГР.
Таким образом, 4ГР разрыхляет мембраны из-за встраивания одиночных молекул и меняет локальный радиус кривизны из-за адсорбции кластеров 4ГР. Хотя заметного утолщения мембран под действием 4ГР за время расчета обнаружено не было, возможно, оно происходит на бо́льших временах. Либо основное утолщение клеточной стенки, наблюдаемое в эксперименте, происходит при заметно большем содержании 4ГР на уровне периплазматического пространства и пептидогликана, изучение которых выходило за рамки настоящей работы и требует проведения отдельного исследования.
Поведение 4ГР в модели наружной мембраны определяется взаимодействиями с остатками О-антигенов и центрального олигосахарида, лежащими на пути проникновения к молекулам липида А. На рис. 4 вверху показана схема липополисахарида, моделируемого в работе. К липиду А (LA) присоединен центральный олисахарид (место его присоединения обозначено как R на рис. 1), состоящий из 10 остатков: двух остатков α-3-деокси-D-манно-окт-2-улозоновой кислоты (AK), трех остатков α-LD-манногептозы (AM), двух остатков α-D-глюкозы (AL), двух остатков α-D-галактозы (AG) и одного остатка β-D-глюкозы (BG). К остатку β-D-глюкозы присоединены пять повторяющихся О-антигенов типа О1B. Каждый из О1-антигенов состоит из пяти остатков: остатка β-N-ацетил-D-глюкозамина (BL), остатка α-D-галактозы (AL), двух остатков α-L-рамнозы (AR) и остатка β-N-ацетил-D-маннозамина (BR). На этом рисунке показан график изменения усредненной энергии связывания молекул ПОФЭ (кривая 1), ПОФГ (кривая 2), липида А (кривая 3), остатков порина Р и участков липополисахарида с 4ГР на 20-наносекундном отрезке траектории. Усредненная энергия находилась как частное от деления потенциальной энергии связывания 110 молекул 4ГР c каждым из компонентов модельной мембраны на количество молекул (для липидов) или остатков этого компонента. Общее количество молекул липидов: 236 – ПОФЭ, 79 – ПОФГ, 96 – липида А; аминокислотных остатков тримера порина – 1020; остатков сахаров – 192 AK, 288 – AM, 192 – AG, 672 – AL, 96 – BG, 480 – BL, 960 – AR, 480 – BM.
Рис. 4.
Вверху – структура липополисахарида (пояснение см. в тексте). Слева – энергия связывания ПОФЭ (кривая 1), ПОФГ (кривая 2), липида А (кривая 3), порина Р и участков липополисахарида с 4ГР. Справа – порин OmpF в открытом и закрытом состояниях. Стрелками показана петля L6 порина (в открытом состоянии) и связавшаяся с ней молекула 4ГР (в закрытом состоянии).

Усредненная энергия позволяет получить данные о молекулярных механизмах взаимодействия 4ГР с внешней мембраной. Основными центрами связывания липополисахаридов оказываются О-антигены (кривые BM, BL, AR, AL). Прилегающие к липиду А остатки сахаров (кривые AK, AM, AG), напротив, связывают молекулы 4ГР слабее, как и остатки BG. О-Антигены и центральные олигосахариды разрыхляют молекулярные кластеры 4ГР и препятствуют их образованию. Если у внутренней мембраны кластеры 4ГР содержат до 15 молекул, то у внешней мембраны – в 2 раза меньше. Метастабильные комплексы с остатками сахаров О-антигенов и центрального олигосахарида способствуют продвижению молекул 4ГР к липиду А наружной мембраны E. coli. Потенциальная энергия связывания 4ГР с молекулами липида А в 2 раза меньше, чем с молекулами ПОФГ и ПОФЭ. Таким образом, 4ГР предпочтительно мигрирует через слой липида А и встраивается в слой ПОФЭ/ПОФГ. Каждый из аминокислотных остатков белка порина имеет относительно низкую энергию связывания с 4ГР (кривая P). Однако алкильный радикал 4ГР вступает в гидрофобное взаимодействие с экспонированными в стороны мембраны неполярными группами белка порина, что вносит значительный вклад в энергетический баланс системы. Связывание 4ГР с внутримембранными областями поринов создает дополнительное напряжение в мембране и приводит к возникновению полостей между липидами и порином, что при повышении концентрации 4ГР может приводить к сильным структурным перестройкам мембран.
Известно, что гидрофобные соединения могут переводить порины из открытого состояния в закрытое за счет связывания с петлей L6 (P239 I T N K F T N T S G F250) этого белка [22]. Расчеты показали, что 4ГР и его кластеры также могут связываться с петлей L6. Таким образом, 4ГР способен переводить канал порина в закрытое состояние (рис. 4 справа), т.е., скорее всего, путь в клетку через канал порина молекулами 4ГР не задействуется или задействуется слабо.
С помощью метода управляемой молекулярной динамики была определена свободная энергия миграции для молекул 4ГР, проходящих через канал порина и модельный бислой. Параметры моделирования были подобраны таким образом, чтобы гистограммы, показывающие статистическое покрытие конформационного пространства вдоль координаты реакции, не содержали областей низкой заселенности. При анализе энергетических профилей (рис. 5) получены следующие величины барьеров: 19 кДж/моль – через бислой, 32 кДж/моль – через открытый канал порина. Энергетический барьер миграции 4ГР через мембрану оказывается несколько меньшим, чем рассчитанный ранее для другого АР – 5-метилрезорцина – 23 кДж/моль [28]. Полученные данные свидетельствуют о том, что предпочтительный путь миграции 4ГР в клетку лежит непосредственно через бислои, а не каналы поринов.
5. ВЫВОДЫ
В работе продемонстрировано дозозависимое воздействие фенольного липида 4-гексилрезорцина (4ГР) на грамотрицательные бактерии E. coli K12, приводящее к цитодифференцировке и влияющее на морфологию и жизнеспособность клеток. Добавление 4ГР в популяцию бактериальных клеток предстационарной фазы роста в концентрациях 10–5 и 10–6 М повышало их стрессоустойчивость и способность к сохранению жизнеспособности. Внесение более высоких концентраций 4ГР (10–4–2 ⋅ 10–4 М) вызывало переход большей части популяции E. coli в анабиотическое покоящееся состояние, характеризующееся изменением клеточной ультраструктуры. В клеточной культуре E. coli с высокой концентрацией 4ГР (10–3 М) бактериальные клетки теряли жизнеспособность и образовывали так называемые мумифицированные формы [16].
Методами молекулярной динамики, управляемой молекулярной динамики и зонтичной выборки изучены молекулярные механизмы миграции 4ГР в модельных наружной и внутренней мембранах E. coli. Исследовано влияние 4ГР на липиды, липополисахариды, пориновые белки и мембраны в целом. Обнаружено, что 4ГР образует метастабильные комплексы с остатками сахаров О-антигенов и центрального олигосахарида, что способствует продвижению этих молекул к липиду А наружной мембраны E. coli. Кластеры 4ГР адсорбируются на внутренней поверхности наружной и внутренней мембранах в области липидных головок. Одиночные молекулы 4ГР проникают внутрь мембран и располагаются параллельно липидным хвостам, разрыхляя мембрану. Наибольшая концентрация 4ГР наблюдается в местах встраивания пориновых белков в мембрану. Однако миграция через каналы поринов для молекул 4ГР сильно затруднена. Из-за наличия гидрофобного углеводородного участка молекула 4ГР связывается с петлей L6 порина, переводя канал этого белка в закрытое состояние. Величина энергетического барьера свободной энергии миграции 4ГР через бислой составляет 19 кДж/моль, через канал порина – 32 кДж/моль. Таким образом, 4ГР предпочтительно мигрирует непосредственно через бислой, проникая внутрь клетки, где может связываться с внутриклеточными структурами и оказывать комплексное воздействие на клетку.
Расчеты проводились на высокопроизводительной вычислительной системе МВС-10П в Межведомственном суперкомпьютерном центре Российской академии наук (МСЦ РАН). Работа выполнена в рамках государственного задания Минобрнауки России (тема 0082-2019-0015, регистрационные номера AAAA-A20-120031490003-7 и АААА-А19-119021490112-1).
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005.
Windels E.M., Van den Bergh B., Michiels J. // PLoS Pathog. 2020. V. 16. № 5. P. e1008431; https://doi.org/10.1371/journal.ppat.1008431
Nikolaev Y.A., Tutel’yan A.V., Loiko N.G. et al. // PLoS One. 2020. V. 15. № 9. P. e0239147; https://doi.org/10.1371/journal.pone.0239147
Ткаченко А.Г. Молекулярные механизмы стрессорных ответов у микроорганизмов. Екатеринбург: УрО РАН, 2012.
Minsky A., Shimoni E., Frenkiel-Krispin D. // Nat. Rev. Mol. Cell Biol. 2002. V. 3. № 1. P. 50; https://doi.org/10.1038/nrm700
Loiko N., Danilova Y., Moiseenko A. et al. // PLoS One. 2020. V. 15. № 10. P. e0231562; https://doi.org/10.1371/journal.pone.0231562
Эль-Регистан Г.И., Мулюкин A.JI., Николаев Ю.А. и др. // Микробиология. 2006. Т. 75. № 4. С. 446.
Kozubek A., Tyman J.H. // Chem. Rev. 1999. V. 99. № 1. P. 1; https://doi.org/10.1021/cr970464o
Лойко Н.Г., Мулюкин А.Л., Козлова А.Н. и др. // Прикл. биохимия и микробиология. 2009. Т. 45. № 2. С. 181.
Кpупянcкий Ю.Ф., Нокc П.П., Лойко Н.Г. и др. // Биофизика. 2011. Т. 56. № 1. С. 13.
Крупянский Ю.Ф., Абдулнасыров Э.Г., Лойко Н.Г. и др. // Хим. физика. 2012. Т. 31. № 3. С. 60.
Терешкина К.Б., Степанов А.С., Синицын Д.О., Крупянский Ю.Ф. // Хим. физика. 2014. Т. 33. № 7. С. 64; https://doi.org/10.7868/S0207401X14070139
Давыдова О.К., Дерябин Д.Г., Никиян А.И., Эль-Регистан Г.И. // Микробиология. 2005. Т. 74. № 5. С. 616.
Мулюкин А.Л., Сорокин В.В., Лойко Н.Г. и др. // Там же. 2002. Т. 71. № 1. С. 37.
Лойко Н.Г., Кряжевских Н.А., Сузина Н.Е. и др. // Там же. 2011. Т. 80. № 4. С. 465.
Сузина Н.Е., Мулюкин А.Л., Лойко Н.Г. и др. // Там же. 2001. Т. 70. № 5. С. 776.
Levinson W.E. Review of Medical Microbiology and Immunology. 11th ed. N.Y.: McGraw-Hill, Lange- Medical Books, 2010.
Grabowicz M., Silhavy T.J. // Trends Biochem. Sci. 2017. V. 42. № 3. P. 232
Zgurskaya H.I., Löpez C.A., Gnanakaran S. // ACS Infect Dis. 2015. V. 1. № 11. P. 512.
Miller S.I., Salama N.R. // PLoS Biol. 2018. V. 16. № 1. P. e2004935.
Breijyeh Z., Jubeh B., Karaman R. // Molecules. 2020. V. 25. № 6. P. 1340.
Yildiz O., Vinothkumar K.R., Goswami P., Kühlbrandt W. // EMBO J. 2006. V. 25. № 15. P. 3702.
Френкель Д., Смит Б. Принципы компьютерного моделирования молекулярных систем: от алгоритмов к приложениям. Пер. с англ. М.: Науч. мир, 2013.
Крупянский Ю.Ф., Балабаев Н.К., Петрова Т.Е. и др. // Хим. физика. 2014. Т. 33. № 7. С. 7; https://doi.org/10.7868/S0207401X14070048
Moiseenko A., Loiko N., Tereshkina K. et al. // Biochem. Biophys. Res. Commun. 2019. V. 517. № 3. P. 463.
Терешкин Э.В., Терешкина К.Б., Коваленко В.В. и др. // Хим. физика. 2019. Т. 38. № 10. С. 48.
Tereshkin E., Tereshkina K., Loiko N. et al. // J. Biomol. Struct. Dyn. 2019. V. 37. № 10. P. 2600.
Терешкин Э.В., Терешкина К.Б., Крупянский Ю.Ф. // Актуальные вопр. биол. физики и химии. 2020. Т. 5. № 4. С. 619.
Szatmári D., Sárkány P., Kocsis B. et al. // Sci. Rep. 2020. V. 10. P. 12002.
Lee J., Cheng X., Swails J.M. et al. // J. Chem. Theory Comput. 2016. V. 12. P. 405.
Gupta D.S. // J. Bacteriol. 1992. V. 174. № 24. P. 7963.
Cowan S.W., Garavito R.M., Jansonius J.N. et al. // Structure. 1995. V. 3. № 10. P. 1041.
Sohlenkamp C., Geiger O. // FEMS Microbiol. Rev. 2016. V. 40. № 1. P. 133.
Liu D., Reeves P.R. // Microbiology (Reading, Engl.). 1994. V. 140. P. 49.
Granovsky A.A. Firefly version 8.2.0.; http://classic.chem.msu.su/gran/firefly/index.html
Spackman M.A. // J. Comput. Chem. 1996. V. 17. P. 1.
Ivani I., Dans P.D., Noy A. et al. // Nat. Methods. 2015. V. 13. № 1. P. 55.
Hess B., Kutzner C., van der Spoel D., Lindahl E. // J. Chem. Theory Comput. 2008. V. 4. P. 435.
Lee J., Patel D.S., Ståhle J. et al. // Ibid. 2019. V. 15. P. 775.
Jämbeck J.P.M., Lyubartsev A.P. // Ibid. 2012. V. 8. № 8. P. 2938.
Anezo C., de Vries A.H., Holtje H.D. et al. // J. Phys. Chem. B. 2003. V. 107. P. 9424.
Pettersen E.F., Goddard T.D., Huang C.C. et al. // J. Comput. Chem. 2004. V. 25. № 13. P. 1605.
Humphrey W., Dalke A., Schulten K. // J. Mol. Graph. 1996. V. 14. № 1. P. 33.
Kumar S., Rosenberg J. M., Bouzida D. et al. // J. Comput. Chem. 1992. V. 13(2). P. 1011.
Hub J.S., De Groot B.L., Van Der Spoel D. // J. Chem. Theory Comput. 2010. V. 6. P. 3713.
Kucerka N., Holland B.W., Gray C.G. et al. // J. Phys. Chem. B. 2012. V. 116. P. 232.
Nagle J.F., Tristram-Nagle S. // Biochim. Biophys. Acta Rev. Biomembr. 2000. V. 1469. P. 159.
Elmore D.E. // FEBS Lett. 2006. V. 580. P. 144.
Zhao W., Rog T., Gurtovenko A.A. et al. // Biochimie. 2008. V. 90. P. 930.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика




