Химическая физика, 2021, T. 40, № 12, стр. 42-47
Биодеградация смесей полиэтилена низкой плотности с натуральным каучуком в почве
И. А. Варьян 1, 2, *, Н. Н. Колесникова 1, А. А. Попов 1, 2
1 Институт биохимической физики им. Н.М. Эмануэля, Российской академии наук
Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: ivetta.varyan@yandex.ru
Поступила в редакцию 18.12.2020
После доработки 14.04.2021
Принята к публикации 20.04.2021
Аннотация
Исследована биологическая деградация смесевых композитов полиэтилена низкой плотности с натуральным каучуком в почве. Биоразлагаемость композитов проанализирована по изменению массы, внешнего вида, а также химического состава материалов с использованием метода инфракрасной спектроскопии. Анализ изменения ИК-спектров образцов после экспозиции в почве показал уменьшение цис-1,4-двойных связей, образование карбонильных групп, а также функциональных групп, принадлежащих биоматериалу. Полученные результаты согласуются с представлениями об окислительном механизме начального этапа процесса биодеградации натурального каучука и дают информацию о накоплении биомассы в образцах смеси полиэтилена низкой плотности и натурального каучука в зависимости от состава.
ВВЕДЕНИЕ
С ростом объема производства и потребления синтетических полимеров связана проблема накопления их отходов, необходимость утилизации которых становится все более острой проблемой [1, 2]. Значительную часть полимерных отходов представляют изделия из полиэтилена (ПЭ), наиболее широко применяемого в упаковочной отрасли и в сельском хозяйстве [3].
С целью снижения загрязнения окружающей среды полимерными отходами активно развивается направление создания биоразлагаемых смешанных композиций синтетических полимеров с натуральными компонентами, представляющими питательные среды для микроорганизмов. Такие материалы должны иметь достаточно высокий уровень эксплуатационных показателей и в тоже время обладать способностью к биоразложению в определенных условиях.
Для придания материалам на основе полиэтилена способности к биоразложению в естественных условиях часто предлагают использовать натуральные наполнители из возобновляемого сырья и отходов промышленного и сельскохозяйственного производства [4–12]. Эти добавки экономически предпочтительны, однако получаемые материалы обладают существенно более низкими механическими свойствами по сравнению с исходным полимером.
Проводятся исследования смесевых композиций ПЭ с добавлением биоразлагаемых полимеров, таких как полигидроксиалканоаты или полилактид [13–16]. Эти полимерные композиции обладают высокой биоразлагаемостью, но сложности биотехнологического процесса их получения и довольно большие затраты на оборудование обуславливают высокую стоимость материалов на их основе.
Одним из известных биодеградирующих полимеров является натуральный каучук (НК). В природе широко распространены разрушающие его микроорганизмы. Описаны многие бактериальные штаммы, которые способны использовать НК в качестве единственного источника углерода и энергии [17, 18]. Наиболее активными являются актиномицеты.
Первоначально научные исследования были направлены на предотвращение микробной деградации природного полиизопрена. Но в последние годы из-за интенсивного использования и накопления отходов этого материала микробная деградация рассматривается как один из альтернативных путей очистки окружающей среды. Растет количество исследований, направленных на изучение биохимического механизма биологического разложения натурального каучука [19–21].
В настоящей работе натуральный каучук (НК) использовали в качестве природной добавки к ПЭ с целью придания материалу способности разлагаться под воздействием почвенных микроорганизмов. Для определения биоразлагаемости композиций ПЭ/НК разного состава применили лабораторный почвенный тест (ISO 846), имитирующий поведение материалов в естественных почвенных условиях.
Ранее в работе [22] было показано насколько легко при наличии воды НК подвергается биоразложению под воздействием почвенных микроорганизмов. Так, потеря массы пленочного образца НК во влажном лабораторном грунте за 90 сут составила 38 мас.%.
Цель настоящей работы – изучение процесса микробиологического разрушения композиций ПЭ/НК разного состава при экспонировании в почве с применением метода инфракрасной спектроскопии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты
Объектами исследования в работе были образцы: полиэтилен низкой плотности (ПЭ) (марка 15803-020, “Нефтехимсевилен”, Россия), натуральный каучук НК (марка SVR 3L, Вьетнам), а также двойные смеси полиэтилен/натуральный каучук (ПЭ/НК), содержащие 10, 20, 30, 40 и 50 мас.% каучука. Молекулярные характеристики ПЭ Mw = 1.0 ⋅ 105, Mn = 1.5 ⋅ 104, Mw/Mn = 6.7 (гель – проникающая хроматография, растворитель – 1,2,4-трихлорбензол, 140 °C) [10].
Получение образцов
Приготовление композиций осуществляли на лабораторном смесителе типа Брабендер (Россия) в атмосфере технического аргона (ГОСТ 10157-79) при температуре 140 °С и скорости вращения ротора 45 об/мин. Рассчитанную навеску предварительно гранулированного образца НК помещали в смесительную камеру, через 2 мин добавляли взвешенное количество образца ПЭ, перемешивание проводили в течение 8 мин. Атмосфера инертного аргона была использована для уменьшения окисления полимеров. После окончания цикла смешения полученные композиции извлекали из смесительной камеры и охлаждали при комнатной температуре до их полного остывания. Далее измельченный материал помещали на целлофановую подложку и путем прессования на ручном гидравлическом прессе ПРГ-10 с электронным блоком для нагрева плит (Россия) при температуре 140 °С, давлении 7.8 МПа (80 кгс/см2) и с последующей закалкой в воде при температуре (22 ± 2) °С получали пленочные образцы диаметром 8 см и толщиной (180 ± 10) мкм.
Методы исследования
Испытания на биоразрушение выполняли путем инкубирования пленочных образцов в почвенном грунте, подготовленном согласно стандарту ГОСТ 9.060-75, в лабораторных условиях при температуре (22 ± 3) °С. Влагоемкость почвы поддерживали на уровне 60%, что является оптимальным для биологической активности микроорганизмов. Образцы, помещенные в почву, выдерживали в течение различных промежутков времени с последующей очисткой от почвы проточной водой и высушиванием при комнатной температуре до постоянной массы.
Оценку деградации проводили по изменению внешнего вида, массы и химического состава образцов после экспонирования во влажной почве. Изменение окраски и физические дефекты образцов оценивали визуально и с помощью оптического микроскопа Axio Imager Z2m (Carl Zeiss, Германия) при увеличении 50× и 200× в проходящем и отраженном свете. Оценка изменения массы образцов проводилась путем взвешивания с погрешностью ±0.1 мг. Изменения молекулярного состава образцов определяли методом ИК-спектроскопии с использованием ИК-фурье-спектрометра Spectrum 100 (Perkin Elmer, США) при температуре (22 ± 2) °С в проходящем свете в области 4000–450 см–1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Одним из параметров, по которым оценивают биоразлагаемость испытуемых материалов, может быть показатель потери массы после экспонирования в почве [23]. На рис. 1 показаны результаты определения изменения массы образцов ПЭ/НК с разным содержанием НК за определенные интервалы времени экспонирования в почве. Снижение массы наблюдается для всех образцов, однако для образцов с содержанием НК 10 и 20 мас.% изменения незначительны; наибольшую потерю массы показали композиции с 40 и 50 мас.% натурального каучука. За 24 месяца эксперимента образец с 40%-ным содержанием НК потерял 30.5% массы, а с 50%-ным содержанием натурального каучука – 42%. С ростом содержания НК в смеси (начиная с 30 мас.%) повышается его доступность для микроорганизмов вследствие изменения фазовой структуры композиции – перехода от дисперсного распределения фазы НК в матрице ПЭ к взаимопроникающим системам [24].
Рис. 1.
Зависимости изменения массы образцов композитов ПЭ/НК с разным содержанием НК: 0 (1), 10 (2), 20 (3), 30 (4), 40 (5) и 50 мас.% НК (6) от времени экспозиции в почве.
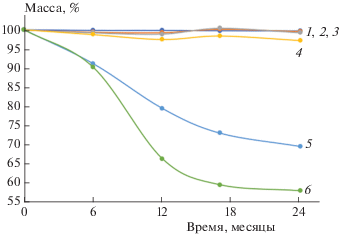
Обращает на себя внимание факт снижения скорости потери массы образцов со временем выдержки в почве. Как отмечено в работе [25], показатель потери массы не всегда может быть однозначным критерием биоразлагаемости материалов в условиях окружающей среды, так как он является суммарным параметром, зависящим как от снижения массы в результате деструкции, так и от прироста биомассы.
Визуально и с помощью оптического микроскопа наблюдали изменения внешнего вида образцов после экспонирования в почве: появление окрашенных участков разной степени интенсивности, изменение рельефных характеристик и целостности (наличие полостей и сквозных отверстий) пленок. Для композиций с содержанием НК 40 и 50 мас.% эти изменения проявляются в наибольшей степени. Представленные на рис. 2 микрофотографии демонстрируют изменения структуры поверхности образца ПЭ/НК состава 50/50 после 24-месячного почвенного теста.
Рис. 2.
Микрофотографии образца композиции ПЭ/НК с содержанием НК 50 мас.% (отраженный свет, увеличение 50× и 200×) до (а, б) и после экспонирования в почве в течение 24 месяцев (в, г).

Контроль изменений химического состава композитов в процессе их деструкции в почве проводили с использованием метода ИК-спектроскопии в проходящем свете. На рис. 3 в качестве примера представлены ИК-спектры поглощения образцов ПЭ/НК состава 70/30 исходного (1) и после экспонирования в грунте в течение 24 месяцев (2). В спектрах исходного образца присутствует полоса поглощения, принадлежащая макромолекулам натурального каучука [20, 26] – полоса при 836 см–1, относящаяся к С–Н-внеплоскостному деформационному колебанию группы С(СНз)=СН, а также полоса при 1663 см–1, относящаяся к валентным колебаниям С=С-групп каучука. Интенсивность этих полос растет пропорционально содержанию НК в образце.
Рис. 3.
ИК-спектры образцов композиции ПЭ/НК с содержанием НК 30 мас.%: 1 – исходного и 2 – после экспонирования в почве в течение 24 месяцев.
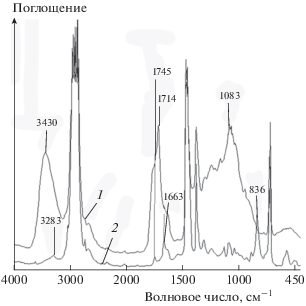
Сравнительный анализ спектров до и после почвенного теста показывает, что через 24 месяца выдержки в почве исчезают полосы, принадлежащие макромолекулам каучука при 836 и 1663 см–1. В то же время после почвенного теста на ИК-спектре образца наблюдаются полосы поглощения в областях 3600–3000, 1770–1500 и 1200–900 см–1, обусловленные появлением в структуре образцов функциональных кислородсодержащих (гидроксильных, карбонильных) групп.
На рис. 4 показаны ИК-спектры образцов композитов с разным содержанием НК после экспонирования в почве в течение 24 месяцев (область 1800–1500 см–1). Как видно из рисунка, спектры образцов с разным содержанием НК, подвергнутых воздействию почвенных микроорганизмов, различаются не только интенсивностью полос поглощения. Для образцов с содержанием каучука до 30 мас.% наблюдается увеличение интенсивности полосы поглощения с максимумом при 1714 см–1, относящейся к колебаниям кетонной, альдегидной и других карбонильных групп, с ростом содержания НК в образцах. Для образцов с 40 и 50%-ным содержанием НК интенсивность полосы уменьшается наряду с появлением полос поглощения в области 1660–1640 и при 1548 см–1. Следует отметить, что эти же образцы в наибольшей степени подверглись структурным изменениям, изменениям окраски и потере массы. Полученные по ИК-спектрам данные можно объяснить с использованием представлений о механизме биодеградации НК.
Рис. 4.
ИК-спектры образцов композиций ПЭ/НК с разным содержанием НК: 0 (1), 10 (2), 20 (3), 30 (4), 40 (5) и 50 мас.% НК (6) после экспонирования в почве в течение 24 месяцев в области 1850–1500 см–1.
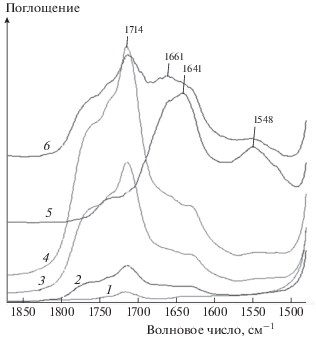
Из-за высокой молекулярной массы каучук не может поглощаться бактериальными клетками и должен быть расщеплен внеклеточно до низкомолекулярного олигомера. Согласно литературным данным [27–30], за первичное воздействие на гидрофобный и водонерастворимый полиизопрен (основной компонент НК) ответственны ферменты оксигеназы. Для микроорганизмов использование каучука в качестве источника углерода и энергии зависит от способности синтезировать расщепляющие каучук оксигеназы и транспортировать эти ферменты из клетки для достижения нерастворимого полимерного субстрата. В результате этого воздействия в аэробных условиях происходит разрыв двойной полиизопреновой связи и образование олигомеров с кетонной и альдегидной группами.
Наблюдаемое нами на спектрах образцов композиций ПЭ/НК после почвенного теста появление полос, принадлежащих карбонильным группам, наряду со снижением интенсивности полос, принадлежащих полиизопрену, свидетельствует об окислительном расщеплении молекул полиизопрена на начальном этапе биодеструкции в почве. Низкомолекулярные промежуточные альдегиды неустойчивы и дополнительно окисляются до кислот, которые дальше участвуют в биосинтезе, обеспечивая рост микроорганизмов.
Полосы поглощения на ИК-спектрах в области 1660–1640 и при 1548 см–1 относятся к валентным колебаниям С=О и деформационным колебаниям N–H и С–N амидных групп. Согласно работам [31, 32], в которых исследовались ИК-спектры биологических образцов, эти полосы поглощения представляют собой принадлежащие бактериям маркерные полосы амидных групп. Появление соответствующих полос на спектрах композиций ПЭ/НК обусловлено накоплением биомассы в образцах при выдерживании их в почве, и позволяет судить о приросте биомассы микроорганизмов в процессе деградации материалов.
На спектрах образцов, после экспонирования в почве, наблюдается интенсивная широкая полоса поглощения в области 1200–900 см–1 (рис. 3). Авторы работы [18], исследовавшие биопленки актиномицетов, разлагающих НК, относят эту полосу к колебаниям C–O-, C–O–C-групп полисахаридов. Наличие полос поглощения полисахаридов подтверждает образование биоматериала в образцах ПЭ/НК, подвергнутых почвенному тесту. Согласно полученным данным, образцы смесевых композиций ПЭ/НК с содержанием НК > 30 мас.%, подвергаются более глубокому окислению, сопровождаемому увеличением биомассы.
ЗАКЛЮЧЕНИЕ
Таким образом, деструкция композитов полиэтилена низкой плотности с добавками натурального каучука в почве сопровождается потерей массы, изменением цветовых характеристик, нарушением целостности пленочных образцов. Применение метода инфракрасной спектроскопии позволяет контролировать использование НК почвенными микроорганизмами посредством ферментативного окисления с разрывом двойных связей и образованием концевых карбонильных групп, а также накопление биоматериала в образцах. Информацию о накоплении биомассы ИК-спектроскопия дает по характерным для функциональных групп белковых соединений спектральным полосам поглощения. Основным эффектом деградации, вызванным микробным усвоением НК в смесях с ПЭ, является увеличение площади поверхности синтетического полимера, что может делать его более восприимчивым к абиотическому окислению.
Работа выполнена с использованием приборов Центра коллективного пользования (ЦКП ИБХФ РАН) “Новые материалы и технологии” и Центра коллективного пользования (ЦКП РЭУ им. Г.В. Плеханова) “Новое оборудование”.
Работа выполнена в рамках бюджетного финансирования по теме госзадания “Полимерное материаловедение: кинетика и механизмы химических и физических процессов в полимерах, композитах и биологических системах” (номер госрегистрации 01201253305).
Список литературы
Prata J.C., Patrício Silva A.L., da Costa J.P., Mouneyrac C., Walker T.R. // Intern. J. Environ. Res. Public Health. 2019. V. 16. Issue 13. P. 2411; https://doi.org/10.3390/ijerph16132411
Потапова Е.В. // Изв. Байкальского гос. ун-та. 2018. Т. 28. № 4. С. 535.
Kyrikou I., Briassoulis D. // J. Polym. Environ. 2007. V. 15. P. 125.
Orhan Y., Buyukgungor H. // Intern. Biodeterior. Biodegrad. 2000. V. 45. P. 49.
Khvatov A.V., Lukanina J.K., Kolesnikova N.N., Popov A.A. // J. Balk. Tribol. Assoc. 2007. V. 13. № 4. P. 527.
Роговина С.З., Ломакин С.М., Алексанян К.В., Прут Э.В. // Хим. физика. 2012. Т. 31. № 6. С. 54.
Pantyukhov P.V., Khvatov A.V., Monakhova T.V., Popov A.A., Kolesnikova N.N. // Intern. Polym. Sci. Technol. 2013. T. 40. № 5. P. T55.
Ayswarya E.P., Francis K.F.V., Renju V.S., Thachil E.T. // Mater. Des. 2012. V. 41. P. 1.
Pantyukhov P.V., Kolesnikova N.N., Popov A.A. // Polym. Compos. 2016. V. 37. P. 1461.
Mastalygina E.E., Shatalova O.V., Kolesnikova N.N., Popov A.A., Krivandin A.V. // Inorg. Mater.: Appl. Res. 2016. V. 7. № 1. P. 58.
Смыковская Р.С., Кузнецова О.П., Волик В.Г., Прут Э.В. // Хим. физика. 2020. Т. 39. № 5. С. 72.
Попов А.А., Зыкова А.К., Масталыгина Е.Е. // Хим. физика. 2020. Т. 39. № 6. С. 71.
Madhu G., Bhunia H., Bajpai P.K. // Polym. Eng. Sci. 2014. V. 54. P. 2155.
Подзорова М.В., Тертышная Ю.В., Попов А.А. // Хим. физика. 2014. Т. 33. № 9. С. 57.
Ol’khov A.A., Iordanskii A.L., Zaikov G.E. // J. Balk. Tribol. Assoc. 2014. V. 20. P. 101.
Тертышная Ю.В., Подзорова М.В. // Прикл. химия. 2018. Т. 91. № 3. С. 377.
Yikmis M., Steinbüchel A. // Appl. Environ. Microbiol. 2012. V. 78. № 13. P. 4543.
Linos A., Berekaa M., Reichelt R., Keller U., Schmitt J. // Appl. Environ. Microbiol. 2000. V. 66. № 4. P. 1639.
Rose K., Steinbuchel A. // Ibid. 2005. V. 71. № 6. P. 2803.
Shah A.A., Hasan F., Shah Z., Kanwal N., Zeb S. // Intern. Biodeterior. Biodegrad. 2013. V. 83. P. 145.
Nanthini J., Sudesh K. // J. Polym. Environ. 2017. V. 25. P. 606.
Колесникова Н.Н., Луканина Ю.К., Попов А.А. // Деформация и разрушение материалов. 2012. № 7. С. 33.
Ермолович О.А.,Макаревич А.В., Гончарова Е.П., Власова Г.М. // Биотехнология. 2005. № 4. С. 47.
Varyan I.A., Kolesnikova N.N., Mastalygina E.E., Popov A.A. // AIP Conf. Proc. 2020. V. 2310. P. 020345; https://doi.org/10.1063/5.0035238
Луканина Ю.К. Дис. … канд. хим. наук. М.: ИБХФ РАН, 2011.
Дехант И., Данц Р., Киммер В., Шмольке Р. Инфракрасная спектроскопия полимеров. Пер. с нем. М.: Химия, 1976.
Birke J., Jendrossek D. // App. Environ. Microbiol. 2014. V. 80. № 16. P. 5012.
Hiessl S., Bose D., Oetermann S., Eggers J., Pietruszka J. et al. // Ibid. № 17. P. 5231.
Braga S.P., Santos A.P., Paganini T., Barbosa D., Epamino G.W. et al. // Braz. J. Microbiol. 2019. V. 50. P. 1051.
Jendrossek D., Birke J. // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 125.
Schmitt J., Flemming H.-C. // Intern. Biodeterior. Biodegrad. 1998. V. 41. P. l.
Maquelin K., Kirschner C., Choo-Smith L.-P., van den Braak N., Endtz H.Ph. et al. // J. Microbiol. Methods. 2002. V. 51. P. 255.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


