Химическая физика, 2021, T. 40, № 2, стр. 84-90
Модификация озоном структурированных на наноуровне пленок диоксида титана для сенсибилизированных красителем солнечных элементов
О. В. Алексеева 1, С. С. Козлов 1, М. Л. Константинова 1, О. И. Шевалеевский 1, *
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: shevale2006@yahoo.com
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Изучена кинетика реакции озона с диоксидом титана. Структура и оптические характеристики структурированных на наноуровне тонких слоев диоксида титана (TiO2), обработанных озоно-кислородной смесью с различной концентрацией озона, исследованы методами оптической и инфракрасной спектроскопии. Показано, что обработка озоном увеличивает адсорбцию рутениевого красителя (N719) в объеме структурированного на наноуровне слоя TiO2. Обработанные озоном слои TiO2 были использованы в качестве фотоэлектродов для конструирования сенсибилизированных солнечных элементов (СЭ). Исследование фотовольтаических параметров сенсибилизированных СЭ при стандартном освещении (спектр AM 1.5g, уровень освещенности – 1000 Вт/м2) показало, что модификация TiO2 озоном приводит к увеличению эффективности преобразования солнечной энергии в электрическую с 7.5 до 8.2%.
ВВЕДЕНИЕ
На сегодняшний день одними из основных задач солнечной фотовольтаики являются поиск и создание новых видов солнечных элементов (СЭ), которые могли бы составить конкуренцию традиционным фотопреобразователям на основе кремния, обладая при этом сравнимой эффективностью при более дешевой технологии изготовления [1, 2]. В этом отношении особый интерес представляют сенсибилизированные красителем СЭ (dye-sensitized solar сells (DSCs)) на основе структурированных на наноуровне слоев диоксида титана (TiO2), которые в последние два десятилетия стали предметом многочисленных поисковых исследований [3]. Основные преимущества DSCs по сравнению с наиболее распространенными СЭ на основе кремния – относительно простая технология изготовления, низкая себестоимость, а также их способность к эффективной работе в условиях низкой и диффузной освещенности [4–7]. Рекордная эффективность DSCs в условиях стандартного освещения (спектр AM 1.5g, уровень освещенности – 1000 Вт/м2) составляет ~13% [8], что уступает эффективности традиционных СЭ на основе кристаллического кремния [9, 10].
Для повышения эффективности DSCs используются различные методы модификации поверхности слоев диоксида титана. Среди наиболее распространенных методов модификации следует отметить следующие: высокоэффективная очистка поверхности и удаление органических остатков в плазме [11, 12], длительная обработка кислородом, ультрафиолетовое (УФ) облучение [13], погружение в кислоты и щелочи, обработка перикисными соединениями [14, 15]. Например, в случае обработки TiO2 пероксидом наблюдалось улучшение покрытия структурированных на наноуровне слоев диоксида титана молекулами красителя [14]. Также было показано, что одним из наиболее эффективных методов предобработки поверхности металлооксидов (TiO2, SnO2, ZnO) является комбинированная обработка УФ-излучением и озоном (UV-ozone treatment) [16]. В настоящее время данный способ применяется в основном в качестве промежуточной стадии очистки тонких слоев TiO2 и SnO2 при создании сенсибилизированных и перовскитных СЭ [17]. Известно, что такая обработка приводит к значительному улучшению фотоэлектрических характеристик СЭ [18]. Однако в условиях комбинированной обработки “УФ + озон” не представляется возможным контролировать концентрацию озона (озон генерируется из воздуха в условиях УФ-облучения, наблюдается сильное повышение температуры) [19], также не ясен вклад каждого из факторов в наблюдаемые изменения фотоэлектрических характеристик СЭ. Обработка озоном структурированных на наноуровне слоев диоксида титана в контролируемых условиях (концентрация O3, температура) [20, 21] в отсутствие УФ-обработки является перспективным подходом для создания высокоэффективных сенсибилизированных СЭ, поскольку озон инициирует формирование специфических групп на поверхности слоя TiO2, которые способствуют увеличению сорбции красителя и, как следствие, улучшают фотоэлектрические параметры СЭ [22].
В данной работе были исследованы основные процессы, происходящие в нанесенных на стеклянные подложки тонких слоях диоксида титана (TiO2) под действием озона. Исследована кинетика реакции озона с диоксидом титана. Выявлено, что она протекает в диффузионно-кинетическом режиме. Исследованы процессы адсорбции красителя в структурированных на наноуровне слоях TiO2 и установлены оптимальные параметры процесса обработки диоксида титана озоном. Определены фотоэлектрические характеристики сенсибилизированных СЭ на основе обработанных озоном слоев TiO2. Показана возможность регулирования и оптимизации процессов озонолиза тонких слоев TiO2 с целью повышения эффективности сенсибилизированных красителем СЭ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Конструирование сенсибилизированных СЭ
Для создания фотопреобразователей типа DSCs в качестве подложек были использованы стекла TEC-8 марки Pilkington с проводящим слоем FTO на основе допированного фтором оксида олова (сопротивление ~8 Ом/см2). Подложки размером 2 × 2 см были предварительно очищены в ультразвуковой ванне последовательно в растворах детергента, этанола и ацетона, после чего они прокаливались при 500 °С в течение 30 мин. Далее подложки обрабатывались в 40 мМ водном растворе TiCl4 в течение 30 мин при 70 °С для образования компактного буферного слоя TiO2. После обработки они промывались водой и этанолом и прокаливались при 500 °С в течение 30 мин.
На следующими этапе, следуя описанной ранее методике [23], на подложки последовательно наносились структурированные на наноуровне слои TiO2 двух типов – сначала прозрачный слой толщиной ~10 мкм на основе наночастиц размером 30–40 нм, а потом рассеивающий слой толщиной ~5 мкм на основе наночастиц размером 300–400 нм. Общая толщина фотоэлектрода составляла около 15 мкм. Затем фотоэлектроды подвергались повторной обработке в 40 мМ водном растворе TiCl4 и последующему отжигу. Далее проводилась обработка полученных фотоэлектродов озоном высокой концентрации в закрытом реакторе (см. ниже).
Процесс сенсибилизации фотоэлектродов проводился в течение 24 ч в 0.3 мМ растворе красителя N719 производства компании Sigma-Aldrich (USA) в смеси ацетонитрила и трет-бутилового спирта в соотношении 1 : 1 [24]. В качестве противоэлектрода использовалась стеклянная проводящая подложка, на которую наносился раствор H2PtCl6 (2 мг Pt в 1 мл этанола) с последующим отжигом при 400 °C в течение 15 мин. При окончательной сборке СЭ сенсибилизированный фотоэлектрод и противоэлектрод накладывались друг на друга с последующей герметизацией по периметру с помощью пленки марки Surlin 1702. Пространство между электродами через отверстия в противоэлектроде заполнялось электролитом, представляющим собой раствор 0.6 M йодида 1‑бутил-3-метилимидазола, 0.03 M I2, 0.1 М гуанидин тиоцианата и 0.5 M 4-терт-бутилпиридина в смеси валеронитрила и ацетонитрила в соотношении 85/15. В результате была приготовлена серия СЭ типа DSCs рабочей площадью ~0.25 см2.
Озонолиз
Все эксперименты по обработке озоном фотоэлектродов на основе диоксида титана проводились с использованием прибора MedOzone-UOTA-60. Озон получали при пропускании струи кислорода через зону электрического разряда (4 кВ) при скорости потока 10–100 мл/мин [27]. Концентрацию озона определяли спектрофотометрически при λ = 254 нм [25, 26]. Озонирование проводили при комнатной температуре и влажности в трехгорлом реакторе при трех различных концентрациях озона: 20 мг/л (4.16 ⋅ 10–4 моль/л), 40 мг/л (8.3 ⋅ 10–4 моль/л), 60 мг/л (1.25 ⋅ 10–3 моль/л).
Скорость и глубину реакции оценивали по разнице между концентрациями озона на входе ([O3]0) и выходе ([O3]г) из реактора: Δ[O3] = [O3]0 – [О3]г, при концентрации озона [O3]0 = 3.65 ⋅ 10–7 моль/л и скорости подачи озоно-кислородной смеси Vг = = 0.1 л/мин [27].
Методы исследования
Количество красителя N719, поглощенного структурированными на наноуровне слоями TiO2, определяли путем десорбции красителя в 0.1 М водном растворе NaOH. Концентрацию десорбированного красителя определяли с использованием спектрофотометрического метода [28].
Исследование слоев TiO2 методом ИК-фурье-спектроскопии проводили на установке FTIR Spectrum Two фирмы “PerkinElmer, Inc.” (USA) с модифицированной приставкой DRIFT (Diffuse Reflectance Infrared Fourier Transform Spectroscopy), использование которой позволяет проводить измерения твердых образцов [29, 30]. Вместо стандартной чашки для проб DRIFT использовались небольшие столики из нержавеющей стали диаметром 13 мм. При этом плоская поверхность столиков действует как зеркало, а инфракрасный луч проникает внутрь образца. Структурированные на наноуровне слои TiO2 соскребались со стеклянной подложки непосредственно перед измерением и помещались на поверхность столика. Положение держателя образца было оптимизировано перед измерением с использованием чистого металлического валика. Инфракрасные спектры записывались в диапазоне 4000–400 см–1 c шагом 4 см–1 и усреднением 16 последовательных сканов.
Фотоэлектрические параметры сконструированных сенсибилизированных СЭ измерялись в стандартных условиях освещения (АМ 1.5g, 1000 Вт/м2) с использованием имитатора солнечного излучения Abet 10500 компании Abet Technologies (USA). Вольт-амперные характеристики записывались с помощью измерительной системы Keithley 4200-SCS (Keithley, USA). Спектры внешней квантовой эффективности СЭ (IPCE) в диапазоне длин волн 300–800 нм были получены с использованием автоматизированной установки QEX10 производства компании PV Measurements (USA).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Использование озона в контролируемых условиях для создания высокоэффективных сенсибилизированных СЭ предполагает исследование кинетики реакции озона с диоксидом титана в тонких слоях. Реакции озона с образцами в тонких слоях отличаются от аналогичных реакций в растворе или на поверхности твердых образцов [31–33]. В настоящей работе диоксид титана имеет мезопористую структуру и движение газа (озона) наблюдается не только вдоль поверхности, но и внутрь образца. Варьирование толщин наносимых на стеклянную подложку слоев диоксида титана и концентраций подаваемого в реактор озона позволяет найти оптимальный режим обработки.
Подготовленные образцы в виде стеклянных подложек с нанесенными на них структурированными на наноуровне слоями TiO2 помещались в реактор, заполненный озоно-кислородной смесью, с непрерывной подачей газа. Изучение кинетики реакции озона с тонкими слоями невозможно при больших концентрациях озона. При концентрации озона 20 мг/л (4.16 ⋅ 10–4 моль/л) реакция на поверхности любых образцов протекает с очень большой скоростью и анализ кинетики затруднен, поэтому опыты проводили при концентрации озона [O3]0 = 3.65 ⋅ 10–7 моль/л и Vг = 0.1 л/мин. Толщины слоев TiO2 составляли 15, 25, 30 и 35 мкм.
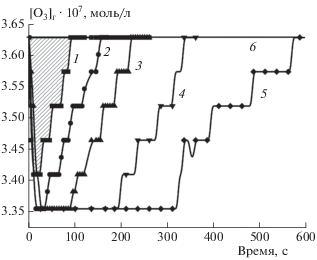
На рис. 1 представлены кинетические кривые изменения во времени концентрации озона на входе и выходе из пустого реактора и реактора с образцами TiO2. Было показано, что реакция озона со структурированным на наноуровне слоем диоксида титана протекает относительно быстро. Площадь, ограниченная кривыми 1 и 6 (заштрихованная область), отражает потери озона на заполнение пустого реактора, а площадь, ограниченная кривыми 2 и 6, 3 и 6, 4 и 6, 5 и 6, – количество озона, затраченное на реакцию с образцами TiO2 различной толщины плюс потери на заполнение реактора. Разница между площадями соответствует затратам озона на химический процесс. Как видно из рис. 1, при проведении реакции озоно-кислородной смеси с TiO2 в нормальных условиях увеличение толщины слоя диоксида титана приводит к пропорциональному увеличению расхода озона. Для любой произвольной точки кинетических кривых поглощения озона диоксидом титана наблюдаемое изменение Δ[О3] связано с изменением константы скорости и количеством окисленных групп в образце диоксида титана:
Рис. 1.
Кинетические кривые изменения концентрации озона на выходе из пустого реактора и реактора с образцами TiO2. Кривая 1 – пустой реактор; образцы TiO2 толщиной: 2 – 15 мкм, 3 – 25 мкм, 4 – 30 мкм, 5 – 35 мкм; 6 – концентрация озона на входе в реактор. Площадь под кривыми 1 и 6 отражает потери озона на заполнение пустого реактора.
В условиях проведения опытов реализовывался стационарно-динамический режим, при котором время контакта (τ) озона со слоем TiO2 можно сопоставить с истинным временем реакции. Численные значения удельной скорости реакции озона с диоксидом титана $({{w}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}})$ для любых моментов времени протекания процесса можно найти, используя разработанную ранее кинетическую модель, которая отражает особенности топохимии исследуемых процессов [31]. Величина ${{w}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ определяется следующим уравнением:
(1)
${{w}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}} = {{ - \ln \left( {{{1 - \Delta {{{\left[ {{{{\text{O}}}_{3}}} \right]}}_{\tau }}} \mathord{\left/ {\vphantom {{1 - \Delta {{{\left[ {{{{\text{O}}}_{3}}} \right]}}_{\tau }}} {{{{\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}_{0}}}}} \right. \kern-0em} {{{{\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}_{0}}}}} \right)} \mathord{\left/ {\vphantom {{ - \ln \left( {{{1 - \Delta {{{\left[ {{{{\text{O}}}_{3}}} \right]}}_{\tau }}} \mathord{\left/ {\vphantom {{1 - \Delta {{{\left[ {{{{\text{O}}}_{3}}} \right]}}_{\tau }}} {{{{\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}_{0}}}}} \right. \kern-0em} {{{{\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}_{0}}}}} \right)} {\left( {\tau \alpha {{{\left[ {{\text{Ti}}{{{\text{O}}}_{2}}} \right]}}_{0}}\gamma } \right)}}} \right. \kern-0em} {\left( {\tau \alpha {{{\left[ {{\text{Ti}}{{{\text{O}}}_{2}}} \right]}}_{0}}\gamma } \right)}},$где γ – объем слоя, α = [O3]0/[O3]г, [TiO2]0 – исходное количество диоксида титана на поверхности подложки [31].
Результаты расчета ${{w}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ для образцов TiO2 различной толщины приведены на рис. 2. Было показано, что в начале процесса реакция идет с большой скоростью, но в дальнейшем последняя уменьшается (стрелка) по мере расходования озона и накопления продуктов реакции. При увеличении толщины слоя диоксида титана до 35 мкм наблюдается уменьшение удельной скорости реакции озона с TiO2. Скорость реакции начинает определяться процессом диффузии озона в подповерхностные слои образца и сквозь барьерный слой продуктов реакции к нижележащим слоям диоксида титана, и процесс, протекающий вначале в кинетическом режиме, плавно переходит в диффузионно-кинетический.
Рис. 2.
Зависимость удельной скорости реакции озона с образцами TiO2 различной толщины (1 – 15 мкм, 2 – 25 мкм, 3 – 30 мкм, 4 – 35 мкм) от количества прореагировавшего вещества.
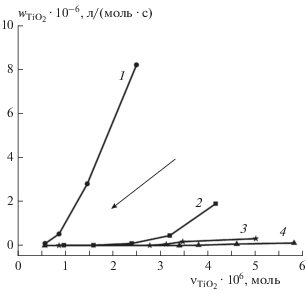
Максимальная удельная скорость процесса (крайние правые точки на рис. 2) соответствует эффективной константе скорости реакции ${{k}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ и составляет 8.2 ⋅ 106, 1.9 ⋅ 106, 3.16 ⋅ 105 и 1.19 ⋅ ⋅ 105 л/(моль ⋅ с) для слоя TiO2 толщиной 15, 25, 30 и 35 мкм соответственно. Топохимические эффекты, полученные для реакции озона со структурированным на наноуровне слоем TiO2, сопоставимы с данными по реакциям озона на поверхности полимерных тонких пленок или с образцами, имеющими развитую поверхность [20, 31]. Таким образом, толщина слоя диоксида титана ~15 мкм является оптимальной для модификации озоном.
Исследование озонированных пленок TiO2 методом ИК-спектроскопии показало, что основные характеристические полосы для контрольного образца TiO2 наблюдались в областях 3696 и 3440 см–1 (поверхностно-адсорбированная вода), 1639 см–1 (гидроксильная группа Ti–OН), 1463 см–1 (растяжение связей Ti–O–Ti). После обработки озоном слоя TiO2 наблюдается уменьшение полос поглощения при 3440 и 3693 см–1, а также полосы при 1635 см–1, что говорит о сокращении количества OН-групп на поверхности TiO2. Появление полосы при 1249 см–1 говорит об образовании перекисных групп (также в виде свободной перекиси, находящейся в порах) в результате обработки озоном пленок TiO2 [32, 33].
Важным параметром, влияющим на эффективность сенсибилизированных СЭ, является количество красителя, адсорбированного на поверхности диоксида титана. На рис. 3 приведены УФ-спектры поглощения десорбированного красителя N719 для контрольного образца TiO2 и для слоев TiO2, озонированных при трех различных концентрациях озона: 20, 40 и 60 мг/л (время обработки – 10 мин). Спектры показывают типичные полосы поглощения красителя N719 около 375 и 510 нм.
Рис. 3.
УФ-спектры поглощения красителя N719, десорбированного из исходного образца (1) диоксида титана и образцов TiO2, обработанных озоном в концентрации 20 (2), 40 (3) и 60 мг/л (4).
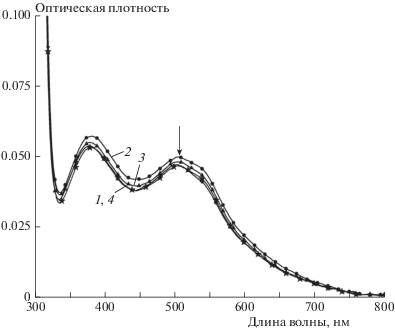
Концентрация адсорбированного красителя рассчитывалась на основе закона Ламберта–Бера: A = εlc, где A – оптическая плотность, ε – молярный коэффициент экстинкции при 515 нм (ε = = 12 406 (M ⋅ см)–1), l – длина пути светового пучка, c – концентрация красителя. Количество адсорбированного на единицу активной площади красителя приведено в табл. 1.
Таблица 1.
Адсорбция красителя N719 фотоэлектродами на основе диоксида титана
| Образец | Количество адсорбированного красителя N719, 10–8 моль/см2 |
|---|---|
| TiO2 | 7.2 |
| TiO2 + 20 мг/л О3 | 7.7 |
| TiO2 + 40 мг/л О3 | 7.4 |
| TiO2 + 60 мг/л О3 | 7.4 |
Полученные результаты свидетельствуют, что обработка озоном в концентрации 20 мг/л приводит к увеличению адсорбции красителя слоем TiO2 (7.7 ⋅ 10–8 моль/см2) по сравнению с контрольным образцом (7.2 ⋅ 10–8 моль/см2). Дальнейшее увеличение концентрации озона приводит к снижению сорбции молекул красителя структурированным на наноуровне слоем диоксида титана. Присутствие свободной перекиси внутри слоя TiO2 также оказывает влияние на сорбционную способность образца за счет увеличения количества доступных –ОН-групп. Краситель адсорбируется в результате взаимодействия карбоксильной группы красителя N719 с OH-группами на поверхности диоксида титана. При увеличении концентрации озона количество групп сокращается в связи с разрушением связи Ti–O–Ti и образованием на поверхности групп Ti–O2H–. Перекисные группы должны способствовать прониканию красителя в образец при больших концентрациях обработки. Однако подобная картина наблюдается только при обработке озоном в концентрации 20 мг/л, а в случае больших концентраций сорбция падает, но не до исходных значений. Скорее всего, это происходит из-за обезвоживания образцов озоном в концентрациях выше 20 мг/л. Большая часть реакционно-способных групп удаляется с поверхности, что может продемонстрировать следующий механизм:
Таким образом, обработка структурированных на наноуровне слоев TiO2 озоном в концентрации 20 мг/л будет оптимальной для улучшения адсорбции красителя слоем диоксида титана и дальнейшего создания сенсибилизированных СЭ на основе озонированных фотоэлектродов.
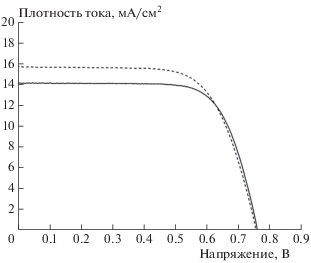
Для демонстрации влияния озонирования на фотоэлектрические характеристики сенсибилизированных СЭ была приготовлена серия образцов СЭ на основе мезоскопических слоев TiO2, озонированных при [O3] = 20 мг/л. Были проведены сравнительные исследования фотоэлектрических параметров сенсибилизированных СЭ, изготовленных на основе необработанных и обработанных озоном фотоэлектродов. На рис. 4 и 5 приведены соответствующие спектры IPCE и вольт-амперные характеристики СЭ. Видно, что для СЭ на основе озонированных фотоэлектродов наблюдается увеличение плотности тока короткого замыкания (JSC) и значений внешней квантовой эффективности. Полученные результаты хорошо объясняются увеличением сорбции красителя N719 в результате обработки мезоскопических фотоэлектродов озоном при концентрации последнего 20 мг/л.
Рис. 4.
Сравнительный вид спектральных характеристик внешней квантовой эффективности сенсибилизированных СЭ на основе стандартного (сплошная кривая) и обработанного озоном (штриховая) фотоэлектродов.
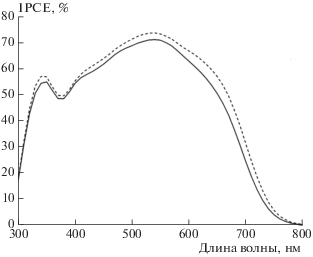
Рис. 5.
Вольт-амперные характеристики для сенсибилизированных СЭ на основе стандартного (сплошная кривая) и обработанного озоном (штриховая) фотоэлектродов.
Значения фотоэлектрических параметров исследованных сенсибилизированных СЭ приведены в табл. 2. Коэффициент полезного действия фотопреобразования (η) рассчитывался по известной формуле:
Таблица 2.
Значения фотоэлектрических параметров сенсибилизированных СЭ на основе структурированных на наноуровне слоев TiO2 (контрольный образец и после обработки озоном с концентрацией 20 мг/л)
| Образец | JSC, мА/см2 | VOC, В | FF | КПД, % |
|---|---|---|---|---|
| TiO2 | 14.1 | 0.76 | 0.72 | 7.7 |
| TiO2 + O3 (20 мг/л) | 15.7 | 0.755 | 0.69 | 8.2 |
где JSC – плотность тока короткого замыкания, VOC – напряжение холостого хода, FF – коэффициент заполнения, Pin – интенсивность освещения (1000 Вт/м2).
Как видно из табл. 2, обработка озоном в концентрации 20 мг/л приводит к увеличению КПД сенсибилизированных СЭ до 8.2% по сравнению с контрольным образцом (7.7%). Таким образом, показано, что обработка мезоскопических слоев TiO2 озоном высокой концентрации является эффективным способом увеличения КПД сенсибилизированных красителем СЭ на основе диоксида титана.
ЗАКЛЮЧЕНИЕ
Изучена кинетика реакции озона с диоксидом титана в структурированных на наноуровне слоях TiO2 различной толщины. Показано, что реакция озона с TiO2 протекает в диффузионно-кинетическом режиме. Определены численные значения эффективных констант скоростей и удельных скоростей процесса озонирования. Установлена оптимальная концентрация озона в процессе обработки (20 мг/л), необходимая для улучшения адсорбции красителя N719 структурированным на наноуровне слоем диоксида титана. Модифицированные озоном слои TiO2 были использованы в качестве фотоэлектродов для конструирования сенсибилизированных красителем СЭ. Проведены сравнительные исследования фотоэлектрических параметров СЭ на основе стандартного и обработанного озоном фотоэлектродов. Показано, что обработка озоном в концентрации 20 мг/л увеличивает КПД сенсибилизированных СЭ на 6%.
Работа выполнена при финансовой поддержке Министерством науки и высшего образования РФ в рамках темы № 01201253312 и частично поддержана грантом Российского фонда фундаментальных исследований № 19-08-01042.
Список литературы
Green M.A., Emery K., Hishikawa Y. et al. // Prog. Photovolt.: Res. Appl. 2017. V. 25. № 7. P. 668.
Chu S., Majumdar A. // Nature. 2012. V. 488. № 7411. P. 294.
Gratzel M. // J. Photochem. Photobiol., C. Rev. 2003. V. 4. № 2. P. 145.
Hardin B.E., Snaith H.J., McGehee M.D. // Nat. Photon. 2012. V. 6. № 3. P. 162.
Reddy K.G., Deepak T.G., Anjusree G.S. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. № 15. P. 6838.
Vildanova M.F., Nikolskaia A.B., Kozlov S.S. et al. // J. Phys.: Conf. Ser. 2015. V. 643. P. 012106.
Шевалеевский О.И., Никольская А.Б., Вильданова М.Ф., Козлов С.С., Алексеева О.В., Вишнёв А.А., Ларина Л.Л. // Хим. физика. 2018. Т. 37. № 8. С. 36.
Mathew S., Yella A., Gao P. et al. // Nat. Chem. 2014. V. 6. № 3. P. 242.
Yoshikawa K., Kawasaki H., Yoshida W. et al. // Nat. Energy. 2017. V. 2. № 5. P. 17032.
Battaglia C., Cuevas A., Wolf S.D. // Energy Environ. Sci. 2016. V. 9. P. 1552.
Park K.-H., Dhayal M. // Electrochem. Commun. 2009. V. 11. № 1. P. 75.
Kim Y., Yoo B.J., Vittal R. et al. // J. Power Sources. 2008. V. 175. № 2. P. 914.
Chu Y., Cai H., Huang L. et al. // Phys. Status Solidi A. 2019. V. 216. № 6. P. 1800669.
Subramanian A., Wang H.-W. // Appl. Surf. Sci. 2012. V. 258. № 20. P. 7833.
Sireesha P., Sun W.G., Su C. et al. // J. Nanosci. Nanotechnol. 2017. V. 17. № 1. P. 354.
Saekow S., Maiakgree W., Jarernboon W. et al. // J. Non-Cryst. Solids. 2012. V. 358. P. 2496.
Méndez P. F., Muhammed S.K.M., Barea E.M. et al. // Solar RRL. 2019. V. 3. № 9. P. 1900191.
Kleine A., Hilleringmann U. // Renewable Energies & Power Quality J. 2016. № 14. P. 102.
Лунин В.В., Попович М.П., Ткаченко С.Н. Физическая химия озона. М.: Изд-во МГУ, 1998.
Alekseeva O., Konstantinova M., Rasumovskii S. // Heteroatom Chem. 2008. V.19. № 7. P. 661.
Valdés H., Sánchez-Polo M., Rivera-Utrilla J. et al. // Langmuir. 2002. V. 18. № 6. P. 2111.
Jang I., Song K., Park J.-H. et al. // Bull. Korean Chem. Soc. 2013. V. 34. № 10. P. 2883.
Ito S., Shen P., Comte P. et al. // Prog. Photovoltaics Res. Appl. 2007. V. 15. № 7. P. 603.
Kozlov S., Nikolskaia A., Larina L., Vildanova M., Vishnev A., Shevaleevskiy O. // Phys. Status Solidi A. 2016. V. 213. № 7. P. 1801.
Alekseeva O.V., Konstantinova M.L., Rasumovskii S. et al. // Oxid. Commun. 2009. V. 32. № 3. 537.
Разумовский С.Д., Гриневич Т.В., Коровина Г.В. // Хим. физика. 2011. Т. 30. № 10. С. 54.
Alekseeva O.V., Rasumovskii S.D. // Kinet. Catal. 2006. V. 47. № 4. P. 533.
Hwang K.-J., Shim W.-G., Kim Y. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 21974.
Shchegolikhin A.N., Lazareva O.L. // Intern. J. Vib. Spect. 1997. V. 1. № 4. P. 95.
Shchegolikhin A.N., Lazareva O.L. // Ibid. 1997. V. 1. № 4. P. 26.
Alekseeva O.V., Konstantinova M.L., Rasumovskii S.D. // Polym. Sci. Ser. B. V. 46. № 9. P. 301.
Кумпаненко И.В., Рощин А.В., Иванова Н.А. и др. // Хим. физика. 2018. Т. 37. № 2. С. 25.
Tai J.Y., Leong K.H., Saravanan P. et al. // J. Mater. Sci. 2017. V. 52. № 19. P. 11630.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


