Химическая физика, 2021, T. 40, № 2, стр. 74-83
Некоторые структурные и термодинамические характеристики кукурузных крахмалов в зависимости от генотипа растений
Л. А. Вассерман 1, 2, *, А. Г. Филатова 2, Э. Б. Хатефов 3, В. Г. Гольдштейн 4, И. Г. Плащина 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
3 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова
Санкт-Петербург, Россия
4 Всероссийский научно-исследовательский институт крахмалопродуктов – филиал ФГБНУ
“Федеральный научный центр им. В.М. Горбатова” Российской академии наук
пос. Красково, Московская обл., Россия
* E-mail: lwasserma@mail.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Приведены результаты исследований, посвященных анализу морфологии, термодинамическим и физико-химическим свойствам крахмалов кукурузы, экстрагированных из разных ее подвидов, относящихся к различным генотипам. Среди исследованных крахмалов кукурузы выделено четыре группы крахмалов, относящихся к генотипам wx, ae, su и смешанного типа. Установлено, что во всех исследованных крахмалах присутствуют гранулы нерегулярной и овальной формы, доля которых в разных генотипах различна. Крахмалы su-генотипа обладают самыми мелкими гранулами по сравнению с крахмалами wx- и ae-генотипов. Установлено, что увеличение содержания амилозы в кукурузных крахмалах wx- и ае-генотипов сопровождается накоплением дефектных структур в исследуемых крахмалах, что отражается в понижении термодинамических параметров их плавления. Термодинамические параметры диссоциации (температура и энтальпия) амилозо-липидных комплексов для генотипов ae и wx кукурузных крахмалов ниже, чем в случае генотипа su. Толщины кристаллических ламеллей для всех исследуемых генотипов крахмалов имеют близкие значения и практически не зависят от содержания в них амилозы. Динамическая вязкость гелей изученных крахмалов уменьшается при увеличении содержания в них амилозы и не зависит от генотипа растений, из которого экстрагирован крахмал.
ВВЕДЕНИЕ
Крахмал – основной углеводный компонент многих растений, который необходимо детально исследовать для понимания его биохимических и функциональных свойств. Основными источниками крахмалов являются зерновые, клубневые (например, картофель или тапиока) и бобовые культуры, а также некоторые незрелые фрукты, такие как бананы или манго [1]. Крахмалы разного ботанического происхождения, а также их модификаты широко применяются в различных областях промышленности как загустители, стабилизирующие и гелеобразующие агенты для производства продуктов пищевого, технического и фармацевтического назначений, а также в качестве компонентов новых композиционных и биоразлагаемых материалов [2–6]. Известно, что крахмалы состоят из двух полисахаридов – линейной амилозы и разветвленного амилопектина. Оба полисахарида являются гомополимерами α-D-глюкопиранозы (глюкозы), но при этом различаются по молекулярной массе и физико-химическим свойствам. Линейная макромолекула амилозы состоит из остатков глюкозы, соединенных гликозидными связями α-(1→4). Макромолекула амилопектина образуется из разветвленных цепочек остатков глюкозы, соединенных гликозидными связями α-(1→4), а в точках разветвления цепи – α-(1→6). Структура амилопектина трехмерна, его ветви расположены во всех направлениях и придают молекуле сферическую форму [7, 8]. Особенности строения и соотношение двух основных полисахаридов в крахмалах определяют их функциональные и физико-химические свойства.
Показано, что на физико-химические и термодинамические свойства крахмалов влияют как условия культивирования растений, из которых экстрагируется крахмал, так и присутствие тех или иных генов, участвующих в биосинтезе полисахаридов крахмала [9, 10]. Изменения активности ферментов, участвующих в процессе биосинтеза полисахаридов крахмала, определяют в конечном счете соотношение основных полисахаридов крахмала и их физико-химические свойства. Существует несколько синтаз, ответственных за биосинтез крахмала и гликогена: крахмалсинтаза (SS), гликогенсинтаза (GS) и крахмалфосфорилаза (SP), принадлежащие к суперсемейству GT-B (CL0113) [11]. У растений обнаружено пять независимо консервативных крахмалсинтаз: GBSSI, SSI, SSII, SSIII и SSIV [11, 12]. Синтаза GBSS является ключевой для синтеза амилозы [13], тогда как мутации в SSIIb и SSIII изменяют уровни содержания амилопектина [14]. В эндосперме зерновых экспрессируется три формы ферментов, способствующих ветвлению молекулы крахмала: фермент I (SBEI), фермент IIa (SBEIIa) и фермент IIb (SBEIIb) [15]. К таким генам относится ген waxy (wx), который характеризуется отсутствием GBSS, что проявляется в полном отсутствии амилозы и в накоплении только амилопектина, ген amylose extender (ae) – генотип с повреждениями гена SBEIIb, которые способствуют накоплению слаборазветвленных полисахаридов, увеличивающих содержание амилозы в крахмале [16, 17].
Кукуруза с содержанием очень высокого уровня амилозы (>90%) была получена при значительном снижении активности фермента SBEI наравне с почти полным подавлением активности фермента SBEII [18]. Такие мутанты по ферменту SBEIIb характеризуются аномальной морфологией крахмальных гранул эндосперма с повышенным содержанием амилозы, что сопровождается повышением температуры плавления гранул крахмала. Кроме того, в этом генотипе обнаруживается значительная часть вещества промежуточного типа между амилозой и амилопектином [19]. Генотип sugary (su) с сахарными синтазами SS (sucrose sinthase), образующими фитогликоген как предшественник амилопектина, характеризуется дефицитом таких ферментов, как изоамилаза и пуллуланаза, нарушающих ветвление крахмалов. Активность такого фермента высока в сахарном сорго и сахарной кукурузе, о чем свидетельствует высокое содержание в них сахаров и пониженное – крахмала. Зерна этих растений, как правило, сморщенные [20, 21].
Образцы сортов кукурузы, находящиеся в коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова, относятся к различным генотипам и поэтому могут иметь широкое практическое применение в различных областях промышленности. В связи с этим цель данного исследования состояла в оценке влияния генов wx, ae, su на структурные и термодинамические свойства крахмалов, экстрагированных из кукурузного зерна растений, относящихся к различным подвидам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МАТЕРИАЛЫ
Размножение семенного материала кукурузы для исследований проводили в Кабардино-Балкарском НИИСХ в предгорной зоне в 2017 г. Сорта и гибриды размножали под бумажными изоляторами методом перекрестного опыления в пределах популяции на делянке. Уборка проводилась вручную после полного созревания початков. Семенной материал кукурузы был представлен восемью образцами нетрансгенных подвидов кремнистой, зубовидной и сахарной кукурузы из мировой коллекции ВИР, выделенных по значению высокого содержания крахмала в зерне (табл. 1).
Таблица 1.
Генетические характеристики зерна кукурузы, содержание крахмала в зерне и амилозы в исследуемых кукурузных крахмалах
| Сорт кукурузы | Плоидность (n) | Генотип | Содержание крахмала в зерне, % | Содержание амилозы в крахмале, % |
|---|---|---|---|---|
| К-5461 | 2 | wx | 70.5 ± 0.1 | 0.0 ± 0.5 |
| Тетрасил | 4 | wx | 73.7 ± 0.3 | 15.0 ± 0.7 |
| Луч | 2 | – | 75.3 ± 0.4 | 17.5 ± 1.0 |
| КБЗ | 2 | – | 73.0 ± 0.1 | 21.0 ±0.9 |
| Баксанская сахарная | 4 | su | 59.3 ± 0.2 | 25.5 ± 1.1 |
| К-9301 | 2 | ae | 71.3 ± 0.3 | 32.0 ± 0.9 |
| К-4520 | 2 | ae | 69.3 ± 0.3 | 38. 0 ± 0.1 |
МЕТОДЫ
Цитологический анализ
Препараты корешков проростков кукурузы для хромосомного анализа фиксировали в ацеталкоголе (фиксатор Карнуа) в фазе трехдневных проростков в утренние часы. Окрашивание хромосом проводили по Фельгену реактивом Шиффа после горячего гидролиза в 1н растворе HCl, который проводили при температуре 60 °С в течение 10 мин, с последующей трехкратной промывкой в сернистой воде [22]. Для облегчения раздавливания зерен препаратов применяли мацерацию целлюлазой из Aspergillus niger производства компании Sigma-Aldrich (USA).
Определение хромосомного числа
Хромосомные числа образцов кукурузы определяли с помощью световой микроскопии в проходящем свете. В каждом образце подсчитывали число хромосом в соматической клетке корешков в 15 метафазных пластинках давленных препаратов под микроскопом Olympus CX43 фирмы “OLYMPUS OPTICAL CO., LTD” (Japan) при 1600-кратном увеличении с использованием иммерсии.
Определение содержания крахмала в зерне, выделение крахмала и определение содержания амилозы в крахмале
Определение содержания крахмала в зерне определяли в соответствии со стандартными европейскими методиками (ISO 10520 : 1997. Native starch – Determination of starch content – Ewers polarimetric method). Крахмалы из зерна кукурузы выделяли по модифицированной методике, предложенной в работе [23]. Содержание амилозы в крахмале определяли колориметрически в соответствии с методикой, описанной в работе [24].
Световая микроскопия и сканирующая электронная микроскопия
Морфологию исследованных гранул кукурузных крахмалов определяли с помощью световой микроскопии и сканирующей электронной микроскопии (СЭМ).
Световая микроскопия: крахмал помещали на предметное стекло и окрашивали одной каплей раствора Люголя (раствор йода в водном растворе йодида калия) [25]. Затем препарат накрывали покровным стеклом и слегка прижимали его для равномерного распределения крахмальных гранул. Избыток красителя удаляли с помощью фильтровальной бумаги. Анализ гранул крахмала проводили при 400-кратном увеличении с применением синего фильтра под оптическим микроскопом Микромед 3 ЛЮМ в проходящем свете с фотонасадкой Oplenic psc600-15c (B51) производства компании Oplenic Corp. (USA).
Сканирующая электронная микроскопия. Микрофотографии гранул крахмалов получены с помощью сканирующего электронного микроскопа Mira 3 LMU производства компании Tescan (Чехия) при комнатной температуре в условиях высокого вакуума с ускоряющим напряжением 500 В.
Дифференциальная сканирующая микрокалориметрия
Термодинамические параметры плавления 0.3%-ных (по весу) водных дисперсий исследуемых кукурузных крахмалов определяли с помощью метода высокочувствительной дифференциальной сканирующей микрокалориметрии (ДСК) на микрокалориметре ДАСМ-4 (Пущино, Россия). Измерения проводили в диапазоне температур 20–120 °С при скорости нагревания 2 °С/мин и постоянном давлении 2.5 МПа. Объем исследуемого образца в закрытой ячейке соответствовал 0.5 см3. Калибровку шкалы избыточной теплоемкости проводили с использованием эффекта Джоуля–Ленца. Ранее показано, что в данных условиях нет необходимости в учете термического запаздывания и продолжительности обработки образца в калориметрической ячейке [26]. В качестве раствора сравнения при измерении использовали деионизованную воду, полученную с помощью системы фильтрации и очистки воды марки Millipore Direct-Q3 (Merck, Germany), с удельным сопротивлением 18.2 МОм ⋅ см при температуре 25 °C.
Средние значения термодинамических параметров плавления кристаллических ламелей крахмалов определяли из не менее трех параллельных измерений. Значение температуры плавления соответствовало максимуму пика теплоемкости на термограмме, а значение экспериментальной энтальпии плавления – площади под пиком кривой зависимости избыточной теплоемкости от температуры. Расчет молярной энтальпии плавления (ΔHm) проводили с учетом концентрации ангидроглюкозного остатка (162 г/моль). Процесс плавления крахмалов в первом приближении можно считать квазиравновесным [10, 27], что дает возможность применять одностадийную модель плавления, в которой процесс плавления крахмалов описывается как равновесная реакция между нативным и расплавленным состояниями.
Значения энтальпии плавления Вант-Гоффа (ΔHvH) рассчитывали, как было описано ранее [28], используя следующее уравнение:
(1)
$\Delta {{H}^{{{v}H}}} = 2{{R}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{T}_{m}}{{\left( {{{C}_{p}} - 0.5\Delta {{C}_{{p\,\exp }}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$где R – универсальная газовая постоянная, Tm – температура плавления кристаллической ламели крахмала, Cp – максимум ординаты пика теплоемкости на термограмме, ΔCp exp – разность значений теплоемкостей между расплавленным и нативным состоянием крахмальных дисперсий. Кооперативную единицу плавления (ν) и толщину кристаллической ламелли (Lcr.l) рассчитывали, как описано в работе [29]:
(2)
$\nu = {{\Delta {{H}^{{{v}H}}}} \mathord{\left/ {\vphantom {{\Delta {{H}^{{{v}H}}}} {\Delta {{H}_{m}}}}} \right. \kern-0em} {\Delta {{H}_{m}}}},$при этом 0.35 нм – значение проекции ангидроглюкозного остатка на ось двойной спирали амилопектина [30].
Для деконволюции термограмм применяли программу Peak Fit (AISN Software Incorporated, Ver. 4).
Определение динамической вязкости
Динамическую вязкость 3%-ных водных гелей крахмалов определяли на ротационном вискозиметре Геплера с падающим шариком диаметром 10 мм [31, 32]. Методика приготовления 3%-ных водных гелей крахмала состояла в следующем: рассчитанное количество крахмала суспендировали в требуемом объеме воды и перемешивали в течение 7–10 мин. Для получения геля крахмала полученную дисперсию нагревали до 95 °С и выдерживали при этой температуре и постоянном перемешивании в течение 10 мин. Далее полученную систему охлаждали до (20 ± 0.5) °С и выдерживали в течение 3 ч. После этого определяли вязкость приготовленных гелей крахмала. Измерения вязкости проводили на трех параллельных образцах, полученные результаты усредняли.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ результатов исследования ранжирования образцов по генотипу крахмалов в зерне позволил выделить образцы, относящиеся к типу wx (сорта кукурузы К-5461, Тетрасил), типу ae (сорта кукурузы К-4520, К-9301) и типу su (сорт Баксанская сахарная), см. табл. 1. Остальные образцы (сорта кукурузы Луч, КБЗ) были отнесены к промежуточным генотипам. С помощью цитологического анализа было установлено, что образцы кукурузы Тетрасил, Баксанская сахарная характеризуются тетраплоидным (4n) числом хромосом, тогда как все остальные образцы имеют диплоидное (2n) число в геноме (табл. 1). Тетраплоидные образцы отличаются от диплоидных тем, что диплоидные генотипы имеют двойной набор всех генов в геноме, а тетраплоидные – четырехкратный. Выявленные тетраплоидные образцы различаются между собой наличием гена sugary2 в гомозиготном рецессивном, su2su2su2su2 (сорт Баксанская сахарная), и доминантном, Su2Su2Su2Su2 (сорт Тетрасил), состояниях. Ген su2 способствует формированию зерен со сморщенным эндоспермом за счет накопления сахаров, тогда как гены wx и ae не вызывают каких-либо существенных видимых изменений в эндосперме кукурузы.
В табл. 1 приведены генетические характеристики исследуемых зерен кукурузы, а также содержание крахмала в них и содержание амилозы в крахмале. Из приведенных данных видно, что образцы кукурузы с амилопектиновым (wx) и амилозным (ae) генотипами характеризуются близкими значениями содержания крахмала в зерне: от 69.3 до 73.7%. При этом крахмалы, экстрагированные из генотипа ae, содержат 32.0–38.8% амилозы, а крахмалы из генотипа wx – 0–15% амилозы. Сахарный генотип (su), представленный единственным тетраплоидным образцом, показал минимальную массовую долю крахмала в зерне: 59.3%, а содержание амилозы в крахмале составило 25.5%. Эти данные подтверждают предположение о том, что количество основных полисахаридов крахмала (амилозы и амилопектина), как и их соотношение, определяется генотипом образца.
Образцы кукурузы, относящиеся к генотипам wx и ae, характеризуются достаточно высоким содержанием в них крахмала. Следует отметить, что содержание крахмала в зерне генотипа su кукурузы сорта Баксанская сахарная достаточно высокое для сахарной кукурузы и составляет 59.3%, при этом этот сорт кукурузы характеризуется низким коэффициентом извлечения крахмала из зерна. Вероятно, при выделении крахмала из кукурузы сорта Баксанская сахарная его потери существенно увеличиваются из-за того, что в данном крахмале преобладают гранулы мелких размеров.
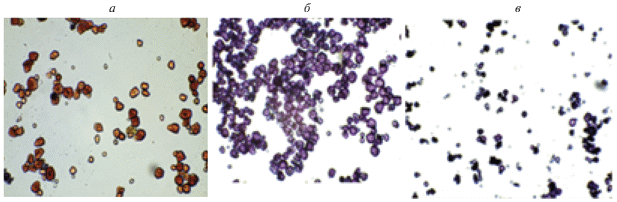
Результаты световой микроскопии исследования гранул кукурузного крахмала в присутствии раствора Люголя приведены на рис. 1. Известно, что молекулы амилопектина и амилозы окрашиваются раствором Люголя по-разному. Макромолекулы амилопектина окрашиваются в коричневый цвет, а макромолекулы амилозы – в синий [25]. Из приведенных микрофотографий видно, что молекулы амилопектина, окрашенные в коричневый цвет, присутствуют в случае wx генотипа крахмала, а в случае ae- и su-генотипов крахмалов в них имеются как макромолекулы амилозы, окрашенные в синий цвет, так и молекулы амилопектина. Также из данных микрофотографий видно, что крахмалы отличающихся генотипов различаются по размерам гранул. Следует отметить, что фракция крахмала su-генотипа, экстрагированного из кукурузы сорта Баксанская сахарная, характеризуется мелкими и очень мелкими гранулами, которые легко проходили через капроновое сито с размерами отверстий 93 мкм (риc. 1) в отличие от гранул крахмалов генотипов wx и ae, обладающих большими по размерам гранулами крахмала.
Рис. 1.
Микрофотографии гранул крахмала с разным генотипом (а – wx, б – ae, в – su), окрашенных раствором Люголя, полученные с помощью световой микроскопии c увеличением ×400 с синим светофильтром.
На рис. 2 приведены микрофотографии исследованных кукурузных крахмалов, полученные методом сканирующей электронной микроскопии. Из приведенных микрофотографий видно, что во всех исследованных кукурузных крахмалах присутствуют гранулы как нерегулярной или кубической, так и овальной формы с ровными краями. В крахмале генотипа wx преобладают гранулы нерегулярной или кубической формы. В случае переходного генотипа увеличивается доля гранул овальной формы наряду с присутствием гранул кубической формы. В крахмале генотипа ae количество гранул овальной формы больше, чем гранул кубической формы. В крахмале генотипа su присутствуют гранулы как овальной, так и нерегулярной или кубической формы, причем доля гранул нерегулярной формы выше по сравнению с долей гранул овальной формы. Следует отметить, что все исследованные кукурузные крахмалы характеризуются наличием гранул разного размера – как крупных, так и мелких. Причем крахмал su-генотипа обладает меньшими по размерам гранулами по сравнению с крахмалами wx- и ae-генотипов, что коррелирует с данными, полученными с помощью световой микроскопиий. Таким образом, размеры и форма гранул кукурузных крахмалов, как и их соотношение, зависят от генотипа растения, из которого экстрагировали крахмал.
Рис. 2.
Микрофотографии кукурузных крахмалов различных генотипов и сортов (указаны вверху), полученные с помощью СЭМ.

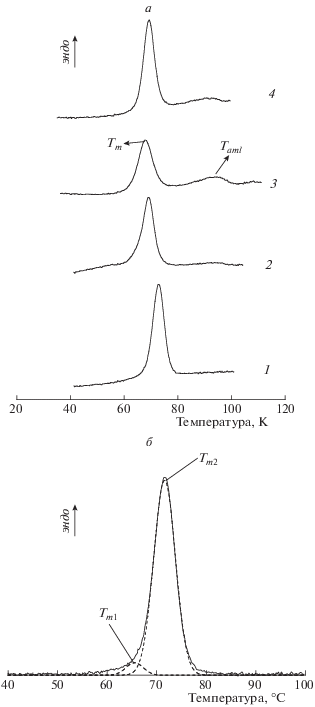
На рис. 3а для примера приведены ДСК-термограммы плавления водных дисперсий кукурузного крахмала с разными генотипами. Полученные ДСК-термограммы являются типичными для плавления кукурузных крахмалов [26, 29]. Из приведенных термограмм видно, что при плавлении кукурузных крахмалов, за исключением амилопектинового, наблюдается два пика. Как известно, первый пик соответствует плавлению кристаллических ламеллей амилопектина или разрушению (раскручиванию) двойных спиралей, образованных H-связями внутри боковых цепей амилопектина, а второй – диссоциации амилозо-липидных комплексов [26, 29]. Естественно, при плавлении амилопектинового кукурузного крахмала (wx-генотип) c содержанием амилозы 0%, экстрагированного из сорта K-5461, наблюдается только один пик плавления, так как данный крахмал не содержат амилозы.
Рис. 3.
а – ДСК-термограммы плавления водных дисперсий кукурузных крахмалов (c = 0.3 вес.%) различных генотипов (1 и 2 – генотип wx с содержанием амилозы 0 и 15% соответственно; 3 – генотип su, содержание амилозы – 25.5%; 4 – генотип ae, содержание амилозы – 32.0%). б – Деконволюция ДСК-термограммы плавления крахмала генотипа wx с содержанием амилозы 0%: экспериментальная (сплошная линия) и рассчитанная (штриховая линия) термограммы; Tm1 и Tm2-температуры плавления низко- и высокотемпературных структур соответственно.
Значения термодинамических параметров плавления кристаллических ламеллей амилопектина довольно близки для крахмалов различных генотипов (табл. 2). Значения толщины кристаллической ламелли, рассчитанные в соответствии с методикой, предложенной в работе [29], во всех исследуемых крахмалах достаточно близки, и среднее значение составляет 5.7 нм вне зависимости от генотипа крахмала и содержания в нем амилозы.
Таблица 2.
Термодинамические параметры плавления кукурузных крахмалов различных генотипов
| Сорт/генотип | Содержание амилозы, % | Тm, °С | ΔHm, кДж/моль | ΔHvH, кДж/моль | ν, ангидроглюкозных остатков | Lcr. l, нм | Тaml, °С | ΔHaml, кДж/моль |
|---|---|---|---|---|---|---|---|---|
| К-5461/wx | 0 | 72.8 ± 0.1 | 3.7 ± 0.2 | 48.6 ± 1.0 | 13.4 ± 0.6 | 4.7 | – | – |
| Тетрасил/wx | 15 | 69.9 ± 0.0 | 2.4 ± 0.1 | 38.2 ± 0.1 | 16.0 ± 0.5 | 5.6 | 93.5 | 0.2 |
| Луч/– | 17 | 70.7 ± 0.1 | 1.9 ± 0.1 | 34.9 ± 1.8 | 17.9 ± 0.1 | 6.3 | 92.6 | 0.3 |
| КБЗ/– | 21 | 70.1 ± 0.0 | 1.9 ± 0.1 | 36.2 ± 4.0 | 20.0 ± 0.8 | 7.0 | 94.3 | 0.1 |
| К-9301/ae | 32 | 70.5 ± 0.0 | 2.8 ± 0.3 | 42.5 ± 2.4 | 15.5 ± 0.8 | 5.5 | 93.1 | 0.3 |
| К-4520/ae | 38 | 69.9 ± 0.0 | 2.7 ± 0.1 | 43.2 ± 2.5 | 16.0 ± 0.4 | 5.6 | 93.0 | 0.3 |
| Баксанская сахарная/su | 25.5 | 67.8 ± 0.1 | 2.4 ± 0.1 | 35.1 ± 0.4 | 14.7 ± 0.8 | 5.2 | 94.3 | 0.7 |
| Среднее значение | 5.7 ± 0.8 | 93.5 ± 0.7 | 0.3 ± 0.2 |
Примечание: Тm – температура плавления кристаллических ламеллей, ΔHm – энтальпия плавления кристаллических ламеллей, ΔHvH – энтальпия Вант-Гоффа, ν – значениe кооперативной единицы плавления, Lcr. l – толщина кристаллической ламелли, Тaml и ΔHaml – температура и энтальпия диссоциации амилозо-липидного комплекса.
Отметим, что в случае крахмалов генотипа wx наблюдается понижение значений как температуры плавления (с 72.8 до 69.9 °С), так и энтальпии плавления кристаллической ламелли (с 3.7 до 2.4 кДж/моль) с увеличением содержания амилозы от 0 до 15%. В то же время значения энтальпии плавления крахмалов генотипа ae (32.0 и 38.0% амилозы) и генотипа wx (0% амилозы) практически совпадают. Таким образом, не наблюдается простой корреляции между содержанием амилозы и значениями термодинамических параметров плавления гранул крахмалов.
Значения температур и энтальпии плавления амилозо-липидных комплексов в изучаемых кукурузных крахмалах также практически неизменны при увеличении содержания амилозы (табл. 2). Учитывая, что термическая стабильность данного комплекса зависит как от кристаллического состояния данного комплекса, так и от природы липидов, а значение энтальпии плавления пропорционально содержанию амилозо-липидных комплексов, можно предположить, что содержание липидов и кристаллическое состояние амилозо-липидных комплексов для исследованных кукурузных крахмалов довольно близки [33].
Термодинамические параметры плавления кукурузного крахмала с генотипом su, экстрагированного из кукурузы сорта Баксанская сахарная, несколько выпадают из ряда аналогичных параметров исследуемых крахмалов (табл. 2). Температура плавления кристаллических ламеллей составляет 67.8 °С, т.е. характеризуется наименьшим значением для исследуемых крахмалов, что свидетельствует о присутствии в данном крахмале менее упорядоченных структур, чем в крахмале с близким содержанием амилозы, экстрагированном из кукурузы сорта КБЗ. В то же время данный крахмал характеризуется большим количеством наиболее стабильного амилозо-липидного комплекса, у которого температура и энтальпия диссоциации равны 94.3 °С и 0.7 кДж/моль соответственно. Вероятно, особенности термодинамических параметров крахмала, экстрагированного из сорта кукурузы Баксанская сахарная, связаны с особенностями генотипа сахарного эндосперма зерна кукурузы, характерного для этого сорта растений. А именно, данный сорт зерна характеризуется генотипом su, в котором влияние гена su2 на формирование крахмальных гранул проявляется в виде нарушений процесса разветвления полисахаридов крахмала, в отличие от других исследованных крахмалов, характеризующихся генотипами wx и ae. Но изучение данного факта требует дальнейших, более глубоких исследований.
Таким образом, анализ термодинамических параметров плавления кукурузных крахмалов разных генотипов и с различающимися содержаниями амилозы показал, что величина этих параметров зависит как от генотипических особенностей растения, из которого экстрагируется крахмал, так и от содержания амилозы в крахмале, выделенном из растений одинакового генотипа (табл. 2), что коррелирует с литературными данными [29, 34].
Известно, что увеличение содержания амилозы сопровождается накоплением как неупорядоченных амилозных цепей в аморфной ламелли, так и амилозных концевых цепей в кристаллических ламеллях, что в конечном итоге приводит к образованию более дефектных или менее упорядоченных кристаллических структур, которые плавятся при более низких температурах [29, 35]. Можно предположить, что этот эффект и наблюдается для исследуемых кукурузных крахмалов. С целью установления влияния накопления дефектных структур на величины термодинамических параметров плавления гранул крахмалов была предпринята деконволюция термограмм.
Термограммы плавления амилопектиновых пиков исследуемых кукурузных крахмалов характеризуются некоторой асимметрией, поэтому можно предположить, что это есть проявление наличия более одного независимого перехода кристаллических структур с различной температурой плавления. В табл. 3 приведены результаты деконволюции кривых теплоемкости по модели двух независимых переходов “все или ничего”, а на рис. 3б представлен пример деконволюции ДСК-термограммы амилопектинового пика для образца кукурузного крахмала сорта К-5461.
Таблица 3.
Результаты деконволюции термограмм плавления кукурузных крахмалов различных генотипов
| Генотип | Содержание амилозы, % | Tm1, °С | α1, % | Тm2, °С | α2, % |
|---|---|---|---|---|---|
| wx | 0 | 65.5 | 4.8 | 71.6 | 95.5 |
| wx | 15 | 63.1 | 15.9 | 67.9 | 84.1 |
| – | 17 | 64.9 | 26.1 | 64.9 | 73.9 |
| – | 21 | 68.8 | 90.8 | 74.0 | 9.2 |
| ae | 32 | 64.3 | 3.6 | 69.2 | 96.6 |
| ae | 38 | 64.5 | 6.4 | 68.7 | 93.5 |
Из приведенных в табл. 3 данных видно, что при плавлении амилопектина проявляются два независимых перехода, соответствующие плавлению структур с различающимися температурами плавления. Следует отметить, что с увеличением содержания амилозы доля структур, характеризующихся низкотемпературным переходом, в кукурузных крахмалах wx- и ae-генотипов возрастает. Причем доля таких структур в крахмалах ae-генотипа меньше, чем в крахмалах wx-генотипа. Низкотемпературный переход для исследованных кукурузных крахмалов, вероятно, связан с плавлением кристаллических ламелей с более дефектной структурой, чем в случае основного пика.
С помощью уравнения Томсона–Гиббса для температуры плавления полукристаллических синтетических полимеров
(4)
${{Т}_{m}} = {{Т}_{{0m}}}\left( {1--{{2{{\gamma }_{i}}} \mathord{\left/ {\vphantom {{2{{\gamma }_{i}}} {\Delta {{H}_{{0m}}}}}} \right. \kern-0em} {\Delta {{H}_{{0m}}}}}{{\rho }_{{cr.{\kern 1pt} l}}}{{L}_{{cr.{\kern 1pt} l}}}} \right),$где Т0m и ΔH0m – соответственно температура и энтальпия плавления гипотетического кристалла неограниченного размера (идеальный кристаллит) или такого кристалла, для которого ролью свободной поверхностной энергии по сравнению с объемной можно пренебречь; с γi – свободная поверхностная энергия торцевых граней кристаллических ламелей; pcr. l и Lcr. l – соответственно плотность и толщина кристаллической ламели, возможно получать полезную информацию относительно термодинамических параметров плавления кристаллических ламеллей, а именно, относительно поверхностной энтропии qi и энтальпии si торцевых граней кристаллических ламелей [36, 37]:
(5)
${{q}_{i}} = (\Delta {{H}_{{0m}}} - \Delta {{H}_{m}}){{\rho }_{{cr.{\kern 1pt} l}}}{{{{L}_{{cr}}}_{{.{\kern 1pt} l}}} \mathord{\left/ {\vphantom {{{{L}_{{cr}}}_{{.{\kern 1pt} l}}} {2.5}}} \right. \kern-0em} {2.5}},$(6)
${{s}_{i}} = {{({{q}_{i}} - {{\gamma }_{i}})} \mathord{\left/ {\vphantom {{({{q}_{i}} - {{\gamma }_{i}})} {{{T}_{m}}}}} \right. \kern-0em} {{{T}_{m}}}}.$Плавление полимерного кристалла начинается с разрушения наиболее слабых мест, т.е. с дефектов в аморфной ламелли, и поэтому значение поверхностной энтропии торцевых граней кристаллической ламелли пропорционально количеству дефектов в структурной организации гранул крахмала [36, 38]. Метод ДСК позволяет качественно оценить наличие дефектов в полимерном кристалле. В крахмалах роль дефектов играют проходные цепи амилозы, представляющие собой одиночные скрученные спирали, имеющие неупорядоченную конформацию, и/или молекулярно-упорядоченные структуры, состоящие из двойных спиралей и находящиеся между кристаллитами в аморфной ламелли, а также В-цепи амилопектина, расположенные в аморфной ламелли [27, 37].
Накопление дефектов сопровождается образованием кристаллитов с более “податливой” поверхностью и уменьшением значения температуры плавления. Были оценены термодинамические параметры поверхности торцевых граней кристаллических ламеллей исследуемых крахмалов (табл. 3). Для расчетов использовали значения Т0m = 366.5 К и ΔH = 35.5 Дж/г, а также pcr. l = = 1.48 г/см3 для А-типа сферолитного кристаллита, к которым относятся кукурузные крахмалы [39, 40]. Значения энтропии плавления, температуры плавления и толщины кристаллической ламелли получали из экспериментальных данных. Из приведенных в табл. 4 данных видно, что значения поверхностной энтропии плавления торцевых граней кристаллических ламеллей для кукурузных крахмалов генотипов wx, ae и su практически одинаковы, что свидетельствует о сходстве в степени их упорядоченности. Наиболее существенные различия, а именно рост величины энтропии плавления торцевых граней наблюдаются для крахмалов переходного генотипа: от wx к ae (сорта Луч, КБЗ), вероятно, вследствие их менее упорядоченной структуры. В то же время при сравнении образцов одного генотипа с различным содержанием амилозы наблюдается рост плавления торцевых граней кристаллических ламелей при повышении содержания амилозы в крахмале (сорта К-5461 и Тетрасил генотипа wx и сорта Луч и КБЗ переходного, от wx к ae, генотипа), что отражает роль амилозы в увеличении доли менее упорядоченных структур в составе крахмалов.
Таблица 4.
Значения свободной поверхностной энергии (γi), энтальпии (qi) и энтропии (si) торцевой грани кристаллической ламели кукурузных крахмалов различных генотипов
| Сорт кукурузы | Генотип | Содержание амилозы, % | γi ⋅ 107 | qi ⋅ 107 | si ⋅ 107 |
|---|---|---|---|---|---|
| Дж/см2 | |||||
| К-5461 | wx | 0 | 6.89 ± 0.37 | 35.93 ± 6.17 | 0.08 ± 0.02 |
| Тетрасил | wx | 15.0 | 9.80 ± 0.39 | 68.74 ± 4.19 | 0.17 ± 0.01 |
| Луч | – | 17.5 | 10.27 ± 0.02 | 87.74 ± 2.07 | 0.23 ± 0.01 |
| КБЗ | – | 21.0 | 11.74 ± 0.50 | 100.73 ± 11.33 | 0.29 ± 0.01 |
| К-9301 | ae | 32.0 | 8.98 ± 0.41 | 59.05 ± 8.67 | 0.15 ± 0.02 |
| К-4520 | ae | 38.0 | 9.39 ± 0.25 | 62.97 ± 4.74 | 0.16 ± 0.01 |
| Баксанская сахарная | su | 25.5 | 9.47 ± 0.48 | 63.34 ± 9.90 | 0.16 ± 0.01 |
Таким образом, увеличение содержания амилозы в исследуемых кукурузных крахмалах сопровождается уменьшением значений термодинамических параметров их плавления, при этом толщина кристаллической ламели и количество амилозо-липидных комплексов остаются неизменными для крахмалов ae- и wx-генотипов. Степень упорядоченности структуры крахмалов определяется не только содержанием в них амилозы, но и генотипом растения, из которого экстрагируется крахмал.
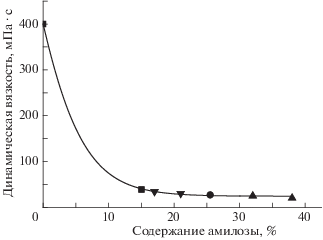
Для оценки влияния содержания амилозы и генотипа крахмала на вязкоупругие свойства гелей кукурузных крахмалов получены предварительные данные по реологии 3%-ных гелей в воде. На рис. 4 приведено изменение динамической вязкости исследуемых гелей крахмалов с различным генотипом в зависимости от содержания в них амилозы. Из представленных данных видно, что зависимость для крахмалов различных генотипов может быть представлена в обобщенной форме (рис. 4), при этом с увеличением содержания амилозы в крахмалах значение динамической вязкости понижается. Этот результат согласуется с литературными данными относительно роли амилозы в реологических свойствах гелей крахмалов [41, 42].
ЗАКЛЮЧЕНИЕ
Установлено, что выбранные для изучения образцы кукурузного крахмала относятся к различным генотипам. К генотипу wx отнесены крахмалы, экстрагированные из сортов кукурузы К-5461, Тетрасил, к генотипу ae – крахмалы, экстрагированные из сортов кукурузы К-4520, К-9301, и к генотипу su – крахмал, экстрагированный из кукурузы сорта Баксанская сахарная. Крахмалы, экстрагированные из сортов Луч, КБЗ отнесены к промежуточным типам. Образец из сорта кукурузы Баксанская сахарная характеризуется меньшим размером гранул и более низкой температурой их плавления.
Установлено, что увеличение содержания амилозы в кукурузных крахмалах wx-генотипа сопровождается понижением значений термодинамических параметров их плавления, что отражается в накоплении дефектных структур в исследуемых крахмалах. Толщина кристаллической ламелли и количество амилозо-липидных комплексов остаются неизменными для всех исследуемых крахмалов. Крахмал, экстрагированный из образца кукурузы Баксанская сахарная (su-генотип), по термодинамическим параметрам плавления отличается от остальных образцов, а именно характеризуется наименьшим значением температуры плавления амилопектина и амилозо-липидного комплекса. При этом энтальпия диссоциации амилозо-липидного комплекса характеризуется наибольшим значением среди исследованных кукурузных крахмалов. Таким образом, термодинамические параметры плавления исследуемых кукурузных крахмалов определяются как содержанием амилозы в них, так и особенностями генотипа растений, из которых экстрагируется крахмал.
Показано, что реологические характеристики гелей исследованных кукурузных крахмалов не зависят от генотипа крахмала, а определяются содержанием в них амилозы. Исследованные сорта кукурузы имеют практическое значение, так как могут быть ценным сырьем для различных областей промышленности и исходным материалом для селекции сортов высококрахмалистой восковидной кукурузы, традиционных сортов и гибридов кукурузы с высокой массовой долей крахмала в ее зернах.
Работа выполнена в рамках государственных заданий, темы 0084-2014-0005 (№ 01201253307), 0082-2018-0006 (регистрационный номер AAAA-A-18-118020890097-1), № 585-2018-0015, № 0662-2019-0006.
Список литературы
Santana A.L., Meireles M.A.A. // Food Public Health. 2014. V. 4. № 5. P. 229.
Zeeman S.C., Kossmann J., Smith A.M. // Ann. Rev. Plant Biol. 2010. V. 61. P. 209.
Сергеев А.И., Шилкина Н.Г., Вассерман Л.А., Шилов С.И., Staroszczyk H. // Хим. физика. 2017. Т. 36. С. 71.
Асеева Р.М., Сахаров П.А., Сахаров А.М. // Хим. физика. 2009. Т. 28. С. 89.
Роговина С.З., Алексанян К.В., Владимиров Л.В., Берлин А.А. // Хим. физика. 2019. Т. 38. С. 39.
Жорина Л.А., Кузнецова О.П., Роговина С.З., Владимиров Л.В., Грачев А.В., Прут Э.В., Берлин А.А. // Хим. физика. 2018. Т. 37. С. 74.
Durrani C.M., Donald A.M. // Polym. Gels Networks. 1995. V. 3. № 1. P. 1.
BeMiller J.N., Whistler R.L. Starch: Chemistry and Technology. Academic Press, 2009.
Christiansen C., Hachem A.M., Janecek S., Vikso-Nielsen A., Blennow A., Svensson B. // FEBS J. 2009. V. 276. P. 5006.
Вассерман Л.А., Кривандин А.В., Филатова А.Г., Васильев В.Г., Колачевская О.О., Тарасов В.Ф., Плащина И.Г., Романов Г.А. // Хим. физика. 2020. Т. 39. № 6. С. 63.
Liu J., Mushegian A. // Protein Sci. 2003. V. 12. P. 1418.
Leterrier M., Holappa L.D., Broglie K.E., Beckles D.M. // BMC Plant Biol. 2008. V. 8. P. 98.
Shure M., Wessler S., Fedoroff N. // Cell. 1983. V. 35. P. 225.
Craig J., Lloyd J.R., Tomlinson K. et al. // Plant Cell. 1998. V. 10. P. 13.
Mizuno K., Kimura K., Arai Y. et al. // J. Biochem. 1992. V. 112. P. 643.
Schwall G.P., Safford R., Westcott R.J. et al. // Nature Biotech. 2000. V. 18. P. 551.
Nishi A., Nakamura Y., Tanaka N., Satoh H. // Plant Physiol. 2001. V. 127. P. 459.
Sidebottom C., Kirkland M., Strongitharm B., Jeffcoat R. // J. Cereal Sci. 1998. V. 27. P. 279.
Takeda C., Takeda Y., Hizukuri S. // Carbohyd. Res. 1993. V.246. P. 273.
Myers A.M., Morell M.K., James M.G., Ball S.G. // Plant Physiol. 2000. V. 122. P. 989.
Zhang H.Y., Dong S.T., Gao R.Q., Li Y.Q. // J. Plant Physiol. Molec. Biol. 2007. V. 33. P. 25.
Romeis B. Mikroskopische Technik. München–Wien– Baltimore, 1989.
Adkins G.K., Greenwood C.T. // Starch–Stärke. 1966. V. 7. P. 213.
McGrance C.J., Cornell H.J., Rix C.J. // Starch, 1998 V. 50. P. 158.
Lille M., Autio K. // Inn. Food Sci. Emer. Technol. 2007. V. 8. P. 117.
Andreev N.R., Kalistratova E.N., Wasserman L.A., Yuryev V.P. // Starch. 1999. V. 50. P. 422.
Wasserman L.A., Papakhin A.A., Borodina Z.M. et al. // Carbohyd. Polym. 2019. V. 212. P. 260.
Privalov P.L., Potekhin S.A. // Methods Enzymol. 1986. V. 131. P. 4.
Matveev Y.I., van Soest J.J.G., Nieman C., Wasserman L.A. et al. // Carbohyd. Polym. 2001. V. 44. P. 151.
Imberty A., Chanzy H., Perez S., Buleon A., Tran V. // J. Molec. Biol. 1988. V. 201. P. 365.
Ptitchkina N.M., Brukhanova O.V., Novikova I.A., Ishin A.G., Morris E.R. // Food Hydrocol. 1994. V. 8. P. 383.
Nielsen S. Food Analysis Laboratory Manual. Springer Intern. Publ., 2017.
Biliaderis C.G. // Food Technol. 1992. V. 46. P. 98.
Singh N., Inouchi N., Nishinari K. // Food Hydrocol. 2006. V. 20. P. 923.
Jenkins P.J., Donald A.M. // Intern. J. Biol. Macromol. 1995. V. 17. P. 315.
Bershtein V.A., Egorov V.M. Differential scanning calorimetry of polymers: physics, chemistry, analysis, technology / Ed. Kemp T.J. N.Y., London, Toronto, Sydney, Tokyo, Singapore: Ellis Horwood Ltd, 1994.
Protserov V.A., Wasserman L.A., Tester R.F. et al. // Carbohyd. Polym. 2002. V. 49. P. 271.
Wunderlich B. Macromolecular Physics. V. 2. Crystal nucleation, growth, annealing. N.Y.: Academic Press, 1977.
Tester R.F. // Intern. J. Biol. Macromol. 1997. V. 21. P. 37.
Whittam M.A., Noel T.R., Ring S.G. // Intern. J. Biol. Macromol. 1990. V. 12. P. 359.
Aparicio-Saguilan A., Méndez-Montealvo G., Solorza-Feria J., Bello-Pérez L.A. // J. Sci. Food Agrical. 2006. V. 86. P. 1078.
Rosa-Millan J., Agama-Acevedo E., Jimenez-Aparicio A.R., Bello-Pérez L.A. // Starch. 2010. V. 62. P. 549.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика