Химическая физика, 2021, T. 40, № 2, стр. 61-65
Изменение относительного содержания оксида азота в коре головного мозга крысы в условиях острой ишемии
Т. С. Константинова 1, Т. Ф. Шевченко 1, *, И. В. Барсков 2, В. Г. Тактаров 2, К. В. Кузнецова 2, П. В. Аболтин 1, Г. Р. Каламкаров 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Московский медицинский университет “РЕАВИЗ”
Москва, Россия
* E-mail: tatianashevchenko@rambler.ru
Поступила в редакцию 02.07.2020
После доработки 10.09.2020
Принята к публикации 21.09.2020
Аннотация
В работе методом ЭПР исследовалось изменение относительного содержания оксида азота в коре головного мозга крысы в условиях острой ишемии. В качестве модели ишемии в работе использован индуцированный лазером тромбоз сосудов. Предварительно в кровоток вводился краситель бенгальский розовый, который в ответ на лазерное воздействие генерирует активные формы кислорода, что приводит к коагуляции белков, повреждению стенки сосуда и, как следствие, к образованию тромба. Гистологически показано, что острый ишемический процесс заканчивается через сутки после лазерной операции, а через трое суток начинается процесс активной ремиссии с соответствующими морфологическими изменениями очага поражения. Относительное содержание оксида азота определялось через 1 и 3 сут после фототромбоза сосудов головного мозга с использованием парамагнитного комплекса NO–Fe–ДЭТК в качестве спиновой ловушки. Содержание оксида азота оценивалось по крайней низкополевой компоненте спектра ЭПР этого комплекса. Показано, что значительное увеличение относительного содержания оксида азота происходит на третьи сутки после лазерной операции и совпадает с началом ремиссии после острой ишемии. В работе обсуждается возможная роль оксида азота в процессе ремиссии.
ВВЕДЕНИЕ
Оксид азота (NO) – универсальная молекула-регулятор многочисленных функций в организме и физиологический мессенджер в центральной нервной системе [1], участвующий в важных процессах, таких как регуляция кровообращения головного мозга [2]. Оксид азота синтезируется NO-синтазой (NOS) путем превращения L-аргинина в L-цитруллин в реакции, идущей с участием кислорода с образованием промежуточного продукта N-ω-гидрокси-L-аргинина.
Существуют три изоформы NOS: нейрональная (nNOS), эндотелиальная (еNOS) и индуцибельная (iNOS). Первые две изоформы являются Ca2+-зависимыми и локализованы в нервных тканях и в эндотелиальных клетках кровеносных сосудов, соответственно [3, 4], а третья – Ca2+-независима и локализуется в глиальных клетках мозга.
Значительное количество исследований подтвердили участие NO в патогенезе ишемического повреждения мозга [5, 6]. В моделях центральной и тотальной ишемии мозга все три изоформы NOS индуцируются в постишемический период, приводя к непрерывному производству NO. Активности ферментов nNOS и eNOS возрастают вскоре после начала ишемии, по-видимому, из-за повышения внутриклеточной концентрации Ca2+ [7–9], в то время как индукция iNOS задерживается на несколько часов. Предположительно, активация nNOS и iNOS приводит к гибели нервных клеток, а активация eNOS, напротив, защищает нейроны [10, 11]. Нейропротекция может происходить вследствие того, что NO, образующийся в эндотелиальных клетках, вызывает расслабление гладкой мускулатуры, что приводит к вазодилатации и увеличению мозгового кровотока в ишемизированной области мозга [5].
Ишемия – распространенное патологическое состояние, возникающее вследствие уменьшения кровоснабжения тканей. При снижении подачи крови к ткани снижается ее обеспечение кислородом и метаболическими субстратами, нарушается удаление продуктов обмена. Именно в тех случаях, когда циркуляция крови не может удовлетворить метаболические потребности тканей, происходят патологические изменения. Продолжительное нарушение кровоснабжения может привести к необратимым повреждениям ткани и ее гибели.
Существуют различные экспериментальные модели ишемии. При исследовании ишемических процессов в разных органах в качестве модели используется метод тромбирования сосудов с помощью лазерного воздействия. Для создания тромба в кровоток вводят фоточувствительный краситель (бенгальский розовый или эритрозин Б). После освещения краситель активируется и вырабатывает синглетный кислород, который повреждает мембрану эндотелиальных клеток с последующей агрегацией тромбоцитов и образованием тромбов, что в конечном итоге приводит к локальному прерыванию кровотока. В настоящей работе мы применили этот метод для исследования ишемии мозга. Его важным преимуществом является способность осуществлять целенаправленное дозированное неинвазивное повреждение с достижением избирательной окклюзии сосудов за счет фотохимического воздействия на клетки сосудистого эндотелия. Это приводит к прекращению кровотока и агрегации клеток крови с последующим тромбообразованием и окклюзией сосуда с сохранением гомеостаза тканей мозга [12].
Целью настоящей работы было определение изменений относительного содержания оксида азота in vivo в условиях острой ишемии и последующего частичного восстановления тканей.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали крыс-самцов линии Wistar весом 150 г, содержавшихся в виварии при естественном освещении и свободном доступе к воде и пище по пять особей в клетке. Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, данным в Приказе Минздрава России № 708н от 23.08.10 “Об утверждении Правил лабораторной практики”, и были согласованы с этическим комитетом Минздравсоцразвития России.
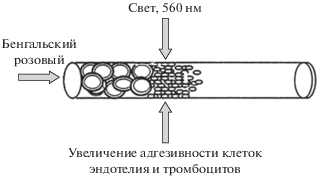
Фототромбоз сосудов проводили по методике, разработанной Ватсоном [13] (рис. 1) и основанной на том, что при действии света с длиной волны 560 нм на введенный в кровоток фоточувствительный краситель бенгальский розовый (Bengal Rose) в области его взаимодействия с фокусированным светом выделяется синглетный молекулярный кислород [14]. Это приводит к повреждению эндотелия сосудов, агрегации, адгезии форменных элементов крови и в конечном итоге – к тромботической окклюзии поврежденных кровеносных сосудов с последующей ишемизацией снабжаемых ими тканей [15, 16].
Рис. 1.
Схема формирования тромба в просвете сосуда под воздействием пучка света с длиной волны 560 нм на введенный в кровоток фотосенсибилизируемый краситель бенгальский розовый.
Для индукции фототромбоза животным, наркотизированным хлоралгидратом (250 мг/кг, внутрибрюшинно), в яремную вену (v. jugularis) вводили 3%-ный раствор фотосенсибилизируемого красителя бенгальского розового в дозе 40 мг/кг. Для воспроизведения коркового инфаркта голову животного фиксировали в стереотаксисе и после продольного разреза кожи устанавливали лазер (длина волны – 560 нм). Облучение коры височно-теменных долей проводили в течение 15 мин, после чего операционную рану ушивали. Постишемические периоды составляли 24 ч и 3 сут, после чего животным, отобранным для гистологического исследования, под глубоким хлоралгидратным наркозом проводили суправитальную транскардиальную перфузию фиксирующим раствором: 40%-ный формалин, 96%-ный спирт, ледяная уксусная кислота в соотношении 2 : 7 : 1. После перфузии мозг животных извлекали и помещали в 70%-ный спирт для последующей гистологической обработки. Гистологический материал – ткань коры головного мозга из очага поражения обрабатывали по методикам, общепринятым при приготовлении парафиновых срезов [17].
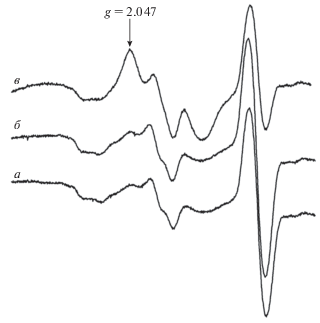
Для исследования радикальных процессов, в том числе и в биологических системах, широко используется метод электронного парамагнитного резонанса (ЭПР) [18–20]. В нашей работе относительное содержание оксида азота в коре головного мозга крыс определяли стандартным методом спиновой ловушки и ЭПР [21, 22]. В качестве ловушки использовали диэтилдитиокарбамат натрия (ДЭТК), который вводили крысе внутрибрюшинно из расчета 500 мг/кг веса. Сразу после введения ДЭТК животному внутримышечно вводили водный раствор смеси 29 мМ FeSO4 и 116 мМ цитрата натрия (2.0 мл/кг веса). Образующиеся in vivo комплексы ДЭТК и Fe равномерно распределялись в органах и тканях и связывали оксид азота, образуя парамагнитные комплексы, которые находятся в равновесии с концентрацией NO в ткани. Через 30 мин животных декапитировали, образцы коры головного мозга замораживали в жидком азоте и регистрировали сигнал ЭПР комплекса NO–Fe–ДЭТК при температуре жидкого азота на ЭПР-спектрометре фирмы “Bruker EMX-8”. Репрезентативные сигналы ЭПР спиновой ловушки в мозге крысы представлены на рис. 2. Сигнал ЭПР представляет собой суперпозицию сигнала комплекса NO–Fe–ДЭТК, а также других парамагнитных центров, которые обнаруживаются в тканях. Однако крайняя низкополевая компонента не перекрывается другими сигналами. Это позволяет оценивать относительную концентрацию оксида азота по этой компоненте триплетной сверхтонкой структуры этого комплекса [21].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
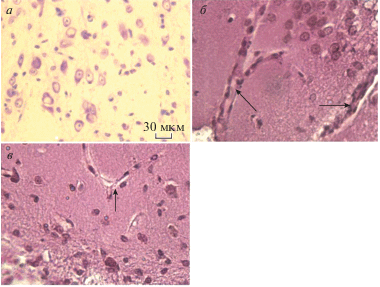
В течение 24 ч после фототромбоза в коре происходило формирование фокального ишемического очага. На гистологических срезах головного мозга, взятых у экспериментальной группы животных, при сравнении с контролем (рис. 3а), которым служил интактный мозг, в ишемическом очаге выявлялась зона формирования тотального некроза, содержавшая нейроны с признаками повреждения, характерными для данной стадии постишемического периода (рис. 3б): перицеллюлярный отек, сморщивание тел нейронов, гомогенизация цитоплазмы, исчезновение глыбок хроматина, изменение конфигурации ядра. Окончательное формирование зоны некроза, содержащей погибшие нейроны и глию, заканчивалось на третьи сутки постишемического периода (рис. 3в), после чего начинается процесс заживления. Таким образом, для определения вероятности участия оксида азота в процессах развития ишемии и постишемического восстановления мозга регистрировалось относительное содержание оксида азота в контроле через сутки (острый период) и через трое суток (начало ремиссии). На рис. 2 представлены спектры ЭПР комплексов NO–Fe–ДЭТК коры головного мозга крысы. Стрелкой отмечена компонента, по величине которой оценивалось относительное содержание оксида азота.
Рис. 3.
Гистологические срезы коры головного мозга крысы: а – контроль, кора интактного мозга; б – состояние сосудистого русла, постишемический период – 24 ч (слева – интактный сосуд, справа – измененный сосуд в зоне ишемизации с последующим формированием зоны некроза (стрелки)); в – состояние сосудистого русла, постишемический период – 3 сут, сосуд после реперфузии в зоне ишемизации (стрелка) и сформировавшаяся зона некроза (внизу). Окрашивание: гематоксилин-ванадиево-кислый фуксин. Увеличение ×40.
Изменение относительного содержания оксида азота представлено в табл. 1. Через сутки после тромбирования сосуда содержание оксида азота в коре головного мозга изменяется незначительно. Существенные изменения наблюдаются через трое суток после проведения операции. По времени это увеличение совпадает с началом процесса заживления после окончания острого периода (см. рис. 3в). Можно предположить, что оно обусловлено двумя факторами. С одной стороны, активируется эндотелиальная NO-синтаза, что приводит к расширению сосуда и частичной компенсации снижения кровотока вследствие тромбирования [11]. С другой стороны, начинается процесс как некротической, так и апоптотической гибели поврежденных нервных тканей. Как известно, при этом активируются нейрональная и индуцибельная NO-синтазы [23] и увеличивается содержание оксида азота в тканях мозга. Оксид азота реагирует с активными формами кислорода, при этом наиболее важным аспектом является его взаимодействие с супероксидным анион-радикалом с образованием пероксинитрита – сильного проапоптотического фактора [24–26].
Таблица 1.
Изменение относительного содержания NO в коре головного мозга крыс при острой ишемии
| Контроль (n = 9) |
Через 1 сут после лазерного тромбоза (n = 8) |
Через 3 сут после лазерного тромбоза (n = 9) |
|---|---|---|
| 0.40 ± 0.07 | 0.55 ± 0.11 p > 0.05* |
0.91 ± 0.01 p < 0.05* |
Изменение содержания оксида азота в условиях острой ишемии изучалось ранее [23–25]. При обсуждении результатов необходимо отметить два принципиальных момента.
1. Примененная в работе [25] методика инициации острой ишемии принципиально отличается от нашего метода. В этой и более ранних работах других авторов [23, 24] ишемия инициировалась путем кратковременного пережатия сонной артерии, что вызывало тотальное повреждение мозга. Процесс же восстановления (реперфузии) вызывали путем прекращения пережатия артерии и восстановления кровотока. При использовании лазерной окклюзии тромбируется относительно небольшая сеть сосудов. Восстановление носит естественный характер за счет компенсаторного эффекта: поврежденный участок дополнительно снабжается кислородом при помощи неповрежденных сосудов. Такой подход значительно ближе к реально наблюдаемому ишемическому инсульту.
2. В работе [25] наблюдалось увеличение содержания оксида азота в первые 30 мин после инициации ишемии. Авторы справедливо связывают это с активацией эндотелиальной NO-синтазы и релаксацией сосудов. В нашей работе мы наблюдаем существенные изменения содержания NO на третьи сутки после тромбирования, т.е. в условиях, когда начинается развитие апоптоза, обусловленного активацией индуцибельной NO-синтазы и образованием пероксинитрита. Полученные результаты еще раз свидетельствуют о том, что на разных этапах развития физико-химических процессов, вызванных гипоксией, оксид азота может играть как нейропротекторную, так и нейротоксическую роль.
ЗАКЛЮЧЕНИЕ
Таким образом, в работе показано, что на третьи сутки в условиях ишемии, инициированной гипоксией, в очаге ишемического повреждения происходит увеличение содержания оксида азота – универсальной молекулы, запускающей многочисленные химические и биохимические процессы в клетках. В гистологических экспериментах установлено, что острый ишемический процесс заканчивается через сутки после лазерной операции, а через трое суток начинается процесс активной ремиссии с соответствующими морфологическими изменениями очага поражения. Важно отметить, что увеличение относительного содержания оксида азота происходит не в острой фазе ишемического процесса, а по времени совпадает с началом ремиссии. Можно предположить, что оксид азота играет важную роль в процессе восстановления тканей после ишемического поражения.
Список литературы
Vincent S.R. // Progr. Neurobiol. 1994. V. 42. P. 129.
Bredt D.S., Snyder S.H. // Annu. Rev. Biochem. 1994. V. 63. P. 175.
Shin D.H., Lee H.Y., Kim et al. // Neurosci. Lett. 1999. V. 270. P. 53.
Cheon E.W., Park C.H., Kang S.S. et al. // Neuroreport. 2003. V. 14. P. 329.
Mares J., Nohejlova K., Stopka P. et al. // Physiol. Res. 2016. V. 65. № 5. P. 853.
Психа Б.Л., Нешев Н.И., Соколова Е.М. и др. // Хим. физика. 2020. Т. 39. № 7. С. 9.
Shin D.H., Lee H.Y., Lee K.H. et al. // Neurosci. Lett. 2000. V. 278. P. 73.
Cheon E.W., Park C.H., Kang S.S. et al. // Neuroreport. 2003. V. 14. P. 329.
Lopez-Costa J.J., Goldstein J., Saavedra J.P. // Neurosci. Lett. 1997. V. 232. P. 155.
Iadecola C. // Trends Neurosci. 1997. V. 20. P. 132.
Zheng L., Ding J., Wang J. // The anatomical record. 2016. V. 299. P. 246.
Labat-gest V., Tomasi S. // J. Vis. Exp. 2013. V. 9. № 76. P. 50370.
Watson B.D., Dietrich W.D., Busto R. et al. // Ann. Neurol. 1985. V. 17. № 5. P. 497.
Шахов А.М., Астафьев А.А., Осыченко А.А. и др. // Хим. физика. 2016. Т. 35. № 10. С. 49.
Gajkowska B., Frontczak-Baniewicz M., Gadamski R. et al. // Acta Neurobiol. Exp. 1997. V. 57. № 3. P. 203.
Saniabadi A.R., Umemura K., Matsumoto N. et al. // Thromb. Haemost. 1995. V. 73. № 5. P. 868.
Ромейс Б. Микроскопическая техника. М.: Изд-во иностр. лит., 1954. С. 648.
Константинова Т.С, Бугрова А.Е., Шевченко Т.Ф. и др. // Биофизика. 2012. Т. 57. № 2. С. 325.
Коварский А.Л., Каспаров В.В., Кривандин А.В. и др. // Хим. физика. 2017. Т. 36. № 4. С. 3.
Воротников А.П. // Хим. физика. 2015. Т. 34. № 11. С. 16.
Vanin A.F, Huisman A., van Faassen E.E. // Methods Enzimol. 2002. V. 359. P. 27.
Obolenskaya M.Yu., Vanin A.F., Mordvintcev P.I., Molsch A., Decker K. // Biophis. Biochem. Res. Com. 1994. V. 202. № 1. P. 571.
Bolanos J.P., Almeida A. // Biochim. Biophys. Acta. 1999. V. 1411. P. 415.
Shinya Sato, Teiji Tominaga, Tomoko Ohnishi et al. // Ibid. 1993. V. 1181. № 2. P. 195.
Tominaga T., Ohnishi S.T., Ohnishi T. et al. // Brain Res. 1993.V. 614. № 1–2. P. 342.
Лобанов А.В., Кобзев Г.И., Давыдов К.С. и др. // Хим. физика. 2014. Т. 33. № 6. С. 3.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика