Химическая физика, 2021, T. 40, № 3, стр. 17-22
Общность процессов гидратации хлоруксусных кислот
Е. С. Васильев 1, Г. В. Карпов 1, Н. Д. Волков 1, И. И. Морозов 1, *, С. В. Савилов 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: igormrzv@gmail.com
Поступила в редакцию 07.05.2020
После доработки 07.05.2020
Принята к публикации 20.05.2020
Аннотация
Масс-спектрографическим методом электрораспыления растворов электролитов в вакууме получены масс-спектры отрицательных ионов водных растворов полностью нейтрализованных монохлоруксусной, дихлоруксусной и трихлоруксусной кислот с концентрацией 0.01 моль/л при 20 °С. Во всех распределениях по степени гидратации кислотного остатка обнаружена зависимость интенсивности ионного тока от количества молекул воды в гидратной оболочке иона. При концентрации кислоты 0.01 моль/л количество гидратированных ионов монохлоруксусной и дихлоруксусной кислот монотонно уменьшается с увеличением степени их гидратации. Для раствора трихлоруксусной кислоты интенсивность ионного тока достигает максимума распределения при двух молекулах воды в ионе.
ВВЕДЕНИЕ
Галогенизированные уксусные кислоты широко распространены в окружающей среде и были обнаружены в воздухе, осадках, поверхностных и грунтовых водах [1] и в почве [2]. Глобальное распространение и высокая стабильность некоторых галогенуксусных кислот вызывают обеспокоенность в связи с тем, что они накапливаются в поверхностных водах и представляют угрозу для людей и экосистемы [3]. Интерес к источникам происхождения хлоруксусных кислот (ХК) и их судьбе быстро рос в течение последних десятилетий, однако многие вопросы, относящиеся к поведению их в водной среде, не до конца понятны [4]. Образование хлорсодержащих кислот в атмосфере также связывают в значительной степени с деградацией хлорвинила, широко используемого в производстве поливинилхлорида и образующегося при утилизации последнего.
Галогенсодержащие соединения в окружающую среду попадают в основном в результате деятельности предприятий органического синтеза, а также гидролизных, целюллозно-бумажных, деревообрабатывающих, коксохимических, лакокрасочных и фармацевтических производств. Кроме того, галогенорганические вещества образуются при хлорировании природных вод [5]. Благодаря своей устойчивости хлоруксусные кислоты могут накапливаться, и их негативное воздействие [6] может приобрести немалые масштабы. Достоверно известно, что галогенуксусные кислоты по содержанию в хлорированной воде занимают второе место после тригалогенметанов [7].
Монохлоруксусная кислота (МХК) играет заметную роль в тонком органическом синтезе. Наиболее значимыми направлениями использования МХК с коммерческой точки зрения считаются: производство карбометилцеллюлозы, синтез средств защиты растений, синтез стабилизаторов полимеров, производство натриевой соли монохлоруксусной кислоты и синтез поверхностно-активных компонентов.
Дихлоруксусная кислота (ДХК) широко используется в технологии органического синтеза, агрохимии и фармакологии. Особую обеспокоенность вызывает наличие этого токсиканта в природной и питьевой воде.
Трихлоруксусная кислота (ТХК) принадлежит к широкому классу хлорированных органических соединений, часто встречающихся в окружающей природе. Она создает агрессивную среду для всего живого [8] и ранее широко использовалась в качестве сильнодействующего гербицида. Методы количественного определения TХК в водных и твердых образцах и процессы формирования в естественных условиях установлены в работе [9]. Трихлоруксусная кислота в высоких концентрациях оказалась токсичной для водных и наземных организмов. С учетом высоких концентраций TХК, измеренных в различных почвах [10], существуют риски и для наземных организмов. Было показано, что поглощение растениями TХК из почв происходит довольно интенсивно. Совместное поглощение TХК из почвы и непосредственно из атмосферы также было показано в работе [10]. Моно- и дихлоруксусные кислоты могут одновременно с TХК присутствовать в атмосфере и почве. Совокупное воздействие TХК и соединений с аналогичными токсическими эффектами, обнаруженными в воздухе и почве, должно учитываться при оценках риска для наземных экосистем. В работе [11] показано, что ХК формируются в атмосфере естественным путем – в химических реакциях с участием таких хлорорганических соединений, как хлорэтилен, тетрахлорэтилен, хлорэтан, окисляющихся в присутствии озона, а также оксидов водорода, азота и углерода. Существуют биотические пути, которые важны для естественного образования ХК в почве.
Моно-, ди- и трихлоруксусные кислоты – продукты атмосферной деградации 1,1,1-трихлорэтана (максимальное время жизни – 4.8 лет) и тетрахлорэтилена (максимальное время жизни – 6 мес.), которые широко используются в производстве. Галогенуксусные кислоты, как правило, накапливаются в природных водах. Период полувыведения ТХК, МХК и ДХК в водной среде при температуре 288 К составляет 46, 15 и 68 лет соответственно [12]. По стабильности по отношению к термической деградации в природных водах эти кислоты можно распределить в следующем порядке, начиная с наиболее стабильной ДХК: ДХК > МХК > ТХК.
Физико-химических свойств, описывающих поведение ХК в воде, недостаточно для понимания процессов их трансформации и воздействия на окружающую среду. Это относится и к гидратации ионов, являющейся важнейшей стадией жидкофазных реакций. Гидратация определяет подвижность ионов, влияя на скорость химических реакций, что существенно для прогресса химической и биологической промышленности. В процессах диффузии должны учитываться как сами ионы, так и ионы с гидратной оболочкой. Наличие гидратных оболочек ионов, в частности, важно учитывать при изучении процессов, протекающих в аэрозолях, которые играют особую роль в атмосферных процессах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общая схема диссоциации водного раствора ХК на отрицательные ионы кислотного остатка (КО) и положительный ион водорода приведена ниже:
Далее происходит процесс гидратации иона CHmClnCOO– иона в воде:
Кислоты диссоциируют на положительный ион водорода и отрицательный ион кислотного остатка. Масс-спектры положительных ионов кислот идентичны: это ряд гидратированных ионов водорода Н+(Н2О)i, i = 0, 1, 2, …. Эти спектры малоинформативны, и поэтому эксперименты проводились с отрицательными ионами кислотного остатка ХК.
Эксперименты по изучению строения гидратированных анионов ХК проводились с помощью масс-спектрографического метода электрораспыления растворов электролитов в вакууме (ЭРРЭВ). Методика проведения эксперимента и экспериментальная установка подробно описаны в работе [13]. На рис. 1 приведена схема экспериментальной установки, подробно описанной в работе [14]. В этом методе раствор электролита по металлическому капилляру 6 подается непосредственно в высоковакуумную камеру 11 масс-спектрографа. При подаче на капилляр 8 высокого потенциала (~10 кВ) на выходном конце капилляра в вакуумной камере масс-спектрографа происходит электрораспыление раствора электролита, и в газовой фазе появляются ионы, эмитированные из раствора электролита. Знак заряда ионов совпадает со знаком высокого потенциала, поданного на капилляр. На выходном конце капилляра происходят следующие процессы. Поле высокого электрического потенциала, поданного на капилляр, провисает внутрь капилляра на его выходном конце. Когда поверхность раствора, движущегося по капилляру, достигает области провисания, в растворе возникают токи ионов, в результате чего на поверхности раствора образуется заряженный слой ионов, заряд которых совпадает со знаком высокого потенциала, поданного на капилляр, а величина потенциала этого слоя стремится стать равной величине высокого потенциала.
Рис. 1.
Схема экспериментальной установки: 1 – смотровое окно, 2 – отклоняющий конденсатор, 3 – исследуемый раствор, 4 – изолятор, 5 – нагреватель, 6 – медный капилляр, 7 – ловушка для жидкого азота, 8 – источник высокого напряжения, 9 – в масс-спектрограф, 10 – высоковакуумная откачка, 11 – входная диафрагма масс-спектрографа, 12 – регулировка потока раствора.
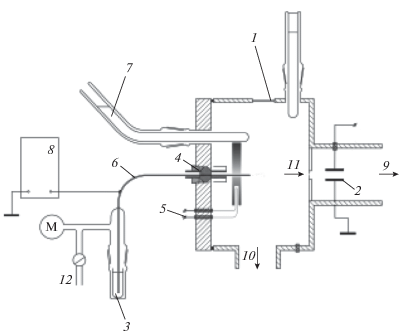
Как правило, эмиссия ионов из растворов электролитов осуществляется методами ЭРРЭВ и полевого испарения из растворов (ПИР). Зонами эмиссии ионов в обоих случаях служат кончики жидких “иголочек”, которые вытягиваются из заряженной поверхности раствора на конце капилляра под действием электрического поля, создаваемого высоким потенциалом.
При эмиссии ионов методом ПИР жидкие “иголочки” сохраняют свою форму, и эмиссия ионов с них может происходить непрерывно в течение долгого времени. При электрораспылении происходит периодическое взрывообразное разрушение кончика жидкой “иголочки”. Поэтому ПИР-ионы могут проявиться в масс-спектре только тогда, когда они предшествуют электрораспылению.
В масс-спектрах эти два механизма эмиссии ионов проявляются в виде дуплетов – двух близкорасположенных линий, которые иногда разделяются, но чаще перекрываются, давая несимметричную по форме, широкую масс-спектральную линию. Заметим, что пики ионов, происходящих из одного источника, всегда симметричны. Пространственное разделение линий дуплета происходит потому, что при электрораспылении ионы получают дополнительную скорость при взрывообразном разрушении кончика жидкой “иголочки”, и поэтому они в магнитном поле отклоняются сильнее, чем ПИР-ионы. Последние дают информацию только о концентрации ионов на поверхности раствора в зоне эмиссии. Их поверхностная концентрация зависит от потенциала капилляра и не связана с объемной концентрацией электролита. Линии ПИР-ионов иногда перекрываются линиями масс-спектров ЭРРЭВ, и желательно найти способы их подавления. Одним из таких способов может быть повышение температуры раствора, при котором уменьшается коэффициент поверхностного натяжения раствора.
Эмиссия ионов происходит импульсами, и поэтому для их регистрации используется интегрирующий способ записи масс-спектра на фотопленку или фотопластинку. Для того чтобы канал капилляра не забивался продуктами реакции кислот с материалом капилляра, использовались водные растворы ХК с добавлением КОН для полной их нейтрализации (рН=7). Работа с растворами полностью нейтрализованых ХК не только защищала напускной капилляр от засорения, но и увеличивала концентрацию ионов КО до величины концентрации кислоты в исходном растворе, способствуя этим созданию благоприятных условий для получения масс-спектров. Таким образом, мы заменяли анализ раствора кислоты анализом раствора ее кислотных остатков с той же концентрацией.
Условия эксперимента и исходные реактивы
Монохлоруксусная, дихлоруксусная и трихлоруксусная кислоты были производства компании Sigma-Aldrich, США, 99%-ной чистоты. Раствор кислот в дистиллированной воде приготавливался при температуре 293 К. Путем добавления щелочи КОН (Sigma-Aldrich, США) проводилась нейтрализация раствора кислот до рН=7. Условия проведения экспериментов: концентрация водного раствора каждой из ХК – 0.01 моль/л; температура раствора – 300 ± 2 К; напряжение на капилляре U = –10 кВ; точность определения интенсивностей масс-спектральных линий ~10–15%; расход раствора через капилляр ~3 ⋅ 10–5 см3 ⋅ с–1; точность измерения интенсивностей линий ионов – 0.5%.
Опубликованные в наших ранних работах [14–16] масс-спектры отрицательных ионов водных растворов нейтрализованых ХК состоят из гидратированых ионов кислотных остатков МХК, ДХК и ТХК и ионов гидроксила, появившихся в растворе из-за небольшого избытка гидроокиси калия при нейтрализации этих кислот. Таким образом, масс-спектр состоит из линий ионов, непосредственно связанных с ХК, и линий ионов, связанных с условиями эксперимента. Например, нейтрализация кислоты гидроокисью калия КОН приводит к появлению в исходном растворе ионов К+ с концентрацией, равной концентрации кислоты. Затем в исходном растворе может появиться небольшое количество ионов ОН–, если при нейтрализации кислоты случайно было добавлено КОН больше, чем нужно. Эти положительные и отрицательные ионы гидроокиси калия могут образовывать достаточно интенсивные ионные пары и соответствующие гидратные серии при их взаимодействии с ионами кислотных остатков ХК.
Ионы, связанные с условиями эксперимента, ниже не рассматриваются. В настоящей работе основное внимание уделено сравнению степеней гидратации нераспавшихся ионов хлоруксусных кислот. (Степень гидратации – это количество молекул воды в гидратной оболочке иона.) Гидратированные ионы выбраны с изотопами хлора 35Cl в кислотном остатке, что упрощает понимание процессов гидратации.
Масс-спектры гидратированых отрицательных ионов водных растворов нейтрализованых ХК показаны в табл. 1 и на рис. 2. В масс-спектре обнаружены пики гидратированных ионов кислотного остатка с m/z = 93, 111, 129, 147, 165, 183, 201 для МХК; m/z = 127, 145, 163, 181, 199, 217 для ДХК; m/z = 161, 179, 197, 215, 233, 251, 269, 287 для ТХК. В табл. 1 приведены количество молекул воды в ионе, масса иона, его интенсивность и структура.
Таблица 1.
Часть масс-спектра гидратированных ионов кислотного остатка хлоруксусных кислот
| Количество n молекул воды в ионе | Интенсивность ионов водного раствора хлоруксусных кислот | ||
|---|---|---|---|
| МХК (35ClH2COO)–(H2O)n |
ДХК (35Cl2HCOO)–(H2O)n |
ТХК (35Cl3COO)–(H2O)n |
|
| 0 | 100 (93) | 100 (127) | 047 (161) |
| 1 | 52 (111) | 78.7 (145) | 081.8 (179) |
| 2 | 27 (129) | 58.7 (163) | 100 (197) |
| 3 | 22 (147) | 32 (181) | 066.8 (215) |
| 4 | 15 (165) | 12 (199) | 033.5 (233) |
| 5 | 5.7 (183) | 7.3 (217) | 020.6 (251) |
| 6 | 2.3 (201) | – | 011.8 (269) |
| 7 | – | – | 007.7 (287) |
Рис. 2.
Распределение по степени гидратации для нераспавшихся ионов хлоруксусных кислот с атомами изотопов 35Cl: ◼ – МХК/Н2О, ⚫ – ДХК/Н2О, ▲ – ТХК/Н2О.
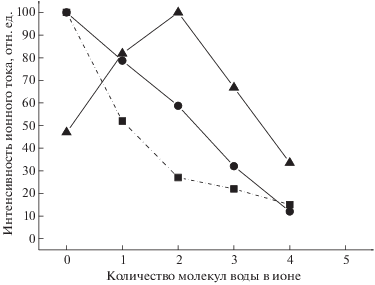
Гидратация происходит в равновесных условиях. Последнее подразумевает, что сильносвязанные с ионом молекулы воды сохраняются в форме гидратируемого иона при эмиссии. Рассмотрим распределение ионов КО по степени их гидратации. Подобная зависимость представлена на рис. 2 для нераспавшихся ионов КО с атомами 35Cl. Видно, что в области между дважды и трижды гидратированными ионами КО зависимость претерпевает излом или максимум распределения, который является характерным свойством последних. Гидратные оболочки ионов, образующиеся в водном растворе в равновесных условиях, можно рассматривать как сумму двух структур. Первую структуру образуют сильносвязанные, а вторую – слабосвязанные с ионом молекулы воды. При эмиссии гидратированных ионов методом ЭРРЭВ первая структура сохраняется, а вторая частично разрушается. Мы полагаем, что этот излом определяет границу между внутренней и внешней гидратными оболочками. Во внутренней оболочке, свойства которой определяются ионами хлора, может находиться не больше двух молекул воды. Все остальные молекулы воды образуют внешнюю гидратную оболочку, структура которой является переходной от структуры внутренней оболочки к структуре чистого растворителя (воды).
Полученное для МХК и ДХК распределение показывает, что в их водных растворах присутствуют наборы ионов с разной степенью гидратации, и при концентрации электролита 0.01 моль/л количество гидратированных ионов монотонно уменьшается с увеличением степени их гидратации. Сложно объяснить наличие максимума на кривой распределения степени гидратации КО трихлоруксусной кислоты. В доступной авторам литературе величин дипольных моментов ХК в водном растворе обнаружить не удалось [17].
В работе [18] были оценены распределение заряда и дипольные моменты нескольких алифатических кислот. Электрические моменты монохлор- (2.86 Д) и трихлоруксусных (3.00 Д) кислот были измерены в растворе диоксана при температуре 35°С. Экспериментальные значения сравнивались с рассчитанными теоретически и были обсуждены с точки зрения различных возможных структур. Если принять, что дипольные моменты кислот в воде незначительно отличаются от аналогичных величин в диоксане, то ион-дипольное притяжение для ионов КО трихлоруксусной кислоты в водном растворе превышает таковое для КО монохлоруксусной кислоты. Это может служить косвенным объяснением более прочного удержания молекул воды в гидратной оболочке ТХК.
ЗАКЛЮЧЕНИЕ
Масс-спектрографическим методом электрораспыления растворов электролитов в вакууме получен масс-спектр отрицательных ионов водного раствора полностью нейтрализованных монохлоруксусной, дихлоруксусной и трихлоруксусной кислот с концентрацией 0.01 моль/л при 20 °С.
На распределении по степени гидратации для нераспавшихся ионов КО дихлорукусусной и монохлоруксусной кислот обнаружены изломы в области между дважды и трижды гидратированными ионами КО. Этот излом трактуется как граница между внутренней и внешней гидратными оболочками ионов КО. На аналогичном распределении для трихлорукусусной кислоты обнаружен максимум в области между дважды и трижды гидратированными ионами КО.
Гидратные оболочки ионов, образующиеся в водном растворе в равновесных условиях, можно рассматривать как сумму двух структур. Первую структуру образуют сильносвязанные, а вторую – слабосвязанные с ионом молекулы. При эмиссии гидратированных ионов из раствора в вакуум при электрораспылении первая структура сохраняется, а вторая частично разрушается.
Полученные результаты могут быть использованы при построении моделей миграции и трансформации галогенсодержащих соединений в окружающей среде.
Работа поддержана грантом Российского фонда фундаментальных исследований № 19-05-50076-Микромир и госзаданием РФ № АААА-А20-120021390044-2.
Список литературы
Lifongo L.L., Bowden D.J., Brimblecombe P. // Chemosphere. 2004. V. 55. P. 467; https://doi.org/10.1016/j.chemosphere.2003.11.006
Peters R.J.B. // J. Environ. Monit. 2003. V. 5. P. 275; https://doi.org/10.1039/b209757p
Wang L., Zhang Q., Chen B., Bu Y. et al. // J. Hazard. Mater. 2020. V. 391. P. 122143;https://doi.org/10.1016/j.jhazmat.2020.122143
Скурлатов Ю.И., Вичутинская Е.В., Зайцева Н.И. и др. // Хим. физика. 2017. Т. 36. № 7. С. 42.
Zhang X., Minear R.A. // Water Res. 2002. V. 36. P. 3665.
Штамм Е.В., Скурлатов Ю.И., Рощин А.В. и др. // Хим. физика. 2019. Т. 11. С. 16.
Hoekstra E.J. // Chemosphere. 2003. V. 52. P. 355.
Lewis T.E., Wolfinger T.F., Barta M.L. // Environ. Intern. 2004. V. 30. № 8. P. 1119; https://doi.org/10.1016/j.envint.2004.04.003
Wu C., Wei D., Fan J., Wang L. // Chemosphere. 2001. V. 44. P. 1293; https://doi.org/10.1016/s0045-6535(00)00273
Weissflog L., Krueger G., Elansky N. // Ibid. 2006.V. 65. P. 975; https://doi.org/10.1016/j.chemosphere.2006.03.039
Wenger J.C., Le Calvé SSidebottom H.W. et al. // Environ. Sci. Technol. 2004. V. 38. № 3. P. 831.
Lifongo L.L., Bowden D.J., Brimblecombe P. // Intern. J. Phys. Sci. 2010. V. 5. № 6. P. 738.
Карпов Г.В. // Электрохимия. 2010. Т. 46. № 1. С. 100;https://doi.org/10.1134/S102319351001012X
Карпов Г.В., Виноградова О.А., Васильев Е.С., Морозов И.И. // Хим. физика. 2018. Т. 37. № 7. С. 1.
Карпов Г.В., Виноградова О.А., Васильев Е.С., Бутковская Н.И., Морозов И.И., Петров Ю.И., Сыромятников А.Г. // Хим. без-ть. 2017. Т. 1. № 2. С. 97; https://doi.org/10.25514/CHS.2017.2.10984
Karpov G.V., Morozov I.I., Vasiliev E.S. et al. // Chem. Phys. Lett. 2013. V. 586. P. 40; https://doi.org/10.1016/j.cplett.2013.09.037
Зленко Д.В., Стовбун С.В. // Хим. физика. 2014. Т. 33. № 8. С. 37; https://doi.org/10.7868/S0207401X14080135
Krishnamurthy S.S., Soundararajan S. // Tetrahedron. 1968. V. 24. № 1. P. 167; https://doi.org/10.1016/0040-4020(68)89018-0
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


