Химическая физика, 2021, T. 40, № 3, стр. 10-16
Строение и свойства бирадикала, содержащего ацетиленовые и фениленовые группы в мостике
А. И. Кокорин 1, 2, *, О. И. Громов 3, А. Е. Путников 2, П. В. Дороватовский 4, Я. В. Зубавичус 5, В. Н. Хрусталёв 6, 7
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
5 Институт катализа им. Г.К. Борескова Сибирского отделения Российской академии наук
Новосибирск, Россия
6 Российский университет дружбы народов (РУДН)
Москва, Россия
7 Институт органической химии им. Н.Д. Зелинского Российской академии наук
Москва, Россия
* E-mail: alex-kokorin@yandex.ru
Поступила в редакцию 22.06.2020
После доработки 09.07.2020
Принята к публикации 20.07.2020
Аннотация
Методами рентгеноструктурного анализа (РСА) и электронного парамагнитного резонанса (ЭПР) X-диапазона исследованы строение и свойства нитроксильного бирадикала Б1 и его радикального аналога Р1, в котором радикальные пиперидиноксильные кольца связаны двумя ацетиленовыми (‒C≡C–) и двумя пара-фениленовыми (–p-C6H4–) группами. Доказано существование Б1 в растворах в виде двух (цис- и транс-) конформеров, характеризующихся разными величинами обменного интеграла |J|, с переходами между ними. Геометрия стабильного нитроксильного бирадикала Б1 в обеих конформациях, рассчитанная методом функционала плотности (DFT), хорошо согласуется с данными РСА.
ВВЕДЕНИЕ
Многие органические, металлорганические и радикальные соединения, содержащие несколько парамагнитных центров в своей структуре (радикалы и/или ионы переходных металлов), представляют большой интерес для создания на их основе новых молекулярных магнетиков и ферромагнетиков [1–5]. Значительное число систем этого типа могут быть созданы на основе стабильных нитроксильных олиго- и полирадикалов, синтез которых хорошо разработан [6–9]. Важную роль в реализации магнитных и ферромагнитных свойств играет внутри- и межмолекулярный спиновый обмен между спинами неспаренных электронов, подробно изученный в работах [10–12].
Значительный интерес в этом плане представляет исследование внутримолекулярного спинового обмена в нитроксильных бирадикалах с различными величинами обменного интеграла J, которые содержат разное число ацетиленовых и фениленовых групп в мостике, соединяющем 1-оксил-2,2,6,6-тетраметилпиперидиновые радикальные фрагменты [6, 8, 12–19]. Меняя число групп –C≡C– и –p-C6H4–, можно варьировать величину обменного интеграла в диапазоне 10 < |J| < 3200 МГц [20]. Синтез таких бирадикалов и исследование особенностей их поведения в растворах представляют несомненный интерес в плане получения органических магнетиков с новыми свойствами. При этом первостепенными задачами остаются выяснение точного строения и возможности конформационных переходов в них. Основной целью данной работы было детальное исследование структуры и конформационных особенностей нового стабильного бирадикала, в котором радикальные кольца соединены между собой мостиком, содержащим по две ацетиленовые и пара-фениленовые группы, а также его монорадикального аналога.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали образцы бирадикала R6–C≡C–(p-C6H4)2–C≡C–R6 (Б1) и радикала p‑C6H5–C≡C–R6 (Р1) (R6 есть 1-оксил-2,2,6,6-тетраметилпиперидин-3-ен-), синтезированные по методике, подробно изложенной в работе [18], и любезно предоставленные проф. T. Kálai (Institute of Organic and Medicinal Chemistry, University of Pécs, Hungary). Бирадикал Б1 выделен в виде темно-желтого кристаллического порошка с Тпл = = 230–233 °C, Rf = 0.60 (смесь гексан/этилацетат в соотношении 2 : 1). В качестве побочного продукта получен монорадикал Р1 [18].
Рентгеноструктурное исследование
Параметры элементарных ячеек и интенсивности отражений для соединений Р1 и Б1 измерены на экспериментальной станции Национального исследовательского центра “Курчатовский институт”, оснащенной двухкоординатным CCd-детектором Rayonix SX165 (T = 100 K, φ-сканирование с шагом 1.0°). Обработка экспериментальных данных проведена с помощью программы iMOSFLM, входящей в комплекс программ CCP4 [21]. Для полученных данных проведен учет поглощения рентгеновского излучения по программе Scala [22]. Основные кристаллоструктурные данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения кристаллической структуры для соединений Р1 и Б1
| Параметры | Р1 | Б1 |
|---|---|---|
| Эмпирическая формула | C17H20NO | C34H38N2O2 |
| Масса, а.е. | 254.33 | 506.66 |
| T, K | 100(2) | 100(2) |
| λ, Å | 0.96600 | 0.96260 |
| Размеры кристалла, мм | ∼0.25 × 0.20 × 0.20 | ∼0.05 × 0.20 × 0.40 |
| Тип кристалла (сингония) | орторомбический | моноклинный |
| Пространственная группа | Fdd2 | P21/c |
| a, Å | 11.931(2) | 17.822(4) |
| b, Å | 14.313(3) | 8.2444(16) |
| c, Å | 16.521(3) | 10.369(2) |
| α, ° | 90 | 90 |
| β, ° | 90 | 99.97(3) |
| γ, ° | 90 | 90 |
| V, Å3 | 2821.3(9) | 1500.5(5) |
| Z | 8 | 2 |
| dc, г ⋅ см-3 | 1.198 | 1.121 |
| F(000) | 1096 | 544 |
| μ, мм−1 | 0.148 | 0.138 |
| 2θmax, ° | 76.4 | 71.0 |
| Диапазон индексов отражения | –15 ≤ h ≤ 15 | –21 ≤ h ≤ 14 |
| –14 ≤ k ≤ 17 | –9 ≤ k ≤ 9 | |
| –18 ≤ l ≤ 17 | –12 ≤ l ≤ 12 | |
| Количество собранных рефлексов | 8858 | 11381 |
| Количество уникальных рефлексов, Rint | 1269(0.113) | 2709(0.116) |
| Количество рефлексов с I > 2σ(I) | 1142 | 1565 |
| Количество независимых рефлексов/зафиксированные параметры/всего параметров уточнения | 1269/5/104 | 2709/18/172 |
| R1, wR2 (I > 2σ(I)) | 0.059, 0.138 | 0.103, 0.227 |
| R1 и wR2 (все данные) | 0.073, 0.157 | 0.162, 0.262 |
| Фактор GOF на F 2 | 1.071 | 1.016 |
| Коэффициент экстинкции | 0.0096(9) | 0.009(1) |
| Tmin, Tmax | 0.955, 0.961 | 0.940, 0.980 |
Примечание: V, Å3 – объем элементарной ячейки, Z – число молекул в элементарной ячейке, dc, г/см3 – расчетная плотность, F(000) – число электронов в элементарной ячейке, μ, мм–1 – коэффициент поглощения рентгеновского излучения, h, k, l – кристаллографические индексы плоскостей; фактор GOF (Goodness of fit) – показатель добротности подгонки, Tmin, Tmax – коэффициенты пропускания рентгеновского излучения.
Структуры определены прямыми методами и уточнены полноматричным методом наименьших квадратов по F 2 в анизотропном приближении для неводородных атомов. Нитроксидный цикл 1-оксил-2,2,6,6-тетраметил-3-ен- в соединении Р1 и бензольные циклы в соединении Б1 разупорядочены по двум положениям, каждый – с равными заселенностями. Абсолютная структура соединения Р1 определена объективно уточнением параметра Флэка, который равен 0.2(5). Положения атомов водорода в обоих соединениях рассчитаны геометрически и включены в уточнение с фиксированными позиционными параметрами (модель “наездник”, “riding” model) и изотропными параметрами смещения (Uiso(H) = 1.5Ueq(C) для CH3-групп и Uiso(H) = 1.2Ueq(C) для остальных групп). Все расчеты проведены с использованием комплекса программ SHELXTL [23]. Таблицы координат атомов, длин связей, валентных и торсионных углов и анизотропных параметров смещения для соединений Р1 и Б1 депонированы в Кембриджском банке структурных данных, номера депонирования – CCDC 1900147 (Р1) и CCDC 1900148 (Б1).
В качестве растворителя был выбран толуол марки “ч.д.а” (Fluka), который дополнительно очищали и сушили над молекулярными ситами в соответствии с рекомендациями из работы [24]. Растворы Р1 и Б1 в концентрации не более 2 ⋅ 10–4 моль/л, чтобы исключить межмолекулярный спиновый обмен [10], в объеме 0.4 мл раствора помещали в тонкую кварцевую ампулу диаметром 3.5 мм, затем три раза вакуумировали (10–3 Торр), замораживая при 77 K и размораживая ампулу для удаления кислорода, а затем отпаивали под вакуумом.
ЭПР-измерения и расчеты
Спектры ЭПР регистрировали на спектрометре X-диапазона Varian E3 (частота модуляции – 100 кГц), оборудованным термостатирующим блоком ER 4131VT (точность термостабилизации составляет ±0.5 K). Температуру варьировали в диапазоне 200–350 K. Для каждого спектра ЭПР определяли величину константы a сверхтонкого взаимодействия (СТВ), измеряли положение линий спектра в магнитном поле, ширины и амплитуды индивидуальных линий. Для точности измерений градуировали магнитное поле, используя эталон, содержащий примесные ионы Mn2+ в матрице MgO. Обработку экспериментальных и расчет теоретических спектров ЭПР проводили, используя пакет компьютерных программ, разработанный проф. А.Х. Воробьёвым (Химический факультет Московского государственного университета им. М.В. Ломоносова) [25].
Геометрические параметры нитроксильного бирадикала Б1 в триплетном состоянии рассчитаны в рамках теории функционала плотности (DFT) на уровне UDFT/B3LYP с полноэлектронным базисным набором cc-PVTZ [26]. Стационарные точки определяли как минимумы на поверхности потенциальной энергии (PES), достижение минимума доказывалось с помощью расчета частот нормальных колебаний. Равновесные геометрии рассчитывали с учетом растворителя (толуола), используя модель COSMO [27]. Расчеты проводили с использованием программного пакета ORCA 4.1 [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Строение соединений Р1 и Б1 в кристалле было однозначно установлено методом РСА. Их молекулярные структуры показаны на рис. 1 и 2, а избранные геометрические параметры представлены в табл. 2 и 3.
Рис. 1.
Молекулярная структура радикала Р1 с 50%-ными вероятностными эллипсоидами анизотропных смещений. Атомы водорода не изображены. Альтернативное положение 1-оксил-2,2,6,6-тетраметил-3-ен-нитроксильного кольца показано пунктирными линиями.
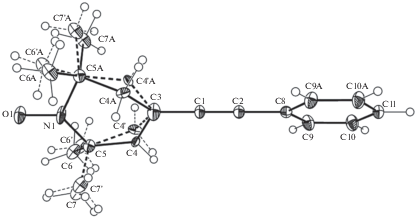
Рис. 2.
Молекулярная структура бирадикала Б1 с 50%-ными вероятностными эллипсоидами анизотропных смещений. Альтернативные положения бензольных колец показаны пунктирными линиями.
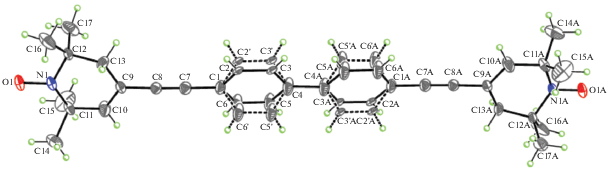
Таблица 2.
Избранные длины связей и углы для радикала Р1
| Тип связи | Длина связи, Å | Тип связи | Валентный угол, ° |
|---|---|---|---|
| O1─N1 | 1.298(4) | O1─N1─C5 | 117.30(13) |
| N1─C5 | 1.479(2) | C5A─N1─C5 | 125.4(3) |
| C1─C2 | 1.205(5) | C1─C3─C4 | 119.2(2) |
| C1─C3 | 1.419(5) | C1─C3─C4A | 119.9(2) |
| C2─C8 | 1.439(5) | C4─C3─C4A | 116.0(3) |
| C3─C4 | 1.386(5) | C3─C4─C5 | 123.0(3) |
| C3─C4A | 1.525(5) | C3─C4A─C5A | 110.3(3) |
| C4─C5 | 1.490(5) | N1─C5─C4 | 113.1(2) |
| C4A─C5A | 1.557(6) | N1─C5A─C4A | 108.4(2) |
| O1•…O1•* | 6.226(3) | – | – |
Таблица 3.
Избранные длины связей и углы для бирадикала Б1
| Связь | Длина связи, Å | Тип связи | Величина, ° |
|---|---|---|---|
| O1─N1 | 1.299(4) | O1─N1─C11 | 115.8(3) |
| N1─C12 | 1.498(4) | O1─N1─C12 | 117.7(3) |
| N1─C11 | 1.502(5) | C11─N1─C12 | 123.4(3) |
| C7─C8 | 1.211(5) | C8─C9─C10 | 121.1(4) |
| C8─C9 | 1.450(5) | C8─C9─C13 | 119.4(3) |
| C9─C10 | 1.369(5) | C10─C9─C13 | 119.5(3) |
| C9─C13 | 1.418(5) | C9─C10─C11 | 125.5(4) |
| C10─C11 | 1.495(6) | N1─C11─C10 | 110.3(3) |
| C12─C13 | 1.494(5) | N1─C12─C13 | 108.9(3) |
| O1•…O1• | 23.667(3) | C9─C13─C12 | 122.1(3) |
| O1•…O1•* | 3.940(3) | – | – |
Молекулы Р1 в кристаллической структуре занимают частное положение на оси второго порядка. Поскольку соединение Р1 не обладает собственной симметрией C2 (2), то это означает, что его различные конформеры занимают в кристалле одни и те же кристаллографические позиции и, следовательно, статистически разупорядочены.
Радикал Р1 содержит длинную цепь сопряженных связей Ph–C2≡C1–C3=C4–C5. Однако следует отметить, что фрагмент Ph–C2≡C1–C3 развернут относительно базальной плоскости тетрагидропиридинового цикла на 37.4(4)°. В радикале Р1 1,2,5,6-тетрагидропиридиновый цикл принимает конформацию типа слегка искаженной “софы” с отклонением атома углерода C4A от средней плоскости, проведенной через остальные атомы цикла, на 0.664(5) Å. Атом азота N1 имеет тригонально-планарную конфигурацию (сумма значений валентных углов при атоме азота равна 360.0(6)°).
Длина связи N–O• в Р1 (1.298(4) Å, табл. 2) несколько превышает длины соответствующих связей в ранее изученных родственных соединениях (1.279(4)–1.2858(9) Å, [29–31]). Кратчайшие межмолекулярные расстояния O•…O• между парамагнитными центрами в структуре Р1 равны 6.226(3) Å (симметрические операции – [1/4 + x, 1¼ – y, 1/4 + z], [1/4 + x, 3/4 – y, –1/4 + z], [–1/4 + x, 1¼ – y, –1/4 + z], [–1/4 + x, 3/4 – y, 1/4 + z]). В кристалле молекулы Р1 образуют стопки вдоль кристаллографической оси a и расположены на ван-дер-ваальсовых расстояниях.
Бирадикал Б1 представляет собой димер, образованный связыванием друг с другом молекул Р1 посредством атомов углерода в пара-положениях фенильных заместителей. Молекулы Б1 в кристаллической структуре занимают частное положение в центре. Однако вследствие стерических взаимодействий между центральными бензольными циклами наличие собственной симметрии Ci ($\bar {1}$) в молекуле Б1 является энергетически невыгодным. Поэтому в кристалле существует статистическая разупорядоченность, связанная с суперпозицией двух молекул, имеющих скрученный на 30.7(6)° бифенильный фрагмент.
Как и в случае радикала Р1, 1,2,5,6-тетрагидропиридиновый цикл в Б1 принимает конформацию типа слегка искаженной “софы” с отклонением атома углерода C12 от средней плоскости, проведенной через остальные атомы цикла, на 0.338(6) Å. Тем не менее важно заметить, что тетрагидропиридиновые циклы в Б1 являются более уплощенными, чем в соединении Р1. Кроме того, наибольший угол между плоскостями бензольных циклов и базальными плоскостями тетрагидропиридиновых циклов (в случае C1/C2/C3/C4/C5/C6 и N1/C9/C10/C11/C12/C13) значительно меньше (16.9(5)°), чем в Р1. Интересно отметить, что атомы O1–N1…C9–C8≡C7–C1–C4–C4A…C1A–C7A≡C8A– C9…N1A–O1A лежат фактически на одной прямой, приводя к внутримолекулярному расстоянию O•…O•, равному 23.667(9) Å.
В отличие от соединения Р1 длина связи N–O• в Б1 (1.299(4) Å, см. табл. 3) хорошо согласуется со значениями соответствующих связей в известных бирадикальных соединениях (1.285(2)–1.32(1) Å, [17, 23, 32]). Кратчайшее межмолекулярное расстояние O•…O• [–x, 1 – y, –z] между парамагнитными центрами в структуре Б1 равно 3.940(6) Å. В кристалле молекулы Б1 образуют стопки вдоль кристаллографической оси b и расположены на ван-дер-ваальсовых расстояниях.
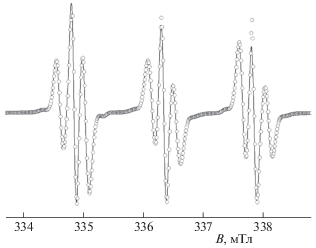
Исследование методом ЭПР растворов бирадикала Б1 в толуоле показало, что в спектре (рис. 3), наряду с тремя основными характерными для нитроксильных радикалов, присутствуют линии, свидетельствующие о наличии внутримолекулярного спинового обмена и позволяющие определить величину обменного интеграла. Действительно, положение и интенсивность всех линий в спектре ЭПР описывается одним значением обменного интеграла |J|, равным (12.5 ± 0.5) МГц при 350 K, что подтверждается расчетом теоретического спектра, приведенным на рис. 3. Измеренная величина a = (1.5 ± 0.02) мТл, что согласуется с данными, известными из литературы [15, 33].
Рис. 3.
Экспериментальный (линия) и теоретический (кружки) спектры ЭПР бирадикала Б1 в толуоле при 313 K.
В общем случае в магнитно-разбавленных жидких маловязких растворах спектр бирадикала можно описать спин-гамильтонианом $\hat {H},$ учитывающим только изотропное сверхтонкое, зеемановское и спин-обменное взаимодействия, так как магнитное диполь-дипольное взаимодействие усредняется до нуля быстрой вращательной диффузией молекул [11]:
где все радикальные фрагменты считаются одинаковыми, индексы k и m обозначают разные радикальные фрагменты, и k, m ≤ 2 для бирадикала. Кроме того, k < m, Jkm – величина обменного интеграла между радикальными фрагментами k и m. Такое приближение выполняется, а заметные поправки могут возникнуть только в случае Sk > 1/2, как это было проанализировано в работе [34].
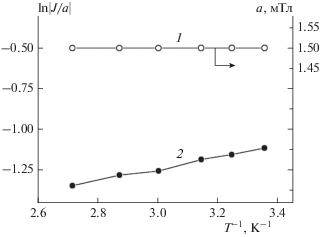
При варьировании температуры от 270 до 350 K наблюдаются изменения в спектрах ЭПР, подтверждаемые компьютерным моделированием. Отметим, что все изменения спектров ЭПР при варьировании температуры были полностью обратимы. На рис. 4 представлены экспериментальные зависимости константы СТВ a и величины обменного интеграла (в единицах a) бирадикала Б1. Из рисунка видно, что значение a практически не меняется, в то время как величина |J/a| заметно убывает при повышении температуры, что указывает на ослабление внутримолекулярного спинового обмена. Такую зависимость |J| от T можно объяснить увеличением подвижности отдельных радикальных колец в Б1 в виде почти свободного вращения радикалов R6 вокруг главной молекулярной оси Б1 и линейных групп ‒C≡C–, как это было показано в работах [17, 18] для бирадикалов R6–C≡C–R6, R6–C≡C–C≡C–R6 и R6–C≡C–p-C6H4–C≡C–R6. На аналогичную возможность быстрых переходов между транс- и цис-конформациями указывает также наличие этих изомеров, обнаруженное методом РСА (рис. 2, табл. 3). Отметим, что величина a в случае радикала Р1 совпадает с графиком для Б1 в пределах погрешности измерения.
Рис. 4.
Зависимость константы СТВ а (1) и величины обменного интеграла |J/a| (2) бирадикала Б1 от температуры.
Важные результаты были получены квантовохимическими расчетами по методу DFT. Геометрическое строение бирадикала Б1 показано на рис. 5, на котором приведены значения длин связей, величины валентных углов для транс- и цис-конформеров. Рассчитанный важный структурный параметр – расстояние RNO–NO между неспаренными электронами >N–O•-групп нитроксильных фрагментов в Б1, равный 23.28 Å, весьма близок к значению, полученному методом РСА для монокристалла.
Рис. 5.
Геометрические строения транс- (а) и цис- (б) конформаций бирадикала Б1, рассчитанные в рамках теории функционала плотности на уровне B3LYP/cc-PVTZ.
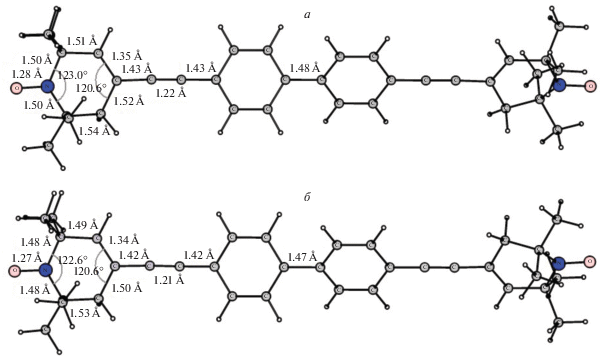
Рассчитанное из температурной зависимости |J/a| эффективное значение разности энтальпий ΔH двух конформаций, между которыми происходят быстрые переходы в бирадикале Б1, равен –(2.9 ± 0.3) кДж/моль (4.0 кДж/моль по данным расчета в рамках теории функционала плотности). Следовательно, даже при довольно низких температурах легко происходят конформационные переходы, что приводит к усреднению значений |J/a|. Этому способствует низкий потенциальный барьер Ea переходов, приводящий к усреднению спектральных параметров конформеров при высоких температурах, как это было показано в работах [16, 17].
ЗАКЛЮЧЕНИЕ
Проведено исследование строения и свойств нитроксильного бирадикала Б1, в котором радикальные пиперидиноксильные кольца связаны двумя ацетиленовыми и двумя пара-фениленовыми группами, а также его аналога – радикала Р1 методами рентгеноструктурного анализа и электронного парамагнитного резонанса. Доказано существование бирадикала в растворах в виде цис- и транс-конформеров, имеющих разные величины обменного интеграла |J|, с быстрыми переходами между ними. Квантовохимические расчеты методом DFT геометрии цис- и транс-изомеров бирадикала Б1 показали хорошее согласие с данными РСА для обоих конформеров.
Работа выполнена при финансовой поддержке Министерством науки и высшего образования РФ (проект № 075-03-2020-223 (FSSF-2020-0017)). Я.В. Зубавичус благодарен Министерству науки и высшего образования РФ за частичную финансовую поддержку по госзаданию Института катализа им. Г.К. Борескова СО РАН (проект АААА-А19-119020890025-3). Авторы благодарят проф. А.Х. Воробьёва (Химический факультет Московского государственного университета им. М.В. Ломоносова) за предоставление пакета программ для расчета спектров ЭПР, проф. T. Kálai (Institute of Organic and Medicinal Chemistry, University of Pécs, Hungary) за предоставление образцов моно- и бирадикала и О.А. Романова за помощь в оформлении статьи.
Список литературы
Miller J.S., Epstein A.J., Reiff W.M. // Science. 1988. V. 240. № 1. P. 40.
Овчаренко В.И., Сагдеев Р.З. // Успехи химии. 1999. Т. 68. № 5. С. 381.
Yang B., Xiao Z., Yuan Y. et al. // Polymer. 2013. V. 54. № 2. P. 490.
Miller J.S. // Mater. Today. 2014. V. 17. № 5. P. 224.
Tuček J., Holá K., Bourlinos A.B. et al. // Nat. Commun. 2017. V. 8. P. 14525.
Розанцев Э.Г. Свободные иминоксильные радикалы. М.: Химия, 1970.
Имидазолиновые нитроксильные радикалы / Под ред. Молина Ю.Н. Новосибирск: Наука, 1988.
Rassat A. // Pure Appl. Chem. 1990. V. 62. № 2. P. 223.
Volodarsky L.B., Reznikov V.A., Ovcharenko V.I. Synthetic Chemistry of Stable Nitroxides. Boca Raton, FL: CRC Press, 1994.
Замараев К.И., Молин Ю.Н., Салихов К.М. Спиновый обмен: Теория и физико-химические приложения. Новосибирск: Наука, 1977.
Пармон В.Н., Кокорин А.И., Жидомиров Г.М. Стабильные бирадикалы. М.: Наука, 1980.
Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. Электронное строение, реакционная способность и применение. М.: Химия, 1973.
Кокорин А.И., Павликов В.В., Шапиро А.Б. // Докл. АН СССР. 1980. Т. 253. № 1. С. 147.
Corvaja C., De Marchi M., Toffoletti A. // Appl. Magn. Reson. 1997. V. 12. № 1. P. 1.
Kokorin A.I. // Ibid. 2004. V. 26. № 2. P. 253.
Kokorin A.I., Golubeva E.N., Mladenova B. et al. // Ibid. 2013. V. 44. № 9. P. 1041.
Gromov O.I., Golubeva E.N., Khrustalev V.N. et al. // Ibid. 2014. V. 45. № 10. P. 981.
Kokorin A.I., Gromov O.I., Kalai T., Hideg K. // Ibid. 2016. V. 47. № 11. P. 1283.
Кокорин А.И., Громов О.И., Kalai T., Hideg K., Путников А.Е. // Хим. физика. 2019. Т. 38. № 10. С. 17.
Likhtenshtein G.I. Nitroxides. Brief History, Fundamentals, and Recent Developments. Ch. 5. Berlin: Springer, 2020. P. 93.
Evans P.R. // Acta Crystallogr. D. 2006. V. 62. P. 72.
Battye T.G.G., Kontogiannis L., Johnson O. et al. // Ibid. 2011. V. 67. P. 271.
Шибаева Р.П., Розенберг Л.П. // Журн. структур. химии. 1975. Т. 16. № 2. С. 236.
Riddick J.A., Bunger W.B., Sakano T.K. Organic Solvents: Physical Properties and Methods of Purification. Techniques of Chemistry. V. II. New York: Wiley-Interscience, 1986.
Vorobiev A.Kh., Chumakova N.A. // Nitroxides – Theory, Experiment and Applications / Ed. Kokorin A.I. Riecka: InTech Publ., 2012. P. 57.
Dunning T.H., Jr. // J. Chem. Phys. 1989. V. 90. P. 1007.
Sinnecker S., Rajendran A., Klamt A., Diedenhofen M., Neese F. // J. Phys. Chem. A. 2006. V. 110. P. 2235.
Neese F. // Wiley Interdiscip. Rev. Comput. Mol. Sci. 2017. V. 8. Issue 1. P. e1327.
Igonin V.A., Shklover V.E., Struchkov Yu.T., Lazareva O.L., Vinogradov G.A. // Acta Crystallogs. 1990. V. 46. P. 776.
Wiley D.W., Calabrese J.C., Harlow R.L., Miller J.S. // Angew. Chem. Intern. Ed. 1991. V. 30. P. 450.
Bats J.W., Frolow O., Engels J.W. // Acta Crystallogr. E. 2009. V. 65. Issue 3. P. o529.
Shklover V.E., Zamaev I.A., Struchkov Yu.T. et al. // Z. Kristallogr. 1990. V. 191. P. 9.
Lebedev Ya.S., Grinberg O.Ya., Dubinsky A.A., Poluektov O.G. // Bioactive Spin Labels / Ed. Zhdanov R.I. Berlin: Springer, 1992. P. 228.
Цукерблат Б.С., Белинский М.И. Магнетохимия и радиоспектроскопия обменных кластеров. Кишинев: Штиинца, 1983.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


