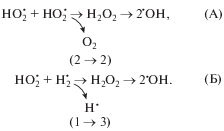Химическая физика, 2021, T. 40, № 5, стр. 36-45
Ценностнoe численное выявление и анализ критических состояний химических реакционных систем
Л. А. Тавадян 1, *, Г. А. Мартоян 2
1 Институт химической физики им. А.Б. Налбандяна национальной Академии наук
Республики Армения
Ереван, Армения
2 Научно-производственная компания “Экоатом”
Ереван, Армения
* E-mail: tavadyan@ichph.sci.am
Поступила в редакцию 03.11.2020
После доработки 17.11.2020
Принята к публикации 20.11.2020
Аннотация
Представлен ценностный метод численного выявления и анализа критических (предельных) состояний химических реакционных систем. В качестве критерия оценки критических состояний реакций предложено экстремальное поведение реакционной системы, при котором при малых изменениях исходных параметров меняется ее качественное поведение. Задача вариационного исчисления при целевом условии решалась с использованием принципа максимума Понтрягина. Ценностный подход, который основывается на гамильтоновой систематизации кинетических уравнений многостадийных реакций, отличается сравнительной простотой расчетных процедур и позволяет также определять ценности – кинетические значимости отдельных химических стадий и химических компонентов реакции. На примере кинетической модели реакционной смеси водорода с кислородом, включающей 42 отдельные стадии и 8 химических компонентов, описаны три известных предела самовоспламенения согласно диаграммe давление–температура (P–T). Предсказано существование в реакционной системе H2/O2 нового вырожденного 4-го предела. Путем выявления ценностной численной субординации химических компонентов и отдельных стадий кинетического механизма реакции водорода с кислородом химически интерпретированы предельные явления.
ВВЕДЕНИЕ
При описании критических явлений исходили из того, что они в первую очередь характеризуются качественным изменением режима протекания реакции при незначительных изменениях исходных концентраций реагентов, кинетических параметров реакционной системы и/или внешних условий (давление, температура), характеристик реактора – его материала, размеров, геометрической формы и т.д. Качественные изменения реакционной смеси могут сопровождаться принципиально отличающимися количественными изменениями характеристик реакций (скорость реакции, период индукции и др.).
Сведения о критических состояниях реакционной системы позволяют очертить в координатах исходных параметров “границы” различных режимов протекания реакции и далее выработать стратегии эффективного их использования или же обхода.
Теоретические представления о пределах самовоспламенения горючих смесей, проявляющихся как критические явления, основываются на двух теориях Семенова [1, 2]: теории разветвленно-цепного воспламенения и теории теплового воспламенения. В последнем случае предел самовоспламенения определяется также из уравнения теплопроводности с нелинейным (химическим) источником тепла.
Аналитическим и численным исследованиям предельных (критических) явлений, в частности в классической реакционной системе водорода с кислородом, посвящено множество работ [3–11]. В настоящей работе представлен метод ценностного численного выявления и анализа критических состояний реакционных систем, с использованием которого выявлены концентрационные критические состояния смеси водорода с кислородом и приведена химическая интерпретация численных результатов.
ЦЕННОСТНЫЙ АНАЛИЗ МЕХАНИЗМОВ СЛОЖНЫХ РЕАКЦИЙ
А. Ценностное выявление кинетических значимостей отдельных стадий и компонентов реакционного механизма
Ценностный подход основывается на гамильтоновой систематизации кинетических уравнений сложной (многостадийной) реакции с выделением целевых характеристик последней [12, 13]. Данная систематизация сводится к составлению общей системы уравнений, которая включает в себя систему кинетических уравнений для компонентов сложной реакции и систему дифференциальных уравнений для ${{\psi }_{i}}\left( t \right)$ (ценностей компонентов), сопряженных согласно цели с концентрациями компонентов в системе гамильтониана H:
(1)
$\begin{gathered} {{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d{{c}_{i}}} \mathord{\left/ {\vphantom {{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d{{c}_{i}}} {dt}}} \right. \kern-0em} {dt}} = {{f}_{i}}\left( {{\mathbf{k}},{\mathbf{c}}} \right) = {{\partial H} \mathord{\left/ {\vphantom {{\partial H} {\partial {{\psi }_{i}}}}} \right. \kern-0em} {\partial {{\psi }_{i}}}}~ \hfill \\ - \,\,{\text{кинетические}}\,\,{\text{уравнения,}} \hfill \\ {{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d{{\psi }_{i}}} \mathord{\left/ {\vphantom {{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d{{\psi }_{i}}} {dt}}} \right. \kern-0em} {dt}} = {{ - \partial H} \mathord{\left/ {\vphantom {{ - \partial H} {\partial {{c}_{i}}}}} \right. \kern-0em} {\partial {{c}_{i}}}} \hfill \\ - \,\,{\text{сопряженные}}\,\,{\text{уравнения,}} \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,H = - F + \sum\limits_i^m {{{\psi }_{i}}{{f}_{i}}} ,\,\,\,\,i = 1,2, \ldots ,m \hfill \\ \end{gathered} $– гамильтониан; здесь ${{c}_{i}}\left( 0 \right) = c_{i}^{0};$ ${{\psi }_{i}}\left( 0 \right) = \psi _{i}^{0};$ t – время; F – целевая величина химической реакции, которая для удобства расчетов представляется обычно в виде линейного соотношения скоростей образования компонентов fi, выделенных согласно цели; k и c – n-вектор констант скоростей и m-вектор концентраций компонентов; $c_{i}^{0}$ – исходные концентрации; $\psi _{i}^{0}$ – исходные значения сопряженных функций ${{\psi }_{i}},$ рассчитываемых исходя из выбранной целевой величины F.
Временны́е траектории компонентов сложной реакции в неизотермических условиях рассчитывались с использованием системы кинетических уравнений, включающих уравнение теплового баланса:
(2)
${{C}_{V}}\rho \frac{{dT}}{{dt}} = - \sum\limits_j {\Delta {{H}_{j}}{{r}_{j}}} - \frac{S}{V}\alpha \left( {T - {{T}_{0}}} \right).$Уравнение теплового баланса записано для ньютоновского закона охлаждения реакционной смеси через стенки реактора. Здесь ${{C}_{V}}$ и ρ – удельная теплоемкость и плотность реакционной смеси, соответственно; α – коэффициент теплоотдачи; T и T0 – температуры реакционной смеси и стенки реактора, соответственно; S/V – отношение внутренней поверхности к объему реактора; ΔHj – изменение энтальпии j-й стадии.
Плотность и теплоемкость реакционной смеси рассчитывали по формулам
где Mmi, νi и Cvi – молярная масса, мольная доля и удельная теплоемкость i-го компонента соответственно.
Физико-химическое кинетическое осмысление сопряженных функций ${{\psi }_{i}}$ позволяет выявить их ценностный смысл, характеризующий кинетическую значимость химических компонентов сложной реакции, согласно выбранной целевой характеристике реакции F(t) [12]:
(3)
${{\psi }_{i}}\left( t \right) = {{\left. {\frac{{\partial F\left[ {{{f}_{1}}\left( t \right), \ldots ,{{f}_{m}}\left( t \right)} \right]}}{{\partial {{f}_{i}}}}} \right|}_{{{{f}_{i}} = {{f}_{i}}\left( {{{t}_{0}}} \right)}}},\,\,\,\,i = 1,2, \ldots ,m.$Из выражения (3) следует, что ценность i-го компонента определяется как отношение отклика целевой величины F(t) в некий момент времени t на величину малого изменения скорости образования i-го компонента, fi, в начальный момент времени t0.
Аналогично ценность отдельной j-й стадии, Gj(t), определяется как отношение отклика целевой величины в некий момент времени t на величину малого изменения скорости j-й стадии, rj, в начальный момент времени:
(4)
${{G}_{j}}\left( t \right) = {{\left. {\frac{{\partial F\left[ {{{r}_{1}}\left( t \right), \ldots ,{{r}_{n}}\left( t \right)} \right]}}{{\partial {{r}_{j}}}}} \right|}_{{{{r}_{j}} = {{r}_{j}}\left( {{{t}_{0}}} \right)}}},\,\,\,\,~j = 1,2, \ldots ,n.$Ценность j-й отдельной стадии равна разности ценностей компонентов, образующихся и участвующих в качестве реагентов в этой стадии, с учетом стехиометрических коэффициентов αjl, αjp химического уравнения:
(5)
${{G}_{j}}\left( t \right) = \sum\limits_p {{{\alpha }_{{jp}}}{{\psi }_{{jp}}}\left( t \right)} - \sum\limits_l {{{\alpha }_{{jl}}}{{\psi }_{{jl}}}\left( t \right)} ,$где индексы “p” и “l” относятся соответственно к продуктам и исходным реагентам j-й стадии.
Кинетические значимости химических компонентов и отдельных стадий определяются также с помощью ценностных вкладов компонентов, bi(t), и отдельных стадий, hj(t), в которых учитывается и фактор интенсивности – скорости образования компонентов (fi) и отдельных стадий (rj), соответственно:
(6)
$\begin{gathered} {{b}_{i}}\left( t \right) = {{\psi }_{i}}\left( t \right){{f}_{i}}\left( t \right),\,\,\,\,i = 1,2, \ldots ,m, \\ {{h}_{j}}\left( t \right) = {{G}_{j}}\left( t \right){{r}_{j}}\left( t \right),\,\,\,\,j = 1,2, \ldots ,n. \\ \end{gathered} $Таким образом, гамильтонова систематизация кинетических моделей сложной реакции позволяет наряду с кинетическими траекториями концентраций компонентов реакции одновременно, согласно уравнениям (1), (3)–(6), рассчитывать кинетические траектории ценностных величин компонентов и отдельных стадий химического механизма многостадийной реакции, а именно ${{\psi }_{i}},$ bi, Gj и hj.
Б. Ценностный метод выявления и анализа критических условий сложных реакций согласно кинетическим моделям
Для численного выявления критического состояния реакционной системы определяется соответствующий критерий. В качестве критерия оценки критического состояния реакционной системы как границы качественного изменения ее поведения в зависимости от исходных параметров предложено экстремальное поведение системы относительно кинетических параметров или исходных условий [12, 13]. Рассматривается экстремальность суммарной концентрации компонентов, которая эквивалентна условию
(7)
$I\left( t \right) = C = \sum\limits_{i = 1}^m {{{c}_{i}}} = \int\limits_0^t {F\left( t \right)dt} \to {\text{extremum\;}},$где
Для газовой реакционной смеси можно использовать целевой функционал $I\left( t \right) = P,$ поскольку общее давление P связано с суммарной концентрацией линейным соотношением $P = C{{k}_{B}}T,$ где ${{k}_{B}}$ – константа Больцмана.
Условие (7), в частности, соответствует минимальному значению расхода суммарной концентрации компонентов реакционной смеси, а также и изменению общего давления P в случае газовой среды. При выборе целевого функционала (7) критическое состояние реакционной системы рассматривается как эволюционный процесс. Такой подход позволяет численно определить критические состояния реакции в медленных процессах, когда качественные изменения последней невозможно или же чрезвычайно трудно зарегистрировать экспериментально.
Поставленная задача в трактовке вариационного исчисления решается с использованием принципа максимума Понтрягина [14]. Для выявления критических условий, согласно критерию (7), в гамильтониане выделяются исходные параметры Φ, посредством которых проводится поиск критических состояний сложных реакций. Тогда гамильтониан реакционной системы записывается в виде
(8)
$H = {{\psi }_{0}}F + \sum\limits_{i = 1}^m {{{\psi }_{i}}{{f}_{i}}\left( {c{\text{,}}k{\text{,}}\Phi } \right)} ,$где
в зависимости от того, решается задача максимума или минимума: ${{\psi }_{0}} = 1$ или ${{\psi }_{0}}~ = - 1;$ $c_{i}^{{act}}$ – концентрации активных промежуточных компонентов реакции, например атомов и радикалов в цепных химических реакциях; Φ – вектор исходных параметров. При записи уравнения (8) по существу вектор исходных параметров Φ рассматривается как управляющий. Для нахождения значений Φ*, соответствующих критическому состоянию, что согласно выбранному критерию соответствует экстремальному поведению реакции, применяется принцип максимума Понтрягина. Этот подход сводится к решению системы уравнений кинетических и сопряженных функций (1) с изменением параметров управления Φ в пределах Φmin ≤ Φ ≤ Φmax. Поиск значений Φ* в данном интервале проводится из определенных классов функций, что существенно облегчает вычисление [14]. Согласно принципу максимума Понтрягина оптимальное значение Φ* выбирают из граничных значений Φlm и величин Φcl, соответствующих классическому условию:
Критическому, а в данном случае – экстремальному состоянию реакции со значениями исходных параметров Φ* соответствует условие
(9)
$H{\text{*}}\left( {{\mathbf{c}}{\text{*}}{\mathbf{\psi }}{\text{*}}{\mathbf{\Phi }}{\text{*}}} \right) = \mathop {{\text{sup}}}\limits_\Phi H\left( {c{\text{,}}{\mathbf{\psi }}{\text{,}}\Phi } \right) = 0.$Условие (10) постоянства величины гамильтониана во времени [14]:
позволяет проводить поиск критических исходных параметров Φ* при малых временах реакции и, соответственно при низких степенях превращения исходных веществ и незначительных изменениях температуры. По существу ценностный метод в отличие от обычно используемых численных методов позволяет определять критические условия реакции без численного симулирования временнóго профиля химических компонентов в полном диапазоне текущего времени. Это дает возможность существенно сократить объем расчетов и обойти труднорешаемую проблему “жeсткости” при численном интегрировании системы дифференциальных уравнений (1).
Таким образом, ценностный подход позволяет универсально (вне зависимости от степени сложности кинетической модели многостадийной химической реакции) выявить численно критические условия реакции. И, что важно, данный подход также посредством ценностных величин реакционных компонентов и отдельных стадий “химически диагностирует” критическое состояние сложной реакции. В качестве примера при представлении целевого функционала в виде суммы концентраций активных промежуточных компонентов в рамках ценностного подхода [12] выведены классические аналитические уравнения Семенова для критических условий для различных модельных случаев разветвленной цепной реакции [1, 2].
В ценностном подходе критические состояния реакционной системы согласно выбранному критерию определяются из условия экстремальности (уравнение (7) и, соответственно, (9)). Условие (9) в случае газовых реакционных смесей сводится к алгебраическому уравнению, содержащему многочлен 5-го порядка по общему давлению. Согласно выражению (1), для гамильтониана максимальный, 5-й порядок алгебраического уравнения (9) определяется произведением ${{\psi }_{i}}\left( t \right){{f}_{i}}\left( t \right).$ Три порядка зависимости от общего давления в многочлене дает величина ${{f}_{i}}\left( t \right)$ с учетом максимальной возможной тримолекулярности отдельных химических стадий, а остальные два порядка зависимости от общего давления многочлена – величина ${{\psi }_{i}}\left( t \right).$ Алгебраическое уравнение (9) с учетом (8) 5-го порядка по давлению в общем случае может иметь до пяти действительных корней, которые могут быть положительными и физико-химически обоснованными [15]. Таким образом, число критических состояний чисто химической, концентрационной природы при изменении общего давления газовой реакционной смеси может достигать 5 без учета тепловых факторов и возможной зависимости констант скорости отдельных стадий от общего давления.
ЧИСЛЕННЫЙ АНАЛИЗ ПРЕДЕЛОВ САМОВОСПЛАМЕНЕНИЯ РЕАКЦИИ ВОДОРОДА С КИСЛОРОДОМ ЦЕННОСТНЫМ МЕТОДОМ
А. Химический механизм
В качестве объекта исследования посредством ценностного подхода выбрана детальная кинетическая модель реакции водорода с кислородом, рассмотренная У. Маасом с соавт. [3] и представленная в табл. 1, которая включает в себя восемь химических компонентов и 42 отдельные химические стадии. Константы скорости рассчитаны по значениям параметров, представленных в табл. 1. Для расчетов, согласно табл. 1, в неизотермических условиях использованы значения коэффициента теплоотдачи α из уравнения (2) и удельной теплоемкости Cv, равные 2.7 ⋅ 10–6 кДж ⋅ см–2 ⋅ К–1 ⋅ с–1 при 803.2 К и 0.0254 кДж ⋅ К–1 при 840 К соответственно [16].
Таблица 1.
Кинетический механизм реакции водорода с кислородом
| № реакции | Реакция | A, см, моль, с | B | Ea | $\Delta H_{{803.2}}^{0}$ |
|---|---|---|---|---|---|
| кДж/моль | |||||
| 1 | ${{O}_{2}} + H \to OH + O$ | 2.00 ⋅ 1014 | 0.00 | 70.30 | 67.89 |
| 2 | $OH + O \to {{O}_{2}} + H$ | 1.46 ⋅ 1013 | 0.00 | 2.08 | –67.89 |
| 3 | ${{H}_{2}} + O \to OH + H$ | 5.06 ⋅ 104 | 2.67 | 26.30 | 5.90 |
| 4 | $OH + H \to {{H}_{2}} + O$ | 2.24 ⋅ 104 | 2.67 | 18.40 | –5.90 |
| 5 | ${{H}_{2}} + OH \to {{H}_{2}}O + H$ | 1.00 ⋅ 108 | 1.60 | 13.80 | –62.32 |
| 6 | ${{H}_{2}}O + H \to {{H}_{2}} + OH$ | 4.45 ⋅ 108 | 1.60 | 77.13 | 62.32 |
| 7 | $OH + OH \to {{H}_{2}}O + O$ | 1.50 ⋅ 109 | 1.14 | 0.42 | –68.22 |
| 8 | ${{H}_{2}}O + O \to OH + OH$ | 1.51 ⋅ 1010 | 1.14 | 71.64 | 68.22 |
| 9 | $H + H + M \to {{H}_{2}} + M$ | 1.80 ⋅ 1018 | 1.00 | 0.00 | –442.17 |
| 10 | ${{H}_{2}} + M \to H + H + M$ | 6.99 ⋅ 1018 | 1.00 | 436.1 | 442.17 |
| 11 | $H + OH + M \to {{H}_{2}}O + M$ | 2.20 ⋅ 1022 | 2.00 | 0.00 | –504.48 |
| 12 | ${{H}_{2}}O + M \to H + OH + M$ | 3.80 ⋅ 1023 | 2.00 | 499.4 | 504.48 |
| 13 | $O + O + M \to {{O}_{2}} + M$ | 2.90 ⋅ 1017 | 1.00 | 0.00 | –504.15 |
| 14 | ${{O}_{2}} + M \to O + O + M$ | 6.81 ⋅ 1018 | 1.00 | 496.4 | 504.15 |
| 15 | $H + {{O}_{2}} + M \to H{{O}_{2}} + M$ | 2.30 ⋅ 1018 | 0.80 | 0.00 | –211.64 |
| 16 | $H{{O}_{2}} + M \to H + {{O}_{2}} + M$ | 3.26 ⋅ 1018 | 0.80 | 195.9 | 211.64 |
| 17 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}} \to {\text{OH + OH}}$ | 1.50 ⋅ 1014 | 0.00 | 4.20 | –156.73 |
| 18 | ${\text{OH + OH}} \to {\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}$ | 1.33 ⋅ 1013 | 0.00 | 168.3 | 156.73 |
| 19 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}} \to {{{\text{H}}}_{{\text{2}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}}$ | 2.50 ⋅ 1013 | 0.00 | 2.90 | –230.53 |
| 20 | ${{{\text{H}}}_{{\text{2}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}} \to {\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}$ | 6.84 ⋅ 1013 | 0.00 | 243.1 | 230.53 |
| 21 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}} \to {{{\text{H}}}_{{\text{2}}}}{\text{O + O}}$ | 3.00 ⋅ 1013 | 0.00 | 7.20 | –224.96 |
| 22 | ${{{\text{H}}}_{2}}{\text{O + O}} \to {\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}$ | 2.67 ⋅ 1013 | 0.00 | 242.5 | 224.96 |
| 23 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + O}} \to {\text{OH + }}{{{\text{O}}}_{{\text{2}}}}$ | 1.80 ⋅ 1013 | 0.00 | –1.70 | –224.62 |
| 24 | ${\text{OH + }}{{{\text{O}}}_{2}} \to {\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + O}}$ | 2.18 ⋅ 1013 | 0.00 | 230.6 | 224.62 |
| 25 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + OH}} \to {{{\text{H}}}_{{\text{2}}}}{\text{O + }}{{{\text{O}}}_{{\text{2}}}}$ | 6.00 ⋅ 1013 | 0.00 | 0.00 | –292.85 |
| 26 | ${{{\text{H}}}_{2}}{\text{O + }}{{{\text{O}}}_{2}} \to {\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + OH}}$ | 7.31 ⋅ 1014 | 0.00 | 303.5 | 292.85 |
| 27 | ${\text{H}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}{{{\text{O}}}_{{\text{2}}}} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}}$ | 2.50 ⋅ 1011 | 0.00 | –5.20 | –159.41 |
| 28 | ${\text{OH + OH + M}} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{ + M}}$ | 3.25 ⋅ 1022 | 2.00 | 0.00 | –214.3 |
| 29 | ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{ + M}} \to {\text{OH + OH + M}}$ | 2.10 ⋅ 1024 | 2.00 | 206.8 | 214.31 |
| 30 | ${{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}} \to {{{\text{H}}}_{{\text{2}}}}{\text{ + H}}{{{\text{O}}}_{{\text{2}}}}$ | 1.70 ⋅ 1012 | 0.00 | 15.70 | –71.12 |
| 31 | ${{{\text{H}}}_{2}}{\text{ + H}}{{{\text{O}}}_{2}} \to {{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}$ | 1.15 ⋅ 1012 | 0.00 | 80.88 | 71.12 |
| 32 | ${{{\text{H}}}_{2}}{{{\text{O}}}_{2}}{\text{ + H}} \to {{{\text{H}}}_{2}}{\text{O + OH}}$ | 1.00 ⋅ 1013 | 0.00 | 15.00 | –290.17 |
| 33 | ${{{\text{H}}}_{2}}{\text{O + OH}} \to {{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}{\text{ + H}}$ | 2.67 ⋅ 1012 | 0.00 | 307.5 | 290.17 |
| 34 | ${{{\text{H}}}_{2}}{{{\text{O}}}_{2}}{\text{ + O}} \to {\text{OH + H}}{{{\text{O}}}_{{\text{2}}}}$ | 2.80 ⋅ 1013 | 0.00 | 26.80 | –65.22 |
| 35 | ${\text{OH + H}}{{{\text{O}}}_{2}} \to {{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}{\text{ + O}}$ | 8.40 ⋅ 1012 | 0.00 | 84.09 | 65.22 |
| 36 | ${{{\text{H}}}_{2}}{{{\text{O}}}_{2}}{\text{ + OH}} \to {{{\text{H}}}_{2}}{\text{O + H}}{{{\text{O}}}_{2}}$ | 5.40 ⋅ 1012 | 0.00 | 4.20 | –133.44 |
| 37 | ${{{\text{H}}}_{2}}{\text{O + H}}{{{\text{O}}}_{2}} \to {{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}{\text{ + OH}}$ | 1.63 ⋅ 1013 | 0.00 | 132.7 | 133.44 |
| 38 | ${\text{H}}{{{\text{O}}}_{2}}\xrightarrow{{{\text{Стенка}}}}{\text{nr}}{\text{.p}}$ | 0.264 | 0.50 | 0.00 | –132.70 |
| 39 | ${\text{O}}\xrightarrow{{{\text{Стенка}}}}{\text{nr}}{\text{.p}}$ | 0.375 | 0.50 | 0.00 | –252.08 |
| 40 | ${\text{H}}\xrightarrow{{{\text{Стенка}}}}{\text{nr}}{\text{.p}}$ | 1.514 | 0.50 | 0.00 | –221.08 |
| 41 | ${\text{OH}}\xrightarrow{{{\text{Стенка}}}}{\text{nr}}{\text{.p}}$ | 0.364 | 0.50 | 0.00 | –160.15 |
| 42 | ${{{\text{H}}}_{2}}{{{\text{O}}}_{2}}\xrightarrow{{{\text{Стенка}}}}{\text{\;nr}}{\text{.p\;}}$ | 0.015 | 0.50 | 0.00 | –105.99 |
Примечание: константы скорости реакции представлены уравнением аррениусовского вида: $k\left( T \right) = A{{T}^{B}}\exp \left( {{{ - {{E}_{a}}} \mathord{\left/ {\vphantom {{ - {{E}_{a}}} {RT}}} \right. \kern-0em} {RT}}} \right),$ где A – предэкспоненциальный множитель, Ea – энергия активации, T – температура в Кельвинах, B – показатель степени температурной зависимости, R – универсальная газовая постоянная; $\Delta H_{{803.2}}^{0}$ – тепловой эффект отдельной стадии при T = 803.2 K; nr.p – нерадикальные продукты.
Процессы деструкции реакционных интермедиатов в нерадикальные продукты на внутренней поверхности реактора представлены реакциями №№ 38–42. Значения констант скорости деструкции этих компонентов на внутренней поверхности реакционного сосуда определялись по формуле
где ${\bar {v}} = {{\left( {{{8{{k}_{B}}T} \mathord{\left/ {\vphantom {{8{{k}_{B}}T} {\pi {{M}_{m}}}}} \right. \kern-0em} {\pi {{M}_{m}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}~$ – средняя скорость теплового движения частиц в газе при температуре T, ${{M}_{m}}$ – молярная масса.
Коэффициент захвата γ при соударении активных частиц с поверхностью обычно изменяется в пределах $ \approx {\kern 1pt} {{10}^{{ - 5}}}{\kern 1pt} - {\kern 1pt} {{10}^{{ - 2}}}$ для стекла и кварцевого стекла [2]. Были приняты следующие значения $\gamma $ для реакций №№ 38–42: ${{\gamma }_{{38}}} = {{\gamma }_{{39}}} = {{\gamma }_{{40}}} = {{\gamma }_{{41}}} = {{10}^{{ - 3}}},$ ${{\gamma }_{{42}}} = 6 \cdot {{10}^{{ - 5}}}.$ Значения γ из отмеченного интервала выбирались в основном по принципу описания экспериментальных данных, соответствующих 1-му пределу самовоспламенения смеси H2/O2 [3, 17].
Для сферического реактора ${S \mathord{\left/ {\vphantom {S V}} \right. \kern-0em} V} = {3 \mathord{\left/ {\vphantom {3 r}} \right. \kern-0em} r},$ где $r$ – радиус реактора, в рассматриваемом случае равный $r = 3.7\,\,{\text{см}}.$ Значения тепловых эффектов реакции, приведенных в табл. 1, рассчитаны с линейным приближением по формуле ${{\Delta }}{{H}_{T}} = {{\Delta }}{{H}_{{298.2}}}$ + + ${{\Delta }}{{C}_{p}}\left( {T - 298.2} \right),$ согласно данным работ [18, 19]; ΔCp – разность молярных теплоемкостей продуктов и исходных веществ отдельной стадии с учетом стехиометрических коэффициентов реакций. Тепловые эффекты поверхностных реакций №№ 38–42 гибели активных интермедиатов рассчитаны согласно химическим уравнениям, приведенным в работе [3]. Значения ΔHT при 803.15 К оценены с использованием величин ΔH298.15 и ΔCp (T = = 500 K) и приняты независящими от температуры.
Б. Расчет критических условий самовоспламенения реакционной смеси водорода с кислородом
Для численных расчетов критических условий, временны́х профилей концентраций компонентов реакции, температуры, а также ценностных величин компонентов и отдельных стадий использовали вычислительную программу VALKIN [12]. В данной программе система дифференциальных уравнений численно интегрировалась с помощью модифицированного метода Рунге–Кутта – ROW-4A [20]. В качестве критерия критического состояния реакции выбрано условие экстремальности целевого функционала (7) для случая активных частиц. Согласно (7) определялись начальные значения сопряженных функций для численного интегрирования (1): $\psi _{i}^{0} = 1$ для активных частиц – H, O, OH , H2O2 и $\psi _{i}^{0} = 0$ в случае H2, O2, H2O.
Определенная на основе ценностного критерия Z-образная P–T диаграмма пределов 1–3 самовоспламенения для стехиометрической смеси водорода с кислородом, представленная на рис. 1, находится в хорошем согласии с теоретическими и экспериментальными результатами, обобщенными в работах [3, 17].
Рис. 1.
Пределы (1–4) для стехиометрической смеси водорода с кислородом в зависимости от исходных температуры и давления, рассчитанные ценностным методом.
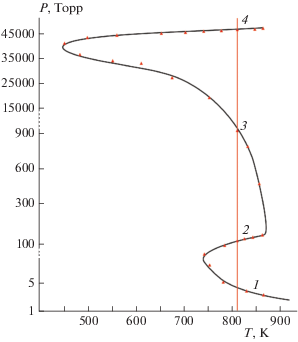
Одновременно предсказан и 4-й предел критических условий самовоспламенения смеси водорода с кислородом нетепловой природы, показанных на рис. 1, при давлениях ≈45 атм и более, который подтверждает вывод о том, что число пределов воспламенения нетепловой природы в реакционной смеси водорода с кислородом без учета возможной зависимости констант скорости отдельных химических стадий от общего давления может быть больше трех. Наличие возможного 5-го критического предела самовоспламенения реакционной смеси водорода с кислородом не исследовалось из-за предполагаемого существенного изменения количественных характеристик – констант скоростей отдельных стадий при давлениях, превышающих несколько десятков атмосфер [21]. При этих условиях величины констант скорости отдельных стадий могут строго не описываться уравнениями, соответствующими сравнительно низким давлениям.
Из данных рис. 1, где представлены расчетные данные, полученные в изотермических условиях, следует, что экспериментально наблюдаемый третий предел самовоспламенения H2/O2 предсказывается ценностным методом без учета тепловых факторов. К подобному выводу ранее пришли авторы работ [5–10]. Как и в работе [7], учет саморазогрева смеси H2/O2 практически не влияет на величину исходных давлений, соответствующих третьему пределу самовоспламенения. Таким образом, согласно нашим исследованиям 3-й предел самовоспламенения смеси H2/O2 имеет разветвленно-цепную природу, a тепловыделение только усиливает количественное отличие различных режимов протекания реакции вблизи 3-го предела самовоспламенения. Между тем следует отметить, что сам тепловой взрыв возможен в Р–Т-областях интенсивного протекания реакции в случае, если соблюдаются условия теплового взрыва [1, 2].
Выявленный на основании ценностного критерия 4-й предел самовоспламенения характеризует критическое состояние, поскольку при повышении давления, в частности при $Т = 803.15\,\,{\text{К,}}$ на P–T-диаграмме видны качественные изменения в поведении реакции. Об этом свидетельствуют численные расчеты, которые указывают, что выше 4-го предела – критической границы – после достижения максимальной концентрации атомов и радикалов и ее последующего уменьшения при одинаковых временах реакции степень конверсии реакции ниже, чем когда значение исходного давления ниже предельного (рис. 1). Однако 4-й предел не является обычно принятым пределом самовоспламенения для смеси ${{{{{\text{H}}}_{2}}} \mathord{\left/ {\vphantom {{{{{\text{H}}}_{2}}} {{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{{{\text{O}}}_{2}}}},$ поскольку при этом не происходит резкое изменение концентрации носителей цепей или температуры. То есть 4-й предел самовоспламенения реакционной смеси, определенный из условия экстремальности (7) и, соответственно, (9), представляется вырожденным.
В. Ценностная диагностика критических условий пределов самовоспламенения реакционной смеси ${{{{H}_{{\mathbf{2}}}}} \mathord{\left/ {\vphantom {{{{H}_{{\mathbf{2}}}}} {{{O}_{{\mathbf{2}}}}}}} \right. \kern-0em} {{{O}_{{\mathbf{2}}}}}}$ в координатах P–T
На рис. 2 приведены величины ценностных вкладов наиболее кинетически значимых отдельных стадий химического механизма реакции водорода с кислородом, соответствующие четырем критическим состояниям реакционной смеси Н2/О2, в координатах P–T.
Рис. 2.
Ценностное тестирование критических пределов стехиометрической смеси H2/O2 при температуре 803.2 K; части а–г соответствуют пределам 1–4. Ценностный вклад отдельной стадии вычисляется как $\overline {{{h}_{j}}} = {{h}_{j}}{{\left( {\sum\limits_{j = 1}^n {h_{j}^{2}} } \right)}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 2}} \right. \kern-0em} 2}}}}.$
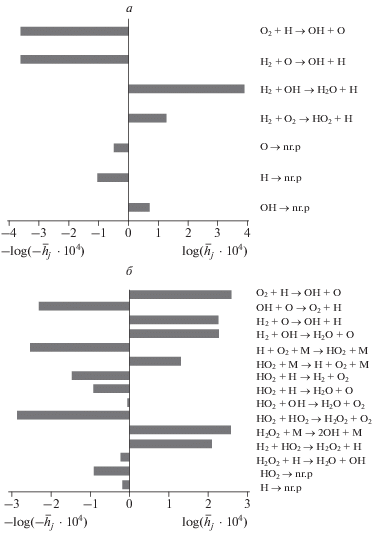
Рис. 2.
Окончание.
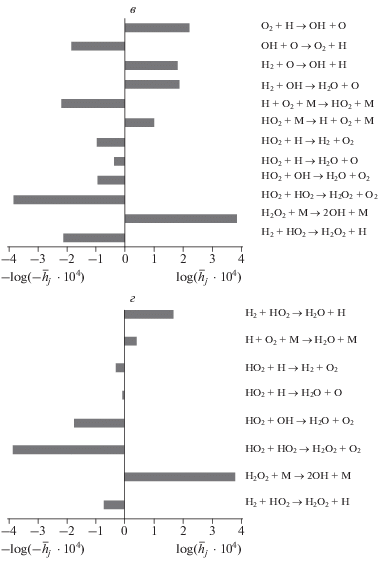
Согласно известным представлениям [1, 2], 1‑й и 2-й пределы самовоспламенения реакционной смеси H2/O2 главным образом определяются реакциями разветвления с участием атома водорода и молекулярного кислорода (реакция № 1 из табл. 1) и гибели носителей цепей (реакции №№ 38–42). При этом наблюдается высокoe значение ценностных вкладов носителей цепей H, O и OH, представленных в табл. 2. В случае 2-го предела самовоспламенения интенсивная тримолекулярная реакция превращения атома H в данных условиях в менее реакционноспособный гидропероксильный радикал (реакция № 15) в целом представляется как стадия обрыва кинетической цепи. Тем не менее вблизи второго, промежуточного предела самовоспламенения, как следует из рис. 2 и табл. 2, существенный вклад вносят химические превращения HO2 и H2O2, включающие образование H2O2 в результате как линейной, так и нелинейной реакций HO2 и последующий радикальный распад пероксида водорода в качестве дополнительной реакции разветвления цепи. К такому же выводу пришли авторы работ [5, 7–10].
Таблица 2.
Ценностные вклады (${{\bar {b}}_{i}}$) химических компонентов в условиях, соответствующих критическим условиям (границы 1–4) ниже (а) и выше (б) по давлению стехиометрической смеси H2/O2 при температуре 803.2 К и $t = 1.5 \cdot 1{{0}^{{ - 3}}}\,\,с$
| Номер границы | ${{\bar {b}}_{{\text{H}}}}$ | ${{\bar {b}}_{{\text{O}}}}$ | ${{\bar {b}}_{{{\text{OH}}}}}$ | ${{\bar {b}}_{{{\text{H}}{{{\text{O}}}_{{\text{2}}}}}}}$ | ${{\bar {b}}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$ | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| а | б | а | б | а | б | а | б | а | б | |
| 1 | 4.6Е–01 | 4.9Е–02 | 2.8Е–02 | 4.5Е–01 | 5.7Е–03 | –5.0Е–01 | 5.6Е–03 | 1.5Е–05 | 2.3Е–06 | 1.3Е–09 |
| 2 | 4.5Е–01 | 4.5Е–01 | 2.2Е–02 | 2.2Е–02 | 4.6Е–03 | 4.5Е–03 | 2.4Е–02 | 2.6Е–02 | 2.6Е–05 | 2.9Е–05 |
| 3 | 2.8Е–04 | 2.1Е–04 | 1.3Е–05 | 9.9Е–06 | 2.7Е–06 | 2.0Е–06 | 8.7Е–01 | 8.8Е–01 | 2.9Е–02 | 3.7Е–02 |
| 4 | 2.0Е–06 | 2.0Е–06 | 9.8Е–08 | 9.6Е–08 | 3.7Е–07 | 3.7Е–07 | 3.8Е–01 | 3.8Е–01 | 5.9Е–01 | 5.9Е–01 |
Для 3-го предела воспламенения наблюдается иная химическая картина. При повышении исходного давления существенно “активируются” химические превращения с участием гидропероксильного радикала HO2 и нерадикального, активного продукта его превращения – пероксида водорода H2O2. При этом, как следует из табл. 2, ценностный вклад радикала HO2$({{b}_{{{\text{H}}{{{\text{O}}}_{{\text{2}}}}}}})$ существенно превышает ценностные вклады H, O и OH, что свидетельствует о доминирующей роли радикала HO2 вблизи 3-го предела воспламенения. С повышением исходного давления при достижении 3-го предела происходит переход от режима медленного протекания реакции к автоускоренному. Причина этого – интенсивное образование H2O2 в реакциях радикалов HO2 между собой (реакция № 27) и продолжения цепи (реакция № 31) посредством реакции HO2 с H2, свободно-радикальный распад которого приводит к интенсивному разветвлению цепей (реакция № 29) дополнительно к реакции № 1. Доминирующие химические превращения, осуществляемые при высоких давлениях с участием гидропероксильного радикала HO2 и пероксида водорода H2O2, представляются отдельными химическими стадиями:
О доминантной роли реакций с участием ${\text{H}}{{{\text{O}}}_{{\text{2}}}}$ и ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}$ при высоких давлениях, соответствующих 3-му и, особенно, 4-му критическим пределам реакционной смеси H2/O2, свидетельствует существенное увеличение их ценностных вкладов (табл. 2).
Наблюдаемый при повышении давления 4-й вырожденный предел характеризует качественный, но не резкий переход реакции в более медленный режим. Это, по-видимому, обусловлено существенным уменьшением кинетической значимости реакции разветвления (№ 1 в табл. 1) с участием атомов водорода и интенсификацией реакции носителей цепей (радикалов HO2) между собой (реакция № 27) с образованием нерадикальных продуктов – пероксида водорода и молекулярного кислорода. Вместе с этим в данных условиях, как следует из рис. 2, ценностный вклад нелинейной реакции № 27 радикалов HO2 между собой, приводящей к образованию H2O2, существенно превышает вклад реакции № 31, ведущей к превращению гидропероксильного радикала HO2 в атом Н. Преобладание роли реакций с участием HO2 по сравнению с реакциями, осуществляемыми посредством атомов Н, связано также с увеличением соотношения концентраций [HO2]/[H] в результате смещения равновесия (реакции №№ 15, 16) с повышением давления в сторону образования гидропероксильных радикалов HO2.
Одновременно вблизи 4-го предела, для которого свойственно преобладание вклада реакции № 27 радикалов HO2 между собой над реакцией № 31 изменяется кинетическое проявление реакции № 29 распада Н2О2 на радикалы. Кинетическое значение реакции № 29 радикального распада Н2О2 зависит от “химии” его предварительного образования в реакционной смеси, и этим обусловлено наличие 4-го критического предела воспламенения. Если Н2О2 образуется в результате нелинейной реакции № 27 радикалов НО2 между собой, то в конечном итоге не происходит мультипликация свободных валентностей, как это представлено на рис. 3, поэтому двухстадийное превращение (А) можно рассматривать как последовательность реакций продолжения цепи. По этой причине вблизи 4-й критической границы доминирующий вклад имеет пероксид водорода (табл. 2). В случае же, когда Н2О2 образуется в результате реакции № 31 отрыва атома водорода радикалами НО2 от H2, в конечном счете происходит мультипликация свободной валентности, и двухстадийное превращение (Б) представляется как последовательность реакций разветвления цепи. Из вышеприведенного следует, что 4-й, вырожденный предел в основном обусловлен сменой с повышением давления представленной на рис. 3 химической последовательности (Б) с участием пероксида водорода последовательностью (А).
ЗАКЛЮЧЕНИЕ
Ценностный численный подход, основанный на гамильтоновой систематизации кинетической модели сложной реакции, позволяет выявлять критические состояния реакционной смеси. В качестве критерия такого состояния, при котором в зависимости от исходных параметров изменяется качественное поведение реакционной смеси, выбрано ее экстремальное состояние в зависимости от управляющих параметров химической системы (например, от давления).
Ценностный подход позволяет также с химической точки зрения осмыслить критические состояния сложной реакции, выявляя кинетические значимости (ценности) отдельных стадий и компонентов. Одним из следствий применения ценностного подхода является предсказание возможного наличия до пяти пределов критичности при условии максимальной тримолекулярности отдельных стадий механизма реакции, что обусловлено исключительно концентрационной динамикой реакционной системы без учета тепловых факторов.
Для реакции водорода с кислородом согласно предложенному критерию показано наличие четырех критических пределов, очерчивающих зоны качественно различающихся режимов протекания реакции. Ценностная субординация отдельных химических стадий и компонентов реакционного механизма реакции водорода с кислородом позволила без предварительных упрощений выяснить основную химическую природу критических условий, выявляя наиболее кинетически значимые отдельные стадии и компоненты химического механизма в зависимости от исходных условий.
Список литературы
Semenov N.N. Chemical kinetics and chain reactions. Oxford: Clarendon Press, 1935.
Semenov N.N. Some problems in chemical kinetics and reactivity. V. 1. Elsevier, 2013.
Maas U., Warnatz J. // Combust. and Flame. 1988. V. 74. № 1. P. 53.
Wu H., Cao G., Morbidelli M. // J. Phys. Chem. 1993. V. 97. № 32. P. 8422.
Lidor A., Weihs D., Sher E. // Proc. 55th AIAA Aerospace Sci. Meeting. V. 1. USA: AIAA, 2017. P. 13634.
Азатян В.В., Андрианова З.С., Иванова А.Н. // Кинетика и катализ. 2010. T. 51. № 3. C. 358.
Иванова А.Н., Адрианова З.С., Азатян В.В. // Хим. физика. 1998. Т. 17. № 8. С. 91.
Liang W., Law C.K. // Phys. Chem. Chem. Phys. 2018. V. 20. № 2. P. 742.
Wang X., Law C.K. // J. Chem. Phys. 2013. V. 138. № 13. P. 134305.
Newcomb L.B., Marucci M.E., Green J.R. // Phys. Chem. Chem. Phys. 2018. V. 20. № 23. P. 15746.
Басевич В.Я., Беляев А.А., Фролов С.М., Фролов Ф.С. // Хим. физика. 2019. Т. 38. № 1. С. 27.
Tavadyan L.A., Martoyan G.A. Analysis of kinetic models of chemical reaction systems. Value approach. N.Y.: Nova Sci. Publ. Inc, 2014.
Martoyan G.A., Tavadyan L.A. // Lecture Notes Comput. Sci. V. 3044. Heidelberg, Germany: Springer, 2004. P. 313.
Pontryagin L.S., Boltyanskii V.G., Gamkrelidze R.V. et al. Mathematical theory of optimal processes. N.Y.: The Macmillan Company, 1964.
Курош А.Г. Курс высшей алгебры. М.: Наука, 1968.
Frank-Kamenetskii D.A. Diffusion and heat transfer in chemical kinetics. N.Y.: Plenum Press, 1969.
Lewis B., von Elbe G. Combustion, flames and explosions of gases. Elsevier, 2013.
Ó Connaire M., Curran H.J., Simmie J.M. et al. // Intern. J. Chem. Kinet. 2004. V. 36. № 11. P. 603.
Li V., Zhao Z., Kazakov A. et al. // Ibid. 2004. V. 36. № 10. P. 566.
Gottwald B., Wanner G. // Simulation. 1981. V. 37. № 5. P. 169.
Мартоян Г.А., Тавадян Л.А. // Хим. физика. 1998. Т. 17. № 5. С. 24.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика