Химическая физика, 2021, T. 40, № 8, стр. 10-18
Упрощенная кинетическая модель горения керосина
Г. Я. Герасимов 1, Ю. В. Туник 1, П. В. Козлов 1, В. Ю. Левашов 1, *, **, И. Е. Забелинский 1, Н. Г. Быкова 1
1 Научно-исследовательский институт механики МГУ им. М.В. Ломоносова
Москва, Россия
* E-mail: vyl69@mail.ru
** E-mail: levashovvy@imec.msu.ru
Поступила в редакцию 08.02.2021
После доработки 18.02.2021
Принята к публикации 22.02.2021
Аннотация
Разработана новая упрощенная кинетическая модель горения керосина, которая может быть включена в комплексное моделирование различных газодинамических течений. Модель базируется на использовании н-декана в качестве суррогата керосина и содержит 24 компонента, которые участвуют в 25 химических реакциях, описывающих воспламенение керосина как при высоких, так и при низких температурах. Проведено тестирование предложенной модели на основе сравнения результатов расчета с имеющимися экспериментальными данными по измерению времени задержки воспламенения в ударных трубах в широком диапазоне температур и давлений.
ВВЕДЕНИЕ
Важным условием при проектировании и разработке новой авиационной и ракетной техники с увеличенной скоростью и дальностью полета является необходимость улучшения характеристик процесса тепловыделения при горении топлива в камере сгорания реактивного двигателя, а также снижения неблагоприятного воздействия продуктов сгорания на окружающую среду. Качественный скачок в этом направлении связывается с разработкой и внедрением принципиально новых типов реактивных двигателей, основанных на детонационном горении [1]. Это в свою очередь вызывает повышенный интерес к пониманию кинетических механизмов горения различных видов топлива, которые могут использоваться в детонационных двигателях [2].
Керосин относится к одному из основных видов транспортного топлива, которое широко применяется в современных авиационных и ракетных двигателях [3]. Детонационная способность паров керосина экспериментально исследована на базе импульсных [1, 4–7] и ротационных (спиновых) [8, 9] детонационных двигателей, где инициирование детонации является самостоятельной задачей. Тем не менее двигатели, работающие на детонационном горении углеводородных топлив, пока не нашли практического применения. Одним из основных препятствий на пути реализации рабочего детонационного двигателя оказывается сложность надежного и контролируемого инициирования детонационной волны в двигателе. Это обстоятельство имеет особо важное значение применительно к жидким углеводородным топливам, когда необходимо одновременно рассматривать распыление, испарение и детонационное горение двухфазных смесей [4].
Горение керосина в камере сгорания реактивного двигателя представляет собой комплекс сложных взаимосвязанных физико-химических процессов, для описания которых используются различные газодинамические и кинетические модели [10, 11]. Кинетическая модель процесса является частью более общей газодинамической модели. Поэтому она должна быть, с одной стороны, предельно простой, а с другой – достаточно точно моделировать поведение химически реагирующей системы. В ряде случаев идеальным считается сведение кинетического механизма процесса к одной или нескольким брутто-стадиям, даже если такая аппроксимация действует в очень узком диапазоне изменения параметров процесса [12].
Численное исследование по детонационному горению паров керосина в установившихся сверхзвуковых потоках обычно проводится на основе глобальных кинетических моделей [13]. В работе [14] для моделирования клиновидной детонации в двухфазной смеси керосин–воздух использовали упрощенный кинетический механизм, который состоит из двух глобальных реакций окисления топлива до CO и H2O при кинетическом равновесии в системе CO–CO2 [15].
Расчет детонационного горения керосина в осесимметричном сопле с коаксиальным центральным телом “цилиндр–конус” [16] проводился с помощью редуцированной кинетической модели [17], которая хорошо описывает экспериментальные данные по временам задержки воспламенения паров керосина только в высокотемпературной области (T ≥ 1100 K). Тем не менее для успешного решения вопроса о компоновке сверх и гиперзвуковых прямоточных двигателей на детонационном горении керосина необходимо иметь редуцированную кинетическую модель, адекватную при температурах ниже 1100 K. Данной проблеме и посвящена настоящая работа, в которой разработана упрощенная кинетическая модель горения керосина, хорошо описывающая воспламенение керосина как при высоких, так и при низких температурах.
КИНЕТИЧЕСКАЯ МОДЕЛЬ
Керосин представляет собой сложную смесь из алифатических предельных (парафины), алициклических (нафтены) и ароматических (арены) углеводородов. Углеводородный состав керосина зависит от природы перерабатываемой нефти и применяемых в технологии переработки нефтехимических процессов. Из-за сложности состава керосина при моделировании его горения обычно используются так называемые суррогатные смеси, которые включают ограниченное количество углеводородных компонентов [18, 19]. Стандартные правила выбора компонентов суррогатной смеси еще не разработаны, но общие принципы такой процедуры требуют, чтобы суррогатное топливо имело основные физические и химические свойства реального топлива [20].
В первом приближении для описания горения керосина достаточно применить механизм окисления одиночного линейного парафина, который имеет примерно ту же энтальпию сгорания, отношение атомов H/C и соответствующее значение молекулярной массы. В случае, если образование ароматических углеводородов не является серьезной проблемой, в качестве наиболее приемлемого суррогатного топлива для моделирования окисления керосина можно использовать н-декан [21].
Разработка кинетических моделей горения углеводородов, входящих в состав суррогатной смеси, ведется, с одной стороны, по пути построения детальных кинетических моделей горения этих составляющих топлива с большим количеством элементарных стадий и возможных компонентов химически реагирующей системы [22–24]. С другой стороны, на основе детальных кинетических моделей строятся редуцированные модели, используемые при расчете сложных газодинамических течений, когда вычислительные трудности не позволяют включить в рассмотрение детальную модель [25–28].
Концепция квазиглобального кинетического механизма позволяет значительно упростить кинетическую модель горения керосина и при удачном выборе параметров модели способна дать удовлетворительное описание достаточно сложных газодинамических задач [29]. В основе концепции лежит представление химического процесса в виде нескольких последовательных и частично перекрывающихся брутто-стадий разложения исходной молекулы топлива на более мелкие промежуточные углеводородные компоненты с последующим их окислением при взаимодействии с молекулярным кислородом [30, 31]. Кинетические параметры стадий определяются на основе сопоставления результатов расчета и эксперимента.
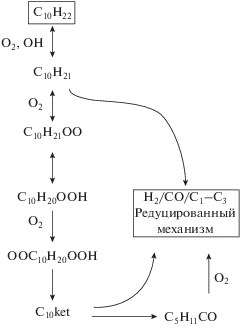
Упрощенная кинетическая модель горения керосина, разработанная в настоящей работе, базируется на использовании н-декана в качестве однокомпонентного суррогата керосина. В качестве модели инициирующих реакций, описывающих разложение н-декана как в высокотемпературной области (T ≥ 1100 K), так и при температурах ниже 1000 K, выбрана модель, представленная в работе [26]. Константы скоростей низкотемпературного механизма были скорректированы в соответствии с данными из работы [27]. Последующее преобразование продуктов инициирующих реакций моделировалось редуцированным кинетическим механизмом [31], описывающим окислительные процессы в системе H2/CO/C1–C3. Этот механизм был проанализирован на предмет включения в него дополнительных реакций [32]. Принципиальная схема химических реакций, входящих в состав упрощенной кинетической модели окисления н-декана, приведена на рис. 1.
В соответствии с имеющимися детальными кинетическими схемами разложения н-декана, окисление молекулы n-C10H22 как в высокотемпературной, так и в низкотемпературной области инициируется реакцией ее взаимодействия с молекулой O2 с образованием соответствующего децилового радикала и радикала HO2 [33]. Вследствие симметричности молекулы н-декана могут образовываться пять различных дециловых радикалов. Для того чтобы уменьшить число компонентов химически реагирующей системы, в кинетической модели из работы [26], взятой в качестве основы для данной модели, рассматривается один типичный дециловый радикал n-C10H21. Влияние других радикалов учитывается корректировкой константы скорости соответствующей реакции. К числу инициирующих реакций, играющих важную роль как в высокотемпературных, так и в низкотемпературных условиях, можно также отнести реакцию отщепления атома H от молекулы исходного топлива при ее взаимодействии с радикалами OH с образованием децилового радикала.
Дальнейшее протекание окислительного процесса связано с преобразованием дециловых радикалов. В высокотемпературной области основную роль играет глобальная реакция β-распада C10H21 с образованием молекул C3H6 и C2H4 и алкильного радикала C2H5, а также взаимодействие C10H21 с молекулой кислорода с образованием олефина и радикала HO2. Последняя реакция, как показали последующие расчеты, практически не влияет на протекание окислительного процесса. В низкотемпературной области высокие энергии активации, связанные с β-распадом дециловых радикалов, делают высокотемпературную часть механизма окисления н-декана более медленной. В этих условиях наиболее важной реакцией является присоединение к дециловому радикалу молекулы O2 с последующим внутренним отщеплением атома Н (Н-сдвиг), вторичным присоединением молекулы О2 и глобальной реакцией распада образовавшегося аддукта. В конечном счете проблема окисления н-декана сводится к окислению низших алкильных радикалов в подсистеме H2/CO/C1–C3. Эта часть кинетического механизма является ответственной за подобие пламен всех алифатических углеводородов.
В окончательном виде упрощенная кинетическая модель содержит 24 компонента, которые участвуют в 25 химических реакциях, описывающих воспламенение керосина как при высоких, так и при низких температурах. Список всех реакций вместе с параметрами соответствующих констант скоростей приведен в табл. 1. Для расчета тепловых эффектов, а также для вычисления констант скоростей обратных химических реакций используются термодинамические полиномы NASA [34], которые дают хорошую аппроксимацию термодинамических функций индивидуальных компонентов химически реагирующей системы в интервале температур от 150 до 3000 K. Для компонентов, приведенных в таблице, соответствующие данные можно найти в приложении к работе [26].
Таблица 1.
Упрощенная кинетическая модель окисления н-декана
| Номер реакции | Реакция | lg A | n | E |
|---|---|---|---|---|
| 1 | C10H22 + O2 = C10H21 + HO2 | 12.85 | 0 | 28.80 |
| 2 | C10H20 + OH = C10H21 +H2O | 7.70 | 1.9 | 0.06 |
| 3 | C10H21 → 2C3H6 + C2H5 + C2H4 | 12.54 | 0 | 28.81 |
| 4 | C10H21 + O2 = C10H21OO | 12.48 | 0 | 0 |
| 5 | C10H21OO = C10H20OOH | 11.18 | 0 | 19.00 |
| 6 | C10H21OOH + O2 → OOC10H20OOH | 12.89 | 0 | 0 |
| 7 | OOC10H20OOH → C10ket +OH | 8.86 | 0 | 17.00 |
| 8 | C10ket → C5H11CO + CH2O + OH + C3H6 | 15.60 | 0 | 43.00 |
| 9 | C5H11CO → C3H6 + C2H5 + CO | 11.00 | 0 | 9.60 |
| 10 | C5H11CO + O2 → C3H6 + C2H4 + CO + HO2 | 13.50 | 0 | 10.00 |
| 11 | C3H6 + OH = CH3CHO + CH3 | 11.54 | 0 | 0 |
| 12 | CH3CHO + OH = CH3 + CO + H2O | 13.00 | 0 | 0 |
| 13 | CH3 + HO2 = CH2O + H + OH | 13.63 | 0 | 0 |
| 14 | CO + OH = CO2 + H | 7.54 | 1.3 | –0.76 |
| 15 | O + OH = O2 + H | 14.60 | –0.5 | 0 |
| 16 | H + O2 + M = HO2 + M | 19.41 | –1.2 | 0 |
| 17 | HO2 + HO2 = H2O2 + O2 | 12.30 | 0 | 0 |
| 18 | OH + OH (+ M) = H2O2 (+ M) k∞ | 13.88 | –0.4 | 0 |
| k0 | 18.63 | –0.9 | –1.70 | |
| 19 | CH2O + OH = HCO + H2O | 10.39 | 1.2 | –0.45 |
| 20 | CH2O + HO2 = HCO + H2O2 | 12.48 | 0 | 8.00 |
| 21 | HCO + O2 = HO2 + CO | 13.52 | –0.4 | 0 |
| 22 | CH4 + O = CH3 + OH | 9.01 | 1.5 | 8.60 |
| 23 | CH4 + HO2 = CH3 + H2O2 | 13.00 | 0 | 18.70 |
| 24 | C2H4 + OH = CH2O + CH3 | 13.78 | 0 | 0.96 |
| 25 | C2H5 + O2 = C2H4 + HO2 | 10.30 | 0 | –2.20 |
РЕЗУЛЬТАТЫ РАСЧЕТОВ И ИХ ОБСУЖДЕНИЕ
Тестирование предложенной кинетической модели было проведено на основе сравнения результатов расчета с имеющимися экспериментальными данными по измерению времени задержки воспламенения τign в смесях керосина и н-декана с воздухом, полученными на ударных трубах в широком диапазоне температур и давлений. Вычислительная процедура основана на хорошо известном пакете прикладных программ CHEMKIN [35]. Расчеты проведены в приближении адиабатического процесса при постоянном давлении. Это приближение при моделировании процесса воспламенения горючих смесей в ударных трубах дает завышенные значения величин τign по сравнению с приближением постоянного объема. Тем не менее, как показано в работе [36], разница между значениями не превышает нескольких процентов, что находится в пределах разброса экспериментальных данных.
Время индукции в экспериментах обычно определяется по задержке выхода на максимальный уровень излучения электронно-возбужденного радикала OH* относительно фронта инициирующей ударной волны. Использование для этой цели радикала OH* обусловлено тем, что его излучение появляется на ранней стадии воспламенения смеси. Так как возбужденный радикал OH* не включен в рассматриваемый кинетический механизм, вычисленные значения τign определялись по максимуму произведения концентраций атомов O и H, которые являются основными компонентами, приводящими к образованию OH* [37].
Результаты экспериментов по определению времени задержки воспламенения горючих смесей τign в ударных трубах относятся к основному массиву данных, на которых проводится тестирование разрабатываемых кинетических моделей горения. В одной из ранних работ по исследованию воспламенения н-декана за отраженной ударной волной [38] время задержки измерялось в обогреваемой ударной трубе в интервале температур T = 700–1300 K при двух значениях давления p, равных 10 и 50 атм, и трех значениях коэффициента избытка топлива (equivalence ratio) ϕ = 0.5, 1.0 и 2.0. Была получена ярко выраженная S-образная зависимость времени задержки воспламенения от температуры (NTC, negative temperature coefficient), которая отражает переход от высокотемпературного механизма окисления топлива к низкотемпературному, что типично для н-алканов.
Исследование самовоспламенения керосина марки Jet-A и смесей бензола, н-гексана и н-декана в воздухе с использованием обогреваемой ударной трубы проведено в работе [39]. Цель исследования – определение состава суррогатной смеси, наилучшим образом моделирующей свойства авиационного керосина. Показано, что н-декан хорошо воспроизводит свойства самовоспламенения керосина марки Jet-A, но имеет немного большее значение времени задержки воспламенения. Задержка воспламенения смеси н-декан/кислород, разбавленной аргоном, была исследована в работе [40] в обогреваемой ударной трубе для ряда смесей с концентрациями н-декана 0.49–1.5% и кислорода 4.16–23.25% в диапазоне температур T = 1239–1616 K и давлений p = 1.82–10.0 атм. Соответствующие результаты измерений, проведенных в аэрозольной ударной трубе, получены в работе [41]. Более поздние экспериментальные данные по воспламенению керосина марок Jet-A и JP-8 [42, 43], н-декана, н-додекана и н-тетрадекана [44], керосина Jet-A [45–47] и другие в основном повторяют результаты предыдущих исследований.
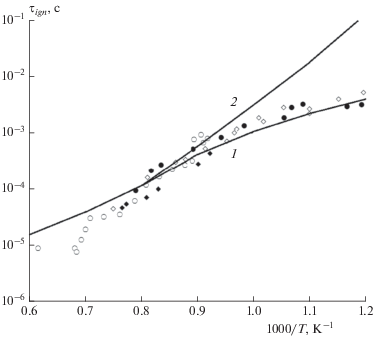
Для иллюстрации влияния давления на величину времени задержки воспламенения τign в стехиометрической смеси керосина с воздухом выбраны экспериментальные данные, полученные в работах [40, 41] при давлении p = 5 атм, в работах [38, 39, 43, 45] при p = 10 атм и в работах [43, 44] при p = 40 атм. Их сравнение с данными расчета по упрощенной кинетической модели, разработанной в настоящей работе, приведено на рис. 2. Во всей области рассмотренных температур и давлений вычисленные значения величины τign хорошо согласуются с результатами измерений. Наблюдается небольшое превышение расчетных данных над экспериментальными при высоких температурах, причем это расхождение увеличивается при уменьшении давления. При низких температурах расчетные кривые лежат в пределах разброса экспериментальных точек, полученных разными авторами. Следует также отметить, что с помощью данной кинетической модели не удается получить ярко выраженный NTC-режим в поведении времени задержки воспламенения, который фиксируется в экспериментах при температурах ниже 800 K [39].
Рис. 2.
Время задержки воспламенения τigh стехиометрической смеси (ϕ = 1.0) н-декан/воздух при различных давлениях: p = 5 (1), 10 (2), 40 атм (3). Символы – экспериментальные данные: △ – [40], ▲ – [41], ⚪ – [39], ⚫ – [38], ◇ – [43], ◆ – [45], ◼ – [44], ◻ – [43], линии – расчет по модели данной работы.
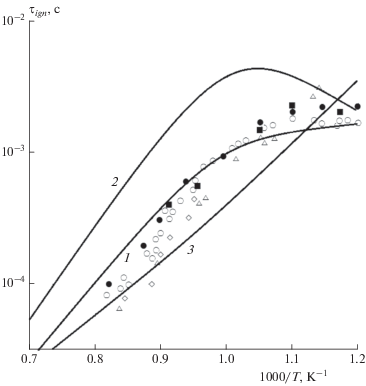
Зависимость времени задержки воспламенения от коэффициента избытка топлива при температурах выше 800 K практически отсутствует. На рис. 3 результаты расчета величины τign по упрощенной кинетической модели при давлении p = 10 атм и различных значениях ϕ сравниваются с экспериментальными данными [38]. Видно, что с увеличением коэффициента избытка топлива расчетное время задержки воспламенения уменьшается, но это уменьшение при изменении ϕ от 0.5 до 2.0 при температуре порядка 1000 K не превышает двух. При более высоких и более низких температурах расчетные кривые еще больше сближаются. В целом наблюдается небольшое превышение экспериментальных точек над данными расчета.
Рис. 3.
Время задержки воспламенения τigh смеси н-декан/воздух при давлении p = 10 атм и различных значениях коэффициента избытка топлива ϕ: 0.5 (1, △), 1.0 (2, ⚪), 2.0 (3, ◇). Символы – экспериментальные данные [38], линии – расчет по модели данной работы.
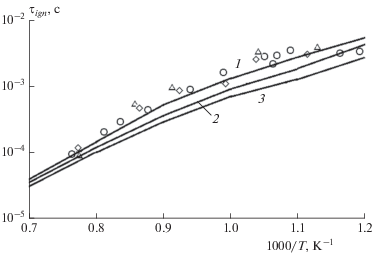
Представленная в настоящей работе упрощенная кинетическая модель объединяет высокотемпературный и низкотемпературный механизмы горения керосина. В связи с этим интересно сравнить поведение теоретических кривых, рассчитанных по полной и укороченной модели, из которой удалены низкотемпературные химические реакции. Результаты данной процедуры проиллюстрированы на рис. 4, где показаны соответствующие расчетные кривые и дано их сравнение с экспериментальными данными [38, 39] для стехиометрической смеси н-декана и воздуха при p = 10 атм. Из рисунка видно, что различия между кривыми начинаются при температурах ниже 1250 K, причем расхождение кривых резко увеличивается при дальнейшем понижении температуры и достигает полутора порядков при T = 830 K. При температурах выше 1250 K обе кривые совпадают, что говорит о преобладании высокотемпературного кинетического механизма.
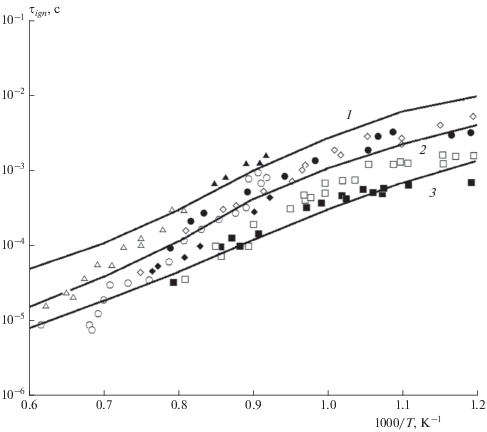
Следует отметить, что за последнее время появилось много работ по построению редуцированных кинетических моделей горения керосина различной степени сложности. В частности, достаточно подробная кинетическая модель [26], низкотемпературная часть которой взята за основу настоящей модели, содержит 40 компонентов и 141 химическую реакцию. Редуцированный кинетический механизм [28], разработанный для моделирования газодинамических течений методом LES (large eddy simulation), имеет более компактную структуру и состоит из 30 компонентов и 77 реакций. На рис. 5 представлено сравнение результатов расчетов с использованием данных моделей с результатами измерений величины τign для стехиометрической смеси керосин–воздух при давлении p = 20 атм [42, 43, 45–47]. Видно, что наилучшее согласие с экспериментальными точками наблюдается у более полной кинетической модели [26] (кривая 1), хотя при высоких температурах расчетная кривая лежит выше измеренных значений величины τign. Расчетные данные по модели из работы [28] (кривая 2) практически при всех температурах лежат выше экспериментальных точек, причем эта разница при температурах выше 1000 K превышает полпорядка. Расчетная кривая, полученная в помощью данной модели (кривая 3), хорошо согласуется с экспериментальными данными при высоких и низких температурах, хотя в промежуточной области температур (T ≈ 1000 K) экспериментальные точки лежат несколько выше.
ВЫВОДЫ
1. Разработана достаточно компактная кинетическая модель горения керосина, которая базируется на использовании н-декана в качестве суррогата керосина и содержит 24 компонента и 25 химических реакций, описывающих воспламенение керосина как при высоких, так и при низких температурах.
2. Небольшой размер модели и достаточно хорошее согласие с экспериментальными данными в интервале температур T = 800–2000 K и давлений p = 5–40 атм позволяют использовать ее при расчете сложных газодинамических течений, включая детонационное горение керосина в гиперзвуковых прямоточных двигателях.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (грант № 20-51-00003 (Бел_а)), а также в рамках госзадания Министерства науки и высшего образования Российской Федерации “Экспериментальное и теоретическое исследование кинетических процессов в газах” (регистрационный номер АААА-А19-119012990112-4).
Список литературы
Фролов С.М., Аксенов В.С., Иванов В.С. // Хим. физика. 2011. Т. 30. № 8. С. 58.
Gonzalez-Juez E.D., Kerstein A.R., Ranjan R., Menon S. // Prog. Energy Combust. Sci. 2017. V. 60. P. 26.
Segal C. The scramjet engine: processes and characte-ristics. Cambridge, NY, USA: Cambridge University Press, 2009.
Fan W., Yan C., Huang X., Zhang Q., Zheng L. // Combust. and Flame. 2003. V. 133. P. 441.
Kindracki J. // Shock Waves. 2014. V. 24. P. 603.
Wang Z., Zhang Y., Huang J., Liang Z., Zheng L., Lu J. // Appl. Therm. Eng. 2016. V. 93. P. 1.
Tian Y., Zeng X., Yang S., Xiao B., Zhong F., Le J. // Aerosp. Sci. Technol. 2019. V. 84. P. 510.
Быковский Ф.А., Ждан С.А., Ведерников Е.Ф. // Физика горения и взрыва. 2013. Т. 49. № 4. С. 60.
Wolański P. // Proc. Combust. Inst. 2013. V. 34. P. 125.
Eckel G., Grohmann J., Cantu L., Slavinskaya N., Kathrotia T. et al. // Combust. and Flame. 2019. V. 207. P. 134.
Luo F., Song W., Chen W., Long Y. // Fuel. 2021. V. 285. Article 119139.
Герасимов Г.Я., Лосев С.А. // Инж.-физ. журн. 2005. Т. 78. № 6. С. 14.
Федоров А.В., Тропин Д.А. // Физика горения и взрыва. 2012. Т. 48. № 1. С. 47.
Ren Z., Wang B., Xiang G., Zheng L. // Proc. Combust. Inst. 2019. V. 37. P. 3627.
Franzelli B., Riber E., Sanjosé M., Poinsot T. // Combust. and Flame. 2010. V. 57. P. 1364.
Туник Ю.В., Герасимов Г.Я., Левашов В.Ю., Славинская Н.А. // Физика горения и взрыва. 2020. Т. 56. № 3. С. 106.
Yan Y., Liu Y., Di D., Dai C., Li J. // Energy Fuels. 2016. V. 30. P. 10847.
Kim D., Martz J., Violi A. // Combust. and Flame. 2014. V. 161. P. 1489.
Wu Z., Mao Y., Raza M., Zhu J., Feng Y. et al. // Ibid. 2019. V. 208. P. 388.
Slavinskaya N.A., Zizin A., Aigner M. // J. Eng. Gas Turbines Power. 2010. V. 132. Issue 11. P. 111501.
Козлов В.Е., Титова Н.С., Торохов С.А. // Хим. физика. 2020. Т. 39. № 5. С. 3.
Westbrook C.K., Pitz W.J., Herbinet O., Curran H.J., Silke E.J. // Combust. and Flame. 2009. V. 156. P. 181.
Mehl M., Pitz W.J., Westbrook C.K., Curran H.J. // Proc. Combust. Inst. 2011. V. 33. P. 193.
Dagaut P., Karsenty F., Dayma G. et al. // Combust. and Flame. 2014. V. 161. P. 835.
Титова Н.С., Торохов С.А., Старик А.М. // Физика горения и взрыва. 2011. Т. 47. № 2. С. 3.
Chang Y., Jia M., Liu Y., Li Y., Xie M. // Combust. and Flame. 2013. V. 160. P. 1315.
Tay K.L., Yang W., Mohan B., Zhou H.A.D., Yu W. // Energy Convers. Manage. 2016. V. 108. P. 446.
Zettervall N., Fureby C., Nilsson E.J.K. // Fuel. 2020. V. 269. Article 117446.
Choi J.-Y. // AIAA 47th Joint Propulsion Conference;
Vandersickel A., Wright Y.M., Boulouchos K. // Combust. Theory Model. 2013. V. 17. P. 1020.
Maroteaux F., Noel L. // Combust. and Flame. 2006. V. 146. P. 256.
Тереза А.М., Андержанов Э.К. // Хим. физика. 2019. Т. 38. № 8. С. 58.
Bikas G., Peters N. // Combust. and Flame. 2001. V. 126. P. 1456.
Burcat A., Ruscic B. Third millennium ideal gas and condensed phase thermochemical database. Tech. Rep. № ANL-05/20, TAE 960. Lemont, IL, USA: Argonne National Laboratory, 2005.
Kee R.J., Rupley F.M., Meeks E., Miller J.A. CHEMKIN III. Tech. Rep. No. SAND96-8218. Livermore CA: Sandia National Laboratories, 1996.
Wang B.L., Oliver H., Grönig H. // Combust. and Flame. 2003. V. 133. P. 93.
Hall J.M., Petersen E.L. // Intern. J. Chem. Kinet. 2006. V. 38. P. 714.
Pfahl U., Fieweger K., Adomeit G. // Proc. 26th Sympos. (Intern.) on Combust. Pittsburgh: The Combust. Inst., 1996. P. 781.
Dean A.J., Penyazkov O.G., Sevruk K.L., Varatharajan B. // Proc. Combust. Inst. 2007. V. 31. P. 2481.
Olchanski E., Burcat A. // Intern. J. Chem. Kinet. 2006. V. 38. P. 703.
Haylett D.R., Davidson D.F., Hanson R.K. // Combust. and Flame. 2012. V. 159. P. 552.
Vasu S.S., Davidson D.F., Hanson R.K. // Ibid. 2008. V. 152. P. 125.
Wang H., Oehlschlaeger M.A. // Fuel. 2012. V. 98. P. 249.
Shen H.-P.S., Steinberg J., Vanderover J., Oehlschlaeger M.A. // Energy Fuels. 2009. V. 23. P. 2482.
Zhukov V.P., Sechenov V.A., Starikovskiy A.Yu. // Fuel. 2014. V. 126. P. 169.
Han H.S., Kim C.J., Cho C.H., Sohn C.H., Han J. // Ibid. 2018. V. 232. P. 724.
Dooley S., Won S.H., Chaos M. et al. // Combust. and Flame. 2010. V. 157. P. 2333.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика