Химическая физика, 2022, T. 41, № 10, стр. 16-22
Реакции бензил- и гидроксиэтил-радикалов с оксидом азота
И. И. Морозов 1, *, Е. С. Васильев 1, Н. Д. Волков 1, О. С. Морозова 1, Д. Р. Нигматуллин 1, А. Г. Сыромятников 1, 2, С. В. Савилов 2, 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
* E-mail: igormrzv@gmail.com
Поступила в редакцию 29.03.2022
После доработки 18.04.2022
Принята к публикации 20.04.2022
- EDN: NAOXJC
- DOI: 10.31857/S0207401X22100089
Аннотация
Бензил- и гидроксиэтил-радикалы играют важную роль в процессах горения и окисления толуола и этанола. В результате их реакций с оксидами азота образуется целый ряд токсикантов, в том числе частицы сажи. Установление механизма реакций бензил- и гидроксиэтил-радикалов с оксидами азота позволят объяснить многие важные химические процессы при горении и в атмосфере. В данной работе с помощью экспериментальной методики, использующей проточный реактор и времяпролетный масс-спектрометр, работающий в режиме многофотонной ионизации, исследованы реакции бензил- и гидроксиэтил-радикалов с оксидом азота в температурном диапазоне 250–360 К при давлении 1 мбар. Для разных типов красителей перестраиваемого лазера получены спектры многофотонной диссоциации гидроксиэтил-радикалов в диапазоне длин волн лазерного излучения от 425 до 590 нм. Экспериментально установлен вид температурной зависимости отношения констант скорости реакций оксида азота с бензил- и гидроксиэтил-радикалами. С использованием литературных данных методом конкурирующих реакций получено значение константы скорости реакции NO c C6H5CH2 при температуре T = 299 К.
1. ВВЕДЕНИЕ
Процессы газофазных трансформаций толуола и этанола играют важную роль в горении и окислении углеводородных топлив, а также в химии атмосферы. Бензил – первичный продукт окисления толуола, образующийся при потере атома водорода H метильной боковой цепи. Толуол является простейшим алкилированным ароматическим соединением и одной из самых крупных компонент дизельного топлива и бензина. Окисление толуола начинается с реакции с гидроксильным радикалом ОН. Далее образовавшиеся свободные радикалы вступают в реакции с молекулярным кислородом и другими малыми газовыми примесями атмосферы, включая оксиды азота. В свою очередь, этанол представляет собой наиболее распространенный органический реагент, который находит широкое практическое применение. В настоящее время во многих странах используется биотопливо, основу которого составляет этанол.
Бензил- и гидроксиэтил-радикалы являются ключевыми промежуточными звеньями в окислении ароматических углеводородных топлив и образовании токсичных полициклических ароматических углеводородов. Реакции бензильных радикалов с оксидами азота играют важную роль в химии атмосферы и процессах горения ароматических соединений, которые коагулируют с образованием частиц сажи. Наличие этих соединений в атмосфере является серьезной экологической проблемой из-за их токсичности [1] и потенциального участия в глобальном потеплении [2]. Для специалистов гидроксиэтильный радикал CH3СНОН представляет особый интерес ввиду его важной роли в процессах горения и трансформации в атмосфере, а также способности реагировать с NOx. В процессах горения и атмосферной трансформации образовавшиеся бензил- и гидроксиэтил-радикалов реагируют с другими окружающими молекулами, в том числе и с монооксидом азота:
(1)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}} + {\text{NO}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{NO}},$(2)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHOH}} + {\text{NO}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHO}} + {\text{HNO}},$(3)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHOH}} + {\text{NO}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CH}}\left( {{\text{NO}}} \right){\text{OH}}{\text{.}}$Процессы (1)–(3), в которых образуются токсиканты, вплоть до настоящего времени недостаточно изучены.
Авторы работы [3], применяя методы лазерного импульсного фотолиза и фотоионизационной масс-спектрометрии, исследовали реакцию радикала гидроксиэтила с оксидом азота (3) и привели значение константы скорости реакции $k = (2.4 \pm 0.6) \cdot {{10}^{{ - 11}}}$ см3 · молекул–1 · с–1. Теоретическое исследование реакции гидроксиэтил-радикалов с оксидом азота в диапазоне температур 200–1100 К и давлений от 1.0 · 10–5 до 10 бар было выполнено в работе [4]. В частности, было показано, как изменяются каналы и продукты реакции в зависимости от давления и температуры.
Впервые кинетика реакции
(4)
${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}} + {\text{NO}} + {\text{M}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{NO}} + {\text{M}}$В лабораторных экспериментах бензил- и гидроксиэтил-радикалы получают в результате реакции атомарного хлора с толуолом и этанолом, т.е.
(5)
$\begin{gathered} {\text{Cl}} + {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{3}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{2}} + {\text{HCl}}, \\ \Delta H = - 4.3{\text{ кДж/моль,}} \\ \end{gathered} $(6)
$\begin{gathered} {\text{Cl}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHOH}} + {\text{HCl}}, \\ \Delta H = - 38.9{\text{ кДж/моль}}. \\ \end{gathered} $Реакция (5) толуола с атомарным хлором исследовалась ранее методом импульсного радиолиза в сочетании с УФ-спектроскопией [7]. Авторы зарегистрировали УФ-спектр бензил радикала в диапазоне длин волн 210–340 нм. Абсолютные значения константы скорости реакции (5) были измерены в работе [8] с одновременным использованием методов лазерного фотолиза и инфракрасного поглощения непрерывного действия, включающего многопроходную абсорбционную ячейку типа Херриотта.
Реакция атомов хлора с этанолом рассматривалась ранее в нескольких лабораториях. Так, в работе [9] реакция (6) в проточном реакторе при комнатной температуре и давлении в несколько мбар исследовалась методом конкурентных реакций с анализом продуктов и реагентов с помощью масс-спектрометра. В этих экспериментах отрыва атомов водорода от ОН-группы не наблюдался, поскольку атом H отрывается от алкильной группы, что термодинамически более выгодно. Более детальная информация об атмосферных процессах с участием бензола и этанола приведена в работах [10, 11].
Метод многофотонной ионизации (МФИ) широко применяется в исследовании кинетики химических реакций [3]. Ионизация свободных радикалов протекает в несколько стадий. Сначала происходит поглощение фотона радикалом и переход последнего в возбужденное состояние. Затем следует поглощение следующего кванта, которое приводит к фотоионизации частицы. Образовавшиеся при этом ионы детектируются масс-спектрометром. Метод МФИ является достаточно высокочувствительным и селективным. Он лишен многих недостатков метода ионизации электронным ударом, которая приводит к диссоциативной ионизации молекул и сложностям интерпретации масс-спектров. Впервые спектр МФИ радикалов бензила был зарегистрирован в реакции атомов хлора с бензолом [12]. В дальнейшем этот метод успешно использовался при исследовании реакций атомарного кислорода с молекулярным бромом [13], в котором был зарегистрирован масс-спектр радикалов BrO.
Цель настоящего исследования заключалась в установлении кинетических закономерностей реакций бензил- и гидроксиэтил-радикалов с оксидом азота при давлении 1 мбар в температурном диапазоне от 250 до 360 K с использованием метода конкурирующих реакций.
2. МЕТОДИКА ЭКСПЕРИМЕНТА
Описание экспериментальной методики, использующей проточный реактор, времяпролетный масс-спектрометр (работающий в режиме многофотонной ионизации и ионизации электронным ударом) и систему напуска реагентов и продуктов реакции в виде молекулярного пучка, было приведено ранее в работах [14, 15]. Указанная методика применялась для детектирования радикалов CH3, C3H5, CH2OH, СН3CHOH и их дейтерированных аналогов при установлении кинетических закономерностей элементарных реакций в газовой фазе.
Методика кинетических измерений
Эта же методика с небольшими модификациями была применена в настоящей работе для исследования реакций (1)–(3) бензил- и гидроксиэтил-радикалов с оксидом азота в проточном реакторе в температурном диапазоне 250–360 К и при давлении 1 мбар = 0.75 Торр.
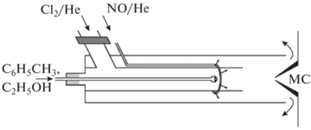
Принципиальная схема экспериментальной установки приведена на рис. 1. Толуол и этанол в определенных концентрациях в смесях с газом-носителем гелием подавали в зону реакции через инжектор 1. На рис. 2 детально показан ввод толуола и этанола в проточный реактор через инжектор. Молекулярный хлор в смеси с гелием вводили в разрядную трубку, а оксид азота подавали в зону реакции через отдельную линию.
Рис. 1.
Времяпролетный масс-спектрометр с многофотонной ионизацией: 1 – инжектор, 2 – высокочастотный разряд, 3 – откачка, 4 – отбор проб, 5 – линза, 6 – время пролетный масс-спектрометр, 7 – манометр, 8 – лазер на красителях, 9 – эксимерный лазер.

Атомы хлора получали в результате пропускания 5%-ной смеси хлора в гелии через высокочастотный разряд выше по потоку по отношению к реакционной зоне. Диссоциация хлора достигала 20–60%. Концентрации толуола, этанола, Cl2 и NO устанавливали по изменению давления в калиброванном объеме. Концентрацию атомов хлора определяли по степени диссоциации молекулярного хлора в разряде.
Концентрации реагентов и продуктов реакций, включая свободные радикалы, измеряли масс-спектрометрическими методами с применением ионизации электронным ударом и МФИ. В работе были задействованы два масс-спектрометра: в первом в качестве анализатора использовался масс-спектрометр с секторным магнитом, а во втором – времяпролетный масс-анализатор. Свободные радикалы детектировались методом МФИ, осуществляемой с помощью перестраиваемого лазера на красителях Lambda Physik FL 2002 (USA), накачка которого осуществлялась эксимерным лазером Lambda Physik LPX205 iCC (USA). Эксимерный лазер работал на длине волны λ = 308 нм (рабочая смесь XeCl) с энергией 400 мДж, длительностью импульса τ = 28 нс и частотой повторения импульсов 5 Гц. Для детектирования ионов использовались многоканальные пластины. Свет от перестраиваемого лазера фокусировался кварцевой линзой на молекулярный пучок в ионном источнике.
Концентрации реагентов в реакциях (1)–(3), определенные с помощью МФИ, составили [C6H5CH2]0 = [СН3CHOH]0 = 2.4 · 1014 молекул/см3. Концентрация [NO]0 изменялась в диапазоне (6÷54) 1013 молекул/см3. Нижний индекс “0” обозначает концентрации веществ до реакций с атомарным хлором.
Скорость потока составляла 40–50 м/с. Расстояние между инжектором и зоной отбора пробы было около 3 см. В реакторе поддерживалось давление в 1 мбар. Температуру устанавливали и поддерживали путем циркуляции в рубашке термостатирующей жидкости термостатом F30 производства компании Julabo (Germany) с точностью ±1 К. Температура измерялась термопарой, помещенной в жидкость. Ионный ток собирался и накапливался за N = 200 лазерных импульсов.
Реактивы и красители
В эксперименте использовали коммерческие реагенты: гелий высокой чистоты (99.996%, Messer-Griesheim), толуол (98.5%, Sigma-Aldrich), этанол (98.7%, Sigma-Aldrich), NO (98.7%, Linde), Ar (99.996%, Messer-Griesheim); Cl2 (98%, Messer-Griesheim, 5%-ный раствор в He). Все реактивы использовали после очистки и обезгаживания.
В перестраиваемом лазере на красителях применяли следующие красители: Coumarin 153 (Dye 153) в области спектра 517–574 нм с максимумом при 535 нм; Coumarin 307 (Dye 307) в области спектра 480–540 нм с максимумом при 500 нм; Coumarin 47 (Dye 47) в области спектра 442–479 нм с максимумом при 460 нм; Coumarin 120 (Dye 120) в области спектра 429–460 нм с максимумом при 441 нм.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Многофотонная ионизация бензил- и гидроксиэтил-радикалов
Как было сказано выше, бензил- и гидроксиэтил-радикалы получали в результате реакции (5) и (6) атомарного хлора с толуолом и этанолом. На рис. 3 приведен масс-спектр радикалов С6Н5СН2 (m/z = 91) и СН3СНОН (m/z = 45), полученный на длине волны λ = 502.5 нм. В табл. 1 для разных типов красителей перестраиваемого лазера представлены характеристики спектров многофотонной диссоциации гидроксиэтил-радикалов в диапазоне длин волн лазерного излучения от 427 до 540 нм.
Рис. 3.
Масс-спектр радикалов С6Н5СН2 и СН3СНОН, генерируемых реакциями (5) и (6) на длине волны 502.5 нм.

Таблица 1.
Характеристики спектров многофотонной диссоциации радикалов гидроксиэтила (λ – длина волны, I – интенсивность сигнала, E – энергия лазерного импульса)
| Краситель | λ, нм | I, отн. ед. | E, мДж |
|---|---|---|---|
| Dye 120 | 425 | 4 | 2.9 |
| 430 | 10 | 4.5 | |
| 435 | 14 | 5.8 | |
| 440 | 20 | 6.4 | |
| 445 | 29 | 6.1 | |
| 450 | 23 | 5.9 | |
| 455 | 27 | 5.3 | |
| 460 | 15 | 4.0 | |
| 465 | 5 | 1.6 | |
| Dye 47 | 440 | 1 | – |
| 443 | 7 | – | |
| 445 | 11 | – | |
| 450 | 5 | 6.9 | |
| 455 | 24 | 8.5 | |
| 460 | 20 | 9.3 | |
| 465 | 40 | 9.6 | |
| 470 | 34 | 9.8 | |
| 475 | 28 | 8.5 | |
| 480 | 20 | 8.0 | |
| 485 | 12 | 5.6 | |
| 490 | 1 | 1.8 | |
| Dye 307 | 485 | 6 | 4.5 |
| 490 | 18 | 9.0 | |
| 492 | 30 | – | |
| 494 | 37 | – | |
| 494.5 | 30 | – | |
| 495 | 45 | 10.4 | |
| 496 | 30 | – | |
| 497 | 55 | – | |
| 500 | 31 | 12.0 | |
| 504 | 19 | – | |
| 505 | 29 | 12.0 | |
| 510 | 32 | 11.2 | |
| 512 | 16 | – | |
| 515 | 28 | 10.6 | |
| 520 | 30 | 10.1 | |
| 525 | 17 | 9.3 | |
| 530 | 14 | 8.5 | |
| 535 | 15 | 6.9 | |
| 540 | 7 | 5.6 | |
| 545 | – | 4.2 | |
| 550 | – | 2.1 | |
| Dye 153 | 525 | – | 4.0 |
| 530 | – | 10.2 | |
| 535 | 40 | 12.3 | |
| 540 | 55 | 12.5 | |
| 545 | 42 | 12.3 | |
| 550 | 40 | 12.3 | |
| 555 | 36 | 11.7 | |
| 560 | 21 | 11.2 | |
| 565 | 25 | 10.9 | |
| 570 | 14 | 9.8 | |
| 575 | 12 | 9.1 | |
| 580 | 9 | 7.7 | |
| 585 | 6 | 6.1 | |
| 590 | 4 | 4.5 |
В верхней части рис. 4 для разных типов применяемых красителей изображена зависимость ионного тока молекулярной массы гидроксиэтил-радикала m/z = 45 от длины волны лазерного излучения. В нижней части этого рисунка приведены соответствующие энергии ионизирующего лазера.
Рис. 4.
Ионный ток гидроксиэтил-радикала, зарегистрированный при m/z = 45 в диапазоне длин волн λ = 420–574 нм. Вверху – интенсивность ионного тока I, внизу – мощность лазерного излучения E. Синие кривые (1) соответствуют красителю Dye 120, желтые (2) – Dye 47, зеленые (3) – Dye 307, красные (4) – Dye 153.
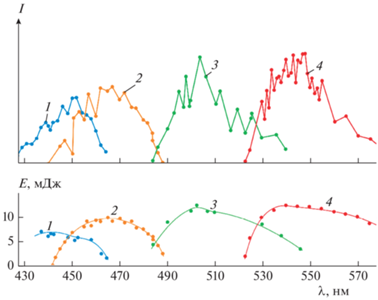
Эксперименты по определению зависимости ионного тока радикала гидроксиэтила от энергии лазера с длиной волны λ = 544 нм были проведены при следующих отношениях массы к заряду: m/z = 45, 29 и 43. По результатам этих экспериментов сделан вывод, что молекулярный ион с m/z = 45 образуется 2 + 1 фотонами, а ионы с m/z = 29 и 43 образуются в процессе фрагментации, и для их ионизации требуется дополнительный, четвертый фотон.
Кинетические измерения
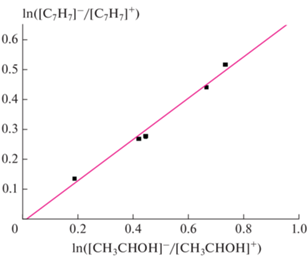
Измерение отношений k1/k2 констант скорости реакций (1) и (2) оксида азота с бензил- и гидроксиэтил-радикалами проводилось для семи различных значений температуры. На рис. 5 представлен результат определения k1/k2 при Т = 299 К.
Рис. 5.
Отношение констант скорости реакций оксида азота с бензил- и гидроксиэтил-радикалами при температуре Т = 299 К.
В табл. 2 собраны данные для отношения констант скорости в диапазоне температур от 250 до 360 К. Обработка этих данных в аррениусовских координатах (см. рис. 6) дает следующее значение:
Используя величину k2, взятую из работы [3], для константы скорости k1 при температуре Т = 299 К получим(8)
${{k}_{1}}\left( {299{\text{ K}}} \right) = 1.67{\text{ }}\cdot{\text{ }}{{10}^{{ - 11}}}\,{\text{с}}{{{\text{м}}}^{3}}\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}}.$Таблица 2.
Температурная зависимость отношения констант скорости реакций бензила и гидроксиэтила с оксидом азота NO в диапазоне температур 250 < T < 360 K
| T, K | k1/k2 |
|---|---|
| 253 | 1.140 |
| 263 | 1.300 |
| 273 | 0.750 |
| 293 | 0.605 |
| 299 | 0.692 |
| 323 | 0.570 |
| 353 | 0.490 |
Рис. 6.
Температурная зависимость отношения констант скорости реакции оксида азота с бензил- и гидроксиэтил-радикалами.

Обратимая реакция (4) радикала бензила с оксидом азота в присутствии молекулярного азота изучалась ранее при различных давлениях и температурах [6]. Так, для прямой реакции (4) были установлены значения констант скорости для нескольких температур:
(9)
$\begin{gathered} {{k}_{4}}\left( {415{\text{ К}}} \right) = \\ = \left( {9.1 \pm 0.8} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,{\text{с}}{{{\text{м}}}^{3}}\,\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\,\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}}, \\ \end{gathered} $(10)
$\begin{gathered} {{k}_{4}}\left( {443{\text{ К}}} \right) = \\ = \left( {8.1 \pm 0.5} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,{\text{с}}{{{\text{м}}}^{3}}\,\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\,\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}}, \\ \end{gathered} $(11)
$\begin{gathered} {{k}_{4}}\left( {466{\text{ К}}} \right) = \\ = \left( {6.2 \pm 0.9} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,\,{\text{с}}{{{\text{м}}}^{{\text{3}}}}\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\,\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}}. \\ \end{gathered} $Однако эти данные были получены в отличных от наших условиях экспериментов, и поэтому их нельзя сравнивать.
В то же время в работе [16] рассматривалась реакция
(12)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHOH + NO + He}} \to \\ \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CH(NO)OH + He,}} \\ \end{gathered} $(13)
$\begin{gathered} {{k}_{{12}}} = \left( {12.5 \pm 0.4} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,{\text{с}}{{{\text{м}}}^{3}}\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}} \\ {\text{при}}\,\,P = 0.55{\text{ Торр}}, \\ \end{gathered} $(14)
$\begin{gathered} {{k}_{{12}}} = \left( {16.6 \pm 0.6} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,{\text{с}}{{{\text{м}}}^{3}}\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}}\, \\ {\text{при}}\,P = 1.00{\text{ Торр}}, \\ \end{gathered} $(15)
$\begin{gathered} {{k}_{{12}}} = \left( {18.1 \pm 0.6} \right){\text{ }}\cdot{\text{ }}{{10}^{{ - 12}}}\,{\text{с}}{{{\text{м}}}^{3}}\cdot{\text{ молекул}}{{{\text{а}}}^{{ - 1}}}\cdot{\text{ }}{{{\text{с}}}^{{ - 1}}} \\ {\text{при}}\,\,P = {\text{ }}2.00{\text{ Торр}}. \\ \end{gathered} $Эти значения оказались близки к результатам, полученным в работе [3] при более высоком давлении (2.0–4.0 Торр). Поэтому использованное нами значение k2, взятое из работы [3], для определения величины k1 (см. (8)) является правомерным.
4. ЗАКЛЮЧЕНИЕ
Настоящее исследование является продолжением цикла работ [17–20] по применению масс-спектрометрии к исследованию атмосферных процессов. В данной работе с помощью экспериментальной методики, в которых используются проточный реактор и времяпролетный масс-спектрометр, работающий в режиме многофотонной ионизации, исследованы реакции бензил- и гидроксиэтил-радикалов с оксидом азота в температурном диапазоне 250–360 К и при давлении 1 мбар = 0.75 Торр. Бензил- и гидроксиэтил-радикалы генерировались получали в результате реакций атомарного хлора с толуолом и этанолом. Для разных типов красителей перестраиваемого лазера получены спектры многофотонной диссоциации гидроксиэтил радикалов в диапазоне длин волн лазерного излучения от 425 до 590 нм.
Экспериментально установлено, что температурная зависимость отношения k1/k2 констант скорости реакций оксида азота с бензил- и гидроксиэтил-радикалами имеет вид
k1/k2 = 0.043exp(6.9/RT).
С использованием литературных данных методом конкурирующих реакций получено следующее значение константы скорости реакции NO c C6H5CH2 при температуре T = 299 К:
k1 (299 K) = 1.67 · 10–11 см3 · молекула–1 · с–1.
Представленное исследование было частично выполнено в университете Гёттингена. Авторы выражают благодарность проф. К. Хоерманну за доброжелательную атмосферу, полезные советы и дискуссии, а также д-ру И. Сииба за помощь в совместной работе.
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (регистрационные номера тем 122040500060-4 и АААА-А21-121011990019-4) и при финансовой поддержке Российским фондом фундаментальных исследований (грант № 19-05-50076 (Микромир)).
Список литературы
Dockery D.W., Pope C.A., Xu X. et al. // New Engl. J. Med. 1993. V. 329. № 24. P. 1753.
Shindell D., Faluvegi G. // Nature Geosci. 2009. V. 2. № 4. P. 294.
Miyoshi A., Matsui H., Washida N. // Chem. Phys. Lett. 1989. V. 160. № 3. P. 291.
Wang X., Song J., Meng Z. // J. Phys. Chem. A. 2019. V. 123. № 35. P. 7544.
Ebata T., Obi K., Tanaka I. // Chem. Phys. Lett. 1981. V. 77. № 3. P. 480.
Boyd A.A., Noziere B., Lesclaux R. // J. Phys. Chem. 1995. V. 99. № 27. P. 10815.
Markert F., Pagsberg P. // Chem. Phys. Lett. 1993. V. 209. № 5–6. P. 445.
Smith J.D., DeSain J.D., Taatjes C.A. // Chem. Phys. Lett. 2002. V. 366. № 3–4. P. 417.
Khatoon T., Edelbüttel-Einhaus J., Hoyermann K. et al. // Bericht. Bunseng. Phys. Chem. 1989. V. 93. № 5. P. 626.
Vereecken L. // Adv. Atmos. Chem. V. 2: Organic oxidation and multiphase chemistry / Eds. Barker J.R., Steiner A.L., Wallington T.J. New Jersey: World Scientific, 2019.
Taketani F., Takahashi K., Matsumi Y. et al. // J. Phys. Chem. A. 2005. V. 109. № 17. P. 3935.
Hoffbauer M.A., Hudgens J.W. // J. Phys. Chem. 1985. V. 89. № 24. P. 5152.
Морозов И.И., Хоерманн К. // Докл. АН. 1997. Т. 355. № 2. С. 203.
Heinemann-Fiedler P., Hoyermann K. // Bericht. Bunseng. Phys. Chem. 1988. V. 92. № 12. P. 1472.
Edelbüttel-Einhaus J., Hoyermann K., Rohde G. et al. // Sympos. (Intern.) Combust. 1992. V. 24. № 1. P. 661.
Daële V., Ray A., Vassalli I. et al. // Intern. J. Chem. Kinet. 1995. V. 27. № 11. P. 1121.
Васильев Е.С., Карпов Г.В., Волков Н.Д. и др. // Хим. физика. 2021. Т. 40. № 3. С. 17.
Дьяков Ю.А., Адамсон С.О., Ванг П.К. и др. // Хим. физика. 2021. Т. 40. № 5. С. 68.
Васильев Е.С., Волков Н.Д., Карпов Г.В. и др. // Хим. физика. 2021. Т. 40. № 10. С. 30.
Васильев Е.С., Карпов Г.В., Шартава Д.К. и др. // Хим. физика. 2022. Т. 41. № 5. С. 10.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика