Химическая физика, 2022, T. 41, № 2, стр. 3-11
Молекулярный докинг цианиновых и скварилиевых красителей с эндорибонуклеазой NSP15 коронавируса SARS-CoV-2
П. Г. Пронкин 1, *, А. С. Татиколов 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: pronkinp@gmail.com
Поступила в редакцию 27.07.2021
После доработки 16.08.2021
Принята к публикации 20.08.2021
- EDN: RMOOPD
- DOI: 10.31857/S0207401X22020091
Аннотация
Продолжающееся распространение коронавирусной инфекции COVID-19 ставит целью найти новые инструменты и методы обнаружения, изучения инфекции и предотвращения заболеваемости (в частности, новые аналитические процедуры и тесты). С целью разработки зондов для обнаружения коронавируса SARS-CoV-2 методом моделирования in silico (молекулярный докинг) изучено нековалентное связывание цианиновых и скварилиевых красителей, имеющих различные заряды молекул и разные типы гетероциклических остатков и заместителей (всего 42 соединения), с разными вариантами эндорибонуклеазы NSP15 коронавируса SARS-CoV-2 (COVID-19): исходного (“дикого”) типа и мутантными типами. Определены энергии взаимодействия и пространственные конфигурации молекул красителей в комплексах с NSP15. Некоторые красители, имеющие отрицательные значения общей энергии комплекса Etot, перспективны для дальнейшего практического изучения в качестве зондов на коронавирус.
ВВЕДЕНИЕ
Угроза продолжающегося распространения коронавируса SARS-CoV-2 (COVID-19), которое сопровождается его мутациями, определяет необходимость разработки новых процедур и тестов для обнаружения, изучения и предотвращения распространения вируса. Один из наиболее эффективных подходов, используемых в настоящее время в вирусных исследованиях, включает использование флуоресцентных зондов и меток, таких как цианиновые красители [1–4] (в частности, оксамонометинцианины [5]). Основными преимуществами цианиновых красителей являются высокие коэффициенты экстинкции, поглощение и испускание в спектральном диапазоне от УФ- до ИК-области, перекрывающим оптическое окно прозрачности биологических образцов, а также их уникальные фотофизические и фотохимические свойства, зависящие от молекулярного окружения [6]. Нековалентное взаимодействие цианиновых красителей с биомолекулами (нуклеиновые кислотами, белками) приводит к изменению фотофизических и фотохимических свойств красителей и зачастую протекает с многократным усилением флуоресценции, что создает предпосылки для использования цианинов в качестве зондов в природных и искусственных системах, содержащих биомакромолекулы [7–12]. Разнообразие структур и свойств цианиновых красителей разных типов (которые содержат полиметиновые цепи разной длины, разные концевые гетероциклы и заместители) требует молекулярного моделирования in silico для предварительного скрининга соединений [13–15]. Ранее нами было изучено in silico (методом молекулярного докинга) взаимодействие между различными полиметиновыми (цианиновыми) красителями (всего 45 соединений) и спайк-протеином (S) SARS-CoV-2 [16]. В данной работе методом моделирования in silico (молекулярный докинг) продолжено изучение взаимодействия цианиновых красителей с молекулярными компонентами коронавируса SARS-CoV-2 — смоделировано взаимодействие различных видов красителей (42 соединения) с разными типами белка-фермента вируса SARS-CoV-2 – эндорибонуклеазы NSP15: как исходного (“дикого”) типа, так и мутантными типами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Молекулярный докинг проводили с помощью сайта DockThor [17–19]. В эксперименте использовали целевые структуры белков, предложенные на сайте DockThor; в качестве референса изучали “дикий” тип белка-фермента NSP15 (PDB-код: 6wxc), соответствующий эталонной последовательности генома вируса (выделен в г. Ухань, провинция Хубэй, Китай, декабрь 2019 г.) [20]. Выполнен также докинг с четырьмя мутантными разновидностями белка NSP15: S294A, S294T, Y343C, Y343H. Структура NSP15 S294A соответствует мутации ключевого аминокислотного участка с нейтральным функциональным эффектом, связанной с заменой остатка Ser294 на Ala294 (замена гидрофильного остатка на гидрофобный в сайте связывания лиганда) [21]. Разновидность S294T имеет аминокислотную замену Ser293 на Thr293 (без изменения функционального эффекта); Y343C получена заменой аминокислотного остатка Tyr343 на Cys 343, что относится непосредственно к сайту связывания лигандов; структура Y343H соответствует мутации в сайте связывания белка с заменой Tyr343 на His343 [20].
Небелковые компоненты (молекулы воды, ионы, кофакторы и лиганды) были удалены (DockThor), добавлены атомы водорода и оптимизирована сеть водородных связей c учетом pH = 6.2 [22]. Для мутантных форм NSP15 “дикий” тип (с PDB-кодом: 6wxc) использован в качестве шаблона. В работе использовались предложенные структуры; дополнительную корректировку протонирования аминокислотных остатков не проводили.
Эксперименты проводили в режиме “слепого” докинга (blind docking); размер аппроксимирующей решетки – 22 Å, центр при X = 63.94, Y = –72.47, Z = = 26.37, шаг дискретизации – 0.25 Å [17–20]. При анализе результатов учитывали до пяти лучших конфигураций.
Исследованы симметричные скварилиевые красители: моно-, три-, пента- и гептаметинцианины, как катионные, так и анионные (имеющие отрицательно заряженные сульфогруппы), с различными гетероциклами (бензимидазолил, бензотиазолил, бензоксазолил) и заместителями в гетероциклах. Триметинцианины (карбоцианины) также имели различные заместители в гетероатомах и мезо-положении полиметиновой цепи. Для создания PDB-структур красителей-лигандов и оптимизации их геометрии (силового поля MMFF94) использовали молекулярный редактор Avogadro [23]. Для трехмерной визуализации и анализа результатов стыковки использовали программу UCSF Chimera [24]. Исходная изомерная форма мезо-замещенных карбоцианинов соответствовала цис-конфигурации как наиболее стабильной для красителей этого типа в полярных растворителях [25].
О стабильности возможных комплексов краситель–белок судили по знаку и величине полной энергии системы Etot, полученной в результате докинга [17, 20]: предполагалось, что образование стабильных комплексов более вероятно при достаточно низких (т.е. бóльших по абсолютной величине) отрицательных энергиях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Молекулярный докинг катионных карбоцианиновых и нейтральных скварилиевых красителей с NSP15
Изучено взаимодействие катионных мезо-замещенных карбоцианиновых (К1–К7) и нейтральных скварилиевых красителей (СК1–СК5) с различными вариантами NSP15. Структурные формулы красителей представлены на рис. 1. Карбоцианиновые красители отличаются друг от друга как заместителями в мезо-положении полиметиновой цепи, так и концевыми гидроциклами. Скварилиевые красители отличаются друг от друга заместителями R1, R2.
Рис. 1.
Структурные формулы цианиновых красителей, а также нейтральных и анионных скварилиевых красителей.
Исследованные катионные и нейтральные красители характеризуются положительными значениями полной энергии Etot при взаимодействии со всеми типами NSP15. В частности, при докинге К1 и К7 с NSP15 “дикого” типа получено: Etot = 16.7 ± 0.7 и 55.4 ± 0.33 ккал · моль–1 соответственно, что практически совпадает с результатом, полученным для мутантного варианта NSP15 Y343H. Наименьшие значения Etot при докинге с “диким” типом NSP15 получены для оксакарбоцианина К5 (Etot = 6.95 ± 0.17 ккал · моль–1) и для тиакарбоцианина К3 (Etot = 10.6 ± 0.93 ккал · моль–1). Отметим, что для катионных карбоцианиновых красителей значения энергии Ван-дер-Ваальса (EvdW) оказались отрицательными: для красителей с различными гетероциклами они близки и лежат в пределах от –19.6 ± 3.32 ккал · моль–1 (краситель К4) до –27.8 ± 0.67 ккал · моль–1 (краситель К3). Аналогичные результаты (Etot > 0) были получены ранее для катионных красителей при докинге со спайк-протеином SARS-CoV-2 [16].
Положительные значения Etot были получены и при докинге незаряженных скварилиевых красителей с NSP15. В частности, для красителей СК2 и СК3 с заместителями R1 = OH значения Etot = 59.4 ± 1.15 и 15.2 ± 0.79 ккал · моль–1 (с “диким” типом NSP15) соответственно. Докинг с NSP15 незамещенного СК1 дает значительно более благоприятное (но тоже положительное) значение энергии (Etot = 7.7 ± 0.56 ккал · моль–1). Аналогичные данные получены при докинге нейтральных скварилиевых красителей со спайк-протеином [16]. Положительные значения Etot могут указывать на недостаточную стабильность комплексов катионных полиметиновых красителей и нейтральных скварилиевых красителей с NSP15.
Независимо от использования мутантных подтипов NSP15, энергии электростатического взаимодействия, Eel, и Ван-дер-Ваальса, EvdW, оказались отрицательными; для основной части красителей их средние значения составляют –13.7 ± 1.01 и ‒13.4 ± 3.7 ккал · моль–1 соответственно. Бромзамещенные красители СК4 и СК5 при докинге с NSP15 (“дикий” тип) имеют EvdW = –29.1 ± 0.62 и –25.6 ± 0.26 ккал · моль–1 и Eel = –0.31 ± 0.51 и ‒1.28 ± 0.39 ккал · моль–1 соответственно.
Молекулярный докинг анионных красителей с NSP15
Анионные скварилиевые красители. Наряду с незаряженными (нейтральными) скварилиевыми красителями (СК1–СК5) был проведен молекулярный докинг анионных скварилиевых красителей СК1.1–СК1.5 с NSP15 (структуры красителей приведены на рис. 1). В результате докинга для большинства исследованных анионных скварилиевых красителей получены отрицательные значения полной энергии (Etot < 0). В частности, при взаимодействии СК1.4 с “диким” и мутантным (Y343H) типами NSP15 получены Etot = –8.78 ± 0.55 и ‒9.46 ± 1.14 ккал · моль–1. В то же время в случае СК1.1 получены положительные значения Etot = = 20.5 ± 0.42 и 20.6 ± 0.89 ккал · моль–1 соответственно. Возможно, это обусловлено стерическими препятствиями для образования комплекса, создаваемыми группами С(СН3)3 [16].
Сильно отрицательные значения Etot были получены при докинге скварилиевых красителей СК1.2 и СК1.5; при этом наиболее отрицательные значения Etot – при докинге с S294T для имеющего бензтиазольные гетероциклы красителя СК1.2 (Etot = –72.1 ± 1.32 ккал · моль–1). Энергии электростатического взаимодействия и Ван-дер-Ваальса для анионных скварилиевых красителей СК1.1–СК1.5 оказались отрицательными. Для красителей СК1.2 и СК1.4, имеющих сульфогруппы в заместителях при атомах N, получены наименьшие значения Eel (–57.2 ± 5.1 и –65.1 ± ± 3.4 ккал · моль–1 соответственно). В среднем для изученных анионных скварилиевых красителей EvdW = –6.2 ± 3.0 ккал · моль–1, тогда как Eel = –55.7 ± 8.5 ккал · моль–1, т.е. Eel выше по абсолютной величине, чем EvdW, в 4.2–20 раз, что свидетельствует о значительном вкладе сил электростатического взаимодействия в стабилизацию комплексов краситель–белок.
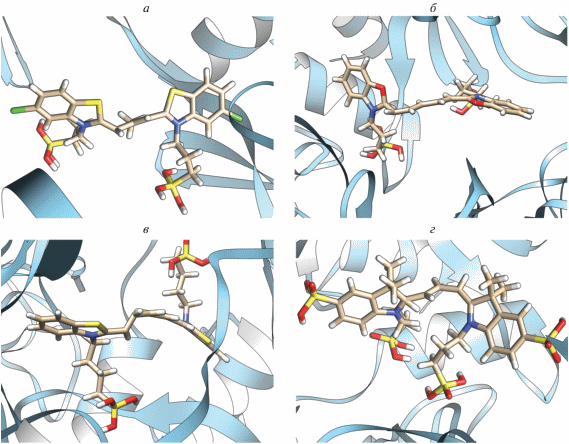
Скварилиевые красители в комплексах с NSP15 зачастую принимают скрученную (близкую к перпланарной) конфигурацию, например, CK1.1. с “диким” типом NSP15 (рис. 2а). Однако для красителя СК1.7 со всеми разновидностями NSP15 характерны практически плоские структуры, близкие к транс-изомерам, в которых концевые гетероциклы красителя лишь незначительно (на ~20°) выводятся из плоскости.
Рис. 2.
Результаты докинга с NSP15 красителей: а – СК1.1 (“дикий” тип NSP15 и б – СК1.5 (Y343H). Исходные конфигурации красителей соответствовали цис-изомерам.
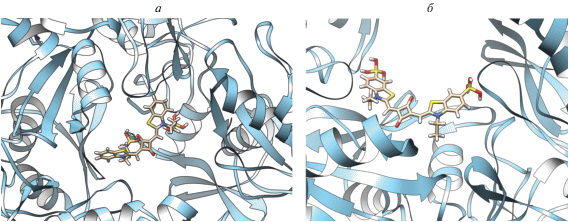
Докинг располагает молекулы лигандов в центральной полости тримера вблизи одной из субъединиц белка. Используя программу UCSF Chimera [22], мы провели анализ поверхностного связывания и поиск водородных связей между атомами лиганда и белка, а также поиск межатомных конфликтов и контактов (на основе ван-дер-ваальсовых радиусов молекул). Анализ связывания показал, что в комплексе с NSP15 молекулы скварилиевого красителя CK1.1 расположены на расстоянии ~ 4 Å от GLY165, и TYR89 субъединицы С, сульфогруппа красителя находится на расстоянии 4 Å от ARG91. В случаях СК1.5 и мутантных форм S294A и Y343H докинг дал практически одинаковые положения лигандов (взаимодействие с субъединицей A). В случае СК1.5 и Y343H (структура красителя в комплексе приведена на рис. 2б) краситель образует водородные связи (2 Å) с GLN203 (с участием концевой сульфогруппы) и с ASP269 (за счет атома О скварилиевого кольца). Поиск межатомных контактов указывает на близкий (3 Å) контакт ARG92 c сульфогруппой красителя; также отмечен контакт (4 Å) GLU268 со скварилиевым кольцом.
Анионные цианиновые красители. Молекулярный докинг также проведен с серией из 26 анионных цианинов с различной длиной полиметиновой цепи: пяти анионных монометинцианиновых красителей (см. рис. 1, структуры 1.1–1.5), девяти мезо-замещенных триметинцианиновых красителей (карбоцианинов, структуры 2.1–2.9), семи пентаметинцианиновых красителей (структуры 3.1–3.7) и пяти гептаметинцианиновых красителей (структуры 4.1–4.5). Мезо-замещенные карбоцианины соответствовали цис-конфигурации.
Докинг показал, что большинство (~90%) выбранных соединений характеризуются отрицательными значениями полной энергии (Etot < –19 ккал · · моль–1, см. табл. 1). Значительные отрицательные значения Etot получены для анионных монометинцианиновых красителей: так, при докинге красителя 1.3, представляющего собой бензоксазолильное производное, с эндорибонуклеазой “дикого” типа Etot = –83.8 ± 1.8 ккал · моль–1. Отметим, что для его аналогов 1.1 и 1.5 получены меньшие по абсолютной величине на ~30–44 ккал · · моль–1 значения Etot. Возможно, здесь так же как и в случае скварилиевых красителей, играет роль стерический фактор, понижающий Etot (по абсолютной величине) для более объемистых красителей 1.1 и 1.5 по сравнению с 1.3.
Таблица 1.
Результаты молекулярного докинга анионных цианиновых красителей с NSP15 (“дикий” тип): общая энергия взаимодействия, энергии Ван-дер-Ваальса и электростатического взаимодействия (ккал · моль–1)
| Краситель | X | Etot | EvdW | Eel |
|---|---|---|---|---|
| 1.1 | S | –53.2 ± 0.86 | –14.2 ± 3.34 | –43 ± 4.12 |
| 1.2 | –61.4 ± 0.66 | –5.1 ± 7.7 | –73.3 ± 7.05 | |
| 1.3 | O | –83.8 ± 1.81 | 0.25 ± 3.15 | –73.8 ± 3.75 |
| 1.4 | –76.2 ± 2.91 | –0.96 ± 2.87 | –74.6 ± 5.36 | |
| 1.5 | C(CH3)2 | –39.8 ± 1.42 | –5.9 ± 2.7 | –50.3 ± 4.98 |
| 2.1 | S | –49.6 ± 0.77 | –4.4 ± 5.55 | –83.3 ± 5.05 |
| 2.2 | –51.7 ± 2.36 | –1.5 ± 3.03 | –83.7 ± 3.57 | |
| 2.3 | O | –57.9 ± 0.48 | –4.2 ± 5.19 | –67.3 ± 6.66 |
| 2.4 | –55.1 ± 0.34 | –11.1 ± 8.19 | –62.7 ± 8.15 | |
| 2.5 | 26 ± 1.07 | –6.5 ± 4.71 | –68.6 ± 3.97 | |
| 2.6 | –59.3 ± 0.42 | –14.0 ± 1.06 | –58.0 ± 3.15 | |
| 2.7 | 36.9 ± 3.71 | –3 ± 7.98 | –71.7 ± 5.78 | |
| 2.8 | C(CH3)2 | –36.4 ± 1.45 | –7.6 ± 4.58 | –53.8 ± 6.13 |
| 2.9 | C(CH3)2 | –96 ± 3.39 | 4.6 ± 4.93 | –90.5 ± 6.97 |
| 3.1 | S | 2.7 ± 1.57 | –8.1 ± 3.12 | –58.3 ± 4.27 |
| 3.2 | –55 ± 0.55 | –3.9 ± 6.07 | –67.7 ± 5.24 | |
| 3.3 | O | 4.1 ± 2.01 | –3.5 ± 6.51 | –86.6 ± 7.85 |
| 3.4 | –74.7 ± 2.32 | –6.3 ± 10.93 | –65.6 ± 11.8 | |
| 3.5 | S | –23.5 ± 1.04 | –9.7 ± 6.02 | –49.9 ± 5.39 |
| 3.6 | C(CH3)2 | –19.7 ± 0.69 | –14.4 ± 6.82 | –48.8 ± 2.6 |
| 3.7 | C(CH3)2 | –86.7 ± 0.28 | 4.3 ± 5.69 | –87.6 ± 8.05 |
| 4.1 | S | –43.4 ± 2.39 | –9.8 ± 4.09 | –61.9 ± 4.41 |
| 4.2 | O | 18.3 ± 1.01 | –6.7 ± 6.22 | –63.3 ± 6.03 |
| 4.3 | –58.4 ± 0.88 | –9.8 ± 4.56 | –62 ± 4.51 | |
| 4.4 | C(CH3)2 | 8.9 ± 2.8 | –11.2 ± 3.44 | –58.1 ± 3.42 |
| 4.5 | C(CH3)2 | –77.8 ± 2.44 | 5.1 ± 3.31 | –88.6 ± 5.54 |
Докинг карбоцианинов (рис. 1, структуры 2.1–2.9) с NSP15 (“дикий” тип) также показал, что эти красители могут образовывать энергетически стабильные комплексы. В частности, при докинге оксакарбоцианинов 2.3, 2.4 и 2.6 получены значения Etot в диапазоне –31.7…–63.9 ккал · моль–1.
Тиакарбоцианины 2.1 и 2.2 показывают сравнимые значения Etot (см. табл. 1). Положительные значения Etot получены для красителей 2.5 и 2.7 (табл. 1), которые имеют объемистые заместители в гетероядрах.
Отрицательные значения Etot получены для большинства пентаметинцианиновых (дикарбоцианиновых) красителей (в частности, для тиадикарбоцианина 3.2 и его окса-аналога 3.4) с NSP15, что может свидетельствовать о стабильности межмолекулярных комплексов этих красителей. Для красителей 3.1 и 3.3 получены положительные значения Etot (2.7 ± 1.57 и 4.1 ± 2.01 ккал · моль–1 соответственно). Значения энергий электростатического взаимодействия и Ван-дер-Ваальса для большинства пентаметинцианиновых красителей (за исключением 3.7) оказались отрицательными; для красителей 3.2 и 3.3, имеющих заместители –OCH3, получены наименьшие значения Eel (табл. 1).
Изучение взаимодействия с NSP15 анионных гептаметинцианиновых красителей (соединения 4.1–4.5) показало, что для части этих красителей энергетически возможно нековалентное взаимодействие, приводящее к образованию стабильных комплексов (Etot < 0). Для красителей 4.2 (оксацианин) и 4.4 (индо-производное) получены положительные Etot (18.3 ± 1.01 и 8.9 ± 2.8 ккал · моль–1 соответственно).
Значения Eel и EvdW для большинства гептаметинцианиновых красителей оказались отрицательными, исключение – краситель 4.5 (для него получено EvdW = 5.1 ± 3.31 ккал · моль–1). Для пентаметинцианиновых (дикарбоцианиновых) красителей 3.1–3.6 значение Eel оказалось в 3.4–24 раз выше по абсолютной величине, чем EvdW; для гептаметинцианиновых красителей 4.1–4.4 Eel выше по абсолютной величине, чем EvdW в 5.2–9.4 раз. Это свидетельствует о значительном вкладе сил электростатического взаимодействия в стабилизацию комплексов краситель–белок. Действительно, молекулярный докинг индокарбоцианинов с четырьмя сульфогруппами (соединения 2.9, 3.7, 4.5) дает значительно более отрицательные значения полной энергии (Etot ~ –77.8…–96.0 ккал · моль–1) из-за большого вклада электростатического взаимодействия в стабилизацию комплексов (Eel ~ ~ ‒87.6…–90.5 ккал · моль–1). Наиболее отрицательные значения Etot получены для индокарбоцианина 2.9 при докинге с NSP15. Красители с большей длиной полиметиновой цепи показывают более умеренные значения Etot (см. табл. 1).
Докинг анионных цианиновых красителей с мутантными формами целевого белка (S294A, S294T, Y343C и Y343H) показал практически одинаковые энергетические параметры связывания по сравнению с “диким” типом. Для монометинцианина 1.1 величины полной энергии, полученные для четырех мутантных форм, практически совпадают с Etot, полученной для исходного белка: –53.62 ± 0.49 и –53.2 ± 0.86 ккал · моль–1 соответственно. Аналогичная ситуация прослеживается и в случае других анионных красителей. Так, для пентаметинцианинового окса-красителя 3.4 величины Etot, полученные при докинге с S294A, S294T, Y343C и Y343H, составляют –74.3 ± 1.56 ккал · моль–1; для гептаметинового окса-красителя 4.2 докинг с мутантными формами дает Etot = –58.9 ± 1.09 ккал · · моль–1, что с учетом доверительного интервала соответствует данным табл. 1. Исключение составляет лишь оксакарбоцианиновый краситель 2.3, при докинге с мутантными формами белка для которого обнаружено уменьшение Etot на 7% (Etot = –62.0 ± 1.29 ккал · моль–1).
Анионные цианиновые красители могут связываться с NSP15 SARS-CoV-2 в различных конформациях. Монометинтиацианины характеризуются скрученной (неплоской) конфигурацией их молекул в связанных состояниях; однако для окса-красителей 1.3, 1.4 возможны почти плоские (энергетически оптимальные) конфигурации. Для монометинцианиновых красителей анализ поверхностного связывания не выявил наличия водородных связей и межатомных конфликтов.
Близкие к плоским конфигурации характерны для карбоцианинов 2.1, 2.2, 2.3. В частности, для 2.2 докинг с NSP15 (“дикий” тип) дает близкую к транс-изомерам конфигурацию красителя (рис. 3а); при этом метильная группа почти перпендикулярна плоскости одного из гетероциклов, а другой гетероцикл повернут на угол ~15°. Для взаимодействия оксакарбоцианина 2.3 и индокарбоцианина 2.8 также характерны почти плоские транс-конфигурации, при этом мезо-заместители выводятся за пределы плоскостей. Для красителей 2.4 и 2.6 расчеты дают “закрученные” на ~45° перпланарные формы. Докинг красителя 2.9, имеющего дополнительную пару сульфогрупп, с NSP15 (“дикий” тип) предполагает искаженную конфигурацию, близкую к транс-изомеру (рис. 3г).
Докинг пентаметинцианинов 3.1, 3.2 с NSP15 дает сильно изогнутые из-за искаженных валентных углов полиметиновой цепи структуры, в которых концевые гетероциклы располагаются практически параллельно друг к другу. Красители 3.4 (рис. 3б) и 3.7 (имеет 4 сульфогруппы) приобретают при взаимодействии с NSP15 скрученные (близкие к перпланарной) структуры; красители не образуют водородных связей и межатомных контактов с белком.
Для докинга гептаметинцианиновых красителей получены различные варианты структур молекул, в основном для них характерны изогнутые структуры. При докинге красителя 4.1 искажения “скручивают” концевые гетероциклические остатки, и заместители в положениях 3 и 3' могут выводиться из плоскости молекулы (рис. 3в). Для красителя 4.2 получена структура с практически перпланарным положением концевых гетероциклов, краситель не образует водородных связей и межатомных контактов с NSP15. Красители 4.3 и 4.5 (4 сульфогруппы) имеют серповидно изогнутые структуры.
ЗАКЛЮЧЕНИЕ
Результаты молекулярного докинга показали, что на нековалентное комплексообразование цианиновых и скварилиевых красителей с NSP15 SARS-CoV-2 существенное влияние оказывают кулоновские взаимодействия в структуре краситель–белок. Положительные значения полной энергии комплекса (Etot > 0) для катионных цианиновых (К1–К7) или нейтральных скварилиевых (СК1–СК5) красителей могут указывать на нестабильность комплексов этих красителей с NSP15. Для многих анионных красителей получены отрицательные значения Etot, что может характеризовать более высокую стабильность соответствующих комплексов. Для индокарбоцианинов с четырьмя сульфогруппами, увеличивающими отрицательный заряд молекулы красителя (2.9, 3.7 и 4.5), получены еще более благоприятные результаты. Кроме того, для большинства анионных красителей значение Eel значительно превышает по абсолютной величине EvdW, что также указывает на ведущую роль кулоновских сил в образовании комплексов. Аналогичное влияние кулоновского взаимодействия на устойчивость комплекса краситель–белок было обнаружено при докинге цианиновых красителей со спайк-протеином SARS-CoV-2 [16].
Структурные различия в молекулах красителя существенно влияют на стабильность комплексов. Для окса-красителей в целом были получены более отрицательные значения Etot, чем для их аналогов с тиазольными и индольными концевыми гетероциклами. Возможно, это связано с более компактной структурой окса-красителей, чем тиа- и индо-аналогов.
По критерию величины Etot, характеризующей устойчивость комплексов с NSP15, можно выделить анионные скварилиевые красители СК1.2, СК1.5, монометинцианиновые анионные красители 1.1–1.5, тиа- и оксацианины 2.1–2.4, 2.6, 3.2, 3.4, 3.5, 4.1, 4.3, индоцианины 2.8, 3.6, а также цианины с четырьмя сульфогруппами 2.9, 3.7 и 4.5.
При использовании красителей для спектральной детекции белков, наряду с устойчивостью комплексов краситель–белок, важную роль играет изменение спектрально-флуоресцентных свойств красителей при комплексообразовании. Для мезо-замещенных карбоцианинов (триметинцианинов) характерен более резкий рост интенсивности флуоресценции и более существенные изменения в спектрах из-за сдвига динамического цис-транс-равновесия, что позволяет обнаруживать очень низкие концентрации биомолекул при использовании красителей в качестве флуоресцентных зондов [7, 8, 10, 12, 26]. Учитывая вышеизложенное, перспективными в качестве таких зондов являются карбоцианины 2.1–2.4 и 2.6.
В комплексах карбоцианинов с биомолекулами наблюдается усиление процесса интеркомбинационной конверсии в триплетное состояние, что приводит к заселению триплетных энергетических уровней [27–29]. Это определяет возможность фотохимических реакций с участием возбужденных триплетных состояний красителей в этих системах и потенциально может привести к образованию активных форм кислорода (фотодинамический эффект). Таким образом, цианины могут быть перспективны для индуцированного светом повреждения компонентов вируса (белков, с которыми связывается краситель) и, таким образом, инактивации самого вируса. Отметим, что УФ-фотоинактивация коронавирусов MERS-CoV и SARS-CoV-2 в сыворотке крови рибофлавином в настоящее время изучается [30, 31]. С рассматриваемой точки зрения мезо-замещенные тиакарбоцианины 2.1 и 2.2 можно выделить для дальнейших практических исследований в этой области.
Следует отметить, что при докинге цианиновых красителей с мутантными формами NSP15 – S294A, S294T, Y343C и Y343H – величина Etot практически совпадала с таковой для “дикого” типа NSP15 (лишь для красителя 2.3 при докинге с мутантными формами обнаружено небольшое уменьшение Etot). Это может свидетельствовать о действенности цианиновых красителей-зондов не только для исходной формы вируса SARS-CoV-2, но и для его мутантных форм, что особенно актуально в настоящее время, когда мутантные формы SARS-CoV-2 получают все большее распространение в мире.
Молекулярная графика и анализы, выполненные с помощью программы UCSF Chimera, разработаны Ресурсом для биокомпьютеров, визуализации и информатики Калифорнийского университета в Сан-Франциско при поддержке NIH P41-GM103311.
Работа выполнена в рамках госзадания № 001201253314 ИБХФ РАН.
Список литературы
Saarnio V.K., Salorinne K., Ruokolainen V.P. et al. // Dyes Pigm. 2020. V. 77. P. 108282; https://doi.org/10.1016/j.dyepig.2020.108282
Eriksson M., Hardelin M., Larsson A., Bergenholtz J., Akerman B. // J. Phys. Chem. B. 2007. V. 111. P. 1139; https://doi.org/10.1021/jp064322m
Soto C.M., Blum A.S., Vora G.J. et al. // J. Amer. Chem. Soc. 2006. V. 128. P. 5184; https://doi.org/10.1021/ja058574x
Robertson K.L., Soto C.M., Archer M.J., Odoemene O., Liu J.L. // Bioconjugate Chem. 2011. V. 22. P. 595; https://doi.org/10.1021/bc100365j
Vus K., Tarabara U., Balklava Z. et al. // J. Mol. Liq. 2020. V. 302. P. 112569; https://doi.org/10.1016/j.molliq.2020.112569
Gopika G.S., Prasad P.M.H., Lekshmi A.G. et al. // Mater. Today: Proceedings. 2021. V. 46. P. 3102; https://doi.org/10.1016/j.matpr.2021.02.622
Татиколов А.С., Пронкин П.Г., Шведова Л.А., Панова И.Г. // Хим. физика. 2019. Т. 38. № 12. С. 11; https://doi.org/10.1134/S1990793119060290
Бычкова А.В., Пронкин П.Г., Сорокина О.Н., Татиколов А.С., Розенфельд М.А. // Коллоид. журн. 2014. Т. 76. № 4. С. 420; https://doi.org/10.7868/S002329121404003X
Пронкин П.Г., Татиколов А.С. // Химия высоких энергий. 2009. Т. 43. № 6. С. 527; https://doi.org/10.1134/S0018143909060101
Пронкин П.Г., Татиколов А.С. // Журн. прикл. спектроскопии. 2015. Т. 82. № 3. С. 429; https://doi.org/10.1007/s10812-015-0126-8
Аниковский М.Ю., Татиколов А.С., Пронкин П.Г. и др. // Химия высоких энергий. 2003. Т. 37. № 6. С. 445; https://doi.org/10.1023/B:HIEC.0000003399.44000.ec
Pronkin P.G., Shvedova L.A., Tatikolov A.S. // Biophys. Chem. 2020. V. 261. P. 106378; https://doi.org/10.1016/j.bpc.2020.106378
Beg M.A., Athar F. // Pharm. Pharmacol. Intern. J. 2020. V. 8. P. 163; https://doi.org/10.15406/ppij.2020.08.00292
Tazikeh-Lemeski E., Moradi S., Raoufi R. et al. // J. Biomol. Struct. Dyn. 2021. V. 39. № 13. P. 4633; https://doi.org/10.1080/07391102.2020.1779133
Al-Masoudi N.A., Elias R.S., Saeed B. // Biointerface Res. Appl. Chem. 2020. V. 10. P. 6444; https://doi.org/10.33263/BRIAC105.64446459
Пронкин П.Г., Татиколов А.С. // Хим. физика. 2021. Т. 40. № 2. С. 3; https://doi.org/10.31857/S0207401X2102014X
Guedes I.A., Barreto A.M.S., Marinho D. et al. // Sci. Rep. 2021. V. 11. P. 3198; https://doi.org/10.1038/s41598-021-82410-1
dos Santos K.B., Guedes I.A., Karl A.L.M., Dardenne L. // J. Chem. Inf. Model. 2020. V. 60. P. 667; https://doi.org/10.1021/acs.jcim.9b00905
de Magalhães C.S., Almeida D.M., Barbosa H.J.C., Dardenne L.E. // Inf. Sci. 2014. V. 289. P. 206; https://doi.org/10.1016/j.ins.2014.08.002
Guedes I.A., Costa L.S.C., dos Santos K.B. et al. // Sci. Rep. 2021. V. 11. P. 5543; https://doi.org/10.1038/s41598-021-84700-0
Kim Y., Jedrzejczak R., Maltseva N.I. et al. // Protein Sci. 2020. V. 29. P. 1596; https://doi.org/10.1002/pro.3873
Olsson M.H.M., Søndergaard C.R., Rostkowski M., Jensen J.H. // J. Chem. Theory Comp. 2011. V. 7. P. 525; https://doi.org/10.1021/ct100578z
Hanwell M.D., Curtis D.E., Lonie D.C. et al. // J. Cheminformatics. 2012. V. 4. P. 1; https://doi.org/10.1186/1758-2946-4-17
Yang Z., Lasker K., Schneidman-Duhovny D. et al. // J. Struct. Biol. 2012. V. 179. P. 269; https://doi.org/10.1016/j.jsb.2011.09.006
Khimenko V., Chibisov A.K., Görner H. // J. Phys. Chem. A. 1997. V. 101. P. 7304; https://doi.org/10.1021/jp971472b
Pronkin P.G., Shvedova L.A., Tatikolov A.S. // J. Chem. Sci. 2020. V. 132. P. 152; https://doi.org/10.1007/s12039-020-01858-2
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Химия высоких энергий. 2006. Т. 40. № 4. С. 295; https://doi.org/10.1134/S0018143906040096
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Там же. № 6. С. 451; https://doi.org/10.1134/S0018143906060087
Татиколов А.С. // Хим. физика. 2021. Т. 40. № 2. С. 11; https://doi.org/10.31857/S0207401X21020163
Keil S.D., Bowen R., Marschner S. // Transfusion. 2016. V. 56. P. 2948; https://doi.org/10.1111/trf.13860
Keil S.D., Ragan I., Yonemura S. et al. // Vox Sang. 2020. V. 115. P. 495; https://doi.org/10.1111/vox.12937
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика