Химическая физика, 2022, T. 41, № 2, стр. 12-19
Антиоксидантная активность двухатомных фенолов
И. Ф. Русина 1, *, Т. Л. Вепринцев 2, Р. Ф. Васильев 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: rusina939@mail.ru
Поступила в редакцию 27.07.2021
После доработки 16.08.2021
Принята к публикации 20.08.2021
- EDN: SQGJHD
- DOI: 10.31857/S0207401X22020108
Аннотация
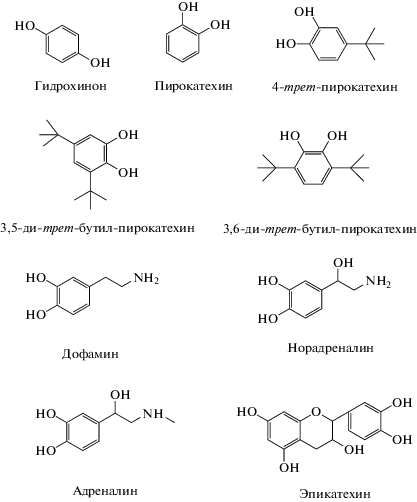
Исследованы на антиоксидантную активность девять соединений, в том числе из класса катехоламинов, содержащих в качестве общего структурного фрагмента 3,4-гидроксифенил (катехол), который придает соединениям в реакциях окисления углеводородного субстрата антиоксидантные свойства. Антирадикальная активность определена хемилюминесцентным методом по перехвату пероксильных радикалов в модельной реакции инициированного окисления этилбензола (RH). Механизм ингибирования процессов цепного окисления соединениями двухатомных фенолов обеспечивается наличием двух активных гидроксигрупп с возможной внутримолекулярной водородной связью, приводящей к ослаблению связи О–Н и высокой константe скорости отрыва атома водорода в реакции с пероксильными радикалами (kinh). Эта реакция является доминирующей и определяет ингибирующую активность антиоксидантов в процессах окисления. Максимальную ингибирующую активность показали: 3,5- и 3,6-ди-трет-бутилпирокатехины, дофамин и эпикатехин.
ВВЕДЕНИЕ
Двухатомные фенолы, содержащие группы ОН в орто-положении, широко распространены в живой природе. Фрагменты пирокатехина присутствуют во многих флавоноидах. Подобные соединения играют важную роль при ингибировании нежелательных окислительных процессов в живых системах, защищая их от последствий окислительного стресса. Большой интерес к изучению полифенолов вызван способностью этих соединений снижать риск развития атеросклероза, онкологических и сердечно-сосудистых заболеваний. В литературе до 90-х годов практически отсутствовали сведения об антиокислительных и биологических свойствах стерически затрудненных двухатомных фенолов группы катехоламинов. В последнее время к определению антиоксидантной активности (АОА) этих соединений приковано большое внимание. В исследованиях используются разнообразные подходы к оценке АОА. Однако результаты многих работ представляются неоднозначными. Изучение АОА природных соединений и их аналогов чаще всего проводят в гетерогенных системах, имитирующих по строению клетку живого организма – мицеллах и липосомах. Однако определенная в этих условиях АОА зависит от различных факторов. Для того чтобы исключить влияние этих факторов, необходимо проводить исследования при окислении модельных систем в гомогенной системе. Актуальным представляется изучение АОА полифенолов при ингибировании окисления в растворе.
Поиск лекарственных средств среди соединений двухатомных фенолов и их производных представляется одним из наиболее перспективных путей создания новых препаратов для лечения таких заболеваний, как полинейропатии различной этиологии, болезни Паркинсона, Альцгеймера и осложнений после заболевания, вызванного коронавирусной инфекцией COVID-19.
Катехоламины – группа биогенных аминов, содержащих в качестве общего структурного фрагмента 3,4-дигидроксифенол (катехол), который придает этим соединениям статус антиоксидантов в реакциях окисления органических соединений. Катехоламины – водорастворимые соединения, выполняющие в живых организмах функции природных нейромедиаторов (адреналин, норадреналин, дофамин) [1–6]. Это обстоятельство поставило задачу определения ключевых кинетических характеристик антиокислительного действия и разработки удобных и надежных инструментальных методов их определения.
Для исследования кинетики окислительных процессов, в том числе с участием антиоксидантов, удобнее всего использовать хемилюминесцентные методы [7–15]. В настоящей работе рассмотрены возможности применения хемилюминесцентного метода, основанного на измерении интенсивности хемилюминесценции (ХЛ), сопровождающей инициированное окисление углеводородов, для получения количественных характеристик антирадикальной активности двухатомных фенолов: констант скорости реакции перекисного радикала с молекулой ингибитора (kinh) и cтехиометрического коэффициента ингибирования (f). Структурные формулы изученных в настоящей работе соединений представлены на рис. 1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследованы пять соединений двухатомных фенолов, гомологов пирокатехина, синтезированных и предоставленных лабораторией синтеза пространственно-затрудненных фенолов (ИБХФ РАН), и четыре соединения ряда природных катехоламинов (Fluka) на антирадикальную активность по отношению к пероксильным радикалам, ведущим цепь окисления. Антирадикальные свойства двухатомных фенолов исследовали по эффекту торможения жидкофазного окисления этилбензола (RH), инициированного термическим распадом инициатора 2,2'-азобисизобутиронитрила (АИБН). Инициатор перекристаллизовывали дважды из этанола с последующей сушкой в вакууме до постоянного веса. Растворитель хлорбензол (Merck) и модельный углеводород этилбензол (Aldrich, 99.8%) использовали без предварительной очистки. Окисляющуюся реакционную смесь (5 мл) помещали в термостатированную при 50 °С кювету хемилюминометра и насыщали кислородом путем барботирования воздуха нагнетающим компрессором. Слабое первичное свечение (триплет-синглетное испускание света возбужденным продуктом – ацетофеноном) усиливали за счет переноса энергии на эффективный люминофор – 9,10-дибромантрацен (ДБА) и регистрировали на хемилюминометре с фотосенсорным модулем H7467 (Hamamatsu, Япония) c интерфейсом RS-232C.
Скорость инициированного окисления, Wi, рассчитывали с помощью соотношения
(1)
$\begin{gathered} {{W}_{i}} = 2{{f}_{{{\text{кл}}}}}{{k}_{0}}\left[ {{\text{АИБН}}} \right] = \\ = 1.2 \times 1.58 \times {{10}^{{15}}}\exp ({{ - 30800} \mathord{\left/ {\vphantom {{ - 30800} {RT}}} \right. \kern-0em} {RT}})\left[ {{\text{АИБН}}} \right], \\ \end{gathered} $Скорость инициирования, Wi, дополнительно контролировали и измеряли непосредственно в реакционной смеси до и после опыта по кинетике ХЛ после введения известного количества стандартного ингибитора хромана (СrC1) – 6-гидрокси-2,2,5,7,8-пентаметилхромана, что позволяло также фиксировать влияние продуктов окисления на скорость окисления $({{W}_{{{{{\text{O}}}_{2}}}}}).$
Основная проблема, возникающая при изучении АОА полифенолов в неполярной среде, связана с их крайне низкой растворимостью в этих условиях. Для приготовления рабочих растворов полифенолов приходится использовать добавки полярных растворителей. Однако полярность среды может оказывать существенное влияние на активность ингибиторов. Причиной такого влияния является образование водородной связи между группой ОН фенола и растворителем. Это ведет к усложнению механизма действия антиоксидантов и дополнительной погрешности в измерении элементарных констант ингибирования. Поэтому была предпринята попытка подобрать такой растворитель, чтобы в нем сочетались хорошая растворимость исследуемых соединений и минимальное влияние на параметры измерений. Подходящим растворителем оказался диметилсульфоксид (ДМСО) в сочетании с ацетонитрилом (АЦН). Сначала растворяли соединение в ДМСО до концентрации 1 · 10–3 М, затем десятикратным разбавлением в ацетонитриле приготавливали разбавленный базовый раствор (1 · 10–4 М). Диметилсульфоксид и АЦН в контрольных измерениях не оказывали влияния на скорость инициирования в реакции окисления углеводородов, поэтому в дальнейшем растворы исследуемых ингибиторов готовили с использованием ДМСО и АЦН.
Эффективную антирадикальную активность измеряли хемилюминесцентным методом, суть которого состоит в регистрации интенсивности ХЛ, сопровождающей инициированное окисление углеводорода (RH) при известной скорости инициирования (Wi). При введении ингибитора скорость окисления уменьшается, и пропорционально ей меняется интенсивность ХЛ, которая затем анализируется [17].
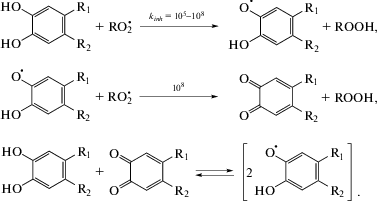
Окисление углеводородов и липидов (RH) развивается по цепному свободно-радикальному механизму, ключевыми стадиями которого являются инициирование, продолжение и обрыв цепи [18–21]:
Схема 1
Здесь R• и ${\text{RO}}_{2}^{ \bullet }$ – свободные радикалы, Y – инициатор, ROOH – гидропероксид, первичный продукт окисления. При умеренных температурах (40–60 °С), небольших степенях превращения и неизменной скорости окисления образующиеся гидропероксиды не влияют на инициирование цепей и являются нейтральными продуктами окисления, а сама реакция проходит в режиме окисления с вырожденным разветвлением [21–23].
Стационарная концентрация ${\text{RO}}_{2}^{ \bullet }$ в цепном процессе равна
(2)
$\left[ {{\text{RO}}_{2}^{\centerdot }} \right] = {{\left( {{{{{W}_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}} {2{{k}_{t}}}}} \right. \kern-0em} {2{{k}_{t}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$а скорость окисления описывается уравнением
(3)
${{W}_{{{{{\text{O}}}_{2}}}}} = \frac{{{{k}_{p}}}}{{2{{k}_{t}}}}\left[ {{\text{RH}}} \right]{{\left( {{{W}_{i}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Установлено, что в процессах окисления углеводородов источником ХЛ является экзотермическая реакция рекомбинации пероксильных радикалов $\left( {{\text{RO}}_{2}^{ \bullet }} \right),$ проходящая через образование промежуточного тетроксида с последующим распадом на продукты [19, 22]:
В этой реакции обычно выделяется энергия в 100–120 ккал/моль, и в каждом таком элементарном акте возбуждается одна молекула продукта – карбонильного соединения Р* (в случае окисления этилбензола – ацетофенона), которая испускает квант света ХЛ. Скорость этой реакции Wi = = 2kt[${\text{RO}}_{2}^{ \bullet }$]2. Следовательно, измерение интенсивности ХЛ можно использовать как удобный кинетический метод, поскольку она пропорциональна kt[${\text{RO}}_{2}^{ \bullet }$]2.
Мерой антиокислительной активности ингибиторов может служить степень тушения ими хемилюминесценции (ХЛ). В присутствии ингибиторов (InH) скорость обрыва цепей увеличивается вследствие участия ингибитора (InH) в реакциях с пероксильными радикалами:
Схема 2
Реакции линейного обрыва цепей на ингибиторе приводят к снижению концентрации ${\text{RO}}_{2}^{ \bullet }$ и скорости ингибированного окисления, которая в простейшем случае, не осложненном побочными реакциями с участием ингибитора, определяется соотношением
(4)
${{W}_{{{{{\text{O}}}_{2}}}}} = \frac{{{{k}_{p}}[{\text{RH}}]{{W}_{i}}}}{{{{k}_{{inh}}}f[{\text{InH}}]}},$где f – стехиометрический коэффициент ингибирования, показывающий, сколько обрывов цепей приходится на одну молекулу [InH] (обычно 1< f < 2).
Для производных пирокатехина механизм взаимодействия с пероксильными радикалами представлен следующим образом [23, 24]:
Схема 3
Конечный продукт реакции – хинон, который не взаимодействует с пероксильными радикалами (реагирует только с алкильными радикалами), но может восстанавливаться до ингибиторного радикала при взаимодействии с исходным соединением пирокатехина. Стехиометрический коэффициент ингибирования при этом f = 2.
При изучении кинетики окисления удобно использовать не абсолютные (I), а относительные (i) значения интенсивности ХЛ, определяемые соотношением
(5)
$i = {I \mathord{\left/ {\vphantom {I {{{I}_{0}}}}} \right. \kern-0em} {{{I}_{0}}}} = {{{{{\left[ {{\text{RO}}_{2}^{\centerdot }} \right]}}^{2}}} \mathord{\left/ {\vphantom {{{{{\left[ {{\text{RO}}_{2}^{\centerdot }} \right]}}^{2}}} {\left[ {{\text{RO}}_{2}^{\centerdot }} \right]_{0}^{2}}}} \right. \kern-0em} {\left[ {{\text{RO}}_{2}^{\centerdot }} \right]_{0}^{2}}} = {{k}_{t}}{{{{{\left[ {{\text{RO}}_{2}^{\centerdot }} \right]}}^{2}}} \mathord{\left/ {\vphantom {{{{{\left[ {{\text{RO}}_{2}^{\centerdot }} \right]}}^{2}}} {{{W}_{i}}}}} \right. \kern-0em} {{{W}_{i}}}},$где I – текущее значение абсолютной интенсивности, а I0 – значение интенсивности в отсутствие ингибитора.
Площадь светосуммы ХЛ над кинетической кривой тушения ХЛ ингибитором показывает, сколько пероксильных радикалов погибло на ингибиторе с момента введения до полного его расходования, и является количественной характеристикой стехиометрического коэффициента ингибирования f, не зависящей от kinh.
Роль продуктов окисления минимизировали использованием низкой скорости инициирования Wi ~ 10–9 М · с–1, которую дополнительно контролировали, измеряя непосредственно в реакционной смеси до и после опыта по кинетике тушения ХЛ стандартным ингибитором, синтетическим аналогом α-токоферола – хроманом (CrC1) в соответствии с соотношением
(6)
${{W}_{i}} = {{f{{{[{\text{InH}}]}}_{0}}} \mathord{\left/ {\vphantom {{f{{{[{\text{InH}}]}}_{0}}} {{{\tau }_{{0.5}}}}}} \right. \kern-0em} {{{\tau }_{{0.5}}}}},$в котором для хромана f = 2, [InH]0 – концентрация ингибитора, τ0.5 – период торможения в секундах от момента введения хромана до выхода интенсивности свечения на уровень 0.5I0 по мере расходования антиоксиданта.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 представлены кинетические кривые тушения ХЛ в процессе окисления этилбензола добавками хромана (СrС1) и образца катехоламина (эпикатехин). По мере расходования антиоксиданта интенсивность ХЛ восстанавливается по S-образной симметричной кривой, определяемой константой скорости (kinh) реакции антиоксиданта с перекисным радикалом, т.е. индивидуальной кинетической характеристикой антиоксиданта. Максимальный наклон кривой зависимости восстановления свечения ХЛ i(t) в точке перегиба определяется как
(7)
${{\left( {{{di} \mathord{\left/ {\vphantom {{di} {dt}}} \right. \kern-0em} {dt}}} \right)}_{{max}}} = {1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T} = 0.273W_{i}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}{{{{k}_{{inh}}}} \mathord{\left/ {\vphantom {{{{k}_{{inh}}}} {{{{\left( {2{{k}_{t}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}} \right. \kern-0em} {{{{\left( {2{{k}_{t}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}.$Рис. 2.
Кинетические кривые тушения ХЛ при окислении этилбензола (20%-ный раствор в хлорбензоле, Wi = 4.8 · 10–9 М · с–1, [ДБА] = 2.0 · 10–4 M, 50 °C) после введения антиоксидантов: 1 – хромана ([СrC1] = 3.8 · 10–7 M), 2 – эпикатехина ([ЭПК] = 4 · 10–6 M). На кинетических кривых стрелками обозначены периоды торможения τ0.5 и обратная крутизна кинетической кривой восстановления интенсивности ХЛ (Т = 1/tgφ, где φ – угол наклона кривой в точке перегиба).
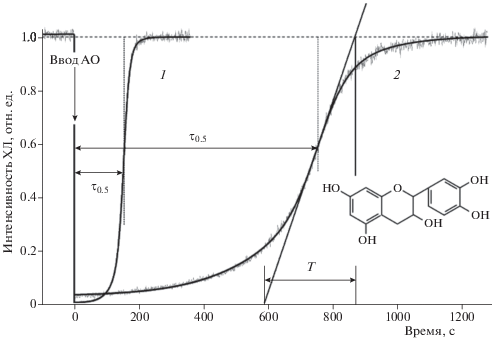
Из выражения (7) следует расчетное соотношение для kinh
(8)
${{\left. {({{k}_{{inh}}})} \right|}_{{{\text{tg}}\varphi }}} = \frac{{{{{(2{{k}_{t}})}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{\text{tg}}\varphi }}{{0.273W_{i}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}.$На рис. 3 приведены четыре характерные кинетические кривые тушения ХЛ после введения в модельную реакцию окисления этилбензола исследуемых антиоксидантов. Результаты измерений параметров ингибирования сведены в табл. 1 вместе с условиями эксперимента.
Рис. 3.
Кинетические кривые тушения ХЛ при окислении этилбензола (20%-ный раствор в хлорбензоле, Wi = = 4.8 · 10–9 М · с–1, [ДБА] = 2.0 · 10–4 M, 50 °C) после введения исследуемых антиоксидантов (1–4, см. табл. 1).
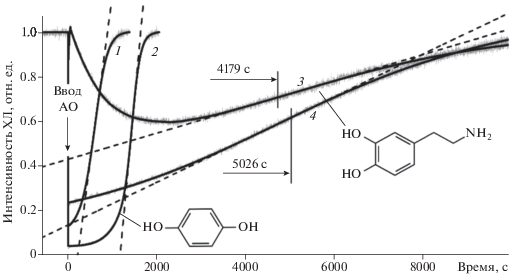
Таблица 1.
Параметры ингибирования хемилюминесцентного процесса окисления этилбензола антиоксидантами, полученные при обработке данных рис. 3
| № кривой на рис. 3 | Антиоксидант | [АО], М | f | kinh, M–1 · с–1 | Wi (М · с–1) по τ0.5 |
|---|---|---|---|---|---|
| 1 | α-нафтол | 1.96 · 10–6 | 2.0 | 3.6 · 105 | 6.54 · 10–9 |
| 2 | гидрoхинон | 9.77 · 10–6 | 2.0 | 5.5 · 105 | 6.78 · 10–9 |
| 3 | дофамин | 1.44 · 10–5 | 1.9 | 1.5 · 105 | 5.88 · 10–9 |
| 4 | ионол | 1.48 · 10–5 | 2.0 | 2.4 · 104 | 5.88 · 10–9 |
Как видно из табл. 1, скорости инициирования для всех АО близки, что позволило совместить их на одном графике (рис. 3).
В табл. 2 представлены результаты определения параметров антиокислительной активности двухатомных фенолов – констант скорости взаимодействия с пероксильными радикалами kinh и стехиометрических коэффициентов ингибирования f при использовании соотношений (8) и (6) соответственно. Для данных, представленных в табл. 1 и 2, ошибка измерения составила ≤15%.
Таблица 2.
Параметры ингибирования хемилюминесцентного процесса окисления этилбензола двухатомными фенолами
| Структурная формула | Название | kinh, M–1 · с–1 | f |
|---|---|---|---|
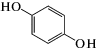 |
n-дигидроксибензол (гидрохинон) | 5.5 ∙ 105 | 2.0 |
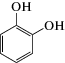 |
o-диоксибензол (пирокатехин) | 2.8 ∙ 106 | 2.0 |
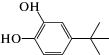 |
4-трет- бутил-пирокатехин | 4.0 ∙ 106 | 2.1 |
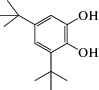 |
3,5-ди-трет-бутил-пирокатехин | 7.7 ∙ 106 | 2.1 |
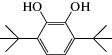 |
3,6-ди-трет-бутил-пирокатехин | 6.8 ∙ 106 | 1.8 |
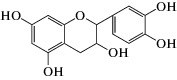 |
эпикатехин | 7.0 ∙ 105 | 2.0 |
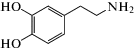 |
дофамин | 1.5 ∙ 105 | 1.9 |
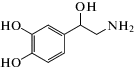 |
норадреналин | 2.4 ∙ 103 | 0.5 |
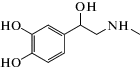 |
адреналин | 4.9 · 103 | 1.6 |
Наличие двух фенольных ОН-групп в соседних положениях в структуре фрагмента пирокатехина приводит к образованию внутримолекулярной водородной связи, за счет которой происходит ослабление одной из связей гидроксигруппы. Это приводит к резкому увеличению константы скорости взаимодействия с пероксильными радикалами в сравнении с фенолом и другими двухатомными фенолами. Было показано, что упомянутое свойство сохраняется для ди-трет-бутилзамещенных пирокатехинов. Так 3,5- и 3,6-ди-трет-бутилпирокатехины по константе скорости взаимодействия с пероксильными радикалами значительно превосходят ди-трет-замещенные фенолы и приближаются по эффективности к α-токоферолу [23–27]. При этом стехиометрический коэффициент ингибирования f = 2.
Особенностью пирокатехинов является низкая устойчивость образующихся в процессе ингибирования продуктов орто-хинонов, что обуславливает их высокую активность по отношению к алкильным радикалам при измерениях АОА катехоламинов в водно-мицеллярных субстратах [27–31, 33].
Так, согласно [32], растворимость кислорода воздуха в хлорбензоле при 50 °С в 47 раз превышает его концентрацию в водно-мицеллярном субстрате, что исключает наличие достаточной концентрации алкильных радикалов для активации их реакции с орто-хиноном. Поэтому в использованной нами модельной реакции инициированного окисления этилбензола взаимодействие катехоламинов с алкильными радикалами не проявляется. Возможно, высокая активность адреналина в водно-мицеллярных средах может проявляться вследствие более сложного механизма торможения процесса окисления и увеличения стехиометрического коэффициента в связи с дополнительным ингибированием продуктами окисления в отличие от модельной реакции окисления углеводородов [34–36].
ВЫВОДЫ
Предложена методика определения истинной реакционной способности двухатомных фенолов по отношению к пероксильным радикалам с использованием в качестве субстрата окисления модельного углеводорода – этилбензола, на основе которой определены параметры антиоксидантной активности (kinh и f) для девяти соединений катехоламинов при окислении этилбензола. Значение стехиометрического коэффициента f = 2, независимо от числа гидроксильных групп.
Установлено, что двухатомные фенолы являются сильными антиоксидантами, сравнимыми по эффективности торможения процессов окисления с α-токоферолом. Максимальную ингибирующую активность показали: 3,5-ди-трет-бутил-пирокатехин, 3,6-ди-трет-бутил-пирокатехин, эпикатехин и дофамин.
Работа выполнена в рамках тем государственного задания №№ 0082-2018-0006 (регистрационный номер АААА-А18-118020890097-1), 0084-2014-0004 (регистрационный номер 001201253314).
Список литературы
Laguerre M., Bayrasy C., Panya A. et al. // Crit. Rev. Food Sci. Nutr. 2014. V. 55. № 2. P. 183.
Maldonado O.S., Lucas R., Comelles F. et al. // Tetrahedron. 2011. V. 67. P. 7268.
Ruiz-Ruiz J.C., Ortiz-Vazquez E.L., Segura-Campos M.R. // Crit. Rev. Food Sci. Nutr. 2017. V. 57. P. 1423.
Song C., Shieh C., Wu Y. et al. // Prog. Lipid Res. 2016. V. 62. P. 41.
Кольман Я., Рём К. // Наглядная биохимия. Пер. с нем. М.: Мир, 2004.
Михасько Т.А., Дубовик Б.В., Шадыро О.И., Полозов Г.И. // Медицинские новости (Минск, РБ). 2002. Т. 82. № 4. С. 81.
Fedorova G.F., Lapina V.A., Menshov V.A. et al. // Photochem. Photobiol. 2019. V. 95. № 3. P. 780.
Васильев Р.Ф., Трофимов А.В., Цаплев Ю.Б. // Успехи химии. 2010. Т. 79. № 2. С. 91.
Цаплев Ю.Б., Трофимов А.В. // ЖФХ. 2020. Т. 94. № 11. С. 1716.
Fedorova G.F., Menshov V.A., Trofimov A.V. // Photochem. Photobiol. 2017. V. 93. № 2. P. 579.
Цаплев Ю.Б., Васильев Р.Ф., Кънчева В.Д. и др. // Хим. физика. 2020. Т. 39. № 6. С. 7.
Васильев Р.Ф., Кънчева В.Д., Наумов В.В. и др. // Хим. физика. 2020. Т. 39. № 6. С. 36.
Наумов В.В., Федорова Г.Ф., Васильев Р.Ф. и др. // Хим. физика. 2021. Т. 40. № 2. С. 24.
Меньшов В.А., Кънчева В.Д., Яблонская О.И. и др. // Хим. физика. 2021. Т. 40. № 2. С. 49.
Kancheva V.D., Dettori M.A., Fabbri D. et al. // Antioxidants. 2021. V. 10. № 4. P. 624.
Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука, 1965.
Шляпинтох В.Я., Карпухин О.Н., Постников Л.М., Захаров И.В., Вичутинский А.А., Цепалов В.Ф. Хемилюминесцентные методы исследования медленных химических процессов. М.: Наука, 1966.
Frankel E.N. Lipid oxidation. Second Ed. Chap. 1. Philadelphia: Woodhead Publishing, 2012.
Васильев Р.Ф., Русина. И.Ф. // ДАН СССР. 1964. Т. 156. № 6. С. 1402.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Эмануэль Н.М., Гал Д. Окисление этилбензола. Модельная реакция. М.: Наука, 1984.
Fedorova G.F., Trofimov A.V., Vasil’ev R.F., Veprintsev T.L. // ARKIVOC. 2007. № VIII. P. 163.
Азатян Н.А., Карпухина Г.В., Белостоцкая И.С., Комиссарова Н.Л. // Нефтехимия. 1973. № 3. С. 435.
Ершов В.В., Никифоров Г.А., Володькин А.А. Пространственно-затрудненные фенолы. М.: Химия, 1972.
Тихонов И.В., Рогинский В.А., Плисс Е.М., Русаков А.И. // Башкирский хим. журн. 2006. Т. 13. № 4. С. 112.
Yen G.-C., Hsieh C.L. // Biosci. Biotechnol. Biochem. 1997. V. 61. № 10. P. 1646.
Ягунов С.Е., Хольшин С.В., Кандалинцева Н.В. // Вестн. Новосибирского гос. пед. ун-та. 2013. Т. 5. № 15. С. 5.
Едимечева И.П., Островская Н.И., Полозов Г.И., Шадыро О.И. // ЖОХ. 2005. Т. 75. № 4. С. 632.
Бельков М.Б., Ксендзова Г.А., Кузовков П.В. и др. // Журн. прикл. спектроскопии (Минск, РБ). 2007. Т. 74. № 5. С. 577.
Рогинский В.А. Фенольные антиоксиданты. Реакционная способность и эффективность. М.: Наука, 1988.
Менгеле Е.А., Плащина И.Г., Касаикина О.Т. // Коллоид. журн. 2011. Т. 73. № 6. С. 815.
Battino R., Rettich T.R., Tominaga T. // J. Phys. Chem. Ref. Data. 1983. V. 12. № 2. P. 163.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Analyst. 2009. V. 134. № 10. P. 2128.
Васильев Р.Ф., Кънчева В.Д., Федорова Г.Ф. и др. // Кинетика и катализ. 2010. Т. 51. № 4. С. 533
Васильев Р.Ф., Вепринцев Т.Л., Долматова Л.С. и др. // Кинетика и катализ. 2014. Т. 55. № 2. С. 157.
Shimizu T., Nakanishi Y., Nakahara M. et al. // J. Clin. Biochem. Nutr. 2010. V. 47. № 3. P. 181.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика