Химическая физика, 2022, T. 41, № 4, стр. 16-23
Кинетика разложения 1,1-диамино-2,2-динитроэтилена (FOX-7). 4. Сравнение реакций разложения FOX-7 и его диазациклических производных
Г. М. Назин 1, В. В. Дубихин 1, А. И. Казаков 1, *, А. В. Набатова 1, Б. Э. Крисюк 1, Н. Н. Волкова 1, А. В. Шастин 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: akazakov@icp.ac.ru
Поступила в редакцию 04.02.2021
После доработки 08.04.2021
Принята к публикации 20.04.2021
- EDN: HTRPIP
- DOI: 10.31857/S0207401X22040069
Аннотация
Манометрическим и калориметрическим методами исследована кинетика термического разложения диазациклических производных 1,1-диамино-2,2-динитроэтилен (FOX-7) в разбавленном растворе нитробензола и в твердой фазе. Данные по энергии активации, полученные для раствора, использованы для сравнения с квантовохимическими расчетами и установления связи стабильности соединений со строением молекул. Разложение этих производных в растворе протекает по такому же механизму, как и разложение FOX-7. Их энергии активации уменьшаются при увеличении длины связи С=С и находятся в хорошем соответствии с литературными данными по квантовохимическим расчетам. По характеру разложения в твердом состоянии эти соединения значительно отличаются от FOX-7. Это различие связано с тем, что конденсированные продукты их разложения являются не твердыми, а жидкими соединениями.
ВВЕДЕНИЕ
Интерес к кинетическому изучению 2-(динитрометилен)-1,3-диазациклопентана (I), 2-(динитрометилен)-1,3-диазациклогексана (II) и 2-(динитрометилен)-1,3-диазациклогептана (III) (табл. 1) в значительной степени связан с тем, что все они являются аналогами известного взрывчатого вещества 1,1-диамино-2,2-динитроэтилена (FOX-7), при разложении которого в твердом состоянии был обнаружен ряд закономерностей, не свойственных другим нитросоединениям [1–5]. Представляет большой интерес узнать, в какой мере эти необычные закономерности распада FOX-7 сохраняются у его ближайших аналогов – соединений I–III.
Таблица 1.
Структурные формулы соединений FOX-7 и I–III
| Соединение | Структурная формула |
|---|---|
| FOX-7 | 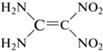 |
| I | 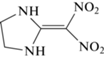 |
| II | 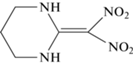 |
| III | 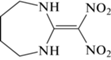 |
Главная особенность FOX-7 заключается в двухстадийном характере его разложения в твердой фазе. Эта особенность в наиболее яркой форме проявляется при исследовании разложения FOX-7 методом дифференциальной сканирующей калориметрии (ДСК) в потоке инертного газа. При самых разных скоростях линейного нагрева наблюдается два пика тепловыделения, разделенных температурным интервалом, превышающем 50 °С, и оба пика обусловлены разложением самого FOX-7. Было доказано [3], что первая стадия – это побочный процесс, связанный с сублимацией и быстрым разложением вещества в газовой фазе. Уникальность газофазной реакции заключается в том, что одним из ее продуктов является тугоплавкое и нелетучее при температуре опыта соединение, которое осаждается на поверхности кристаллов в виде тонкой пленки, препятствующей сублимации. В условиях потока пленка образуется медленно, и в области первого пика тепловыделения теряется до 40% массы вещества. В замкнутых сосудах первая стадия заканчивается быстро. Доля вещества, распавшегося в первой стадии, зависит от отношения массы навески m к свободному объему V и может быть очень мала. Дальнейшее разложение идет в твердой фазе “под пленкой”, разрушение которой сопровождается резким подъемом скорости.
В отличие от всех других нитросоединений разложение FOX-7 протекает без образования жидкой фазы. Реакция идет по типу “Твердое → → твердое + Газ”. Твердый остаток представляет собой порошок с частицами наноразмера, который не проявляет каталитической активности.
Экспериментальное исследование разложения соединений I–III проводилось в работах [6, 7]. В [6] исследование выполнено методом ДСК в потоке аргона. Максимальное тепловыделение для I–III происходит при температурах 207–263 °С, т.е. находится в области первого пика разложения FOX-7 (235 °С). Однако второй пик тепловыделения у всех трех соединений отсутствует. Можно сделать вывод, что в отличие от FOX-7 разложение его аналогов в потоке аргона протекает в одну стадию. Температура, при которой достигается максимум скорости, уменьшается в ряду
Этот ряд не совпадает с рядом повышения летучести
Отсюда можно сделать вывод, что вещества отличаются не только летучестью, но и скоростью разложения в газовой фазе. Соединение I является более летучим, чем FOX-7 [7], и в то же время пик тепловыделения у него находится при более высокой температуре, чем у FOX-7. Поэтому надежный вывод, который можно сделать из работы [6], заключается в том, что соединение I в газовой фазе более стойко, чем FOX-7.
В работе [7] кинетика тепловыделения исследована в замкнутых сосудах. Реакция имеет автокаталитический характер с ярко выраженным периодом индукции, длительность которого уменьшается в ряду
Можно отметить, однако, что этот ряд может и не соответствовать порядку изменения стабильности, так как период индукции в значительной степени зависит от скорости каталитического процесса, а не начальной стадии.
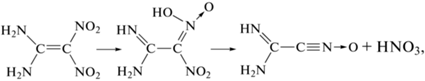
Квантовохимический расчет энергии активации для различных каналов распада [6] показал, что для соединений I–III наиболее выгодным каналом является изомеризация в нитроновую кислоту:
т.е. сохраняется механизм, установленный ранее для FOX-7 [3]. Энергия активации, а следовательно, и стабильность уменьшаются в рядуВ данной работе предпринято боле детальное исследование реакций разложения соединений I–III. Реакции изучены не только в твердом состоянии, но и в разбавленных растворах инертных растворителей. Ранее было установлено, что общей закономерностью реакций разложения нитроолефинов с аминогруппой в цис-положении является независимость скорости реакции разложения от полярности растворителя. Это характерно и для FOX-7 [5].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в данной работе образцы FOX-7 и аппаратура для манометрических и калориметрических измерений при повышенных давлениях описаны в работах [3, 4]. Вещества синтезированы по методике, описанной в работе [9]
Разложение в растворе. Как показано в работах [5, 8], реакции изомеризации амино-нитроолефинов протекают с незначительным изменением дипольного момента, и поэтому их скорость не зависит от полярности среды. В связи с этим разложение соединений I–III было изучено только в одном растворителе, нитробензоле, который отличается высокой стабильностью, инертен к действию NO2 и хорошо растворяет I–III.
Примеры кинетических кривых газовыделения для соединений I–III показаны на рис. 1. Видно, что наибольшую скорость разложения имеет соединение II, но разница между соединениями III и II невелика. Разложение I идет значительно медленнее, чем разложение соединений II и III. Соединение I имеет при 250 °С такую же скорость разложения, как и II при 220 °C. Все реакции хорошо описываются уравнением 1-го порядка. Кинетические параметры разложения соединений I–III в нитробензоле представлены в табл. 2. В этой же таблице приведены данные для FOX-7, взятые из работы [5].
Рис. 1.
Примеры кинетических кривых разложения соединений I, II и III в растворе нитробензола при концентрации 1.0 мас.% Соединение, температура (°С): 1 – II, 210; 2 – III, 210; 3 – II, 200; 4 – III, 200; 5 – I, 220. Кружки соответствуют экспериментальным точкам разложения соединения I при 250 °С.
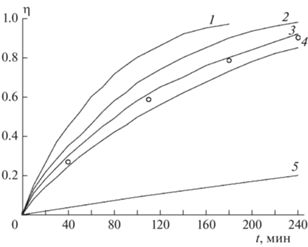
Таблица 2.
Кинетические параметры разложения FOX-7 [5] и соединений I–III в растворе и в твердой фазе
| Соединение | ∆Т, °С | Е, кДж/моль | log(A, c–1) | ∆Т, °С | Е, кДж/моль | log(A, c–1) |
|---|---|---|---|---|---|---|
| нитробензол | твердая фаза | |||||
| FOX-7 | 180–240 | 149.0 ± 8.4 | 11.9 ± 0.9 | 170–230 | 161.2 ± 8.4 | 11.3 ± 0.9 |
| I | 200–220 | 154.5 ± 5.0 | 11.3 ± 0.5 | 175–210 | 140.6 ± 1.8 | 8.7 ± 0.9 |
| II | 180–210 | 130.2 ± 7.9 | 10.5 ± 0.9 | 160–187 | 136.5 ± 7.9 | 10.0 ± 0.9 |
| III | 180–220 | 118.1 ± 8.8 | 8.7 ± 1.0 | 160–187 | 121.4 ± 4.6 | 7.9 ± 0.5 |
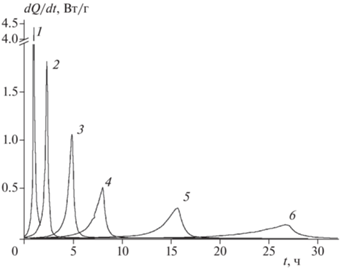
Разложение в твердой фазе. Кинетика разложения соединений I–III изучена калориметрическим методом. Первичные кинетические кривые в координатах “скорость тепловыделения – время” при разных температурах для всех трех соединений показаны на рис. 2–4.
Рис. 2.
Зависимость скорости тепловыделения от времени при термическом разложении соединения I. Температура (°С), m/V · 103 (г/см3): 1 – 210.5, 11.8; 2 – 199.8, 7.3; 3 – 199.8, 3.6; 4 – 197.7, 8.2; 5 – 187.6, 8.3; 6 – 181.2, 8.7; 7 – 175.5, 10.0.
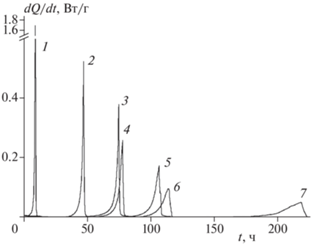
Рис. 3.
Зависимость скорости тепловыделения от времени при термическом разложении соединения II. Температура (°С), m/V · 103 (г/см3): 1 – 187.2, 8.2; 2 – 181.2, 8.4; 3 – 175.5, 6.3; 4 – 170.6, 9.1; 5 – 166.6, 9.4; 6 – 160.0, 8.6.
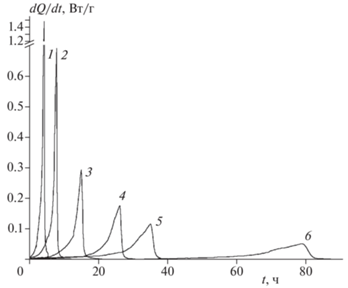
Рис. 4.
Зависимость скорости тепловыделения от времени при термическом разложении соединения III. Температура (°С), m/V · 103 (г/см3): 1 – 187.2, 8.9; 2 – 180.6, 8.9; 3 – 175.5, 10.2; 4 – 170.6, 9.5; 5 – 166.2, 5.2; 6 – 160.0, 8.3.
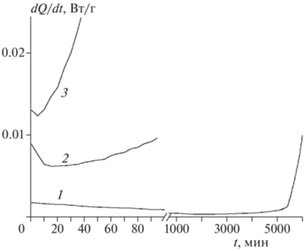
Начальная побочная реакция разложения через газовую фазу, отчетливо проявляющаяся в случае FOX-7 [3], заметна также и для соединений I–III. Во всех трех случаях в начале разложения наблюдается тепловыделение, идущее с уменьшающейся скоростью (рис. 5). После окончания этой реакции образец окрашивается в темно-коричневый цвет. Как и у FOX-7, при m/V ∼ 10–2 г/см3 глубина разложения, которая достигается в результате прохождения газофазной реакции, ничтожно мала.
Рис. 5.
Начальные участки скоростных кривых тепловыделения соединений I (1), III (2) и II (3) при 181.2 °С.
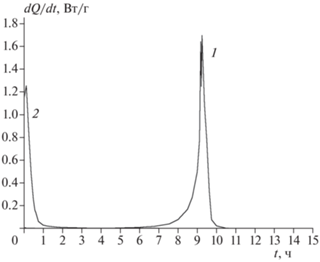
Конденсированные продукты, которые остаются после разложения соединений I–III, представляет собой вязкую жидкость черного цвета. На примере соединения III было показано, что добавление этого остатка к свежей порции вещества приводит к резкому увеличению скорости разложения (рис. 6), т.е. конечные продукты распада проявляют высокую каталитическую активность.
Рис. 6.
Влияние конечных продуктов на скорость разложения соединения I при 210.5 °С: 1 – исходное вещество, m = 30.7 мг; 2 – смесь соединения I (11.7 мг) c продуктами разложения (6 мг).
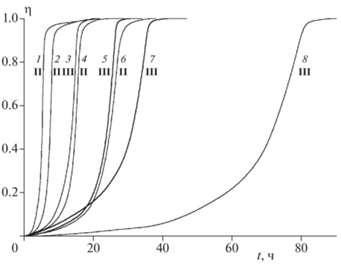
В каждом опыте был определен полный тепловой эффект реакции Q∞. После этого кинетические кривые были преобразованы обычным способом к интегральной зависимости Qтек (t) и для устранения ошибок, допущенных при определении m/V, они приведены к виду η(t), где η – степень разложения, равная отношению текущей теплоты к полному тепловому эффекту реакции: η = Qтек/Q∞. Для соединения I эти данные приведены на рис. 7. Сравнение кинетических кривых тепловыделения для соединений II и III приведено на рис. 8. Из рис. 7 и 8 видно, что, в твердой фазе, как и в растворе, наименее стабильным является соединение II. При этом различие между соединениями III и II невелико, и оба этих вещества по стабильности в твердой фазе значительно уступают I.
Рис. 7.
Зависимость глубины реакции η от времени при термическом разложении соединения I в твердой фазе. Температура (°С), m/V · 103 (г/см3): 1 – 210.5, 11.8; 2 – 199.8, 7.3; 3 – 199.8, 3.6; 4 – 197.7, 8.2; 5 – 187.6, 8.3; 6 – 181.2, 8.7; 7 – 175.5, 10.0.
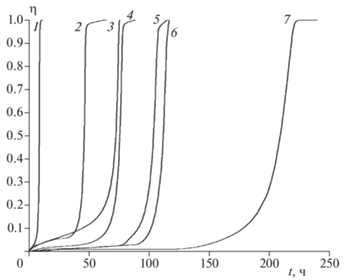
Рис. 8.
Сравнение кинетических кривых разложения соединений II и III в твердой фазе при 175.5 (1, 3), 170.6 (2, 5), 166.6 (4, 7) и 160 °С (6, 8) при m/V = (5÷10) · 103 г/см3.
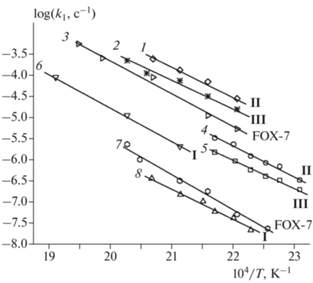
Разложение I–III в твердой фазе характеризуется сильным ускорением. Скорость каталитической реакции сильно зависит от величины отношения m/V. В то же время на начальных участках, как видно из рис. 2, на котором приведены результаты опытов при 198 °С и двух значениях m/V, влияния отношения m/V на начальную стадию не наблюдается. Значение констант скорости начальной стадии, k1, были определены путем экстраполяции удельной скорости dη/dt(1 – η) к значению t = 0. Полученные данные представлены в табл. 1 и на рис. 9.
Рис. 9.
Аррениусовская зависимость константы скорости начальной стадии разложения соединений I, II, III и FOX-7 в растворе (1, 2, 3, 6) и в твердой фазе (4, 5, 7, 8).
Из сравнения рис. 1 с рис. 7 и 8 следует, что скорость разложения на стадии ускорения в твердой фазе намного превышает скорость реакции в растворе. Константа скорости, описывающая стадию ускорения разложения, например, вещества I, в сотни раз больше, чем k1. Кроме того, необходимо отметить, что максимум скорости разложения в твердой фазе наблюдается в конце реакции.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Независимость k1 от полярности растворителя позволяет использовать экспериментальные данные, полученные в растворе, для сравнения с квантовохимическими расчетами энергии активации, выполненными для реакции в газовой фазе. Соответствующие данные приведены в табл. 3. Из этой таблицы видно, что наименьшее экспериментальное значение k1 имеет соединение I. При 200 °С k1 увеличивается в ряду
Таблица 3.
Сравнение эксперимента с расчетом
| Соединение | Ераств, кДж/моль | 105k1, c–1 при 200 °С | Ерасч,
кДж/моль [6] |
Длина связи С=С, Å | Угол поворота нитрогрупп, град [11] | |
|---|---|---|---|---|---|---|
| расчет [7] | в кристалле | |||||
| эксперимент в нитробензоле | ||||||
| FOX-7 | 149.0 | 2.8 | 131.3 | 1.4248 | 1.450 [10] | – |
| I | 154.5 | 0.17 | 140.3 | 1.4115 | 1.439 [11] | 2.0 |
| II | 130.2 | 13.0 | 130.2 | 1.4401 | 1.473 [11] | 89.0 |
| III | 118.1 | 4.8 | 136.8 | 1.4361 | 1.473 [11] | 79.3 |
причем между FOX-7 и III различие в значениях k1 является небольшим. Самое заметное приращение энергии активации и, соответственно, уменьшение скорости наблюдается для соединения I. Такой же вывод следует из рассмотрения расчетных данных работы [6] по энергии активации для реакции переноса атома Н на атом кислорода нитрогруппы, т.е. для реакции (1). Отметим, что ряд (e) не совпадает ни с одним из рядов (a), (с), (d), построенных по данным работ [6, 7]. В то же время последовательность (е), по-видимому, наиболее правильно отражает связь стабильности со строением молекулы. По крайней мере она лучше, чем другие ряды, коррелирует с такой важной структурной характеристикой молекулы, как длины связи С=С (lС=С).
Реакция (1) представляет собой согласованный процесс, идущий через шестичленное переходное состояние, в котором наряду с образованием новых связей происходит одновременный разрыв связи N–H и π-связи между атомами углерода. Как показано в работах [6, 11], длина, а следовательно, и прочность связи С=С сильно зависят от строения молекул. В свою очередь, уменьшение прочности связи С=С приводит к снижению энергии активации разложения.
Длина связи lС=С в FOX-7 и его аналогах имеет промежуточное значение между lС=С в этилене (1.33 Å) и в этане (1.54 Å), т.е. длина связи С=С в этих соединениях близка к полуторной. Причиной удлинения связи С=С является сопряжение (перекрывание) р-орбиталей атомов углерода с неподеленной парой электронов, которая занимает одну из sp3-орбиталей атомов азота как в амино-, так и в нитрогруппе. При этом в аминогруппе sp3-орбиталь, несущая неподеленную пару электронов, расположена в вершине тригональной пирамиды и наклонена относительно вертикальной линии р-орбиталей атомов С, что затрудняет взаимодействие электронных орбиталей атомов С и N. При уплощении диазацикла сопряжение между аминогруппой и связью С=С будет усиливаться. В нитрогруппе неподеленная пара электронов образует донорно-акцепторную связь с атомами кислорода. Ее орбиталь охватывает оба атома кислорода и имеет форму диска, лежащего в плоскости нитрогруппы. При перпендикулярном расположении этой плоскости относительно направления р-орбиталей атомов углерода сопряжение π-связи с нитрогруппой невозможно. Для возникновения этого сопряжения необходимо, чтобы произошел разворот плоскостей нитрогрупп относительно друг друга или поворот нитрогрупп относительно связи С=С.
По данным работы [11] в 1,1-дииод-2,2-динитроэтилене, который имеет плоское строение, lС=С = 1.33 Å, т.е. в этом соединении влияние нитрогрупп на lС=С отсутствует. В соединении I нитрогруппы также практически не выходят из плоскости, перпендикулярной направлению р-орбиталей атомов углерода. Угол φ, определяемый как угол между CNN-плоскостями 1,1- и 2,2-заместителей, равен всего 2°, как и аналогичный угол в дииодпроизводном. Тем не менее из-за сопряжения двойной связи с аминогруппами lС=С в I значительно увеличена. В соединениях II и III нитрогруппы фиксируются в положениях, которые соответствует увеличению угла φ до 79° и 89°. При таком повороте нитрогрупп, по-видимому, создаются условия для их сопряжения со связью С=С. По сравнению с I lС=С в этих соединениях увеличивается, хотя и не очень сильно. Сам поворот нитрогрупп может быть простимулирован образованием сильных внутримолекулярных водородных связей [12]. Прочность этих связей зависит от расстояния между атомами водорода аминогрупп и атомами кислорода нитрогрупп. Самое большое расстояние между Н и О и, соответственно, самая слабая водородная связь наблюдаются в соединении I [12].
При разложении соединений I–III в твердой фазе порядок изменения скорости реакции в их ряду сохраняется таким же, как в растворе. Однако при сравнении этих соединений с FOX-7 наблюдаются значительные различия. Отношение констант kраств/kтв для соединений I–III не превышает 10, в то время как для FOX-7 оно равно 100. Скорость разложения I в растворе на два порядка ниже, чем в случае с FOX-7, а в твердом состоянии эта разница уменьшается до двух раз. Обычно энергия активация в твердой фазе (Eтв) равна или незначительно выше, чем в жидкой (Eж), а в случае I, наоборот, Етв < Eж. При этом ошибка эксперимента значительно меньше наблюдаемой разницы в энергиях активации.
Все эти аномалии, проявляющиеся в твердой фазе, связаны с тем, что, в отличие от FOX-7, конденсирующиеся продукты, образующиеся при разложении I–III, являются не твердыми, а жидкими (даже при комнатной температуре) соединениями. Взаимодействуя с этими продуктами, исходные вещества сами переходят в жидкое состояние. Кроме того, жидкие продукты проявляют высокую каталитическую активность.
В соответствии с детальным механизмом реакций, установленным в [3], в продуктах распада соединений I–III должны появляться первичные аминосоединения алифатического ряда. Будучи достаточно сильными основаниями, эти вещества могут взаимодействовать с гем-динитроолефинами с образованием термически неустойчивых молекулярных комплексов донорно-акцепторного типа, предельной формой которых являются комплексы с переносом заряда. Можно ожидать, таким образом, что катализ разложения соединений I–III имеет кислотно-основную природу. Отсутствие автокатализа в случае FOX-7 связано, скорее всего, с тем, что продуктами его разложения являются твердые высокоплавкие соединения, которые образуют с мелкими кристаллами FOX-7 сыпучие смеси со слабым контактом между частицами.
При разложении твердых соединений I–III наблюдается, как и в случае с FOX-7, быстрый побочный процесс сублимации и разложения в газовой фазе. При проведении опытов в запаянных сосудах часть продуктов газофазного разложения конденсируется на поверхности кристаллов и подавляет сублимацию. Тот факт, что эти продукты являются жидкими соединениями, не препятствует быстрому образованию защитной пленки. В результате этого побочная реакция при разложении соединений I–III подавляется не менее эффективно, чем в случае FOX-7. По данным работы [6], при исследовании распада соединений I–III в режиме линейного нагрева в потоке аргона торможения первой побочной стадии не наблюдается совсем. Это может быть связано с высокой летучестью низкоплавких продуктов разложения, которые сдуваются потоком аргона с поверхности кристаллов.
Из-за перехода вещества в жидкое состояние и автокаталитического действия продуктов разложение первоначально твердых соединений I–III заканчивается намного быстрее, чем это происходит в растворе. При соотношении констант скоростей каталитической и начальной стадий, превышающем два порядка, вклад каталитического распада в скорость реакции может стать заметным на глубине превращения менее 1%, и уже в момент прогрева наблюдаемая скорость разложения может значительно превысить скорость начальной твердофазной реакции. Последнее обстоятельство может быть причиной сравнительно слабого тормозящего эффекта твердой фазы, обнаруженного для соединений I–III.
После полного растворения исходного вещества в продуктах кинетика разложения должна подчиняться закономерностям жидкофазных автокаталитических реакций с выгоранием [13]. В этих реакциях концентрация катализатора дополнительно увеличивается из-за уменьшения объема жидкой фазы. Максимум скорости разложения в таких процессах наблюдается в конце реакции, что и наблюдается на опыте для соединений I–III.
ЗАКЛЮЧЕНИЕ
С помощью известного приема проведения реакции в разбавленном растворе инертного растворителя определены значения констант скорости k1 и энергии активации первой, некаталитической стадии разложения соединений I–III. По механизму разложения эти соединения не отличаются от FOX-7. Константа скорости k1 растет в ряду I $ \ll $ FOX-7 < III ≈ II и коррелирует с увеличением длины связи С=С. Последняя зависит от степени сопряжения двойной связи С=С с амино- и нитрогруппами. Самую большую стабильность имеет соединение I, в котором связь С=С является наиболее прочной.
По характеру разложения в твердой фазе соединения I–III значительно отличаются от FOX-7. Продукты разложения I–III являются жидкими (даже при комнатной температуре), а не твердыми, как у FOX-7, соединениями. Кроме того, эти продукты сильно катализируют реакцию разложения. Автокатализ проявляется на самых ранних стадиях разложения, что затрудняет измерение истинных констант скоростей разложения в твердой фазе.
Работа выполнена на средства ИПХФ РАН в рамках выполнения госзаданий (регистрационные номера АААА-А19-119101690058-9 и АААА-А19-119100800130-0).
Список литературы
Bellamy A.J. // Struct Bond. 2007. V. 125. P. 1;https://doi.org/10.1007/430_2006_054
Ticmanis U., Kaiser M., Pantel G. et al. // Proc. 35th Intern. Annual Conf. ICT. Karlsruhe: ICT, 2004. P. 70/1.
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 6. С. 54.
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 7. С. 16.
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2022. Т. 41. С. 48.
Krisyuk B.E., Zakarov V.V., Chukanov N.V. et al. // Cent. Eur. J. Energ. Mater. V. 17. № 1. P. 20; https://doi.org/10.22211/cejem/118513
Volkova N.N., Kazakov A. I., Danilchik A.V. et al. // New Trends Res. Energ. Mater. Proc. 21th Semin. Czech Republic: Univ. Pardubice, 2018. P. 1143.
Назин Г.М., Дубихин В.В., Далингер И.Л. и др. // Хим. физика. 2021. Т. 40. № 1. С. 30.
Шастин А.В., Корсунский Б.Л., Лодыгина В.П. // ЖПХ. 2009. Т. 82. № 10. С. 1653; https://doi.org/10.1134/S1070427209100115
Crawford M.-J., Evans J., Cӧbel M. et al. // Propellants Explos. Pyrotech. 2007. V. 32. № 6. P. 478; https://doi.org/10.1002/prep.200700240
Baum K., Bigelow S.S., Nguyen N. V., et al. // J. Org. Chem. 1992. V. 57. № 1. P. 235; https://doi.org/10.1021/jo00027a042
Крисюк Б.Э. // Хим. физика. 2020. Т. 39. № 1. С. 3; https://doi.org/10.31857/S0207401X20010057
Дубовицкий Ф.И., Манелис Г.Б. Мержанов А.Г. // ДАН СССР. 1958. Т. 121. № 6. С. 668.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика