Химическая физика, 2022, T. 41, № 4, стр. 38-43
Физико-химические характеристики, состав и термическая устойчивость комплекса неодима(III) с гепарином
М. И. Скобин 1, *, М. А. Феофанова 1, В. М. Никольский 1, Т. В. Крюков 1, В. Г. Алексеев 1, А. И. Иванова 1
1 Тверской государственный университет
Тверь, Россия
* E-mail: Skobin.MI@tversu.ru
Поступила в редакцию 18.05.2021
После доработки 09.07.2021
Принята к публикации 20.07.2021
- EDN: CBBECY
- DOI: 10.31857/S0207401X22040100
Аннотация
Методом рН-метрического титрования при 37 °С (фоновый электролит 0.15 М NaCl) исследовано комплексообразование Nd (III) с анионами гепарина. С использованием программы NewDALSFEK рассчитана константа образования (β) комплекса [NdHep]: lgβ(NdHep) = 4.28 ± 0.02). Комплекс [Nd(H2O)3Hep]n выделен в твердом виде. Его состав определен по результатам рентгеноспектрального электронно-зондового анализа, термогравиметрии, дифференциальной сканирующей калориметрии, ИК-спектроскопии.
ВВЕДЕНИЕ
Активное изучение физико-химических свойств координационных соединений обусловлено огромной ролью, которую они играют во многих биологических процессах, а также их широким практическим применением в различных сферах деятельности человека при соблюдении экологического равновесия в природе. В последние годы установлено, что кластеры золота являются идеальными флюоресцентными метками в биологии и исследованиях окружающей среды [1]. Спектрофотометрическими методами исследования показано, что введение комплексов марганца с тетрафенилпорфирином в состав композиционных материалов придает последним антибактериальные свойства [2]. Показаны также перспективы создания биоразлагаемых композитов на основе кератина и сополимеров сэвилена [3], а также преимущества модификации первичными аминами полифосфатов для повышения водостойкости поликомплексов [4].
Нами получен и изучен ряд биоразлагаемых комплексонов, производных аспарагиновой и глутаминовой кислот [5], и в интересах химиков-фармакологов изучены специфические свойства их оптических изомеров при комплексообразовании с биометаллами [6]. В настоящей работе продолжено исследование комплексообразования представителей редкоземельных элементов (РЗЭ), в частности неодима, с гепарином (биополимер H3Hep группы глюкозаминогликанов, используемый в медицине в качестве антикоагулянта). Ранее было показано, что введение в биосистемы ионов РЗЭ может значительно повысить эффективность антикоагулянтов крови [7]. На примере исследования комплексов гепарина с тербием установлено, что в процессе конкурентного комплексообразования ионов РЗЭ и кальция с белками, ответственными за свертывание крови, возрастает антикоагулянтная активность препарата [8]. Возможность замещения кальция ионами РЗЭ определяется сходством их ионных радиусов и подобием физико-химических характеристик [9].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экспериментов использовали фармакологический раствор натриевой соли гепарина ({Na3Hep}n) производства Белмедпрепараты (Республика Беларусь), содержащий 38.5 г/л гепарина. Растворы хлорида неодима (III) готовили из навесок соли NdCl3 ∙ 6H2O (Центр технологий “Лантан”, Россия) марки “х.ч.” и стандартизировали методом комплексонометрического титрования с ксиленоловым оранжевым [10].
Измерение значений pH проводили с помощью иономера И-160МП, укомплектованного измерительным комбинированным электродом ЭСЛК-01.7 “Аквилон” и автоматическим термокомпенсатором ТКА-1000.1. Точность измерения pH составляла ±0.01. Для поддержания температуры в 37 °С использовали ультратермостат UTU-2/77.
Твердый комплекс [Nd(H2O)3Hep]n был синтезирован путем смешения растворов NdCl3 и {Na3Hep}n в эквимолярных количествах с последующим доведением объема раствора до 50 мл. Предварительно, по диаграммам распределения комплексных форм, установили оптимальное значение рН синтеза комплексов, равное 4.5. Необходимой кислотности среды добивались путем добавления 0.05 н HCl марки “х.ч.” (АО “База № 1 Химреактивов”, Россия) к натриевой соли гепарина. Приливанием ацетона в объемном соотношении 1 : 2 получали гелеобразный осадок, который промывали в ацетоне, отделяли центрифугированием и сушили на воздухе.
Качественный и количественный анализ комплекса был сделан методом EPMA с использованием энергодисперсионного микроанализатора Oxford INCA Energy 350 производства компании Oxford Instruments (UK) и растрового электронного микроскопа JEOL JSM-6610LV (Japan). Термический анализ проводили на приборе Netzsch STA 449 F3 Jupiter (Germany) в атмосфере воздуха. ИК-спектры образцов-таблеток с KBr марки “х.ч.” (АО “База № 1 Химреактивов”, Россия) записывали на приборе “Equinox 55” компании Bruker (USA) в диапазоне 450–4000 см–1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексообразование в системе Nd3+–Hep3– исследовали методом рН-метрического титрования. Раствор, содержащий по 1.26 · 10–4 моль NdCl3 и {Na3Hep}n (фоновый электролит – 0.15 М физиологический раствор NaCl марки “х.ч.” производства АО “База № 1 Химреактивов”, Россия), титровали 0.05 М раствором HCl. При этом традиционно [11] принимали во внимание, что каждое мономерное дисахаридное звено макромолекулы гепарина ведет себя как обычный низкомолекулярный анион. Константы протонирования рассчитывали из усредненной кривой, используя следующую модель равновесий: H+ + OH– ↔ H2O, Hep3– + H+ ↔ [HHep]2–, Nd3+ + Hep3– ↔ [NdHep]. В эксперименте учитывалось протонирование Hep3– по карбоксилатной группе.
По кривой титрования и диаграмме распределения комплексных форм установлено, что в изученном интервале рН образуется только монокомплекс [NdHep], логарифм устойчивости которого lgβ([NdHep]) = 4.28 ± 0.02. Теоретический выход [NdHep] по результатам pH-метрии и математического моделирования составил 80%.
Результаты идентификации полученного комплекса гепарина с неодимом, осуществленной методом сканирующей электронной микроскопии (за исключением неопределяемых этим методом 16 легчайших атомов водорода), представлены в табл. 1.
Результаты элементного EPMA-анализа
По результатам элементного анализа можно надежно определить состав комплекса гепарина с неодимом. Это не касается азота, который этим методом обнаруживается в элементарном безводном комплексе в количестве двух атомов вместо фактического одного. Эта аномалия результата элементного анализа объясняется наличием остаточного количества азота в рабочей камере электронного микроскопа, необходимого для компенсации накапливающегося отрицательного заряда на непроводящем образце комплекса гепарина с неодимом [12].
Для получения информации о структуре координационной сферы комплекса было осуществлено исследование исходного твердого комплекса [Nd(H2O)xHep]n. Термический анализ (рис. 1) показал, что процесс дегидратации комплекса неодима с гепарином начинается уже при температуре 40 °С и продолжается вплоть до 190 °С. При этом на кривой, полученной методом дифференциальной сканирующей калориметрии (ДСК), при температуре около 100 °С наблюдается минимум эндотермического эффекта, что соответствует завершению удаления внешнесферной кристаллизационной воды и переходу к удалению более прочно связанной в комплекс с неодимом внутрисферной воды. Количественно эти процессы оцениваются следующим образом: при общей массе навески комплекса [Nd(H2O)xHep]n в 21.81 мг масса удаленной из него внешнесферной воды составила 1.39 мг (1.39/18 = 0.077 мМ), а внутрисферной – 1.51 мг (1.51/18 = 0.083 мМ). Суммарно масса удаленной воды составила 13.29%.
Рис. 1.
Результаты синхронного термического анализа [Nd(H2O)3Hep]n. Кривые ТГ (штриховая кривая) и ДСК (сплошная кривая).
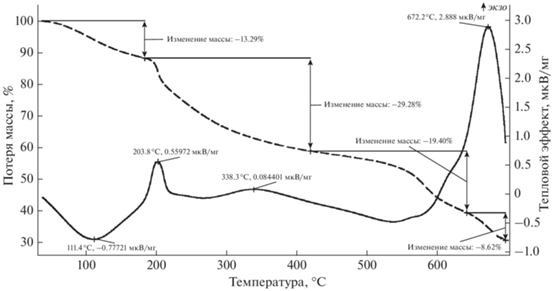
Масса безводного комплекса C12H16NdNO16S2 (638.242 г/моль) составляет 21.81 – 2.9 = 18.91 мг (18.91/638 = 0.03 мМ). Значит мольное соотношение между массами внешнесферной и внутрисферной воды составляет 2.5 : 3 (0.077/0.03 : 0.083/0.03). Тогда брутто-формула внутренней сферы комплекса будет следующей: [Nd(H2O)3Hep]n.
После дегидратации при 190 °С и вплоть до 420 °С наблюдается значительная убыль массы, сопровождаемая появлением экзотермических пиков на кривой ДСК при 203 и 338 °С и связанная с разрушением гликозидной связи и углеродного скелета гепарина. Суммарно убыль массы на данном этапе составляет 29.28% (6.4 мг). При этом в процессе термической деградации гепарина образуются газы, смолы, жидкие и твердые побочные продукты, так же как, например, при горении целлюлозы [13].
На следующем этапе термического воздействия часть образующихся летучих фракций при температуре 400–450 °С удаляется (19.4%, т.е. 4.23 мг), а другая часть продуктов горения соединяется с неодимом, образуя неорганические соединения, в том числе и Nd2(SO4)3. Некоторая часть продуктов горения превращается в карбонизированный остаток (огарок), который способен выдерживать воздействие высокой температуры – до 600 °С [14]. Такой огарок темно-серого цвета был обнаружен на поверхности тигля после эксперимента. Вес огарка рассчитывался следующим образом: 161.1 (масса тигля после анализа) – 160.42 (масса тигля до начала анализа) = 0.68 мг.
В ходе дальнейшего разложения (выше 600 °С) деструкции подвергается и неорганический продукт Nd2(SO4)3, образовавшийся после разрушения углеродного скелета гепарина при 300 °С. При такой высокой температуре сульфат неодима трансформируется в оксисульфат неодима Nd2O2SO4 [15]. Причем авторы работы [16] дифференциально-термическим, термогравиметрическим (ТГ), химическим и ИК-спектроскопическим методами установили, что при температурах выше 620 °С должно образоваться устойчивое соединение Nd2O2(SO4)0.6. Об этой высокотемпературной трансформации сульфата неодима на кривой ТГ свидетельствуют убыль массы на 8.62% (1.9 мг) и появление экзотермического пика на кривой ДСК при 672 °С.
В конечном итоге после полного цикла термогравиметрирования комплекса неодима с гепарином осталось 29.1% (6.35 мг) несгоревшего опытного образца в виде огарка (0.68 мг) и Nd2O2(SO4)0.6 (6.35 – 0.68 = 5.67 мг). Отсюда следует, что если в моле оксисульфата неодима (377.6 г/моль) на неодим приходится 288 г, то в 5.88 мг оксисульфата неодима содержится 5.67 ∙ 288/377.6 = 4.33 мг (4.33/144 = 0.03 мМ) этого металла. Таким образом, весь неодим из исходных 0.03 мМ комплекса [Nd(H2O)3Hep]n перешел в итоговый оксисульфат неодима Nd2O2(SO4)0.6 с содержанием металла, равным 0.03 мМ.
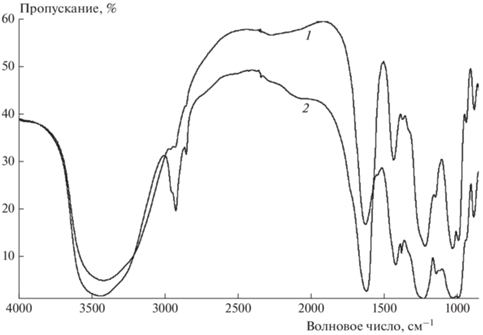
Интерпретацию характеристических полос поглощения в ИК-спектре [Nd(H2O)3Hep]n (рис. 2) проводили по надежным спектральным данным, полученным для натриевой соли гепарина. На спектрах 1 и 2 (рис. 2) присутствует широкая полоса в области 3500–3300 см–1, которая соответствует валентным колебаниям связей в функциональной группе О–Н: при 3443 см–1 на кривой 2 и при 3418 см–1 на кривой 1. На спектре натриевой соли гепарина (кривая 2) обнаружена полоса при 1128 см–1, принадлежащая “изгибным” деформационным колебаниям группы С–О–Н [17, 18]. На спектре комплекса гепарина с неодимом (кривая 1) в диапазоне 1140–1100 см–1 характеристического пика группы С–О–Н не наблюдается, вероятно, в результате его смещения, вызванного координацией кислорода гидроксильной группы с неодимом.
Установлено, что полоса при 1624 см–1 в спектре натриевой соли гепарина принадлежит деформационным колебаниям кристаллогидратной воды [19] и асимметричным валентным колебаниям связи C=O в карбоксилатной группе, а полоса при 1424 см–1 характеризует асимметричные валентные колебания связи C=O [17]. Соответствующие полосы есть и в спектре [Nd(H2O)3Hep]n при 1631 и 1438 см–1.
Пики при 1235 и 1026 см–1 на спектрах натриевой соли гепарина соответствуют асимметричным и симметричным колебаниям связи S=O внутри сульфонатной и аминосульфонатной групп [20]. Для комплекса гепарина с неодимом частоты валентных асимметричных и симметричных колебаний составляют 1227 и 1036 см–1 соответственно.
В диапазоне частот ниже 1000 см–1 можно выделить валентные ассиметричные колебания С–O–C при 891 (в моносахаридном кольце) и 942 см–1 (гликозидные связи) для {Na3Hep}n [17, 18], при 888 и 942 см–1 для [Nd(H2O)3Hep]n.
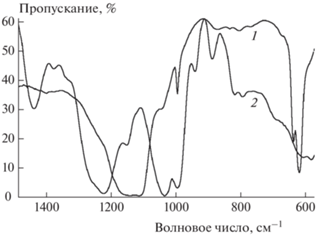
ИК-спектроскопическое исследование комплексов гепарина с неодимом при различных температурах также подтвердило выводы об особенностях свойств этого комплекса. Так, исчезновение в спектре при его нагревании до 250 °С (рис. 3) полосы валентных ассиметричных колебаний гликозидной связи С–O–C свидетельствует о распаде молекулы гепарина на моносахариды с последующим разрушением углеродного скелета и отщеплением карбоксильной, сульфонатной и аминосульфонатной групп, что подтверждается отсутствием их характеристических полос поглощения в спектре 2.
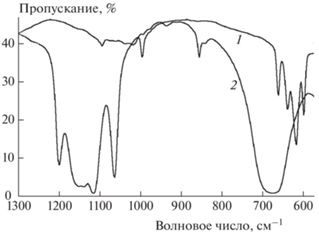
Чтобы исключить сомнения в образовании конечного продукта Nd2O2(SO4)0.6 при термическом разложении комплекса гепарина с неодимом, на рис. 4 совместно со спектром исследуемого комплекса при 700 °С представлен спектр Nd2O3. При сравнении спектров 1 и 2 очевидно их различие. Наличие в спектре 1 пиков, соответствующих валентным колебаниям группы ${\text{SO}}_{4}^{{2 - }}$ при 1201, 1140, 1117, 1065 и 997 см–1 в сопровождении “изгибных” деформационных колебаний при 662, 639, 618 и 599 см–1 [16, 21, 22] и отсутствие характерных пиков в этих областях в спектре 2 указывает на образование именно сульфосодержащего соединения.
ЗАКЛЮЧЕНИЕ
Установлено, что в системе Nd3+–H2O–Hep3– в исследуемом интервале рН образуется только монокомплекс вида [NdHep], который был выделен из раствора в твердом виде.
Методом элементного EPMA-анализа надежно определен состав мономерного звена твердого комплекса гепарина с неодимом и получена его брутто-формула C12H16NdNO16S2, согласующаяся с теоретическими представлениями авторов о составе изучаемого соединения.
Синхронный термический анализ показал, что термодеструкция исследуемого комплекса состоит из трех основных стадий: 1) дегидратации, 2) термодеструкции комплексного соединения и разрушения мономерного звена гепарина, 3) образования и превращения неорганических соединений с одновременным выгоранием остатков углерода. В результате анализа дериватограммы определено, что выделенный комплекс содержит во внутренней сфере три молекулы воды.
По данным pH-метрии, синхронного термического исследования, элементного анализа и ИК-спектроскопии установлено, что структурная формула комплексного мономерного звена представляет собой дисахарид, состоящий из остатка идуроновой кислоты и глюкозамина, сульфатированного по амино- и гидроксильной группам, координированный через атомы кислорода карбоксилатной, гидроксильной, сульфонатной и аминосульфонатной групп с ионом неодима (III).
Список литературы
Дьяков Ю.А., Яржемский В.Г., Голубков М.Г. // Хим. физика. 2020. Т. 39. № 12. С. 10; https://doi.org/10.31857/S0207401X20120055
Тертышная Ю.В., Лобанов А.В., Хватов А.В. // Хим. физика. 2020. Т. 39. № 11. С. 52; https://doi.org/10.31857/S0207401X20110138
Смыковская Р.С., Кузнецова О.П., Волик В.Г., Прут Э.В. // Хим. физика. 2020. Т. 39. № 5. С. 72; https://doi.org/10.31857/S0207401X20050106
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Ткаченко Л.А., Шаулов А.Ю. // Хим. физика. 2020. Т. 39. № 3. С. 66; https://doi.org/10.31857/S0207401X20030115
Логинова Е.С., Никольский В.М. // Хим. физика. 2017. Т. 36. № 8. С. 94; https://doi.org/10.7868/S0207401X1708009X
Биберина Е.С., Никольский В.М., Феофанова М.А. // Изв. АН. Сер. хим. 2020. Т. 69. № 10. С. 1916; https://doi.org/10.1007/S11172-020-2978-1
Феофанова М.А., Никольский В.М., Егорова И.Ю. // Вестн. ТвГУ. Сер.: Химия. 2003. №1. С. 123.
Николаева Л.С., Семенов А.Н., Мамонтов М.Н., Добрынина Н.А., Феофанова М.А. // ЖНХ. 2008. Т. 53. № 5. С. 890; https://doi.org/10.1134/S0036023608050252
Николаева Л.С., Семенов А.Н., Хомутов А.Е. // Хим.-фарм. журн. 2012. Т. 46. № 2. С. 9.
Пршибил Р. Аналитические применения этилендиаминтетрауксусной кислоты и родственных соединений. М.: Мир, 1975.
Карпухин Л.Е., Феофанова М.А., Николаева Л.С., Мамонтов М.Н., Добрынина Н.А. // ЖНХ. 2006. Т. 51. № 6. С. 979; https://doi.org/10.1134/S0036023606060106
Криштал М.М., Ясников И.С. Сканирующая электронная микроскопия и рентгеноспектральный микроанализ. М.: Техносфера, 2009.
Байклз Н., Сегал Л. Целлюлоза и ее производные. Т. 2. М.: Мир, 1974.
Плоткина Н.С., Вирник А.Д. // Антибиотики и химиотерапия. 1967. № 3. С. 245.
Гризик А.А., Абдуллина Н.Г., Гарифджанова Н.М. // ЖНХ. 1973. Т. 18. № 3. С. 596
Сахарова Ю.Г., Борисова Г.М. // Там же. 1976. Т. 21. № 1. С. 76.
Devlin A., Mauri L., Guerrini M. et al. // BioRxiv. 2019; https://doi.org/10.1101/744532
Wiercigroch E., Szafraniec E., Czamara K. et al. // Spectrochim. Acta, Part A. V. 185. 2017. P. 376; https://doi.org/10.1016/j.saa.2017.05.045
Grant D., Long W.F., Moffat C.F. et al. // Biochem J. 1991. V. 275. P. 93; https://doi.org/10.1042/bj2750193
Grant D., Long W.F., Frank B.W. // Biochem J. 1987. V. 244. № 1. P. 143; https://doi.org/10.1042/bj2440143
Periasamy A., Muruganand S., Palaniswamy M. // Rasayan J. Chem. 2009. V. 2. № 4. P. 981.
Sifontes A.B., Edgar Canizales E., Toro-Mendoza // J. Nanomater. 2015. V. 2015. P. 8; https://doi.org/10.1155/2015/510376
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика