Химическая физика, 2022, T. 41, № 4, стр. 44-55
Структура и свойства пленок и покрытий из бутадиен-стирольного термоэластопласта
Л. С. Шибряева 1, 2, *, Л. Р. Люсова 2, С. Г. Карпова 1, Ю. А. Наумова 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Российский технологический университет МИРЭА
Москва, Россия
* E-mail: lyudmila.shibryaeva@yandex.ru
Поступила в редакцию 20.11.2020
После доработки 09.03.2021
Принята к публикации 22.03.2021
- EDN: AKUWNW
- DOI: 10.31857/S0207401X22040070
Аннотация
Работа посвящена установлению связи антибактериальных свойств поверхности со структурой и составом покрытий на основе бутадиен-стирольного термоэластопласта с полилактидом и антибактериальными агентами: тетраметилендиэтилентетрамином или дистеарилдиметиламмоний хлоридом. Показано, что механизм антибактериального действия композиции основан на вымывании (высвобождении) антибактериальных агентов в водной среде вместе с микроорганизмами. Эффект самоочищения поверхности зависит от структурной организации покрытия, которая способствует ускорению их вымывания, и усиливается благодаря включению антибактериальных агентов в подверженную гидролизу фазу полилактида, который локализуется в бутадиен-стирольной матрице вокруг доменов полистирола. Особенности структуры пленок и покрытий были установлены методом растровой электронной микроскопии, с помощью парамагнитного зонда, физико-механических испытаний и путем исследования закономерностей термодеструкции с помощью термогравиметрии.
ВВЕДЕНИЕ
Важной и актуальной проблемой народного хозяйства является борьба с разрушением различных материалов и изделий вследствие развития биохимических процессов, вызываемых колониями микроорганизмов, накапливающихся на их поверхности. Это приводит, с одной стороны, к изменению эксплуатационных свойств изделий, а с другой – к накоплению вредных форм микроорганизмов в рабочей среде [1–4]. Например, металлические и пластиковые трубы для коммуникаций подвержены биохимическому разложению в почве в присутствии ферментов, выделяемых почвенными микроорганизмами. При использовании труб в водопроводной, водоотводной и канализационной сетях их внутренние поверхности подвергаются мощному обрастанию микроорганизмами, вследствие чего уменьшается рабочий просвет труб [5–8]. Обрастание морскими организмами поверхности днищ судов, технических конструкций, находящихся в морской воде, начинается с колонизации их микроорганизмами [9].
Особенно значимой проблемой является вред, наносимый колониями микроорганизмов живым организмам, в том числе человеку. Микроорганизмы, образующие биопленки, вызывают развитие вторичных инфекций, хронизацию воспалительных процессов и различные осложнения [10–13]).
Для борьбы с обрастанием биопленками различных поверхностей используют антибактериальные покрытия, в более общем случае – антимикробные поверхности [14]. Проявление антимикробных поверхностей в подавляющем большинстве случаев связано с применением полимерных материалов, в том числе и при защите поверхностей неполимерной природы.
На сегодняшний день для производства медицинских инструментов используют композиции на основе эластомеров и биодеградируемых полимерных композиций, наполненных лекарственными препаратами [15–17]. В наших работах [18–20] предложен метод модификации материалов, из которых изготовлены медицинские инструменты, с целью придания им антиадгезионных свойств по отношению к клеткам бактерий. Для этого предложен состав поверхностного слоя, вызывающий не только разрушение бактериальной пленки, но и способный уничтожать зародыши бактериальных колоний, продуктов их жизнедеятельности и распада. Для эластомерных материалов медицинского назначения авторами в [18–20] предложены для использования антибактериальные покрытия на основе бутадиен-стирольных термоэластопластов, обладающие повышенной стойкостью к образованию биопленок на их поверхности. Последнее достигается путем введения в эластомерную основу биоразлагаемых пластиков совместно с антибактериальными агентами. При этом важной проблемой является установление факторов, оказывающих влияние на эффективность антибактериального действия и усиливающих его путем снижения адгезии бактерий к поверхности [20].
Целью данного исследования было установление связи антибактериальных свойств поверхности со структурой пленок и покрытий из композиций на основе бутадиен-стирольного термоэластопласта с полилактидом разного состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты и методы исследования
В работе использовали следующие соединения:
1) бутадиен-стирольный термоэластопласт марки ДСТ-30-01 (далее – ДСТ) производства ОАО “Воронежсинтезкаучук” (Россия) в виде гранул (ТУ 38.103.267-99) со следующими характеристиками: среднее содержание связанного стирола – 30 мас.%, показатель текучести расплава при 190 °С, 5 кГс составляет <1 г/10 мин, содержание летучих веществ – 0.5 мас.%, содержание золы – 2.0 мас.%, содержание стабилизатора – 0.2–0.5 мас.%, условная прочность при растяжении – не менее 19.6 МПа, относительное удлинение при разрыве – не менее 650%;
2) полилактид (ПЛА) марки L-, D,L-энантиомер Ingeo Biopolymer 4032D в виде гранул со следующими характеристиками: молекулярная масса – 1.7 · 105, плотность – 1.27 г/см3, предел текучести при растяжении – 60 МПа, относительное удлинение при разрыве 6%, температура плавления – 165–170 °С, степень кристалличности – 50–60%;
3) тетраметилендиэтилентетрамин (ТМДЭТА) – циклический третичный амин, синтезируемый путем конденсации этилендиамина с формальдегидом, антибактериальный агент с противовирусной активностью – желтовато-белый порошок, легко растворимый в воде, спиртах, хлороформе; температура плавления – 195 °С, стабилен при хранении, в том числе в виде водных растворов, малотоксичен для теплокровных животных и человека.
4) дистеарилдиметиламмония хлорид (ДСДМАХ) – четвертичная соль аммония, белый порошок плотностью 0.84 г/см3, нерастворимый в воде, растворимый в спиртах, кетонах; не плавится до разложения, температура разложения – 135 °С; при хранении стабилен, в том числе в виде спиртовых растворов; катионный ПАВ, антибактериальный агент широкого спектра действия, среднетоксичен для теплокровных животных и человека.
Композиции, содержащие ДСТ, ПЛА, ТМДЭТА и ДСДМАХ, изготавливали путем растворения компонентов в хлороформе в чашках Петри. Пленки получали из раствора путем испарения растворителя. Покрытия из этих композиций создавали нанесением раствора одноразовым шприцем на поверхность субстрата – резины из натурального каучука (НК) марки НК SVR-3L, которую использовали в качестве модельного субстрата для антибактериальных покрытий и изготавливали по следующей рецептуре: на 100 мас. ч. НК приходится 2 мас. ч. стеариновой кислоты, 3 мас. ч. оксида цинка, 0.5 мас. ч. сульфенамида Ц, 1 мас. ч. агидола-2, 1 мас. ч. серы. Оптимальное время вулканизации резины составило 20 мин. Физико-механические параметры субстрата: условная прочность при растяжении – 19.0 МПа, относительное удлинение при разрыве – 750%, относительное остаточное удлинение – 25%.
Субстрат хорошо смачивали используемым растворителем и растворами на его основе, что способствовало равномерному распределению покрытия. Перед его нанесением поверхность субстрата обезжиривали ацетоном. Толщина пленки покрытия составляла 100 мкм.
Для оценки антимикробных свойств покрытий раствор наносили на образцы субстрата площадью 2 × 2 см. Для определения усталостной выносливости покрытий при растяжении раствор наносили на поверхность рабочего участка стандартного образца субстрата в виде двусторонней лопатки, при продольном изгибе – на поверхность образца с прямой канавкой, непосредственно в канавке и на расстоянии до 2 см от нее. После нанесения раствора образцы высушивали при комнатной температуре в закрытом вытяжном шкафу не менее 3 сут до полного испарения растворителя. Для дальнейших испытаний отбирали образцы, не имевшие видимых дефектов поверхности покрытия.
Физико-механические испытания покрытий проводили на пленках толщиной 100 мкм согласно ГОСТ 270–75. Из пленок на вырубном прессе штанцевым ножом вырубали стандартные образцы в виде двусторонних лопаток с длиной и шириной рабочего участка 1 и 0.4 см соответственно. Определение физико-механических характеристик при растяжении проводили на разрывном электромеханическом испытательном комплексе Instron 3345.
Определение адгезии модельных бактерий к поверхности покрытий проводили на культурах клеток и микроорганизмов на базах Центра экспериментальной эмбриологии и репродуктивных биотехнологий и Всероссийского научно-исследовательского института технологии консервирования. Для определения количества микроорганизмов в качестве метода подсчета колоний использовали “чашечный метод” по ГОСТ ISO 10718-2018. Для определения адгезии модельных микроорганизмов образцы покрытий помещали в суспензию модельных бактерий Escherichia coli (кишечная палочка) и Staphylococcus aureus (золотистый стафилококк), являющихся представителями грамотрицательных и грамположительных бактерий соответственно. Для приготовления суспензий брали 100 мкл суточной бульонной культуры на 100 мл стерильной воды. Затем готовили плотную питательную среду (L-агар) и разливали в чашки Петри. Образцы покрытий площадью 2 × 2 см погружали в суспензию бактерий на 2 с и на 72 ч. По истечении выбранного времени контакта производили смыв стерильной водой, чтобы убрать излишки суспензии и смыть бактерии, которые не закрепились на поверхности материала. После смыва в воде делали реплики образцов на плотной питательной среде, L-агаре, которые термостатировали в течение 24 ч. Термостатирование образцов проводили при температуре 37 °С в шейкере.
Адгезию бактерий к покрытию определяли по числу колоний, выросших из бактерий, нанесенных на поверхность покрытия [21]. Число выросших колоний регистрировали с помощью оптического микроскопа в виде числа колониеобразующих единиц (КОЕ) путем визуального подсчета. Подсчет выросших колоний проводили, не открывая чашки Петри, перевернув их кверху дном. Для оптимизации процесса счета колоний использовали прибор, снабженный осветительным устройством, лупой, светофильтрами, сеткой на круглом стекле, перовой ручкой и счетчиком.
Количество КОЕ в 1 мл исходного инокулята рассчитывали, исходя из степени серийного разведения и количества выросших колоний, по формуле
где N – КОЕ в 1 мл исходного инокулята; R – разведение, из которого сделан высев; M – среднее количество КОЕ, выросших на чашке Петри в разведении R; V – объем инокулята, взятого для посева в чашку Петри из разведения R.Исследование пленок и покрытий методом растровой электронной микроскопии (РЭМ) проводили в Центре коллективного пользования научными приборами на базе Московского государственного технического университета им. Н.Э. Баумана. Для испытания использовали образцы пленок размером 1 × 1 см и толщиной 100 мкм.
Исследование пленок методом парамагнитного зонда (ПМЗ) с применением электронного парамагнитного резонанса (ЭПР) проводили на базе Центра коллективного пользования приборами Института биохимической физики им. Н.М. Эмануэля РАН. Спектры ЭПР (Х-диапазона) регистрировали на автоматизированном спектрометре ЭПР-В производства Института химической физики РАН (Москва). Значение микроволновой мощности в резонаторе во избежание эффектов насыщения не превышало 7 мВт. При записи спектров амплитуда модуляции всегда была существенно меньше ширины резонансной линии и не превышала 0.5 Гс. В качестве зонда использовали стабильный нитроксильный радикал 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО). Радикал вводили в образец из газовой фазы при температуре 60 °C.
Значения времени корреляции вращения зонда (τ) в области быстрых вращений (5 · 10–11 < τ < 10–9 с) находили из спектров ЭПР по формуле [22]
Процесс термодеструкции образцов изучали с помощью термогравиметрического анализа на термомикровесах TG 209 F1 Iris (“Netzsch”) в динамических условиях нагревания в токе аргона во избежание усложнения картины изменения массы образцов с увеличением температуры за счет окислительных процессов, происходящих в присутствии кислорода воздуха. Для испытания были изготовлены образцы пленок в форме диска. Навески образцов составляли 5–8 мг, анализ изменения массы образца в зависимости от температуры проводили при скорости нагревания 20 град/мин. Также были получены дифференциальные кривые (ДТГА), демонстрирующие зависимость скорости изменения массы от температуры. Точность определения температур составляла ±2 °С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
К вопросу о механизме антибактериальной активности покрытия
В данной работе в качестве механизма антибактериальной защиты поверхности материала рассматривается удаление бактерий и их колоний с поверхности антибактериального агента в среду биологической жидкости. Таким образом, разрабатываемые покрытия должны проявлять эффект угнетения роста бактерий за счет антибактериальных агентов и самоочищения поверхности от бактерий за счет биоразлагаемых пластиков.
Исследования показали, что выдержка пленок ДСТ в воде и водных растворах неорганических и органических соединений приводит к деструкции ее поверхности. Выдержка же этих пленок в различных водных средах, в растворе хлорида натрия (0.9 мас.%) и мочевины (0.02 мас.%), не содержащих микроорганизмы, приводит к незначительному изменению массы пленок полимера – 4% при выдержке в течение нескольких месяцев. Нахождение пленки ДСТ в течение 72 ч в суспензии бактерий E. coli и последующее отмывание колоний бактерий приводят к деструкции поверхности. Нахождение ДСТ в водной среде, содержащей клетки бактерий и питательную среду, также оказало деструктивное влияние на материал; при этом дефекты поверхности имели размер порядка нескольких десятков микрон. На основании этих данных было сделано предположение, что эффект самоочищения поверхности от бактерий (антибактериальный эффект) может быть обусловлен деградацией поверхностного слоя ДСТ. В этом случае возникает задача усиления данного эффекта. Последний можно усилить путем введения в ДСТ в качестве ингредиентов покрытий биоразлагаемых пластиков, склонных к участию в процессе гидролиза, например ПЛА. Таким образом, у поверхности можно создать условия для низкой адгезии бактериальных клеток за счет ее самоочищения. При этом применение антибактериальных агентов может усиливать эффект самоочищения покрытия.
Влияние состава покрытия на антибактериальный эффект
Для уточнения механизма защитного антибактериального действия покрытий из ДСТ были проведены две серии микробиологических экспериментов. Во-первых, была исследована адгезия бактериальных клеток – определено число выросших колоний (число колониеобразующих единиц КОЕ) на поверхности покрытий после контакта с суспензией бактерий. Во-вторых, определена степень угнетения роста микроорганизмов в среде, находящейся в контакте с образцом покрытия.
В качестве модельных были использованы грамотрицательные (E. coli) и грамположительные бактерии (S. aureus). В полимерное покрытие из ДСТ вводили биодеградируемый компонент ПЛА и/или антибактериальные агенты – ТМДЭТА или ДСДМАХ.
В качестве контроля в экспериментах используется покрытие из ДСТ без биоразлагаемых пластиков и антибактериальных агентов, нанесенное на субстрат резины из НК. Влияние вида бактерий и времени контакта покрытия из ДСТ с суспензией бактерий на число КОЕ приведено на рис. 1.
Рис. 1.
а – Влияние вида бактерий и времени контакта с суспензией бактерий на число КОЕ на поверхности субстрата (резина из НК и покрытие из ДСТ без пластиков и агентов): левые столбцы – время контакта 2 с, правые – 72 ч; б – влияние содержания ПЛА на число КОЕ E. coli на поверхности покрытий: левые столбцы – первый контакт в течение 72 ч, правые – повторный контакт в течение 72 ч тех же образцов после смыва клеток. Цифры над столбиками – число КОЕ.
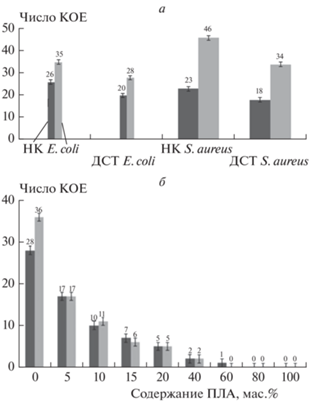
Как видно из диаграммы, представленной на рис. 1, покрытие из ДСТ на 20–30% менее восприимчиво к колонизации бактериями, чем резина из НК. Тем не менее оба материала подвержены адгезии обеих модельных бактерий. В отличие от ДСТ и НК биоразлагаемый пластик ПЛА демонстрирует практически полную невосприимчивость к адгезии клеток E. coli. Этот вывод вытекает из данных, полученных путем подсчета колоний на поверхности пленки через 72 часа после высевания стандартных штаммов бактерий вида E. coli (грам(–)) и S. aureus (грам(+)), а также через 72 ч после повторного засевания теми же штаммами тех же пленок после смыва колоний (рис. 1). Сравнения данных числа КОЕ, полученных при смыве и повторной колонизации бактериями (рис. 1), позволяют продемонстрировать высокую оценку сохранения антибактериального действия материала [19].
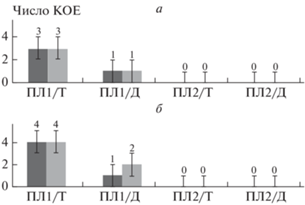
Биоразлагаемые пластики при нахождении в водных средах не выделяют продуктов гидролиза, токсичных для клеток, поэтому полученный эффект можно объяснить только с позиции самоочищения поверхности (бактериям ничто не вредит, но они не могут прикрепиться к деструктирующему поверхностному слою пластика). Нами выдвинуто предположение о том, что введение биоразлагаемого полимера (ПЛА) в ДСТ должно снизить бактериальную адгезию за счет ускорения деструкции поверхностного слоя путем гидролиза ПЛА. Исследования по влиянию содержания агентов на адгезию бактериальных клеток при времени контакта с суспензией 2 с и 72 ч показали, что эффективная защита поверхности от колонизации бактериями достигается при содержании в ДСТ 10% ПЛА и 0.5% ТМДЭТА или ДСДМАХ. В этом случае колониеобразование на поверхности пленки не происходит (рис. 2).
Рис. 2.
Влияние содержания ПЛА (ПЛ1, ПЛ2), ТМДЭТА (Т), ДСДМАХ (Д) в ДСТ на число КОЕ E. coli (а) и S. aureus (б) на поверхности покрытий: левые столбцы – первый контакт в течение 72 ч, правые – повторный контакт в течение 72 ч тех же образцов после смыва клеток; П – пленка/покрытие, Л1 – концентрация ПЛА 5 мас.%, Л2 – концентрация ПЛА 10 мас.%, Т – концентрация ТМДЭТА 0.5 мас.%, Д – концентрация ДСДМАХ 0.5 мас.%. Цифры над столбиками – число КОЕ.
Физико-механические свойства покрытий
С целью изучения особенностей структуры покрытий из композиций ДСТ с ПЛА и ТМДЭТА или ДСДМАХ были проведены физико-механические испытания пленок модельных смесей ДСТ/ПЛА в широком интервале составов. Эти испытания показали, что введение ПЛА в ДСТ приводит к значительным изменениям условной прочности и относительного удлинения при разрыве (рис. 3). Причем сравнение экспериментальных кривых зависимостей механических параметров от содержания ПЛА (кривые 1) с теоретическими кривыми, полученными аддитивным сложением параметров отдельных компонентов системы с учетом их состава (кривые 2), демонстрирует нарушение аддитивности. Введение ПЛА в ДСТ в концентрации до 40 мас.% приводит к аномально резкому снижению как условной прочности, так и удлинения при разрыве по сравнению с ДСТ. Рост содержания ПЛА свыше 80 мас.% приводит у увеличению обоих параметров. При этом минимум на кривых зависимостей обоих параметров, наблюдаемый во всем интервале концентраций ПЛА, составляет около 60% (рис. 3).
Рис. 3.
Влияние содержания ПЛА в ДСТ на условную прочность при растяжении (а) и относительное удлинение при разрыве пленок (б), приготовленных из раствора. Экспериментальные (1) и теоретические (2) кривые, полученные по аддитивной схеме с учетом значений физико-механических параметров и содержания ПЛА и ДСТ в системе ДСТ/ПЛА.
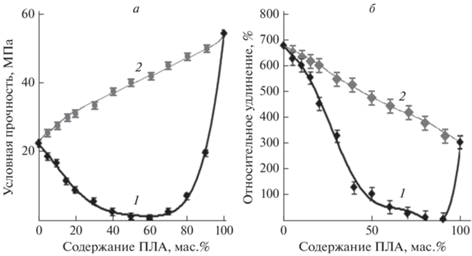
Согласно представлениям Кулезнева, наблюдаемые экспериментальные закономерности изменения физико-механических параметров в зависимости от состава композиции соответствуют изменению фазового состава смеси [23]. При этом минимум на кривых зависимостей (рис. 3) соответствует области обращения фаз. Анализ литературных данных позволяет констатировать, что ПЛА термодинамически несовместим с ДСТ [24]. Тем не менее явное различие экспериментальных и теоретических кривых указывает на наличие в изучаемой системе межкомпонентных взаимодействий ПЛА с ДСТ. Вероятно, наличие взаимодействия компонентов системы имеет кинетическую природу и обусловлено растворным методом приготовления пленок.
В работе рассмотрены свойства пленок и покрытий из ДСТ, содержащих полилактид совместно с антибактериальными агентами. Были определены физико-механические и динамические свойства (при многократном растяжении и многократном продольном изгибе), а также прочность связи при расслаивании в системе покрытие–резина. В табл. 1 представлены результаты испытаний для систем, содержащих 5 и 10% ПЛА и 0.5–1% антибактериальных агентов. Для сравнения приведены данные, соответствующие пленкам/покрытиям, не содержащим агентов (отмечены жирным шрифтом). Как видно из этой таблицы, одновременное введение пластиков и антибактериальных агентов приводит к снижению физико-механических характеристик пленок и покрытий по сравнению с аналогичными результатами для систем, содержащих только пластик. Исходя из того, что введение ДСДМАХ в количестве 1 мас.% совместно с пластиками существенно ухудшает свойства покрытий, для всех последующих экспериментов концентрация обоих агентов была выбрана равной 0.5 мас.%, а количество биоразлагаемого ПЛА в количестве не превышало 10 мас.%.
Таблица 1.
Физико-механические и адгезионные параметры пленок и покрытий, содержащих пластики и антибактериальные агенты
| Состав пленки/покрытия, мас.% | Условная прочность пленки при растяжении, МПа | Относительное удлинение при разрыве, % | Кол-во циклов до разрушения при многократном растяжении, тыс. | Кол-во циклов до разрушения при многокр. изгибе, тыс. | Прочность связи пленка покрытия – резина, кН/м | ||
|---|---|---|---|---|---|---|---|
| ДСТ + ПЛА | ДСТ + ТМДЭТА | ДСТ + ДСДМАХ | |||||
| 5 | – | – | 18.4 | 625 | 260 | 178 | 0.90 |
| 5 | 0.5 | – | 16.5 | 625 | 255 | 182 | 0.90 |
| 5 | 1.0 | – | 11.6 | 600 | 220 | 170 | 0.75 |
| 5 | – | 0.5 | 13.4 | 550 | 150 | 110 | 0.60 |
| 5 | – | 1.0 | 9.5 | 525 | 40 | 70 | 0.45 |
| 10 | – | – | 16.5 | 600 | 210 | 168 | 0.65 |
| 10 | 0.5 | – | 12.5 | 600 | 210 | 171 | 0.60 |
| 10 | 1.0 | – | 10.1 | 550 | 180 | 165 | 0.40 |
| 10 | – | 0.5 | 9.2 | 600 | 90 | 85 | 0.55 |
| 10 | – | 1.0 | 6.4 | 575 | 10 | 47 | 0.35 |
| Чистый ДСТ | – | – | 22.2 | 675 | 300 | 186 | 1.20 |
Особенности структуры покрытий
Как говорилось выше, ПЛА термодинамически несовместим с ДСТ, однако в образцах, полученных по растворной технологии, проявляется взаимодействие компонентов ДСТ и ПЛА. При этом параметр растворимости ПЛА δ = 20.3 (МДж/м3)1/2 ближе к значению δ = 18.2 (МДж/м3)1/2 полистирола (ПС) жестких блоков ДСТ, чем к значению δ = 16.9 (МДж/м3)1/2 полибутадиена (ПБ) эластомерной фазы. При испарении растворителя из раствора ДСТ/ПЛА происходит определенное распределение частиц ПЛА в матрице ДСТ. Исходя из значений параметров растворимости, можно предположить, что частицы ПЛА должны находиться в полистирольной фазе ДСТ. Но при испарении растворителя ПС переходит в стеклообразное состояние, поэтому он должен вытеснять частицы ПЛА на периферию растущего домена. Данная картина распределения может быть визуализирована с помощью электронной микроскопии.
Для изучения структуры поверхности пленок изучаемых материалов на основе ДСТ был использован метод РЭМ, где для получения изображения использовались сигналы, образованные вторичными электронами. На рис. 4 представлены РЭМ-изображения поверхности пленок из ДСТ и ДСТ + 10% ПЛА. Светлые области, обладающие большей плотностью, соответствуют доменам ПС, темные – распределению эластомерной среды ПБ.
Из рис. 4 видно, что введение ПЛА в ДСТ приводит к изменению в структуре поверхности пленки. На РЭМ-изображении ПЛА представлен в виде светлых колец. Данная картина постоянно изменялась, кольца находились в движении. Это связано с тем, что при взаимодействии электронов с ПЛА происходит его разложение с мощной эмиссией вторичных электронов, высвечивающих области разложения. Таким образом, кольцеобразные структуры соответствуют ПЛА, который локализуется в эластомерной фазе вокруг более темных областей, соответствующих доменам ПС. Повышение контрастности снимка из-за вторичной эмиссии при разложении ПЛА не позволяет сравнить в данном случае электронную плотность ПС и ПБ. Тем не менее, если бы ПЛА находился в беспорядочном состоянии в эластомерной фазе, наблюдаемая картина не содержала бы кольцеобразных структур. Введение ТМДЭТА или ДСДМАХ не оказывает существенного влияния на картину поверхности на изображениях РЭМ.
Таким образом, полученные данные РЭМ позволяют предположить, что ПЛА локализуется в ДСТ вокруг доменов ПС. Тем не менее ясно, что визуального анализа изображений поверхности недостаточно для подтверждения локализации ПЛА в матрице ДСТ. Однако такая локализация объясняет наблюдаемые зависимости значений физико-механических параметров от состава систем ДСТ/ПЛА, полученных в эксперименте, и их отличие от теоретических зависимостей.
Динамические характеристики аморфной фазы полимеров
Для изучения изменения структуры материалов из ДСТ при введении в него ПЛА был использован метод электронного парамагнитного резонанса. В образцы пленок смесей с различным содержанием ПЛА при 60 °С был введен спиновый зонд – стабильный нитроксильный радикал ТЕМПО, так как температура стеклования ПЛА составляет 55 °С. Интенсивность вращательного движения радикала и, соответственно, молекулярную подвижность оценивали по времени корреляции τ вращения зонда. На рис. 5 представлена зависимость времени корреляции вращения зонда от содержания ПЛА в материале. Поскольку время корреляции изменяется в широких пределах, на рис. 5 зависимость показана в двух разных масштабах. Из этого рисунка видно, что время корреляции при увеличении содержания ПЛА от 0 до 50 мас.% изменяется незначительно (в 2.5 раза). Дальнейшее увеличение содержания ПЛА приводит к резкому росту времени корреляции: в 5 раз для 60%, в 10 раз для 70%, в 45 раз для 90%, и, наконец, для 100%-ного ПЛА (без ДСТ) время корреляции увеличивается в 85 раз по сравнению с ДСТ. Таким образом, при увеличении содержания ПЛА в системе ДСТ/ПЛА молекулярная подвижность снижается, причем резкое ее изменение имеет место при концентрации ПЛА >50 мас.%.
Рис. 5.
Зависимость времени корреляции τ вращения зонда от содержания ПЛА: 1 – общий вид кривой, 2 – кривая в десятикратно уменьшенном масштабе.
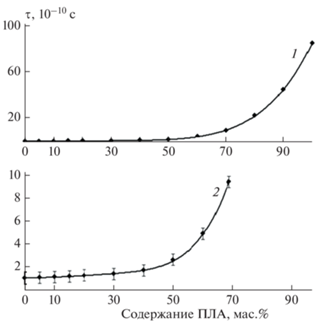
Полученную зависимость можно объяснить следующим образом. В смесевых композициях часть полимерной матрицы находится в высокоэластическом состоянии, часть – в стеклообразном. Соответственно, концентрация радикала будет распределяться неравномерно по матрице. В высокоэластических областях концентрация будет более высокой по сравнению со стеклообразной фазой [25, 26]. В полимерах с высокой концентрацией ДСТ молекулярная подвижность высока и время корреляции характеризуется низкими значениями τ. При концентрации ПЛА в смеси 50–70% имеет место инверсия фаз (о чем свидетельствует резкий излом на зависимости) и непрерывной фазой является ПЛА. Структура ПЛА характеризуется высокой жесткостью и низкой молекулярной подвижностью, о чем свидетельствует высокое значение τ для ПЛА (рис. 5). Важно отметить, что именно обращением фаз в материале объясняются проходящие через минимум зависимости физико-механических параметров (условной прочности при растяжении и относительного удлинения при разрыве) от содержания ПЛА в ДСТ, представленные на рис. 3.
Важное следствие из полученных данных – несущественное изменение молекулярной подвижности в системе ДСТ/ПЛА при увеличении концентрации ПЛА от 0 до 10 мас.%, которая рекомендуется нами в качестве базовой для защитных антибактериальных пленок. При этом рост времени корреляции вращения зонда составляет не более 7%. Таким образом, незначительное ухудшение физико-механических и адгезионных характеристик покрытий для 10%-ного содержания ПЛА по сравнению с ДСТ без ПЛА также связано с незначительным уменьшением молекулярной подвижности в системе ДСТ/ПЛА.
Введение в изучаемую систему антибактериального агента в количестве 0.5 мас.% приводит к количественным изменениям зависимости времени корреляции от содержания ПЛА. Полученная зависимость для системы с введенным ТМДЭТА изображена на рис. 6. Из сравнения зависимостей, полученных для систем ДСТ/ПЛА с введенным ТМДЭТА и без него, видно, что ТМДЭТА снижает время корреляции тем сильнее, чем выше содержание ПЛА в системе. Для ДСТ снижение времени корреляции составляет 5%, для материала ДСТ + 10% ПЛА + 0.5% ТМДЭТА – 20%, для ДСТ + 60% ПЛА + 0.5% ТМДЭТА – 50%, для 100%-ного ПЛА – 63%. Данная зависимость может быть объяснена тем, что ТМДЭТА разуплотняет структуру полимера и, как следствие, увеличивается молекулярная подвижность. Некоторое уменьшение физико-механических характеристик при введении ТМДЭTА в систему ДСТ/ПЛА при этом объясняется увеличением неоднородности материала, поскольку при введении ТМДЭТА в систему ДСТ/ПЛА с содержанием ПЛА до 60 мас.% агент будет распределяться преимущественно в эластомерной фазе ПБ, с которой ДСТ менее совместим, чем с ПЛА.
Рис. 6.
Зависимость времени корреляции τ вращения зонда от содержания ПЛА: кривые 1,1' – без ТМДЭТА; 2,2' – с добавлением 0.5 мас.% ТМДЭТА. Общий вид кривых (1, 2) и кривые в десятикратно уменьшенном масштабе (1', 2').
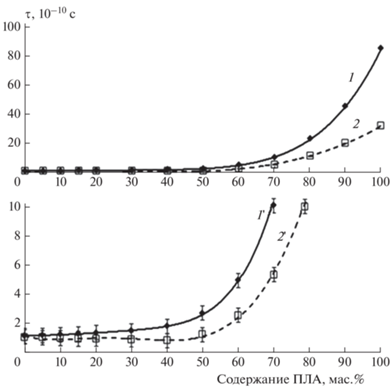
Зависимость, полученная для системы ДСТ/ПЛА с введением 0.5% ДСДМАХ, аналогична таковой для ТМДЭТА. Отличие состоит в том, что ДСДМАХ несколько сильнее увеличивает молекулярную подвижность системы ДСТ/ПЛА, чем ТМДЭТА, что связано с его поверхностно-активными свойствами.
Итак, увеличение молекулярной подвижности при введении антибактериальных агентов в систему ДСТ/ПЛА тем более сильное, чем выше содержание ПЛА, говорит о том, что агенты распределяются преимущественно в фазе ПЛА. Это подтверждают и данные ТГА: агенты оказывают стабилизирующий эффект по отношению к ПЛА, что подразумевает их дислокацию в фазе ПЛА. Этим объясняется сохранение антибактериальной активности покрытий при повторном контакте с суспензией бактерий (см. рис. 1, 2): при гидролизе ПЛА в среде происходит высвобождение антибактериальных агентов. Важную роль в уменьшении адгезии бактерий играет и расположение фазы ПЛА в среде ДСТ – вокруг доменов ПС, что подтверждено данными РЭМ и ПМЗ. Такое расположение ПЛА способствует снижению стойкости ДСТ к гидролизу, поэтому даже добавление 5 мас.% ПЛА снижает адгезию бактерий, что можно объяснить только эффектом самоочищения материала. При введении антибактериальных агентов происходит их высвобождение из гидролизующегося слоя, полностью предотвращающее адгезию бактерий даже при повторном контакте.
Важно отметить, что локализация ПЛА в ДСТ должна влиять на термическое разложение материала. Для установления этого факта и особенностей связи антибактериальных агентов со структурой пленок из ДСТ и, как следствие, с их термостойкостью был использован метод термогравиметрического анализа (ТГА).
Изучение термостойкости композиций методом термогравиметрии
Как известно, структура полимерной композиции оказывает влияние на закономерности ее термодеструкции. Применение динамических методов ТГА/ДТГА является перспективным в качестве инструмента исследования механизма физико-химических процессов, протекающих при деградации твердых тел [27–29]. Для установления особенностей структуры композиций ДСТ/ПЛА, ДСТ/ПЛА/ДСДМАХ, ДСТ/ПЛА/ТМДЭТА был использован метод ТГА, проведенного в аргоне при неизотермичом нагреве образцов с постоянной скоростью 20 град/мин.
Был проведен сравнительный анализ термокинетических кривых потери веса (ТГА) в ходе деструкции и величин температур характеристических пиков деструкции, определяемых по ДТГА-кривым. Кривые ТГА (штриховые линии) и дифференциальные кривые ТГА (ДТГА, сплошные линии) для различных образцов пленок ДСТ, содержащих ПЛА, ТМДЭТА и ДСДМАХ, представлены на рис. 7.
Рис. 7.
Кривые ТГА (штриховые линии) и ДТГА (сплошные линии) для образцов ДСТ (а), ДСТ + 10% ПЛА (б), ДСТ + 10% ПЛА + 0.5% ТМДЭТА (в), ДСТ + 10% ПЛА + 0.5% ДСДМАХ (г).
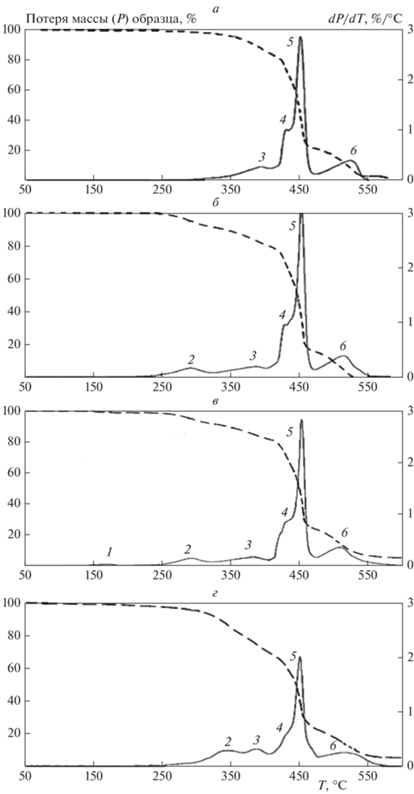
На кривых ДТГА (сплошные линии) можно увидеть шесть отчетливых пиков (нумерация пиков выполнена в порядке возрастания температуры):
Пик 1 при 150–175 °С появляется только в случае, если в композиции есть ТМДЭТА. Его наличие может быть связано как с разложением ТМДЭТА на этилендиамин и формальдегид, так и с сублимацией ТМДЭТА.
Пик 2 при 290–310 °С появляется при наличии в составе ПЛА. Температура отрыва 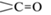 -групп ПЛА составляет 270 °С, поэтому данный пик однозначно может быть отнесен к ПЛА
[27].
-групп ПЛА составляет 270 °С, поэтому данный пик однозначно может быть отнесен к ПЛА
[27].
Наличие пиков 3–6 на всех изображениях позволяет сделать вывод об их принадлежности к ДСТ.
Пик 3 при 380 °С является самым стабильным пиком. Он не смещается и почти не изменяется в разных композициях. Можно предположить, что этот пик связан с выделением стирола-мономера, причем статистически присоединенного к ПБ (который обязательно присутствует в ДСТ), и разложением стирол-бутадиенового статистического сополимера, преобладающего у границ ПС-блоков макромолекул ДСТ и содержащего преимущественно структуру 1,2-ПБ.
Пик 4 при 420 °С представляет собой левое плечо самого большого пика (пика 5). Учитывая принадлежность пика 5 к структуре транс-1,4-ПБ (см. ниже), и то, что температура деструкции цис-изомеров ниже, чем транс-изомеров, пик 4 следует отнести к структуре цис-1,4-ПБ.
Пик 5 при 450 °С наиболее интенсивен и потому соответствует структуре 1,4-транс-ПБ, поскольку именно она является преобладающей в ДСТ.
Пик 6 при 480–500 °С соответствует разложению ПС-блоков ТЭП как самых термостойких. Уширение пика объясняется большим количеством конкурирующих процессов разложения.
При сравнении кривых ДТГА для систем ДСТ, ДСТ/ПЛА и ДСТ/ПЛА + ТМДЭТА (рис. 7а, б, в) можно отметить, что при введении ТМДЭТА появляется пик 1, очевидно, относящийся к фазовому переходу ТМДЭТА, а также наблюдается уменьшение пиков 3–6, что говорит о стабилизирующем действии ТМДЭТА по отношению к ДСТ. Изменение пика 2 при этом практически незаметно.
Добавление ПЛА в ДСТ (рис. 7а, б) также вызывает существенные изменения. Появляется пик 2, который может быть отнесен к деструкции ПЛА. При этом происходит снижение температуры начала разложения с 355 до 290 °С. Наблюдается снижение скорости деструкции ПС (пики 3 и 6), по-видимому, за счет взаимодействия ПЛА с блоками ПС. Следует отметить смещение пика 6 по температуре от 525 °С в ДСТ до 510 °С в ДСТ/ПЛА.
Таким образом, ПЛА действительно распределяется в ДСТ преимущественно у блоков ПС. Учитывая термодинамическую несовместимость ПЛА и ПС, а также заметное уменьшение пика 3, относящегося к границам ПС-блоков в присутствии ПЛА, можно предположить, что частицы ПЛА распределяются в эластомерной фазе, а именно в среде статистического бутадиен-стирольного сополимера у границ ПС-блоков.
При добавлении ДСДМАХ (рис. 7г) происходит смещение пика 2 в сторону высоких температур, благодаря чему происходит увеличение его интенсивности. Несмотря на то, что пик 3 почти не смещается по температуре, его интенсивность также увеличивается. Данные изменения можно объяснить тем, что ДСДМАХ стабилизирует ПЛА, причем при увеличении температуры стабилизирующее действие снижается, вызывая тем самым интенсивное начало разложения ПЛА.
Левое плечо 4 большого пика 5 стало малозаметным, а сам пик 5 значительно уменьшился. Уменьшение интенсивности разложения должно быть связано со стабилизирующим действием ДСДМАХ на ПБ-блоки ДСТ. Предположительно, ДСДМАХ стабилизирует ПС (пик 6 становится ниже), причем ДСДМАХ находится и внутри блоков ПС, изменяя характер деструкции и увеличивая количество реакций разложения, что проявляется в уширении пика. Итак, можно считать, что ДСДМАХ стабилизирует ПЛА, увеличивая температуру его разложения, и стабилизирует ДСТ, снижая скорость деструкции, распределяясь как в ПБ, так и в ПС-блоках. Соединения ТМДЭТА и ДСДМАХ могут распределяться в объеме стеклообразной фазы ПС в отличие от ПЛА, который является высокомолекулярным соединением и обладает поэтому значительно более низкой совместимостью с ПС.
Главным же выводом является то, что ТМДЭТА и ДСДМАХ должны находиться во всех фазах материала, и при нахождении в водной среде будет происходить вымывание (высвобождение) данных агентов из всех фаз, но преимущественно в фазе ПЛА, гидролиз которого будет способствовать вымыванию находящихся в его матрице агентов. Это объясняет увеличение антибактериального действия при совместном введении ПЛА и агентов в ДСТ.
ЗАКЛЮЧЕНИЕ
Таким образом, покрытия на основе ДСТ обладают повышенной стойкостью к образованию биопленок на их поверхности, что достигается путем введения в эластомерную основу биоразлагаемых пластиков совместно с антибактериальными агентами.
Анализ структуры покрытия, данные методов РЭМ, ПМЗ, ТГА, физико-механические исследования показали, что введение антибактериальных агентов в систему ДСТ/ПЛА приводит к их распределению преимущественно в фазе ПЛА, что обеспечивает по отношению к нему стабилизирующий эффект. При гидролизе ПЛА в среде происходит высвобождение антибактериальных агентов. Важную роль в уменьшении адгезии бактерий играет расположение фазы ПЛА в среде ДСТ – вокруг доменов ПС, что подтверждено данными РЭМ, характером зависимостей параметров условной прочности при растяжении, относительного удлинения при разрыве пленок, а также изменения сегментарной подвижности от содержания ПЛА в ДСТ и данными, полученными методом ТГА.
Локализация ПЛА в ДСТ способствует снижению стойкости ДСТ к гидролизу, поэтому даже добавление 5 мас.% ПЛА уменьшает вероятность адгезии бактерий, что можно объяснить эффектом самоочищения материала. При введении антибактериальных агентов происходит ускорение их высвобождения за счет локализации в фазе гидролизующейся компоненты, что полностью предотвращает адгезию бактерий даже при повторном контакте. Поэтому для получения материалов, невосприимчивых к колониеобразованию, следует применить комбинированные системы, содержащие биоразлагаемый пластик и антибактериальный и/или антиадгезионный агент.
Авторы выражают сердечную благодарность Ильину Андрею Александровичу за активное участие и помощь, оказанную в работе.
Данное исследование проведено с использованием оборудования Центров коллективного пользования Института биохимической физики им. Эмануэля РАН (Москва) и Института химической физики им. Н.Н. Семёнова РАН (Москва).
Список литературы
Современная микробиология. Прокариоты. В 2-х т. Пер. с англ. / Под ред. Ленгелер Й., Древс Г., Шлегель Г. и др. Т. 1. М.: Мир, 2012.
Современная микробиология. Прокариоты. В 2-х т. Пер. с англ. / Под ред. Ленгелера Й., Древса Г., Шлегеля Г. и др. Т. 2. М.: Мир, 2012.
Тейлор Д., Грин Н., Стаут У. Лаборатория знаний. Биология в 3 т. / Пер. с англ. Т. 1. М.: Бином, 2015; ISBN 5-03-003687-3
Нетрусов А.И., Котова И.Б. Микробиология. Университетский курс. М.: Издат. центр “Академия”, 2012.
Великанов Н.Л., Корягин С.И., Наумов В.А. // Технико-технологич. пробл. сервиса. 2015. № 2(32). С. 20.
Сауткина Т.Н., Калякин А.М., Чеснокова Е.В., Хурчакова А.А. // Науч. тр. SWorld. 2013. Т. 35. № 4. С. 49.
Труфакина Л.М. // Вода: химия и экология. 2011. № 9. С. 92.
Свалова М.В., Гринько Е.А., Ходова Е.А. // Вестн. ИжГТУ им. М.Т. Калашникова. 2013. № 1. С. 143.
Сиденко В.П., Кузнецов О.В., Приказюк A.M. // Актуальные проблемы транспортной медицины. 2009. № 1(15). С. 116; ISSN: 1818-9385
Поздеев О.К. Медицинская микробиология М.: ГЭОТАР-Медиа, 2010.
Зверев В.В., Бойченко М.Н. Медицинская микробиология, вирусология и иммунология. В 2-х т. Т. 1. М.: ГЭОТАР-Медиа, 2010.
Biering-Sorensen F. // Curr. Opin. Urol. 2002. V. 12. P. 45.
Matsumoto T., Takahashi K., Manabe N. et al. // Intern. Antimicrob. Agents. 2001. V. 17. P. 293.
Tiller J.C. // Adv. Polym. Sci. 2011. V. 240. P. 193.
Rojas I.A., Slunt J.B., Grainger D.W. // J. Controlled Release. 2000. V. 63. Issue 1–2. P. 175.
Daugherty A.L., Mrsny R.J. // Adv. Drug Delivery Rev. 2006. V. 58. Issue 5–6. P. 686.
Simchi A., Tamjid E., Pishbin F., Boccaccini A.R. // Nanomedicine: Nanotechnology, Biology and Medicine. 2011. V. 7. Issue 1. P. 22.
Il'in A.A., Lyusova L.R., Shibryaeva L.S., Makarov O.V. // Polym. Sci. Ser. D. 2017. V. 10. № 3. P. 260. https://doi.org/10.1134/S1995421217030054
Shibryaeva L.S., Makarov O.V., Andryukhin M.I., Lyusova L.R., Il’in A.A. // Polym. Sci. Ser. D. 2015. V. 8. № 1. C. 75. https://doi.org/10.1134/S1995421215010128
Люсова Л.Р., Ильин А.А., Ковалева А.Н. и др. Состав эластичного антибактериального материала: Патент на изобретение. RU 2629603 // Б.И. 2017. № 25. С. 7.
Nill P., Loeffler R., Kern D.P., Goehring N., Peschel A. // Proc. 36th Intern. Conf. Micro & Nano Engineering. Amsterdam, 2011. P. 178.
Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. М.: Химия, 1973.
Кулезнев В.Н. Смеси и сплавы полимеров. СПб.: Научные основы и технологии, 2013.
Rubber Technology. Thermoplastic Elastomers / Ed. Morton. M. Dordrecht: Springer Science & Business, 2013; ISBNs: 978-9-40-172925-3
Карпова С.Г., Ольхов А.А., Бакиров А.В. и др. // Хим. физика. 2018. Т. 37. № 2. С. 64; https://doi.org/10.7868/S0207401X18020097
Карпова С.Г., Ольхов А.А., Тюбаева П.М. и др. // Хим. физика. 2019. Т. 38. № 3. С. 37; https://doi.org/10.1134/S0207401X19030038
Краткий справочник физико-химических величин / Под ред. Мищенко К.П., Равделя А.А. Л.: Химия, 1974.
Ломакин М.С., Шаулов А.Ю., Коверзанова Е.В. и др. // Хим. физика. 2019. Т. 38. № 4. С. 74; https://doi.org/10.1134/S0207401X19040083
Кузнецова А.В., Иванов В.Б., Родионова О.Е., Померанцев А.Л. // Хим. физика. 2020. Т. 39. № 12. С. 74; https://doi.org/10.31857/S0207401X20120080
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика



