Химическая физика, 2023, T. 42, № 2, стр. 60-65
Исследование взаимодействия в системе Ni(NO3)2 ∙ 6H2O – C6H12N4 методами дифференциального термического анализа и термогравиметрии
А. С. Арзуманян 1, Н. Г. Амирханян 1, Е. Г. Григорян 1, *, С. Л. Харатян 1
1 Институт химической физики им. А.Б. Налбандяна Национальной Академии наук Республики Армения
Ереван, Армения
* E-mail: yeva.grig@gmail.com
Поступила в редакцию 22.02.2022
После доработки 17.05.2022
Принята к публикации 20.05.2022
- EDN: IWHXEM
- DOI: 10.31857/S0207401X23020036
Аннотация
В работе представлены результаты исследований одной из распространенных систем в синтезе при горении растворов: Ni(NO3)2 · 6H2O (гексагидрат нитрата никеля) – C6H12N4 (гексаметилентетрамин) с применением методов ДТА/ТГ, РФА и сканирующей электронной микроскопии. Указанная система изучена в виде порошковой смеси, геля, полученного путем растворения исходных реагентов в дистилированной воде, и того же геля, прошедшего термическую обработку при 100 °C. Установлено, что образование металлического никеля возможно лишь в том случае, если смесь реагентов предварительно переводится в состояние геля. Проведен расчет значений эффективных энергий активации процессов образования NiO и металлического никеля и представлены особенности протекания взаимодействий в зависимости от метода приготовления исследуемых образцов.
ВВЕДЕНИЕ
В течение последних лет метод синтеза при горении растворов (СГР, solution combustion synthesis) приобретает все более широкое применение как новый метод получения наноразмерных материалов, применяемых в сфере катализа, разработки топливных элементов, биотехнологии и т.д. [1–6]. Метод СГР основан на экзотермической самораспрoстраняющейся реакции, которая протекает в насыщенном растворе металлсодержащего окислителя (как правило, нитрата металла) и горючего, какими являются водорастворимые органические соединения: амины, кислоты, аминокислоты и т.д. [7, 8]. При нагреве подобного раствора до определенной температуры, которая в зависимости от системы в среднем не превышает 400–450 °С, происходит разложение компонентов системы (нитрата и органического горючего) и инициируется самораспространяющаяся экзотермическая реакция, сопровождающаяся выделением большого количества газообразных продуктов. Главные особенности данного метода, заключающиеся в следующем: исходные вещества перемешиваются в растворе на молекулярном уровне, а также выделяется большое количество газообразных продуктов, позволяют в качестве твердых продуктов реакции получать наноразмерные материалы [3–6]. Как правило, это оксиды металлов [9, 10], однако при достаточном количестве горючего возможно и восстановление соответствующего металла [11–13].
Несмотря на распространенность и потенциал метода СГР для современного материаловедения, изучению кинетики и механизма процессов синтеза в литературе посвящено немного исследований. Это обычно объясняется протеканием этих процессов при высоких скоростях нагрева вещества в реакционной зоне, что создает определенные трудности для их исследования. С целью преодоления возникших затруднений исследования процессов СГР можно проводить в более мягких, управляемых условиях с применением методов термического анализа [14–17] в сочетании с рентгенофазовым анализом и сканирующей электронной микроскопией.
В данной работе представлены результаты исследований системы гексагидрат нитрата никеля Ni(NO3)2 · 6H2O (далее – ГГНН) – гексаметилентетрамин C6H12N4 (далее – ГМТА) методами дифференциального термического анализа (ДТА) и термогравиметрии (ТГ). Исследованы фазовый состав и микроструктура продуктов превращения.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследованы три различных типа образцов вышеназванной системы: I – механическая смесь порошков исходных реагентов, II – гель, III – гель II после термической обработки при 100 °C в течение 24 ч (далее – “просушенный гель”). Такое изучение позволило сформировать представление об особенностях протекания процесса в зависимости от метода подготовки образцов.
Исследования проводили на дериватографе Q-1500D фирмы “MOM” (Венгрия), подключенной к персональному компьютеру через DTA/DTG-контроллер, позволяющий проводить оцифровку сигналов посредством десятиразрядного АЦП и управление температурными режимами дериватографа. Полученные данные обрабатывались программой DTA-DTG.exe. (DTA/DTG-контроллер и программа DTA-DTG.exe разработаны в лаборатории Макрокинетики твердофазных реакций ИХФ НАН Армении).
С целью изучения влияния неизотермичности на поведение исследуемых образцов в относительно широком диапазоне скоростей нагрева проведено расширение возможностей вышеупомянутого дериватографа по скорости нагрева исследуемых образцов с помощью увеличения электрической мощности нагревателя. Таким образом обеспечивается нагрев исследуемых образцов с постоянной скоростью нарастания температуры, достигающей 50 °С/мин, по сравнению с имеющимся ранее максимальным значением, равным 20 °С/мин. Следует отметить, что, несмотря на увеличение скорости нарастания температуры, нагрев исследуемых образцов происходит в условиях отсутствия температурного градиента в образце. Таким образом, сохраняется одно из основных требований в термическом анализе. Безградиентный нагрев исследуемых образцов в новом расширенном диапазоне скоростей нагрева был подтвержден путем нагрева термографического стандартного вещества (СаСО3) и сопостовления ДТА/ТГ-кривых с полученными в стандартном диапазоне скоростей нагрева: были зарегистрированы близость температурных интервалов и совпадение формы отклонения термических эффектов на кривых ДТА/ТГ/ДТГ.
Эксперименты проводили в условиях линейного нагрева исследуемых образцов с различными скоростями нагрева (5, 10, 20, 30, 50 °С/мин) в потоке азота (скорость потока – 2 мл/с) с использованием стандартных корундовых тиглей цилиндрической формы. При подготовке исследуемых образцов использовали следующие реагенты: ГГНН производства компании Alfa Aesar (Germany) с чистотой 98% и ГМТА производства компании Sigma-Aldrich (USA) с чистотой 99%. Чистота азота – 99.97%.
Состав исследуемых образцов был подобран исходя из результатов предварительных исследований, проведенных для реализации синтеза при горении раствора ГГНН и ГМТА, где оптимальное мольное соотношение между реагентами, приводящее к образованию металла, составляло 1 : 0.1.
Исследуемые образцы были приготовлены тремя различными способами:
I. Механическую смесь готовили путем перемешивания исходных порошкообразных реагентов ГГНН и ГМТА в мольном соотношении 1 : 0.1 в агатовой ступке в течение 15 мин.
II. Гель ГГНН/ГМТА был получен путем перемещивания исходных реагентов с небольшим количеством воды.
III. “Просушенный гель” ГГНН/ГМТА, полученный путем подсушивания полученного геля II при температуре 100 °С в течение 24 ч.
Заранее взвешенные образцы (∼50 и 100 мг) помещали в тигель и нагревали с постоянной скоростью. Предварительно изучали поведение как ГГНН, так и ГМТА в аналогичных условиях нагрева.
По завершению превращений проводили рентгенофазные (дифрактометр ДРОН-3.0 с Cu(Kα)-излучением, работающий при 25 кВ и 10 мА; Буревестник, Россия) и микроскопические (сканирующий электронный микроскоп Prisma E с энергодисперсионным анализатором, EDS производства компании Thermo Fisher Scientific (USA)) исследования продуктов. С этой целью охлаждение образцов до комнатной температуры осуществляли в потоке азота.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ДТА/ТГ-исследование ГГНН и ГМТА
На рис. 1 приведены результаты ДТА/ТГ-исследования процессов разложения ГГНН и ГМТА. Нагрев ГМТА со скоростью 20 °/мин сопровождается его эндотермическим превращением в температурном интервале от 190 до 320 °С, в результате чего ГМТА полностью разлагается на газообразные продукты (кривые ДТА-1 и ТГ-1, рис. 1), как это описано в работе [18].
Согласно форме кривых ДТА-2 и ТГ-2, приведенных на рис. 1, при нагреве ГГНН, начиная с 130 °С, наблюдается ряд последовательных эндотермических стадий, сопровождающихся потерей массы образца. Согласно литературным данным [19], этим превращениям сопутствуют стадийная дегидратация ГГНН до образования Ni(NO3)2 · 2H2Օ и затем процесс превращения последнего с образованием NiՕ в температурном интервале 310–380 °С. Образование NiՕ в качестве конечного продукта процесса разложения ГГНН в указанных условиях подтверждается методом ТГ (рис. 1, кривая ТГ-2), так как количество продукта реакции (~25% от исходного ГГНН) примерно соответствует содержанию NiՕ в исходном ГГНН (25.7%).
Дериватографическое исследование механической смеси порошков ГГНН/ГМТА
На рис. 2 приведены результаты дериватографического исследования механической смеси Ni(NO3)2 · 6H2O + 0.1 ГМТА, где на ТГ- и ДТГ-кривых наблюдаются три последовательные стадии, сопровождающиеся убылью массы. На кривой ДТА регистрируются две эндотермические стадии превращения в температурных интервалах 110–270°C и 310–380 °C соответственно. Сравнивая приведенные данные с результатами, полученными при нагреве ГГНН в аналогичных условиях (рис. 1, кривые ДТА-2, ТГ-2), можно заключить, что в данной смеси реагентов протекает процесс разложения компонента смеси ГГНН, так как совпадают температурные интервалы превращений. С другой стороны, по окончании превращения регистрируемое на кривой ТГ количество вещества (28 мг или 28% от исходной массы) примерно соответствует количеству NiO в исходной смеси (∼25%). Следует отметить также, что стадия разложения ГМТА, протекающая в температурном интервале от 190 до 320 °С (рис. 1, кривая ДТА-1), предположительно проявляется на кривой ДТГ (рис. 2) в температурном интервале 255–270 °С в виде небольшого отклонения, так как ГМТА присутствует в смеси в достаточно малом количестве (4.6%).
Дериватографическое исследование геля ГГНН/ГМТА
Согласно результатам дериватографического исследования геля ГГНН + 0.1 ГМТА в данной системе имеет место двухстадийное превращение (рис. 3, кривая ДТА). Наличие воды-растворителя в исследуемом образце, использованной для получения геля ГГНН/ГМТА, обуславливает начало первой стадии превращения еще при температуре 60 °С. До температуры 200 °С из исследуемого образца удаляется как вода-растворитель, так и частично кристаллическая вода, входящая в состав ГГНН (рис. 3, кривые ТГ, ДТГ). За этой стадией, в отличие от случая с порошковой смесью реагентов ГГНН/ГМТА, непременно следует экзотермическое превращение в температурном интервале 200–250 °С. Оно сопровождается убылью массы и согласно термогравиметрическому анализу по завершении стадии количество вещества составляет 23.7% от исходной массы смеси. Учитывая, что содержание элементарного никеля в исходном веществе составляет 19.3%, на этой стадии имеет место экзотермический процесс, предположительно приводящий к восстановлению никеля на 94.5%. Зарегистрированное количество вещества, составляющее 23.7% от массы исходной смеси, указывает на ~80%-ное содержание металлического никеля в продукте.
Дериватографическое исследование “просушенного геля” ГГНН/ГМТА
В отличие от предыдущих двух систем при нагреве “просушенного геля” ГГНН + 0.1 HMTA наблюдается всего одна экзотермическая стадия превращения, сопровождающаяся убылью массы в температурном интервале 180–240 °С (рис. 4). По завершении превращения количество продукта составляет 21% от массы исходного вещества (рис. 4, кривая ТГ), тогда как содержание элементарного никеля в исходном веществе составляет 19.3%. Это предполагает восстановление никеля на 98%, т.е. продукт превращения на 92% состоит из металлического никеля.
Рис. 4.
Дериватограмма “просушенного геля” ГГНН + + 0.1 ГМТА в потоке азота; m = 100 мг, V = 20 °С/мин.

Температура начала превращения, как и в случае с гелем ГГНН/ГМТА, близка к температуре разложения ГМТА (рис. 1, кривая 1). Следовательно, можно предположить, что в реакцию восстановления вступают продукты разложения ГМТА.
Рентгенофазовый и микроструктурный анализ продуктов превращения
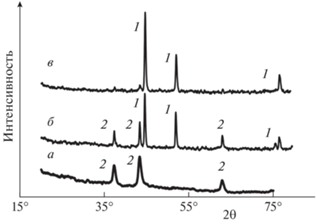
Результаты рентгенофазового анализа (РФА), которые были получены для продуктов превращений в системах механическая смесь ГГНН/ГМТА, гель ГГНН/ГМТА и “просушенный гель” ГГНН/ГМТА приведены на рис. 5. Согласно исследованиям в продукте превращения механической смеси ГГНН/ГМТА обнаруживается лишь оксид никеля NiO (рис. 5, кривая a), что подтверждает отсутствие процесса восстановления Ni в изученной системе. Между тем продукт превращения геля ГГНН/ГМТА состоит в основном из металлического никеля с определенным количеством оксида никеля NiO (рис. 5, кривая б), тогда как продукт превращения “просушенного геля” ГГНН/ГМТА представляет собой преимущественно металлический никель (рис. 5, кривая в). Данные локального рентгенспектрального анализа (EDS) приведены в табл. 1.
Расчет эффективной энергии активации
Исследования вышеуказанных образцов проводились также при различных скоростях нагрева (5, 10, 20, 25, 50°С/мин). Известно, что скорость нагрева влияет на температурный интервал протекания взаимодействий, сдвигая его в сторону более высоких значений температур при увеличении скорости нагрева [20]. Соответственно, с увеличением скорости нагрева в сторону более высоких значений смещается и значение температуры, соответствующее максимальному отклонению на кривой ДТА $\left( {T_{{max}}^{{{\text{DTA}}}}} \right),$ характеризующему тепловой эффект. Описанное явление лежит в основе метода Киссинджера [21], используемого для расчета кинетических параметров в неизотермическом анализе.
По методу Киссинджера значение эффективной энергии активации рассчитывается на основе результатов экспериментов, проведенных при различных скоростях нагрева V (°С/мин), исходя из прямолинейной зависимости ln$\left( {\frac{V}{{{{{\left( {T_{{max}}^{{{\text{DTA}}}}} \right)}}^{2}}}}} \right)$ от $\left( {\frac{1}{{T_{{max}}^{{{\text{DTA}}}}}}} \right){\text{:}}$
На рис. 6 на примере двух систем: геля ГГНН/ГМТА и “просушенного геля” ГГНН/ГМТА, продемонстрирован расчет эффективных значений энергий активации процессов восстановления никеля гексаметилентетрамином в исследуемых образцах. Рассчитанные значения энергий активации исследованных процессов приведены в табл. 2 (расчетные данные приводятся с точностью ±1 ккал/моль). Согласно приведенным данным процесс превращения отдельного ГГНН и процесс превращения, протекающий в порошковой смеси ГГНН + ГМТА, характеризуются достаточно близкими значениями энергии активации: 23.9 и 22.6 ккал/моль соответственно. Как уже было отмечено, эти превращения происходят в одном и том же температурном интервале и соответствуют образованию NiО согласно данным гравиметрического, рентгенофазового анализов и микроскопии. Близкие значения энергии активации были получены и авторами работ [22, 23], в которых изучен процесс разложения ГГНН в неизотермических условиях.
Рис. 6.
Расчет эффективных значений энергий активации процессов восстановления никеля гексаметилентетрамином в исследуемых образцах геля (кривая 1) и “просушенного геля” (кривая 2).

Таблица 2.
Рассчитанные значения энергий активации исследованных процессов
| Исследованный образец | Eа, ккал/моль |
|---|---|
| Ni(NO3)2 ⋅ 6H2O | 23.9 |
| Механическая смесь ГГНН/ГМТА | 22.6 |
| Гель ГГНН/ГМТА | 19.7 |
| “Просушенный гель” ГГНН/ГМТА | 19.3 |
С другой стороны, близкими значениями энергии активации описываются и превращения в системах гель ГГНН/ГМТА и “просушенный гель” ГГНН/ГМТА (19.7 и 19.3 ккал/моль соответственно), приводящие к образованию металлического никеля, обнаруженного в продуктах реакции в результате сопоставления результатов термогравиметрического и рентгенофазового анализов, а также зафиксированного с помощью анализа элеметного состава образца.
Анализ и сопоставление полученных выше результатов позволяет предположить, что восстановление никеля из ГГНН в описанных выше условиях происходит в том случае, когда смесь реагентов предварительно переводится в состояние геля. Это обусловлено тем, что в подобных системах металлсодержащий окислитель (в данном случае – нитрат металла) и горючее, каковым в изученной системе является ГМТА, при переходе в состояние геля, согласно работам [24–28], образуют координационные комплексные соединения, высвобождающие металл в процессе экзотермического разложения. В частности, в работе [25] выделено и изучено комплексное соединение нитрата никеля с ГМТА и установлен механизм экзотермического разложения последнего.
Близость полученных значений эффективной энергии активации, рассчитанных по методу Киссинджера для образцов гель ГГНН/ГМТА и “просушенный гель” ГГНН/ГМТА, подтверждает, что в обоих случаях речь идет об одном и том же процессе, т.е. об образовании никеля в результате экзотермического превращения, что подтверждается также фазовым составом продуктов взаимодействия (рис. 5).
Немаловажен и тот факт, что температура разложения комплексного соединения, образующегося в системе ГГНН/ГМТА при переходе в состояние геля, близка по значению к температуре разложения ГМТА – горючего-восстановителя. Таким образом, температура разложения образованного комплекса, а следовательно, и температурный интервал образования металла обусловлены температурой разложения входящего в состав комплекса ГМТА.
ВЫВОДЫ
1. Методом дифференциально-термического анализа изучены особенности протекания термических превращений в системе Ni(NO3)2 · 6H2O – C6H12N4 в зависимости от метода подготовки исследуемых образцов: порошковой смеси компонентов системы, геля ГГНН/ГМТА и “просушенного геля” ГГНН/ГМТА.
2. Установлено, что образование металлического никеля возможно лишь в том случае, если смесь реагентов предварительно переводится в состояние геля через стадию образования комплексного соединения ГГНН + ГМТА.
3. Рассчитаны эффективные значения энергий активации образования никеля и NiO в системе ГГНН/ГМТА.
Список литературы
Wena Wei, Wu Jin-Ming // RSC Adv. 2014. V. 4. P. 58 090; https://doi.org/10.1039/C4RA10145F
Mukasyan A.S., Dinka P. // Intern. J. SHS. 2007. V. 16. P. 23; https://doi.org/10.3103/S1061386207010049
Manukyan Kh.V., Cross A., Roslyakov S. et al. // J. Phys. Chem. C. 2013. V. 117. P. 24417; https://doi.org/10.1021/jp408260m
Varma A., Mukasyan A.S., Rogachev A.S., Manukyan K.V. // Chem. Rev. 2016. V. 23. P. 14493; https://doi.org/10.1021/acs.chemrev.6b00279
González-Cortés S.L., Imbert F.E. // Appl. Catal. A: 2013. V. 452. P. 117; https://doi.org/10.1016/j.apcata.2012.11.024
Khort A., Roslyakov S., Loginov P. // Nano-Struct. Nano-Objects. 2021. V. 26. 10072https://doi.org/10.1016/j.nanoso.2021.100727
Aruna S.T., Mukasyan A.S. // Combust. Synth. Nanomater. Curr. Opin. Sol. St. Mater. Sci. 2008. V. 12. P. 44; https://doi.org/10.1016/j.cossms.2008.12.002
Patil K.C., Aruna S.T., Mimani T. // Combust. Synthesis: An Update. Curr. Opin. Sol. St. Mater. Sci. 2002. V. 6. P. 507; https://doi.org/10.1016/S1359-0286(02)00123-7
Deshpande K., Mukasyan A.S., Varma A. // Chem. Mater. 2004. V. 16. P. 4896; https://doi.org/10.1021/cm040061m
Carlos E., Martins R., Fortunato E., Branquinho R. // Chem. Eur. J. 2020. V. 26. P. 9099; https://doi.org/10.1002/chem.202000678
Erri P., Nader J., Varma A. // Adv. Mater. 2008. V. 20. P. 1243; https://doi.org/10.1002/adma.200701365
Kumar A., Wolf E.E., Mukasyan A.S. // AIChE J. 2011. V. 57. P. 3473; https://doi.org/10.1002/aic.12537
Yermekova Z., Roslyakov S.I., Kovalev D.Y. et al. // J. Sol-Gel Sci. Technol. 2020. V. 94. P. 310; https://doi.org/10.1007/s10971-020-05252-9
Тертышная Ю.В., Подзорова М.В., Монахова Т.В., Попов А.А. // Хим. физика. 2019. Т. 38. № 3. С. 80; https://doi.org/10.1134/S0207401X19030105
Ушакова Т.М., Старчак Е.Е., Гостев С.С. и др. // Хим. физика. 2020. Т. 39. № 5. С. 66; https://doi.org/10.31857/S0207401X2005012X
Захаров В.В., Чуканов Н.В., Шилов Г.В. и др. // Хим. физика. 2021. Т. 40. № 7. С. 35; https://doi.org/10.31857/S0207401X21070128
Перова А.Н., Бревнов П.Н., Усачёв С.В. и др. // Хим. физика. 2021. Т. 40. № 7. С. 49; https://doi.org/10.31857/S0207401X21070074
Gusev E.A., Dalidovich S.V., Krasovskaya L.I. // Thermochim. Acta. 1985. V. 93. P. 21; https://doi.org/10.1016/0040-6031(85)85006-1
Brockner W., Ehrhardt C., Gjikaj M. // Ibid. 2007. V. 456. P. 64; https://doi.org/10.1016/j.tca.2007.01.031
Григорьян Е.Г., Ниазян О.М., Харатян С.Л. // Хим. физика. 2008. Т. 27. № 9. С. 54.
Kissinger H.E. // Anal. Chem. 1957. V. 29. P. 1702; https://doi.org/10.1021/ac60131a045
Mansour S. // Thermochim. Acta. 1993. V. 228. P. 173; https://doi.org/10.1016/0040-6031(93)80287-K
Dollimore D., Gamlen G.A., Taylor T.J. // Ibid. 1981. V. 51. P. 269; https://doi.org/10.1016/0040-6031(81)85164-7
Amirkhanyan N., Kharatyan S., Manukyan Kh., Aprahamian A. // Combust. and Flame. 2020. V. 211. P. 119; https://doi.org/10.1016/j.combustflame.2020.07.038
Afanasiev P., Chouzier S., Czeri T. et al. // Inorg. Chem. 2008. V. 47. P. 2303; https://doi.org/10.1021/ic7013013
Prakash A.S., Khadar A.M.A., Patil K.C. et al. // J. Mater. Synth. Process. 2002. V. 10. P. 135; https://doi.org/10.1023/A:1021986613158
Afanasiev P. // Inorg. Chem. 2002. V. 41. P. 5317; https://doi.org/10.1021/ic025564d
Singh G., Baranwal B.P., Kapoor I.P.S. et al. // J. Therm. Anal. Calorim. 2008. V. 91. P. 971; https://doi.org/10.1007/s10973-007-8615-5
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика