Химическая физика, 2023, T. 42, № 7, стр. 33-40
Исследование кинетики полимеризации L-лактида в присутствии Ti(Tbse)2 методом дифференциальной сканирующей калориметрии
С. С. Москвичев 1, 2, *, П. В. Дмитряков 1, Н. Г. Седуш 1, 3, С. Н. Чвалун 1, 3
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
3 Институт синтетических полимерных материалов им. Н.С. Ениколопова Российской академии наук
Москва, Россия
* E-mail: ssmoskv03@mail.ru
Поступила в редакцию 30.05.2022
После доработки 12.07.2022
Принята к публикации 20.07.2022
- EDN: YCIPHG
- DOI: 10.31857/S0207401X23070129
Аннотация
Полилактид – биоразлагаемый полимер, который с каждым годом все более активно применяется при производстве медицинских изделий и экологолически безопасной упаковки. Актуальной задачей является поиск новых катализаторов для синтеза полилактида, которые не содержат токсичного олова и обеспечивают получение полимера с контролируемым комплексом свойств. В представленной работе синтезирован и охарактеризован каталитический комплекс на основе титана (IV). Методом дифференциальной сканирующей калориметрии исследована кинетика полимеризации L-лактида в присутствии этого катализатора, определена энтальпия реакции ((–125.1 ± 1.5) Дж/г) и рассчитаны кинетические параметры уравнения Аррениуса (Ea = (95.7 ± 7.5) кДж/моль, ln Aef = 22.7 ± 1.9).
1. ВВЕДЕНИЕ
Полилактид представляет собой биосовместимый и биоразлагаемый алифатический полиэфир, который широко используется в производстве как упаковочных материалов, так и биомедицинских изделий: хирургических нитей, систем доставки лекарств, каркасов для тканевой инженерии и других [1–5]. Высокомолекулярный полилактид синтезируют в основном путем полимеризации лактида с раскрытием цикла [6]. Наиболее распространенным катализатором является 2-этилгексаноат олова. Это соединение характеризуется высокой каталитической активностью и обеспечивает синтез высокомолекулярного полимера, однако в полученном материале присутствуют остатки олова, полностью избавиться от которых затруднительно [7]. Для использования материала в упаковке допускается содержание 2‑этилгексаноата олова в пределах 1 вес.%, но для биомедицинских применений полилактида этот показатель гораздо ниже – 200 ppm. В связи с этим актуальной задачей является поиск не содержащих олова катализаторов полимеризации лактида с раскрытием цикла.
В последнее время в качестве катализаторов предложены металлические комплексы на основе алюминия [8], магния [9], лития [10], кальция [11], индия [12], цинка [13], циркония [14], иттрия [15] и железа [16]. Направленный дизайн окружающих металл лигандов позволяет изменять свойства металлического центра и предотвращать некоторые побочные реакции (переэтерификация и реакции “back-biting”) [17], а также придавать функциональные свойства материалу, например свойство флуоресценции [18]. Комплексы металлов саленового типа и комплексы, содержащие феноксикетиминовые лиганды, продемонстрировали возможность стереоконтролируемой полимеризации лактида [19].
В качестве катализаторов полимеризации широко используют комплексы титана, например при производстве полиэтилена с контролируемой структурой и молекулярной массой [20]. Недавно сообщалось [21–23], что различные комплексы титана проявляют каталитическую активность и в полимеризации лактида.
В работе [20] изучали кинетические характеристики реакции полимеризации D,L-лактида в присутствии бис(3,5-ди-трет-бутилсалицилальдегид-со-этаноламин)-комплекса титана (IV) Ti(Tbse)2 и бензилового спирта. Реакцию проводили при температуре от 130 до 160 °С в течение 4–24 ч. Максимальная степень конверсии α = 96% достигалась за 26 ч при 160 °С. На основании анализа кинетических кривых были определены частные порядки реакции: первый порядок по катализатору, второй – по мономеру. Были рассчитаны параметры уравнения Аррениуса: энергия активации составила 77 кДж/моль, предэкспоненциальный множитель – 3.3 · 1011 л2 · моль–2 · ч–2.
В работе [24] был синтезирован би-титановый катализатор и исследована кинетика полимеризации D,L-лактида. Показано, что при 160 °С равновесная степень превращения α = 96% достигается за 16 ч. Подтверждено, что реакция полимеризации протекает по третьему порядку: второй порядок по мономеру, первый – по катализатору. Энергия активации составила 96 кДж/моль.
Одним из эффективных методов, позволяющих определять термодинамические и кинетические параметры химических реакций, является метод дифференциальной сканирующей калориметрии (ДСК). Среди прочих методов исследования он выделяется точностью, высокой скоростью и простотой пробоподготовки, что дает возможность изучать протекание быстрых реакций. Этот метод позволяет всего за один эксперимент получить кривую ДСК, а затем и кинетическую кривую процесса полимеризации, в отличие от классического метода отбора проб. С применением метода ДСК нами ранее уже были исследованы кинетические закономерности и определены термодинамические параметры полимеризации лактида в присутствии ряда катализаторов: октоата олова [25], цинк-гуанидинового комплекса [26] и ацетилацетоната циркония [27].
В настоящей работе представлен метод синтеза комплекса Ti(Tbse)2 титана (IV) – катализатора полимеризации лактида. Методом ДСК исследована кинетика полимеризации L-лактида в присутствии Ti(Tbse)2 при различных температурах, рассчитаны параметры уравнения Аррениуса – энергия активации и предэкспоненциальный множитель.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для полимеризации использовали L-лактид производства фирмы “Corbion” (Netherlands), который от примесей воды очищали перекристаллизацией в бутилацетате марки “ОСЧ” производства фирмы “Компонент-Реактив” (Россия), а затем сушили в вакуумном шкафу при комнатной температуре. Для синтеза катализатора использовали 3,5-ди-третбутилсальциловый альдегид производства фирмы “Sigma-Aldrich” (USA), моноэтаноламин (“Sigma-Aldrich”, USA) и изопропоксид титана (“Sigma-Aldrich”, USA). В качестве растворителей использовали абсолютированный этанол (“Sigma-Aldrich”, USA) и толуол марки “ОСЧ” (“Компонент-Реактив”, Россия).
Кинетику полимеризации L-лактида исследовали на дифференциальном сканирующем калориметре компенсационного типа DSC8500 производства компании PerkinElmer (USA) в изотермическом режиме. Реакцию проводили в токе азота (20 мл/мин) при температуре от 145 до 180 °С. Точность определения температуры составляла 0.1 °С. Реакционную смесь готовили следующим образом. Химическую посуду перед использованием прокаливали при 120 °С в вакуумном шкафу. В коническую стеклянную колбу объемом 25 мл вводили 21 ммоль L-лактида, затем – 0.42 ммоль инициатора и тщательно перемешивали шпателем в течение 10 мин. Навеску реакционной смеси помещали в алюминиевый тигель объемом 50 мкл и герметично запечатывали его с помощью пресса. Навески взвешивали на электронных весах SartoriusCPA225D с точностью до 0.01 мг. Запись кривой ДСК включала три этапа. На первом этапе проводили нагревание от 30 до 120 °С со скоростью 20 °С/мин для получения однородного расплава (температура плавления L-лактида составляет 96 °С), затем следовало нагревание от 120 °С до температуры реакции со скоростью 100 °С/мин, и далее процесс шел в изотермическом режиме в течение 6 ч. Герметичность тиглей контролировали путем взвешивания образца после окончания измерения. Обработка экспериментальных данных проведена с помощью пакета прикладных программ термического анализа PyrisSoftwareThermalAnalysis версии 10.1.0.0412 компании Perkin-Elmer.
Строение синтезированного комплекса и степень превращения мономера определяли методом протонного магнитного резонанса с использованием прибора VNMRS 700 производства компании Varian-Agilent (USA) при комнатной температуре и рабочей частоте 700 МГц. Значение конверсии рассчитывали по интегральной интенсивности сигналов CH-групп мономера (δ = 5.06–5.13 м.д.) и полимера (δ = 5.19–5.30 м.д.). Предполагаемое строение титанового комплекса подтверждали методом инфракрасной спектроскопии с использованием комплекса ИК-фурье-спектроскопии Nicolet iS5 (“Thermo Scientific”, USA).
Элементный состав синтезированного катализатора Ti(Тbse)2 анализировали методом сжигания в элементном анализаторе ЕА 1112 (“Thermo Finnigan Italia S.Р.A”, Italian). Продукты сгорания (СО2, Н2О, NO2 и др.) анализировали методом газовой хроматографии (хроматограф газовый 6890N фирмы “Agilent”, USA).
Температурную стабильность комплекса титана оценивали методом термогравиметрического анализа на приборе Pyris 1 TGA (Perkin-Elmer, USA) в динамическом режиме в диапазоне от 30 до 700 °С со скоростью нагрева 10 °С/мин в токе азота частотой 99.999% (100 мл/мин). Использовали стандартный открытый платиновый тигель – держатель образцов. Точность определения температуры 0.1 °С. Точность весов – до 0.001 мг. Обработка экспериментальных данных проведена с помощью пакета прикладных программ термического анализа PyrisSoftwareThermalAnalysis версии 10.1.0.0412 компании Perkin-Elmer.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и характеризация Ti(Tbse)2
Синтетическая последовательность получения титанового комплекса представлена на рис. 1. В основе синтеза лежит описанный в работе [21] метод, который был модифицирован для увеличения выхода основания Шиффа и, как следствие, – целевого продукта.
Рис. 1.
Схема синтеза Ti(Тbse)2 из 3,5-ди-третбутилсальцилового альдегида: 1 – замещенный салициловый альдегид, 2 – основание Шиффа; 3 – изопропоксид титана, 4 – имино-феноксильный комплекс Ti(Тbse)2.
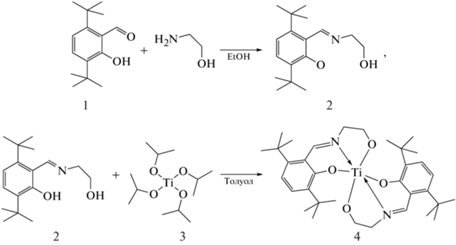
Первая стадия. В трехгорлую колбу добавляли 3,5-ди-трет-бутилсалицилдегид в количестве 25 ммоль и абсолютированный этанол объемом 30 мл. После перемешивания в течение 1 ч по каплям добавляли 25 ммоль моноэтаноламина. Реакционную смесь кипятили при 80 °С с обратным холодильником в токе аргона (1.5 мл/мин) в течение 4 ч, а затем охлаждали до комнатной температуры. Спирт упаривали на роторном испарителе. Продукт желтого цвета (основание Шиффа) кристаллизовали при пониженной температуре и сушили в течение 24 ч при комнатной температуре и пониженном давлении (выход – 95%).
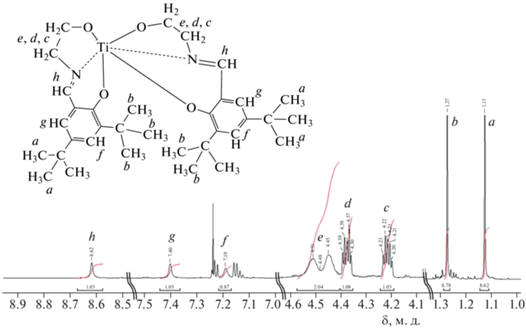
Вторая стадия. К раствору основания Шиффа в количестве 10 ммоль в толуоле объемом 15 мл добавляли 5 ммоль изопропоксида титана в токе аргона (1.5 мл/мин). Смесь перемешивали в течение 24 ч при комнатной температуре. Ярко-желтое твердое вещество получали после удаления толуола при пониженном давлении. Титановый комплекс выкристаллизовывали из раствора гексана (20 мл) при –30 °С (выход – 90%). Структуру полученного комплекса подтверждали методами ЯМР- и ИК-спектроскопии. Спектр ЯМР синтезированного титанового комплекса представлен на рис. 2.
На основании литературных данных о химических сдвигах и смещении электронной плотности [28] было доказано предполагаемое строение Ti(Tbse)2. Стоит отметить, что на спектре различимы сигналы в диапазоне 7.12–7.25 м.д., что говорит о наличии остатков толуола в синтезированном комплексе.
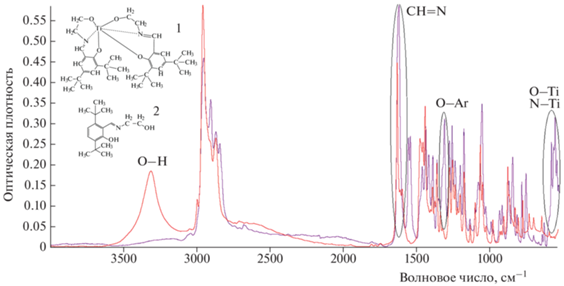
Инфракрасные спектры полученного основания Шиффа и металлического комплекса Ti(Tbse)2 представлены на рис. 3. Полосы при 1620 и 1280 см–1 были отнесены к иминному (–CH=N–) и валентному колебаниям фенольного гидроксила (Ar–O) соответственно. Отсутствие широкой полосы в диапазоне 3100–3500 см–1 подтверждает прямое взаимодействие атомов О с атомом Ti в титановом комплексе (1 на рис. 3), а вновь возникший пик при 550 см–1 свидетельствует об успешной координации между атомами N в основании Шиффа (2 на рис. 3) и атомом Ti в изопропоксиде титана.
Посредством элементного анализа было определено процентное содержание базовых элементов в исходном образце катализатора: C – 67.19%, H – 8.32%, N – 4.69%. Расчетное процентное содержание при этом практически полностью совпадает с экспериментальным: C – 68.21%, H – 8.42%, N – 4.68%.
Термическую стабильность Ti(Tbse)2 оценивали методом термогравиметрического анализа (ТГА). На кривой ТГА видны две стадии деструкции. Первая стадия при 110–140 °С соответствует испарению толуола (0.5%), содержание которого в образце было подтверждено ЯМР-исследованиями. Вторая стадия при 225–350 °С относится к разложению Ti(Tbse)2. Таким образом, было показано, что соединение стабильно до 225 °С. Это позволяет использовать Ti(Tbse)2 в качестве катализатора для полимеризации лактида в расплаве в соответствующем диапазоне температур.
Кривые ДСК для реакции полимеризации L-лактида
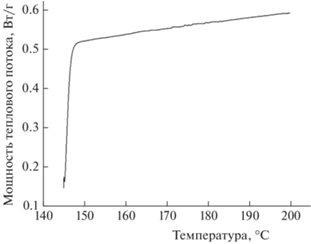
Полимеризация L-лактида с раскрытием цикла – экзотермическая реакция. Каждый акт раскрытия цикла мономера и присоединения к растущей цепи сопровождается выделением тепла, что позволяет исследовать реакцию в ячейке дифференциального сканирующего калориметра. Кривые ДСК (рис. 4) для реакции полимеризации L-лактида в присутствии титанового комплекса получали в изотермическом режиме в интервале температур 145–180 °С. Базовую линию проводили горизонтально, а ее уровень определяли по величине мощности теплового потока после окончания реакции. Площадь пика соответствует тепловому эффекту полимеризации при заданной степени конверсии. Поскольку образующийся в результате реакции поли(L-лактид) характеризуется температурой плавления 170–180 °С, то проведение эксперимента при температуре 145–150 °С может сопровождаться кристаллизацией продукта реакции с выделением тепла. В таком случае на ДСК-кривой будет наблюдаться суммарный тепловой эффект полимеризации и кристаллизации, что затруднит дальнейшую обработку кривых. С целью определения степени кристалличности в продукте реакции, полученном при 145 °С, непосредственно после окончания эксперимента (не охлаждая образец) проводили его анализ методом ДСК в динамическом режиме (от 145 до 220 °С при скорости нагрева 10 °С/мин). Эндотермический эффект плавления обнаружен не был (рис. 5), что исключает возможности кристаллизации продукта в изотермическом процессе. Этот вывод также подтверждается близкими значениями теплового эффекта полимеризации, проведенной как при низких (145 °С), так и при высоких (220 °С) температурах. Таким образом, на ДСК-кривых наблюдается исключительно экзотермический эффект реакции.
Рис. 4.
Кривые ДСК полимеризации L-лактида в изотермическом режиме при разных температурах реакции, °С: 1 – 180, 2 – 170, 3 – 160, 4 – 155, 5 – 150, 6 – 145. Концентрация катализатора – 2 мольн.%.
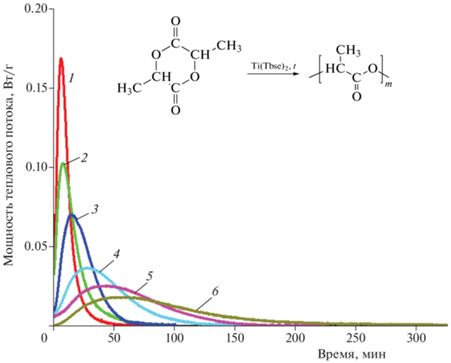
Рис. 5.
Кривая ДСК образца поли(L-лактида), синтезированного при температуре 145 °С. Нагрев инициировали непосредственно после окончания эксперимента по полимеризации, без охлаждения образца. Динамический режим, температурный диапазон – от 145 до 200 °С, скорость нагрева – 10 °С/мин.
Величину энтальпии полимеризации, ΔHα = 100%, соответствующую степени конверсии α = 100%, рассчитывали из отношения теплового эффекта реакции к измеренной величине степени конверсии. Путем усреднения значений энтальпии всех экспериментов было получено значение, равное (–125.1 ± 1.5) Дж/г (табл. 1). В работе [26] экспериментально найденное значение энтальпии довольно близкó и составляет (–131.9 ± 3.5) Дж/г. Конечные значения степени конверсии для всех образцов составляли примерно 96–98%.
Таблица 1.
Термодинамические и кинетические параметры полимеризации L-лактида под действием Ti(Tbse)2
| T, °С | Степень конверсии, % | ΔHα = 100%, Дж/г | n | m | n + m | ln kef |
|---|---|---|---|---|---|---|
| 145 | 97.5 | –123.0 | 1.11 | 0.58 | 1.69 | –3.70 |
| 150 | 97.2 | –124.2 | 1.05 | 0.56 | 1.61 | –3.48 |
| 155 | 96.9 | –124.9 | 1.06 | 0.53 | 1.59 | –3.05 |
| 160 | 96.6 | –125.0 | 1.09 | 0.55 | 1.64 | –2.68 |
| 170 | 96.4 | –126.5 | 1.15 | 0.53 | 1.68 | –2.40 |
| 180 | 95.9 | –127.1 | 1.12 | 0.56 | 1.68 | –1.50 |
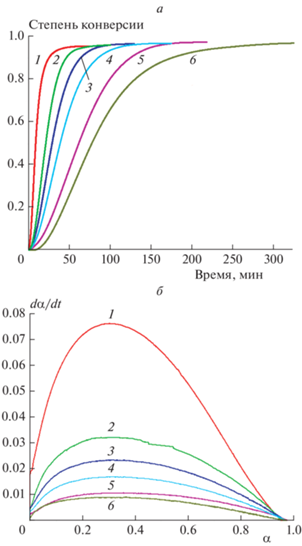
Путем интегрирования кривых ДСК были получены кинетические кривые полимеризации при заданной температуре процесса (рис. 6а). Отсутствие резкого начала на кинетических кривых может быть связано со стерическими трудностями, вызванными объемными лигандами катализатора, замедляющими образование активных центров реакции. Из рис. 6а видно, что с увеличением температуры реакция ускоряется. Например, при 145 °С предельная конверсия достигается через 300 мин, а при 180 °С – уже через 75 мин.
Кинетические параметры полимеризации L-лактида
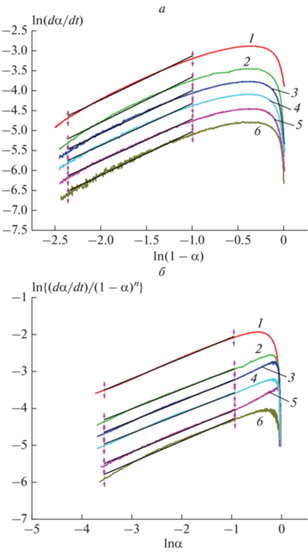
Существующие модели химических реакций могут быть сведены к трем основным типам: ускоряющимся, замедляющимся и сигмоидальным (иногда также называемым автокаталитическими) [29]. Выбор кинетической модели реакции полимеризации предполагает изучение характера зависимости степени конверсии от времени и скорости реакции (dα/dt) от степени конверсии. В случае полимеризации L-лактида под действием Ti(Tbse)2 все интегральные кинетические кривые имеют S-образный характер (рис. 6а), а зависимости dα/dt от степени конверсии проходят через максимум (рис. 6б). Поэтому кинетическое уравнение для скорости полимеризации L-лактида сводится к сигмоидальной модели. Начальная и конечная стадии процесса демонстрируют ускоряющееся и замедляющееся поведение соответственно.
Наиболее общей и универсальной сигмоидальной моделью в полимерной химии [30] является кинетическая модель Сестака и Берггрена [31]:
Значение n может быть определено из тангенса угла наклона зависимости (рис. 7a):
Для определения m и kef выражение для ln(dα/dt) перестраивают в следующее (рис. 7б):
Рис. 7.
Графики зависимости ln(dα/dt) от ln(1–α) – а и ln{(dα/dt)/(1–α)n} от lnα – б для полимеризации L-лактида при температурах от 145 до 180 °С. Обозначения те же, что и на рис. 5.
Таким образом, частный порядок реакции по мономеру (n + m) равен 1.62, а уравнение для скорости реакции полимеризации L-лактида под действием Ti(Tbse)2 согласно сигмоидальной модели приобретает вид
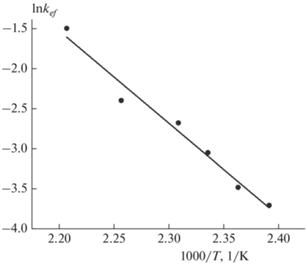
На основании полученных констант скорости (табл. 1) была построена зависимость Аррениуса (рис. 8), по тангенсу угла наклона прямой определена энергия активации Ea, а по ее пересечению с осью ординат – натуральный логарифм эффективного предэкспоненциального множителя, ln Aef:
Величина энергии активации при проведении полимеризации в присутствии наиболее распространенного катализатора 2-этилгексаноата олова заметно ниже: (50 ± 5) кДж/моль [26], (45 ± 5) кДж/моль [27]. Тем не менее можно обеспечить достаточно короткое время реакции и компенсировать недостаток каталитической активности предложенного катализатора путем использования его высокой концентрации, что невозможно в случае оловосодержащих катализаторов из-за их токсичности.
ЗАКЛЮЧЕНИЕ
Модифицированным методом синтеза получен каталитический комплекс Ti(Tbse)2, структура которого подтверждена методами ЯМР, ИК-спектроскопии и элементного анализа. Показана эффективность использования метода ДСК для исследования кинетики полимеризации L-лактида в присутствии Ti(Tbse)2, позволившего непосредственно из эксперимента получить кинетические кривые и значение энтальпии реакции. Определен тепловой эффект полимеризации L-лактида, который составил (–125.1 ± 1.5) Дж/г. Рассчитаны следующие кинетические параметры уравнения Аррениуса: Ea = (95.7 ± 7.5) кДж/моль, ln tAef = 22.7 ± 1.9.
Исследования методами ГПХ, ИК-спектроскопии, ЯМР, ТГА и ДСК проведены в Ресурсных центрах НИЦ “Курчатовский институт”.
Работа выполнена при поддержке внутреннего гранта НИЦ “Курчатовский институт” (приказ № 2755 от 28.10.2021 г.).
Список литературы
Гомзяк В.И., Седуш Н.Г., Пучков А.А., Поляков Д.К., Чвалун С.Н. // Высокомолекуляр. соединения. Б. 2021. Т. 63. № 3. С. 190.
Седуш Н.Г., Кадина Ю.А., Разуваева Е.В. и др. // Росс. нанотехнологии. 2021. Т. 16. № 4. С. 462.
Трофимчук Е.С., Поцелеев В.В., Хавпачев М.А., Москвина М.А., Никонорова Н.И. // Высокомолекуляр. соединения. С. 2021. Т. 63. № 2. С. 190.
Иванова Т.А., Голубева Е.Н. // Хим. физика. 2022. Т. 41. № 6. С. 35.
Попов А.А., Зыков А.К., Масталыгина Е.Е. // Хим. физика. 2020. Т. 39. № 6. С. 71.
Роговина С.З., Алексанян К.В., Владимиров Л.В., Берлин А.А. // Хим. физика. 2019. Т. 38. № 9. С. 39.
Weidner S. M., Kricheldorf H.R. // J. Polym. Sci. Pol. Chem. 2018. V. 56. № 24. P. 2730.
Stanford M.J., Dove A.P. // Chem. Soc. Rev. 2010. V. 39. P. 486.
Chamberlain B.M., Cheng M., Moore D.R. et al. // J. Amer. Chem. Soc. 2001. V. 123. P. 3229.
Kasperczyk J.E. // Macromolecules. 1995. V. 28. P. 3937.
Wheaton C.A., Hayes P.G., Ireland B.J. // Dalton Trans. 2009. № 25. P. 4817.
Myers D., White A.J.P., Forsyth C.M. et al. // Angewandte Chemie. 2017. V. 129. № 19. P. 5361.
Fuchs M., Schmitz S., Schafer P.M. et al. // Eur. Polym. J. 2020. V. 122. P. 109302.
Dobrzynski P. // J. Polym. Sci., Part A: Polym. Chem. 2004. V. 42. P. 1886
Xu T.T.-Q., Yang G.-W., Liu C. et al. // Macromolecules. 2017. V. 50. № 2. P. 515.
Biernesser A.B., Bo Li, Byers J.A. // J. Amer. Chem. Soc. 2013. V. 135. № 44. P. 16553.
Kricheldorf H., Kreiser-Saunders I., Stricker A. // Macromolecules. 2000. V. 33. № 3. P. 702.
Sedush N.G., Izraylit V.V., Mailyan A.K. et al. // Mendeleev Communications. 2017. V. 27. № 3. P. 281.
Hormnirun P., Marshall E.L., Gibson V.C. et al. // J. Amer. Chem. Soc. 2004. V. 126. P. 2688.
Thomas C.M. // Chem. Soc. Rev. 2010. V. 39. P. 165.
Xu T.-Q., Gao W., Mu Y. et al. // Polyhedron. 2007. V. 26. P. 3357.
Press K., Cohen A., Goldberg I. et al. // Angew. Chem. 2011. V. 123. P. 3591.
Hu C., Wang Y., Xiang H. et al. // Polym. Intern. 2012. V. 61. № 10. P. 1564.
Durr C.B., Williams C.K. // Inorg. Chem. 2018. V. 57. № 22. P. 14240.
Li X., Yang B., Zheng H. et al. // PLoS One. 2018. V. 13. № 8.
Sedush N.G., Chvalun S.N. // Europ. Polym. J. 2015. V. 62. P. 198.
Kalinin K.T., Sedush N.G., Dmitryakov P.V. et al. // ChemistryOpen. 2021. V. 9. № 10. P. 1027.
Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. М.: БИНОМ. Лаборатория знаний, 2014.
Vyazovkin S., Burnham A.K., Criado J.M. et al. // Thermochim. Acta. 2011. V. 520. P. 1.
Limwanich W., Punyodom W., Kungwan N., Meepowpan P. // Intern. J. Chem. Kinet. 2015. V. 47. № 11. P. 734.
Sestak J., Berggren G. // Thermochim. Acta. 1971. V. 3. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика