Химия твердого топлива, 2021, № 3, стр. 29-36
ИССЛЕДОВАНИЕ БИОТОПЛИВ МЕТОДОМ ПИРОЛИТИЧЕСКОЙ ГАЗОХРОМАТОГРАФИИ
П. А. Марьяндышев 1, *, А. И. Кангаш 1, **, С. А. Покрышкин 1, ***, В. К. Любов 1, ****, Г. Тувэ 2, *****, А. Брийард 2, ******, Ж.-Ф. Брийак 2, *******
1 Северный (Арктический) федеральный университет имени М.В. Ломоносова,
Кафедра теплоэнергетики и теплотехники
163000 Архангельск, Россия
2 Университет Верхнего Эльзаса, Лаборатория управления рисками и защиты окружающей среды
68200 Мюлуз, Франция
* E-mail: p.marjyandishev@narfu.ru
** E-mail: a.kangash@narfu.ru
*** E-mail: s.pokryshkin@narfu.ru
**** E-mail: vk.lubov@mail.ru
***** E-mail: gwenaelle.trouve@uha.fr
****** E-mail: alain.brillard@uha.fr
******* E-mail: jean-francois.brilhac@uha.fr
Поступила в редакцию 02.07.2020
После доработки 31.07.2020
Принята к публикации 03.02.2021
Аннотация
Исследован процесс термического разложения различных видов биотоплива методом пиролитической газовой хроматографии. Получены хроматограммы для пяти образцов биотоплива, идентифицировано более 40 компонентов, которые были классифицированы в восемь групп. Проведены качественный анализ продуктов пиролиза и сравнение полученных результатов для разных биотоплив.
Биотопливо является перспективным энергетическим ресурсом для преодоления зависимости от ископаемых видов топлива. Оно может использоваться как для производства высококалорийного топлива, так и непосредственно для производства тепловой и электрической энергии при прямом сжигании. Одним из основных наиболее развитых процессов термохимического преобразования биотоплив является процесс пиролиза, который используется с древних времен. Этот процесс включает в себя термическое разложение элементов при заданной температуре в отсутствие воздушной среды. Результатом процесса пиролиза является твердый остаток – биоуголь, конденсируемая органическая часть и не конденсируемые газы. Тем не менее пиролиз рассматривается как процесс сухой перегонки. Более того, следует удалять влагу из биотоплив перед проведением их пиролиза. Процесс сушки требует больших затрат энергии, поэтому возможным топливом для данного процесса является биомасса с наименьшим содержанием влаги. Древесное биотопливо и побочные продукты процесса лесопиления, в виде коры, опилка, щепы, поступающие в топочные устройства котельных агрегатов, имеют высокое содержание влаги, до 60%. Это топливо может быть энергетически утилизировано с использованием процесса гидротермального насыщения углеродом [1–7].
Основная часть сточных вод населенных пунктов, предприятий целлюлозно-бумажной, нефтехимической промышленности и других отраслей очищается биологическими методами, с использованием активного ила. При этом происходит образование большого количества отработанного ила, в результате трансформации части исходных загрязнений в активную биомассу. Утилизация осадка сточных вод (ОСВ) является более трудоемкой задачей, чем непосредственно их очистка, поэтому технологии, позволяющие снизить количество данного отхода, оказываются экономически оправданными и экологически целесообразными [8].
ОСВ представляет собой сложный органо-минеральный комплекс, органическая часть которого представляет собой биомассу и адсорбированные и частично окисленные загрязняющие вещества сточных вод, а также азот- и фосфорсодержащие соединения. Многие специалисты считают, что энергетическое использование осадка сточных вод является практически единственным реальным способом решения такой важнейшей экологической, санитарной и социальной проблемы, как избавление от ОСВ. При этом в большинстве случаев эти отходы относят к биотопливам, имеющим крайне низкую энергетическую ценность. Поэтому исследование процесса пиролиза ОСВ является актуальной задачей.
Торф занимает промежуточное место между возобновляемыми и невозобновляемыми источниками энергии. Он относится к медленно возобновляющимся топливам, так как период его восстановления на месте добычи превышает 200 лет. Выделяющиеся при сжигании торфа газы относятся к парниковым, как и для случая с ископаемым топливом. Однако потребление торфа в РФ намного отстает от его ежегодного естественного прироста, что позволяет, в данных условиях, рассматривать торф как возобновляемый источник энергии.
Аналитический пиролиз, совмещенный с газовой хроматографией, открывает большие возможности для изучения и описания комплексных полимеров, таких как углеводороды и лигнин в биомассе. Данный комплексный метод позволяет получить детальную информацию по молекулярным изменениям и требует малых количеств исследуемых материалов [9]. Более того, он позволяет определить содержания отдельных типов лигнина: S-, G- и H- типов без пересечения с другими составляющими [10].
Пиролитическая газовая хроматография (пиролитическая ГХ-МС) широко используется для изучения процесса пиролиза и выделяющихся во время термического разложения компонентов. Данный метод может быть использован для идентификации состава продуктов пиролиза с использованием библиотек масс-спектров при различных режимах проведения процесса пиролиза [11]. Ряд авторов использовали пиролитическую ГХ-МС для описания процесса термического разложения [12–14], так Шен и соавт. [12] исследовали рисовую шелуху, шелуху грецкого ореха, кукурузный початок, солому и другие виды биомассы. Лианг и соавт. [13] изучали древесину бамбука методами термогравиметрического анализа и пиролитической ГХ-МС. Было установлено, что максимальная потеря массы происходит в диапазоне температур 200–400°С и при повышении температуры термогравиметрическая (ТГ) кривая смещается в диапазон более высоких температур. Так же были установлены основные продукты пиролиза – бензофуран, гликольальдегид, пентанон 2, фуран, уксусная кислота, фенол, вода, метан, СО, СО2, NO, NO2.
Органические компоненты древесины – целлюлоза и гемицеллюлоза в процессе пиролиза разлагаются до сахаров гексоз, пентоз и их производных, включая фураны и легкие (низкомолекулярные) кислородсодержащие компоненты [16–19]. Лигнин разлагается на фенольные компоненты, включая гваякол, катехол и другие фенолы [20, 21]. Эти продукты пиролиза далее подвергаются серии реакций и в конечном итоге образуют ароматические углеводороды [20]. Для примера, в первую очередь, сахара трансформируются в фураны, далее в ароматические углеводороды [22, 23]. Низкомолекулярные продукты пиролиза, такие как кислоты и кетоны, подвергаются реакциям олигомеризации, ароматизации, переносу водорода и бескислородным реакциям, также образуя ароматические углеводороды [20, 24].
Целью данной работы является исследование процесса термического разложения различных видов биотоплива методами пиролитической газохроматографии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В данной работе исследовались образцы гидролизного лигнина, сосны, ели, осадка сточных вод и торфа. Отбор первичных проб исследуемых биотоплив, формирование объединенных проб, их сокращение, измельчение и деление выполнялись в полном соответствии с действующими ГОСТами.
Результаты теплотехнического анализа проб испытуемых биотоплив представлены в табл. 1.
Таблица 1.
Теплотехнические характеристики испытуемых образцов
| Образец | Влажность (W a),% | Зольность (Аа),% | Летучие вещества (V daf),% | Низшая теплота сгорания ($Q_{i}^{a}$), Дж/кг |
|---|---|---|---|---|
| Гидролизный лигнин | 5.43 | 4.44 | 64.40 | 19.54 ‧ 106 |
| Ель | 6.90 | 0.46 | 85.39 | 17.00 ‧ 106 |
| Сосна | 6.80 | 0.34 | 85.68 | 17.61 ‧ 106 |
| Торф | 10.74 | 2.75 | 68.24 | 15.47 ‧ 106 |
| Осадок сточных вод | 5.27 | 2.61 | 76.73 | 21.78 ‧ 106 |
Масса образцов при проведении пиролитической газохроматографии была следующая: осадок сточных вод – 147 мкг, гидролизный лигнин – 134 мкг, сосна – 147 мкг, ель – 152 мкг, торф – 147 мкг.
Навеска пробы подвергалась термическому разложению в среде гелия с использованием пиролизера EGA/PY-3030D (Frontier Lab) с криоловушкой. Анализ продуктов пиролиза исследуемых проб проводился методом газовой хроматомасс-спектрометрии на приборе GCMS-QP2010Plus (Shimadzu, Япония).
Условия пиролиза были следующие: газовая среда – гелий, режим работы – Single Shot (однократный пиролиз), температура печи пиролизера составляла 500°С, температура криоловушки – 197°С.
Условия хроматографирования следующие: колонка капиллярная HP-5MS, диаметр 0.25 мм, толщина неподвижной фазы 0.25 мкм, длина колонки 30 м, ввод пробы с делением потока 1:100, температура устройства ввода 280°С, газ-носитель – гелий, управление потоком газа – постоянное давление, поток через колонку 1 мл/мин. Температурная программа термостата начиналась с 30°С, удерживалась в течение 5 мин, далее повышалась со скоростью 5°С/мин до 230°С и скоростью 15°С/мин до 320°С. Конечная температура термостата составляла 320°С, термостат выдерживался при данной температуре 5 мин. Температура устройства сопряжения с масс-детектором составляла 280°С, температура ионного источника 230°С, энергия ионизации 70 эВ, напряжение на детекторе 0.9 кВ (по результатам автонастройки), масс-детектор работал в режиме сканирования масс-спектра (TIC Scan) в диапазоне 15–600 а.е.м.
Хроматограммы продуктов пиролиза исследованных видов биотоплива содержат большое количество пиков для различных компонентов. В данной работе приведены основные продукты пиролиза, пики которых имели достаточное соотношение сигнал/шум для их надежной идентификации. Идентификация продуктов пиролиза осуществлялась сравнением полученных масс-спектров хроматографических пиков с библиотеками масс-спектров Wiley-2010 и Nist-2011. Критерием положительной идентификации принималась степень совпадения с библиотечным спектром более 80%. Так же использовались приведенные в литературе [25, 26] данные по времени удерживания и масс-спектрам продуктов пиролиза растительных компонентов. Для оценки содержания идентифицированных компонентов использовалась площадь пиков по полному ионному току.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хроматограммы исследуемых образцов по полному ионному току представлены на рис. 1. По оси ординат – отклик детектора по полному ионному току, по оси абсцисс – время анализа.
Рис. 1.
Хроматограммы образцов торфа (а), осадка сточных вод (б), гидролизного лигнина (в), сосны (г) и ели (д).
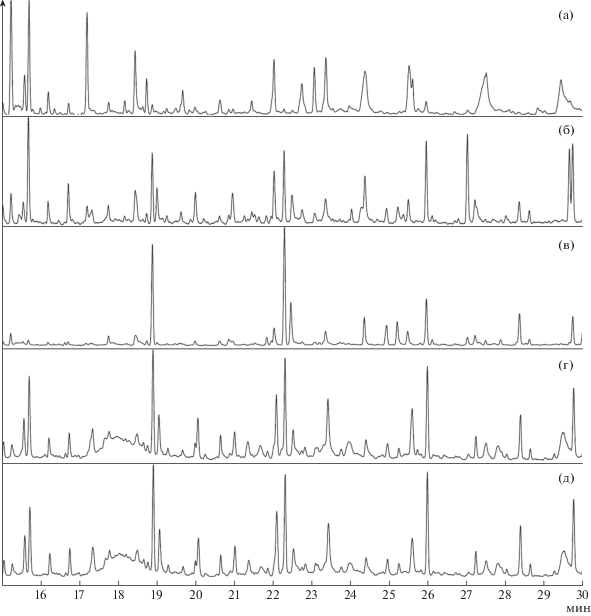
Следует отметить, что на хроматограммах четко прослеживаются пять основных пиков с примерным временем удерживания 15.7, 19, 22.5, 26 и 30 мин. Пик со временем удерживания 15.7 мин соответствует компоненту 2,2-диэтил-3-метилоксазолидин, пик около 19 мин – это 2-метокси-фенол, пик со временем удерживания 22.5 мин – креозол, также есть характерный пик около 26 мин – это 2-метокси-4-винилфенол, и 30 мин – 2-метокси-4-(1-пропенил)фенол.
Можно заметить, что хроматограммы образцов сосны и ели имеют мало отличий, основные пики повторяются. В отличие от них, на хроматограмме гидролизного лигнина отсутствует достаточно ярко выраженный пик со временем удержания 15.7 мин. Хроматограмма образца осадка сточных вод имеет дополнительный пик на 27 мин, которому соответствует компонент 2,6-диметоксифенол. Пики на хроматограмме образца торфа в целом имеют менее выраженный характер.
В результате анализа хроматограмм были получены данные о составе продуктов пиролиза, относительной численности идентифицированных соединений, выделены группы соединений. Идентифицированные компоненты были объединены в восемь групп: гидроксифенильные, гваяцильные и сирингильные фенолы, кетоны, кислоты и ангидриды, ароматические углеводороды, фураны, альдегиды.
Основные компоненты и площади пиков на ионных хроматограммах, соответствующие этим компонентам, приведены в табл. 2.
Таблица 2.
Основные компоненты и площади пиков на ионной хроматограмме
| Компонент | Класс соединения | Площадь пика на ионной хроматограмме | ||||
|---|---|---|---|---|---|---|
| торф | осадок сточных вод | гидро-лизный лигнин | сосна | ель | ||
| 2-Метилфенол | Гидроксифенильный фенол | 141 685 | 58 942 | 199 789 | 53 620 | 66 144 |
| 2,6-Диметилфенол | Гидроксифенильный фенол | 3487 | 7063 | 17 021 | 5365 | 8294 |
| 3-Этилфенол | Гидроксифенильный фенол | 182 626 | 40 618 | 31 624 | 9560 | 13 516 |
| 4-Этилфенол | Гидроксифенильный фенол | 16 803 | 26 585 | 52 847 | 18 030 | 23 985 |
| 4-Пропенилфенол | Гидроксифенильный фенол | 13 905 | 5147 | 9783 | 6258 | 14 257 |
| 2-Метоксифенол | Гваяцильный фенол | 75 966 | 397 584 | 1 877 884 | 868 213 | 1 065 757 |
| 2-Метокси-3-метилфенол | Гваяцильный фенол | 0 | 0 | 2745 | 0 | 0 |
| 3-Метоксифенол | Гваяцильный фенол | 0 | 8790 | 20 841 | 12 502 | 10 590 |
| 4-Этил-2-метоксифенол (этилгваякол) | Гваяцильный фенол | 10 025 | 95 444 | 478 073 | 140 744 | 173 888 |
| 2-Метокси-4-винилфенол | Гваяцильный фенол | 64 600 | 330 716 | 620 256 | 608 408 | 779 257 |
| 3-Метокси-5-метилфенол | Гваяцильный фенол | 3357 | 21 303 | 59 973 | 14 198 | 17 812 |
| 2-Гидрокси-5-метоксиацетофенон | Гваяцильный фенол | 0 | 2317 | 10 794 | 3360 | 4506 |
| 4-Гидрокси-3-метоксибензальдегид (ванилин) | Гваяцильный фенол | 11 729 | 91 143 | 460 313 | 287 065 | 383 254 |
| 2-Метокси-4-пропилфенол | Гваяцильный фенол | 1921 | 24 442 | 372 743 | 296 307 | 373 282 |
| 2,6-Диметоксифенол (сирингол) | Сирингильный фенол | 22 932 | 323 835 | 26 251 | 9504 | 0 |
| 4-Этил-2,6-диметоксифенол (4-этилсирингол) | Сирингильный фенол | 2390 | 47 354 | 3069 | 1257 | 0 |
| 4-Этенил-2,6-диметоксифенол (4-винилсирингол) | Сирингильный фенол | 11 213 | 282 713 | 7588 | 8143 | 0 |
| 4-Гидрокси-3,5-диметоксибензальдегид (сирингальдегид) | Сирингильный фенол | 2808 | 95 570 | 2955 | 3230 | 0 |
| 1-(4-Гидрокси-3,5-диметоксифенил)-этанал (гомосирингальдегид) | Сирингильный фенол | 0 | 0 | 0 | 3000 | 0 |
| 4-Гидрокси-3,5-диметоксиацетофенон (ацетосирингон) | Сирингильный фенол | 7229 | 91 436 | 4965 | 2641 | 0 |
| 2-Бутанон | Кетоны | 246 643 | 21 4379 | 165 265 | 242 290 | 250 287 |
| 4-Циклопентен-1,3-дион | Кетоны | 35 761 | 35 888 | 13 265 | 39 861 | 50 112 |
| 2-Метил-2-циклопентен-1 | Кетоны | 24 138 | 31 304 | 16 321 | 19 273 | 24 876 |
| 4-Гидрокси-2-метил-1,3-циклопентанодион | Кетоны | 150 177 | 0 | 7584 | 225 324 | 179 944 |
| Уксусная кислота | Кислоты | 75 350 | 0 | 50 095 | 312 344 | 382 840 |
| 2-Оксо-пропановая кислота, сложный метиловый эфир | Кислоты | 156 876 | 4 172 182 | 353 725 | 2 226 634 | 2 625 359 |
| 4-Оксо-пентановая кислота | Кислоты | 637 101 | 1 668 592 | 723 905 | 4 078 935 | 4 884 914 |
| 2-Фуранкарбоновая кислота, сложный метиловый эфир | Кислоты | 29 617 | 0 | 29 848 | 78 263 | 63 662 |
| Бензол | Ароматические углеводороды | 108 261 | 43 738 | 25 080 | 108 311 | 130 191 |
| Толуол | Ароматические углеводороды | 84 253 | 56 412 | 86 658 | 35 193 | 23 634 |
| Катехол | Ароматические углеводороды | 277 169 | 261 626 | 353 080 | 129 540 | 44 916 |
| 3-Метил-1,2-бензолдиол | Ароматические углеводороды | 112 946 | 333 261 | 1 276 719 | 394 415 | 503 145 |
| 4-Метил-1,2-бензолдиол | Ароматические углеводороды | 9914 | 74 947 | 343 847 | 73 123 | 91 319 |
| 2-Метил-фуран | Фураны | 13 638 | 77 301 | 390 811 | 84 310 | 105 281 |
| Фурфураль | Фураны | 47 394 | 42 114 | 15 902 | 65 266 | 80 071 |
| 5-Гидроксиметил-фурфураль | Фураны | 1 558 900 | 545 025 | 155 801 | 412 548 | 469 247 |
| 2-Бутеналь | Альдегиды | 46 500 | 93 147 | 29 512 | 137 633 | 159 783 |
| 2-Метил-2-бутеналь | Альдегиды | 0 | 0 | 13 104 | 206 109 | 204 743 |
| Пропаналь | Альдегиды | 5102 | 19 367 | 5468 | 145 077 | 107 038 |
| Гексаналь | Альдегиды | 0 | 14 420 | 26 702 | 17 414 | 16 907 |
Компоненты с небольшим временем удерживания (муравьиная кислота, фурфураль и др.) в основном выделяются во время разложения гемицеллюлозы. Кислотные и фурановые компоненты – продукт термического разложения целлюлозы и гемицеллюлозы [27]. Углеводороды являются результатом различных реакций, таких как разрыв С–С связей и дегидратации углеводов и продуктов их распада. Основные продукты пиролиза – фенолы, образуются в результате деструкции лигнина – ароматического компонента древесных биотоплив. Известно, что с увеличением температуры процесса пиролиза увеличивается количество образующихся фенолов. Так как экспериментальные исследования были проведены при достаточно высокой температуре (500 °С), соответственно, и большое количество компонентов фенольных групп было обнаружено. Фенолы были разделены на три группы: гидроксифенильные фенолы (фенолы, не содержащие метоксильную группу), гваяцильные фенолы (фенолы, содержащие одну метоксильную группу) и сирингильные фенолы (фенолы, содержащие две метоксильные группы). К основным компонентам гидроксифенильной группы следует отнести 2-метилфенол, 3-этилфенол, 4-пропенилфенол. К гваяцильной группе – гваякол, винилфенол. К сирингильной группе отнесены сирингол (2,6-диметоксифенол) и 4-винилсирингол (2,6-диметокси-4-этенилфенол).
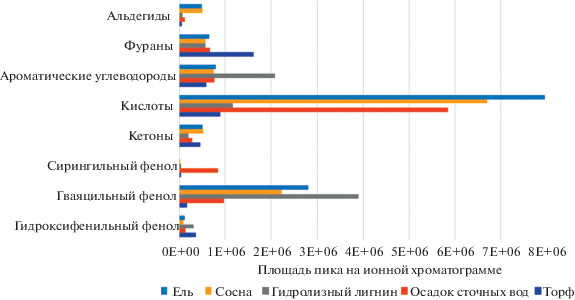
Площади идентифицированных компонентов, объединенные в группы, представлены на рис. 2.
Полученные результаты (рис. 2) позволяют провести качественный анализ, из которого следует, что продукты пиролиза образцов сосны и ели, разделенные по группам, в целом имеют схожие показатели по площадям пиков. Относительно других образцов, для сосны и ели характерно большее количество альдегидов – продуктов пиролиза углеводов (целлюлозы и гемицеллюлоз), а также жирных и смоляных кислот.
При термическом разложении гидролизного лигнина образуется больше ароматических углеводородов, но меньше кислот по сравнению с другими исследованными материалами, что связано с большим количеством фенольных компонентов в лигнине. Для осадка сточных вод распределение фенолов несколько отличается от остальных групп – меньше гваяцильных фенолов, но больше сирингильных, что может быть объяснено содержанием в нем лигнинов лиственных и травянистых растений. Для процесса пиролиза торфа характерно образование меньшего количества кислот и фенолов и большего количества фуранов, образующихся в ходе пиролиза углеводной части пробы (целлюлоз и гемицеллюлоз).
ВЫВОДЫ
В данном исследовании был изучен процесс термического разложения пяти образцов биотоплива методами пиролитической газовой хроматографии. Эксперименты проводились при температуре 500°С, так как в данных условиях наблюдается выделение основной массы газовых компонентов при термическом разложении биотоплив. С помощью метода газовой хроматомасс-спектрометрии были исследованы продукты пиролиза и получены хроматограммы. В результате анализа хроматограмм были определены состав продуктов пиролиза, относительная численность идентифицированных соединений, выделены группы соединений, выполнено сравнение основных пиков хроматограмм для каждого из образцов. Используя информацию о площади пиков групп веществ на хроматограммах, выполнен качественный анализ продуктов пиролиза, проведено сравнение полученных результатов для каждого из видов биотоплив.
Список литературы
Poerschmann J., Weiner B., Wedwitschka H., Baskyr I., Koehler R., Kopinke F.D. // Bioresour. Technol. 2014. V. 164. P. 162.
Funke A., Ziegler F. // Biofuel Bioprod Biorefin. 2010. V. 4. P. 160.
Kruse A., Dahmen N. // J. Supercrit Fluids. 2015. V. 96. P. 36.
Zhu X., Liu Y., Qian F., Zhang S., Chen J. // Energ Fuel. 2015. V. 29. P. 5222.
Shen Y., Yu S., Ge S., Chen X., Ge X., Chen M. // Energy. 2017. V. 118. P. 312.
Titirici M.-M., White R.J., Falco C., Sevilla M. // Energy Environ Sci. 2012. V. 5. P. 6796.
Libra J.A., Ro K.S., Kammann C., Funke A., Berge N.D., Neubauer Y., Titirici M.-M., Fuhner C., Bens O., Kern J., Emmerich K.-H. // Biofuels. 2011. V. 2. P. 71.
Sobgayda N.A., Solodkova A.B. // Int. J. Environ. Probl. 2015. V. 1. P. 64.
Río J.C.D., Gutiérrez A., Romero J., Martinez M.J., Martínez A.T. // J. Anal. Appl. Pyrolysis. 2001. V. 58. P. 425.
Ohra-aho T., Tenkanen M., Tamminen T. // J. Anal. Appl. Pyrolysis. 2005. V. 74. P. 123.
Chen W-H., Wang C-W., Kumar G., Rousset P., Hsieh T-H. // Bioresour. Technol. 2018. V. 259. P. 469.
Chen L., Wang X., Yang H., Lu Q., Li D., Yang Q., Chen H. // J.Anal. Appl. Pyrolysis. 2015. V. 113. P. 499.
Liang F., Wang R., Hongzhong X., Yang X., Zhang T., Hu W., Mi B., Liu Z. // Bioresour. Technol. 2018. V. 256. P. 53.
Syarif H., Abu Bakar M.S., Yang Y., Neeranuch P. // J. Anal. Appl. Pyrolysis. 2018. V. 134. P. 510.
Vyazovkin S., Sbirrazzuoli N. // Macromol. Rapid Commun. 2006. V. 27. P. 1515.
Ponder G.R., Richards G.N., Stevenson T.T. // J. Anal Appl Pyrolysis. 1992. V. 22. P. 217.
Paine J.B., Pithawalla Y.B., Naworal J.D. // J. Anal. Appl. Pyrolysis. 2008. V. 83. P. 37.
Shen D., Gu S., Bridgwater A. // Carbohydr Polym. 2010. V. 82. P. 39.
Patwardhan P.R., Brown R.C., Shanks B.H. // Chem. Sus. Chem. 2011. V. 4. P. 636.
Liu C., Wang H., Karim A.M., Sun J., Wang Y. // Chem. Soc. Rev. 2014. V. 43. P. 7594.
Stefanidis S.D., Kalogiannis K.G., Iliopoulou E.F., Michailof C.M., Pilavachi P.A., Lappas A.A. // J. Anal. Appl. Pyrolysis. 2014. V. 105. P. 143.
Carlson T.R., Jae J., Lin Y.-C., Tompsett G.A., Huber G.W. // J. Catal. 2010. V. 270. P. 110.
Cheng Y.-T., Huber G.W. // ACS Catal. 2011. V. 1. P. 611.
Wang K., Kim K.H., Brown R.C. // Green Chem. 2014. V. 16. P. 727.
Ralph J., Hatfield D. // J. Agric Food Chem. 1991. V. 39. P. 1426.
Lin Y., Dence W. Methods in Lignin Chemistry. B.: Springer, 1992. Pt. 7. Ch. 4. 578 p.
Wang T., Zhang R., Peng L., Ai Y., Lu Q. // J. Anal. Appl. Pyrolysis. 2017. V. 128. P. 257.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива