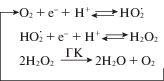Химия твердого топлива, 2021, № 5, стр. 67-72
РОЛЬ ГУМИНОВЫХ КИСЛОТ В ДЕТОКСИКАЦИИ НЕФТЯНЫХ УГЛЕВОДОРОДОВ В ПОЧВЕ
Е. В. Линкевич 1, *, Н. В. Юдина 1, **, А. В. Савельева 1, ***
1 ФГБУН Институт химии нефти СО РАН
634055 Томск, Россия
* E-mail: maltseva2@gmail.ru
** E-mail: natal@ipc.tsc.ru
*** E-mail: anna@ipc.tsc.ru
Поступила в редакцию 11.12.2020
После доработки 10.02.2021
Принята к публикации 06.04.2021
Аннотация
Исследовано влияние концентрации и состава гуминовых кислот (ГК) на биодеструкцию нефтяных углеводородов. ГК получены из бурого окисленного угля щелочной экстракцией и при механообработке угля в присутствии 3 и 8 мас. % NaOH (ГК1 и ГК2). Показано, что твердофазный щелочной гидролиз в присутствии 8 мас. % NaOH с последующим выделением ГК2 водой приводит к повышению степени ароматичности и количества фенольных групп. Почвенная микрофлора, стимулированная ГК1 и ГК2, обладает повышенной деструктивной нефтеокисляющей активностью. Методом спектрофотометрии установлено снижение концентрации фенантрена в растворе за счет образования комплекса при взаимодействии с гуминовыми кислотами.
ВВЕДЕНИЕ
Проблема детоксикации, очистки и восстановления свойств и плодородия почв, загрязненных нефтью и нефтепродуктами, является важной и актуальной в деятельности нефтедобывающих, транспортирующих и нефтеперерабатывающих предприятий. К наиболее токсичным компонентам нефти относятся легкие фракции и ароматические углеводороды. Большую опасность для живых организмов представляет группа полициклических ароматических углеводородов (ПАУ), характеризующихся ярко выраженной мутагенностью и канцерогенностью [1].
Способы ликвидации последствий нефтезагрязнения почвы и водных бассейнов, помимо сорбционных процессов, основаны на биодеградации нефтяных углеводородов, связывании и детоксикации органических загрязнителей [2]. Интенсивность и характер биодеградации нефтяных углеводородов в почве определяются питательной средой и функциональной активностью углеводородокисляющих микроорганизмов, присутствующих в почве [3, 4]. При этом предполагается не только внесение биопрепаратов, содержащих углеводородокисляющие микроорганизмы, но и активация аборигенной микрофлоры загрязненных объектов [2]. Сырьем для производства биопрепаратов служат торф и бурый уголь, поверхностно активными веществами которых являются гуминовые кислоты (ГК), стимулирующие активность микроорганизмов при биодеградации углеводородов [5–7].
Сорбционные и детоксицирующие свойства ГК по отношению к органическим загрязнителям зависят от их функционального состава. Способность вступать в ионные и донорно-акцепторные взаимодействия, образовывать водородные связи определяется наличием в молекулах ГК широкого спектра функциональных групп в сочетании с ароматическими фрагментами [8, 9]. Благодаря этому ГК связывают экотоксиканты (пестициды, полициклоароматические углеводороды, тяжелые металлы) в нетоксичные комплексы [10–13].
Структурно-групповые параметры ГК определяются способом их выделения [14–16]. Установлено, что при минимальных значениях количества щелочи выход ГК понижен, но при этом выше их степень ароматичности и биологическая активность [17]. Условия механообработки (МО) твердых каустобиолитов позволяют снизить щелочность среды и при этом повысить выход ГК и детоксицирующую способность [18, 19].
Цель данной работы – исследование влияния способа выделения ГК на их детоксицирующие свойства по отношению к нефтяным углеводородам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами являлись гуминовые кислоты (ГК), выделенные из бурого окисленного угля (ОУ, месторождение Чай-Кэнул, Китай). Техническая характеристика ОУ: зольность – 16.8 мас. % влажность – 16.7 мас. %, содержание ГК – 35.7 мас. %.
Механообработку угля проводили в планетарной мельнице АГО-2 (Новосибирск) в присутствии 3 и 8 мас. % NaOH (х.ч., “ХПК-Групп”, Пенза) [20, 21].
Гуминовые вещества из исходного угля и после МО с 3 мас. % (ГК1) выделяли 0.1 н. NaОН при температуре 90°С в течение 1 ч (рН 11.5), из угля после МО с 8 мас. % NaOH (ГК2) – дистиллированной водой при 20°С (рН 8.5). Растворы фильтровали и осаждали ГК 0.1 н. НCl (рН 2). Осадок ГК промывали на фильтре дистиллированной водой.
Содержание кислых ионогенных групп в ГК определяли методом потенциометрического титрования. Навеску ГК растворяли в 0.1 н. NaОН, добавляли насыщенный раствор NаСl (ч., “ХПК-Групп”, Пенза) для создания постоянной ионной силы раствора и титровали 0.1 н раствором HCl (Химпром, Кемерово).
Элементный состав гуминовых кислот определяли на элементном анализаторе Vario El Cube (Германия). Фрагментный состав получен методом ЯМР 13С-спектрометрии на радиоспектрометре Bruker 300 (Германия) при рабочей частоте 100 МГц с использованием методики фурье-преобразования с накоплением. Ширина развертки спектра составляла около 26 000 Гц, время регистрации сигнала спада свободной индукции 0.6 с, интервал между импульсами 8 с при ширине импульса 90°, длительность накопления спектра 24 ч. Навеску препарата 50–70 мг растворяли в 0.7 см3 0.3 М NaOD.
Вольтамперометрическим методом катодного восстановления кислорода с использованием ртутного пленочного электрода определяли критерий антиоксидантной активности (АОА) К. Фоновым электролитом являлся фосфатный буфер (“ИМС”, Москва, рН 6.8). Навеску анализируемого вещества 5 · 10–3 г растворяли в 5 мл 0.1 н NaOH. Антиоксидантная активность К отражает количество кислорода и активных кислородных радикалов, прореагировавших с антиоксидантом за минуту времени [22].
где I – ток электровосстановления (ЭВ О2) в присутствии ГК в растворе, мкА; I0 – ток ЭВ О2 в отсутствие ГК в растворе, мкА; $C_{{{{{\text{O}}}_{2}}}}^{0}$– исходная концентрация кислорода в растворе, мкмоль/л; t – время протекания процесса, мин.Для создания нефтезагрязнения в дерново-подзолистую почву при интенсивном перемешивании вносили высокопарафинистую нефть в количестве 15 г/кг. Детоксицирующими агентами нефтезагрязнений являлись растворы ГК при рН 7 и концентрации 0.005–0.05 мас. %. В течение 8 нед. определяли численность почвенной микрофлоры на примере гетеротрофов разных физиологических групп методом посева на селективные среды. Контролем служила численность микроорганизмов в чистой и нефтезагрязненной почве.
В нефтезагрязненной почве определяли содержание битумоидов экстракцией хлороформом. Методом колоночной хроматографии из сырой нефти и битумоидов в образцах нефть/почва/ГК (НПГК), нефть/почва/ГК1 (НПГК1) и нефть/почва/ГК2 (НПГК2) выделяли парафинонафтеновые углеводороды (ПНУВ), ароматические углеводороды (АУВ), смолы и асфальтены.
Индивидуальный состав н-алканов анализировали на газовом хроматографе Agilent-6890 (США). Калибровка проводилась с использованием н-С20.
Для количественной оценки взаимодействия фенантрена с ГК в водной среде использовался метод спектрофотометрии на спектрофотометре Agilent Cary Win (США). В исследуемый раствор с известной концентрацией фенантрена (5 · 10–5–4 · 10–4 г/л) добавляли раствор ГК с концентрацией 0.005–0.01 г/л и определяли оптическую плотность при той же длине волны. Математическую обработку полученных спектров осуществляли с помощью программы Assayer.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что на выход и состав ГК существенно влияют условия щелочной экстракции. Согласно [12, 21], для максимального извлечения ГК из угля требуется проводить экстракцию с повышенным количеством щелочи. Исследования показали, что при щелочной экстракции ОУ извлекается 35.7 мас. % ГК, в процессе МО угля с 3 мас. % NaOH – 55.4 мас. %, а при 8 мас. % NaOH образуются механокомпозиты, из которых водой экстрагируется 79.0 мас. % водорастворимых гуминовых веществ, содержащих 61.4 мас. % ГК.
По результатам анализа элементного состава ГК1 и ГК2 в большей степени обогащены кислородом по сравнению с ГК, выделенными щелочной экстракцией (табл. 1). Данные ЯМР 13С-спектроскопии свидетельствуют об одинаково высокой степени ароматичности (ΣCar + CarO) молекул. В ГК1 и ГК2 повышается доля окисленных ароматических фрагментов, представленных в виде показателя СarO/Car + CarO, и снижается содержание окисленных алкильных фрагментов СalkO/Сalk (табл. 1). По результатам потенциометрического титрования кислородсодержащих групп в ГК2 в большей степени возросло содержание фенольных гидроксилов и снизилось количество карбоксильных групп (табл. 2). Более мягкие условия щелочной экстракции ГК2 (рН 8.5) определили фрагментный и функциональный состав молекул.
Таблица 1.
Элементный и фрагментный состав гуминовых кислот
| Параметр | ГК | ГК1 | ГК2 |
|---|---|---|---|
| Атомное отношение | |||
| H/C | 1.14 | 1.15 | 1.16 |
| O/C | 0.48 | 0.51 | 0.54 |
| Фрагментный состав | |||
| Сar + CarO | 40.0 | 42.0 | 45.2 |
| Car /ƩСar + CarO | 0.28 | 0.32 | 0.37 |
| CalkO/Calk | 0.37 | 0.32 | 0.28 |
| Содержание С=О, отн. % | 15.8 | 13.6 | 14.5 |
Таблица 2.
Функциональный состав и критерий антиоксидантной активности гуминовых кислот
| Образец | Функциональный состав, мг-экв./г | К, мкмоль/л мин | ||
|---|---|---|---|---|
| ArOH | ArCOOH | CnCOOН | ||
| ГК | 9.1 ± 0.2 | 4.8 ± 0.2 | 1.1 ± 0.1 | 0.368 |
| ГК1 | 10.3 ± 0.4 | 5.5 ± 0.1 | 0.8 ± 0.1 | 0.438 |
| ГК2 | 11.8 ± 0.3 | 4.5 ± 0.2 | 0.8 ± 0.1 | 0.695 |
При окислении органических веществ в качестве первичных продуктов реакции образуются гидропероксиды, которые распадаются на радикалы, зарождающие цепи окисления с образованием активных форм кислорода (АФК), что приводит к оксидативному стрессу. АФК постоянно образуются в живых клетках как продукты нормального метаболизма кислорода и являются причиной их разрушения [23]. Нейтрализация радикалов и прекращение цепной реакции в биологических объектах осуществляются антиоксидантами (АО). Механизм действия АО ГК заключается в реакции диспропорционирования АФК [22].
Антиоксидантная активность (К) существенно возрастает для образца ГК2, в составе молекул которых выше доля ароматических фрагментов и фенольных гидроксилов. Это обеспечивает контроль АФК и является важной протекторной системой в биохимических процессах (табл. 2).
Снижение щелочности при экстракции, как показали авторы [17], приводит к увеличению степени ароматичности и количества гидроксильных групп в составе ГК1 и ГК2, которые способны участвовать в окислительно-восстановительных реакциях.
Окисление нефти начинается сразу после ее попадания в почву. Общими чертами этого процесса являются разрушение метано-нафтеновых фракций, относительное увеличение доли смолистых веществ в нефти, переход части нефтяных компонентов в нерастворимые в органических растворителях формы. Скорость изменения содержания отдельных углеводородов и фракций зависит от природно-климатических зон, состава исходной нефти и стимулирования биодеградации нефти.
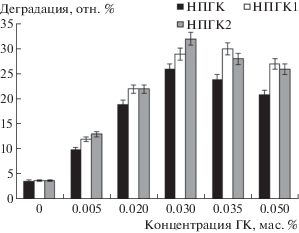
Количество битумоидов в почве без добавок ГК через 8 нед. эксперимента составило 96.0 мас. % (рис. 1). При обработке почвы водными растворами гуминовых кислот максимальная степень деградации нефти наблюдалась при концентрации 0.03 мас. %. При более высоких концентрациях отмечено снижение стимулирующего эффекта ГК, отразившегося на биодеградации нефтяных углеводородов. Из этого эксперимента следует, что процесс биодеградации нефти при низких концентрациях превалирует над процессом адсорбции, проявляющимся при более высоких концентрациях ГК.
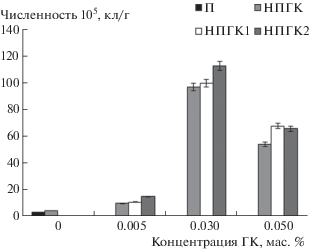
В чистой и нефтезагрязненной почвах параллельно деградации нефти определялась численность гетеротрофных микроорганизмов через 8 нед культивирования (рис. 2). В чистой почве гетеротрофные микроорганизмы присутствуют в количестве 3.5 · 105 кл/г. В нефтезагрязненной почве их численность резко падает и максимально возрастает при добавлении раствора ГК2 в концентрации 0.03 мас. %.
Корреляция между деградацией и численностью микрофлоры отразилась на составе битумоидов, экстрагируемых из нефтезагрязненной почвы. В табл. 3 показано, что за исследуемый период времени в битумоидах снизилось количество парафинонафтеновых углеводородов, в меньшей степени – содержание ароматических углеводородов. При этом возросло содержание смол и асфальтенов. Изменения в составе битумоидов связаны с усилением активности почвенной углеводородокисляющей микрофлоры. Повышение биодоступности связывают с образованием комплекса ГК с углеводородами и целенаправленным переносом его к клеткам бактерий. В [24] показано, что после МО углей выделенные ГК характеризуются возрастанием поверхностной активности, что связано с увеличением гидрофобности молекул и количества кислородсодержащих групп.
Таблица 3.
Групповой состав нефти и битумоидов из нефтезагрязненной почвы
| Состав | Содержание, мас. % | |||
|---|---|---|---|---|
| нефть | НПГК | НПГК1 | НПГК2 | |
| ПНУВ | 83.2 ± 7.5 | 76.3 ± 6.0 | 75.4 ± 6.3 | 73.4 ± 6.3 |
| АУВ | 11.2 ± 0.9 | 9.2 ± 0.8 | 9.1 ± 0.9 | 8.8 ± 0.8 |
| Смолы | 4.0 ± 0.4 | 10.0 ± 0.9 | 10.5 ± 0.8 | 12.8 ± 0.8 |
| Асфальтены | 1.6 ± 0.1 | 4.5 ± 0.4 | 5.0 ± 0.5 | 5.0 ± 0.5 |
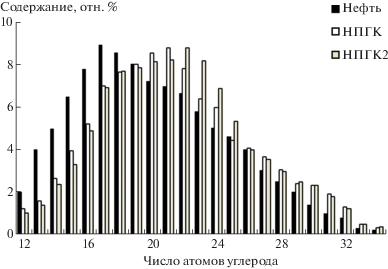
Известно, что среди нефтяных компонентов микробиологической деградации в первую очередь подвергаются УВ нормального строения. Изменения в составе н-алканов в образцах битумоидов НПГК и НПГК2 наиболее наглядно демонстрируют деструкцию углеводородов (рис. 3). В составе н-алканов из битумоидов снижается содержание углеводородов С12–С19. Максимум в молекулярно-массовом распределении н-алканов в нефти приходится на С17–С18, в битумоидах НПГК – С19–С21, НПГК2 – С22–С24.
Для оценки деградации нефти используют показатели, приведенные в табл. 4. Содержание н-алканов С12–С18 в нефти выше в 1.5–1.6 раза по сравнению с битумоидами из нефтезагрязненной почвы. При этом в битумоидах НПГК и НПГК2 возросло содержание н-алканов С19–С27, менее подверженных микробиологической деструкции за указанный период времени. Об уменьшении доли углеводородов средней молекулярной массы свидетельствует изменение показателя нС17/нС27. Процесс биохимического окисления углеводородов связан с изменением разветвленности углеводородных цепей. Показатель iC19 + iC20/нС17 + нС18 позволяет оценить глубину процессов биодеградации нефти. Из табл. 4 видно, что в битумоиде НПГК2 в большей степени снижается содержание iC19 + iC20. Исходя из этого, присутствие гуминовых кислот в почве стимулирует процесс биохимического окисления.
Таблица 4.
Показатели деградации нефти
| Показатель | Нефть | НПГК | НПГК2 |
|---|---|---|---|
| ƩнС12–нС18 | 42.8 | 29.2 | 26.5 |
| ƩнС19–нС27 | 51.4 | 57.7 | 61.0 |
| нС17/нС27 | 2.9 | 1.9 | 1.9 |
| ƩiC19 + iC20/нС17 + нС18 | 0.28 | 0.8 | 0.7 |
| 2нС29/нС28 + нС30 | 1.02 | 0.9 | 0.8 |
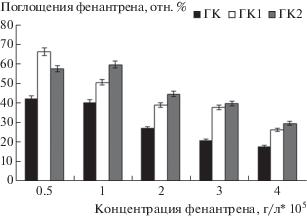
Известно, что три- и тетрациклические углеводороды в нефти подвержены биодеградации [25]. Роль ГК в снижении токсичности нефтяных АУВ заключается в связывании их в комплексы за счет наличия в структуре гидрофобного ароматического каркаса. Этот факт подтверждается методом спектрофотометрии при определении концентрации фенантрена, поглощенного молекулами ГК. Образование комплекса ГК-АУВ зависит от концентрации ГК и фенантрена (рис. 4). Максимальное поглощение фенантрена образцом ГК наблюдалось при его концентрации 5 · 10–4 г/л и составило 43 отн. %. При возрастании концентрации фенантрена остаточная доля токсичного вещества в растворе увеличивается, что указывает на ограниченную поглощающую способность ГК. Наибольший эффект связывания фенантрена отмечается в присутствии молекул ГК2, характеризующихся большей степенью ароматичности. При увеличении концентрации ГК образуются крупные мицеллоподобные агрегаты, затрудняющие доступ молекул фенантрена к ароматическим фрагментам, поэтому их взаимодействие в этом случае не столь значительно.
ЗАКЛЮЧЕНИЕ
Повышенной деструктивной окислительной активностью по отношению к нефти обладает почвенная микрофлора, стимулированная подвижными водными растворами гуминовых кислот. Максимальная деструкция нефти и рост численности гетеротрофных микроорганизмов наблюдались в присутствии 0.03 мас. % ГК, молекулы которых характеризуются большей гидрофобностью и количеством кислородсодержащих групп. Увеличение концентрации ГК вызвало снижение уровня деградации нефтяных углеводородов, что может быть связано с ингибированием деятельности микроорганизмов.
Стимулирование растворами ГК процесса окислительной деструкции нефтяных углеводородов подтверждается уменьшением количества легких углеводородов и ростом доли смолистых компонентов. Модельный эксперимент с детоксикацией фенантрена показал, что существенное снижение его концентрации достигается в присутствии гуминовых кислот с более высокой долей ароматических фрагментов в их составе.
Список литературы
Гречищева Н.Ю., Перминова И.В., Мещеряков С.В. // Экология и промышленность России. 2016. Т. 20 (1). С. 30. https://doi.org/10.18412/1816-0395-2016-1-30-36
Филатов Д.А., Кривцов Е.Б., Свириденко Н.Н., Головко А.К., Алтунина Л.К. // Нефтехимия. 2017. Т. 57. № 8. С. 386. https://doi.org/10.7868/S0028242117040050
Roger C., Prince, Bryan M. Hedgpeth, Aaron D. Redman // Open J. Marine Sci. 2019. V. l9. № 3. P. 113.
Иванов А.А., Юдина Н.В., Мальцева Е.В., Матис Е.Я., Сваровская Л.И. // Почвоведение. 2010. Т. 43. № 2 С. 229. [Eurasian Soil Science, 2010. V. 43. № 2. P. 210. https://doi.org/10.1134/S1064229310020110]
Prince R.C., Hedgpeth B.M., Redman A.D. and Butler J.D. // Open J. Marine Sci. 2019. 9. P. 113.
Pineda-Flores G., Boll-Arguello G., Lira-Galeana C., Mesta-Howard A.M. //Biodégradation. 2004. V. 15. № 3. P. 145. https://doi.org/10.4236/ojms.2019.93009
Chioma Chikere, Blaise Ositadinma Chikere, Gideon Okpokwasili // African J. Biotechnol. 2009. V. 8. № 11. P. 2535.
Sutton R. // Environ. Sci. Tech. 2005. V. 39. № 23. P. 9009. https://doi.org/10.1021/es050778q
Liang Y.-N., Britt D.W., McLean J.E. // Appl. Microbiol. Biotechnol. 2007. V. 74. № 6. P. 1368.
Smith K.E., Thullner M., Wick L.Y., Harms L.Y. // Environ. Sci. Technol. 2009. V. 43. № 19. P. 7205. https://doi.org/10.1021/es803661s
Юдина Н.В., Мальцева Е.В., Чайковская О.Н., Нечаев Л.В. // ЖФХ. 2011. Т. 85. № 9. С. 1676. [Russian Journal of Physical Chemistry A, 2011. V. 85. № 9. P. 1558. https://doi.org/10.1134/S0036024411090147]
Aniefiok E., Nicola F. Hanney, Kirk T. Semple // Intern. J. Environmental Bioremediation & Biodegradation. 2015. V. 3 № 2. P. 40. https://doi.org/10.12691/ijebb-3-2-1
Shirshin E.A., Budylin N.Yu., Fadeev V.V., Perminova I.V. // Photochem. Photobiol. Sci. 2016. V. 15. P. 842. https://doi.org/10.1039/c6pp00052e
Tchaikovskaya O.N., Yudina N.V., Mal’tseva E.V. Sokolova I.V. // Luminescence. 2005. № 20. P. 187–191. https://doi.org/10.1002/bio.818
Скрипкина Т.С., Бычков А.Л., Тихова В.Д., Ломовский О.И. // ХТТ. 2018. № 6. С. 16. [Solid Fuel Chemistry, 2018. V. 52, no 6. P. 356. https://doi.org/10.3103/S0361521918060101].https://doi.org/10.1134/S0023117718060117
Skripkina T.S., Bychkov A.L., Tikhova V.D., Smolyakov B.S., Lomovsky O.I. // Environmental Technology & Innovation. 2018. V. 11. P. 74. https://doi.org/10.1016/j.eti.2018.04.010
Жеребцов С.И., Вотолин К.С., Малышенко Н.В., Смотрина О.В., Дугаржан Ж., Исмагилов З.Р. // ХТТ. 2019. № 5. С. 3. [Solid Fuel Chemistry, 2019. V. 53. № 5. P. 253. https://doi.org/10.3103/S0361521919050124].https://doi.org/10.1134/S0023117719050128
Tchaikovskaya O.N., Yudina N.V., Nechaev L.V., Mal’tseva E.V. // Luminescence. 2016. V. 31. № 5. P. 1098. https://doi.org/10.1002/bio.3077
Савельева А.В., Мальцева Е.В., Yudina N.V., Ломовский О.И. // Химия в интересах устойчивого развития. 2016. Т. 24. № 2. С. 263–268. https://doi.org/10.15372/KhUR20160221
Urazova T.S., Bychkov A.L., Lomovskii O.I. // Rus. J. Appl. Chem. 2014. V. 87. № 5. P. 651. https://doi.org/10.1007/s11172-015-0997-0
Юдина Н.В., Савельева А.В., Линкевич Е.В. // ХТТ. 2019. № 1. С. 34. [Solid Fuel Chemistry, 2019. V. 53. № 1. P. 29. https://doi.org/10.3103/S0361521919010099]https://doi.org/10.1134/S0023117719010092
Юдина Н.В., Савельева А.В., Иванов А.А., Короткова Е.И., Ломовский О.И. // ЖПХ. 2004. Т. 77. Вып. 1. С. 48–53. [Russian Journal of Applied Chemistry, 2004. V. 77. № 1. P. 46. https://doi.org/10.1023/B:RJAС.0000024574.01023.fe]
Klein O.I., Kulikova N.A., Filimonov I.S., Koroleva O.V., Konstantinov A.I. // Soils and Sediments. 2018. V. 18. № 4. P. 1355. https://doi.org/10.1007/s11368-016-1507-1
Юдина Н.В., Савельева А.В., Ломовский O.И. // Химия в интересах устойчивого развития. 2019. № 4. С. 637. https://doi.org/10.15372/KhUR2019156
Антипенко В.Р., Баканова О.С., Филатов Д.А. // Нефтехимия. 2019. Т. 50. № 5. С. 508–515. https://doi.org/10.1134/S0028242119050022
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива