Химия твердого топлива, 2021, № 5, стр. 56-66
Н-АЛКАНЫ И Н-АЛКАН-2-ОНЫ – ЛИПИДНЫЕ БИОМАРКЕРЫ ВЕРХОВЫХ ТОРФОВ И БОЛОТНЫХ РАСТЕНИЙ ЗАПАДНОЙ СИБИРИ
Е. Б. Стрельникова 1, *, И. В. Русских 1, **, Ю. И. Прейс 2, ***
1 ФГБУН Институт химии нефти СО РАН
634055 Томск, Россия
2 ФГБУН Институт мониторинга климатических и экологических систем СО РАН
634055 Томск, Россия
* E-mail: seb@ipc.tsc.ru
** E-mail: rus@ipc.tsc.ru
*** E-mail: preisyui@rambler.ru
Поступила в редакцию 11.12.2020
После доработки 11.12.2020
Принята к публикации 06.04.2021
Аннотация
Методом хромато-масс-спектрометрии проведен сравнительный анализ состава липидных биомаркеров н-алканов и н-алкан-2-онов в сфагновых мхах, травяных растениях, вересковых кустарничках и торфах верховых болот Западной Сибири. Показано, что различные виды растений болот отличаются соотношением длинноцепочечных н-алканов, что позволяет диагностировать источник этих соединений в торфе. Выявлено, что сфагновые торфа, залегающие в верховых болотах, формирующихся в разных природно-климатических условиях, отличаются распределением н-алкан-2-онов, что дает возможность использовать эти соединения для реконструкции палеоклиматических условий.
Болота представляют собой естественный природный архив данных, в котором можно почерпнуть сведения об эволюции палеоэкологической среды. Данные исследований происхождения и трансформации болот используются для реконструкции изменений климата и оценки влияния человеческой деятельности на региональном и глобальном уровнях. Одним из наиболее широко используемых методов изучения истории торфяников является метод определения ботанического состава торфа. Однако в случае высокой степени разложения торфов реконструкция структуры и видового состава растительных сообществ, отложивших торфа, является сложной задачей, так как содержание остатков растений, наиболее подверженных деструкции, может значительно понизиться, вплоть до полного их исчезновения. В настоящее время для реконструкции палеофитоценозов также используется метод липидных биомаркеров, который хорошо зарекомендовал себя для верховых торфов. Верховой торф содержит широкий спектр сложных углеводородных молекул, в том числе биомаркеров, в высоких концентрациях. Биомаркеры – это устойчивые к разложению соединения, для которых известен их природный источник. Наличие и соотношение биомаркеров определяется вкладом в торф той или иной группы торфообразующих растений, факторами окружающей среды, такими как температура и pH, и диагенетическими процессами, протекавшими при разложении торфа. Биомаркеры в торфяных залежах дают информацию об изменениях, происходивших с растительностью и климатом за длительный период времени, что способствует разработке на их основе ряда палеоклиматических показателей. В настоящее время для реконструкции и количественной оценки изменений климата используется широкий спектр биомаркеров, начиная от н-алканов до тетраэфиров глицерина и диалкилглицерина [1–5].
Западная Сибирь – один из крупнейших мировых торфяных регионов. Половина болот Западной Сибири – верховые (омбротрофные), расположенные обычно на водоразделах, питающиеся только за счет атмосферных осадков с низким содержанием минеральных веществ. Типичные растения верховых болот: олиготрофные сфагновые мхи, вересковые кустарнички, пушица, шейхцерия, сосна. Развитие верховых болот напрямую зависит от температуры окружающей среды и количества осадков, поэтому они очень чувствительны к изменению климата. Особый интерес представляет то, что западно-сибирские болота расположены преимущественно в зоне отрицательных среднегодовых температур, гораздо менее изученной по сравнению с болотами других регионов в плане влияния палеоэкологических условий на состав и содержание липидов. Это обуславливает новизну и актуальность исследований.
Цель исследования заключалась в изучении и оценке характера взаимосвязей между молекулярным распределением н-алканов и н-алкан-2-онов в болотных растениях и верховых торфах Западной Сибири, формирующихся в разных природно-климатических условиях.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Растения из болота, включая мхи и сосудистые растения, для анализа липидов были отобраны в Томской области (ТО), а также в Ханты-Мансийском (ХМАО) и Ямало-Ненецком (ЯНАО) автономных округах (табл. 1). Данные среднегодовой температуры приведены по метеостанциям, ближайшим к местам отбора проб (http://www.pogodaiklimat.ru). Перед анализом растения были промыты. В пределах южной тайги исследованы образцы растений болот Томской области. Образцы мха Sphagnum fuscum отобраны с болот Темное, Бакчарское и Большое, мхов Sphagnum magellanicum и Sphagnumbalticum– с топяных участков болот Темное и Бакчарское соответственно. Кроме того, исследованы характерные для растительности болот южной тайги Пушица влагалищная (Eriophorum vaginatum), Шейхцерия болотная (Scheuchzeria palustris), Осока шаровидная (Carex globularis) и вересковые кустарнички: Багульник болотный (Ledum palustre) и Хамедафна обыкновенная (Chamaedaphne calyculata). Два вида мха (топяной Sphagnum papillosum и Sphagnum subsecundum) представляют растительность болот среднетаежной зоны (Кондинский район ХМАО), а мох Sphagnum fuscum – северной тайги (Надымский район ЯНАО). Два вида мха, Sphagnum fuscum и Sphagnum balticum, отобраны на плоскобугристом болоте лесотундры (Газ-Сале, ЯНАО), а Пушица Шейхцера (Eriophorum scheuchzeri), Водяника черная (Empetrum nigrum) и Багульник болотный (Ledum palustre) – в тундре полуострова Ямал, на хасырее. Проведен анализ состава липидов 9 мхов, 4 травянистых растений, 4 вересковых кустарничков.
Таблица 1.
Характеристика растений верховых болот Западной Сибири
| Наименование | Группа видов | Место отбора | Т, °С | ПКЗ/ПЗ | Координаты точки отбо-ра (с.ш., в.д.) | ACL | Paq | CPI | KET |
|---|---|---|---|---|---|---|---|---|---|
| Sphagnum magellanicum | Сфагновые мхи | ТО (болото Темное) | 0.3 | Южная тайга | 56°49', 84°38' | 24.59 | 0.94 | 5.80 | 0.82 |
| Scheuchzeria palustris | Травяные | 26.91 | 0.51 | 7.86 | 1.01 | ||||
| Eriophorum vaginatum | Травяные | 28.61 | 0.32 | 7.96 | 0.69 | ||||
| Carex globularis | Травяные | 27.02 | 0.51 | 3.71 | 0.84 | ||||
| Sphagnum fuscum | Сфагновые мхи | ТО (болото Бакчарское) | –0.3 | 56°58', 82°37' | 25.60 | 0.82 | 6.50 | 0.27 | |
| Sphagnum balticum | Сфагновые мхи | 25.01 | 0.84 | 5.77 | 0.59 | ||||
| Ledum palustre | Вересковые кустарнички | 30.52 | 0.02 | 22.24 | 0.22 | ||||
| Chamaedaphne calyculata | Вересковые кустарнички | 28.88 | 0.10 | 10.73 | 0.16 | ||||
| Sphagnum fuscum | Сфагновые мхи | ТО (болото Большое) | –1.1 | 58°47', 81°11' | 25.31 | 0.88 | 7.54 | 0.28 | |
| Sphagnum papillosum | Сфагновые мхи | ХМАО, Кондинский район | –0.7 | Средняя тайга | 60º53', 63º38' | 25.09 | 0.85 | 3.62 | 0.64 |
| Sphagnum subsecundum | Сфагновые мхи | 26.32 | 0.63 | 3.34 | 0.69 | ||||
| Sphagnum fuscum | Сфагновые мхи | ЯНАО, Надым (плоскобугристое болото) | –5.4 | Северная тайга | 65°17', 72°53' | 25.88 | 0.76 | 6.02 | 0.42 |
| Sphagnum fuscum | Сфагновые мхи | ЯНАО, Газ-Сале (плоскобугристое болото) | –8.4 | Лесотундра | 67°20', 78°45' | 25.79 | 0.81 | 6.32 | 0.70 |
| Sphagnum balticum | Сфагновые мхи | 25.47 | 0.78 | 5.47 | 0.75 | ||||
| Eriophorum scheuchzeri | Травяные | ЯНАО, Ямал, оз. Сохонто (хасырей) | –7.7 | Тундра | 69°08', 70°15' | 26.86 | 0.51 | 8.12 | 0.33 |
| Ledum palustre | Вересковые кустарнички | 30.06 | 0.02 | 19.27 | 1.14 | ||||
| Empetrum nigrum | Вересковые кустарнички | 29.73 | 0.01 | 35.96 | 0.96 |
Образцы торфа отобраны в пределах шести природно-климатических зон/подзон (ПКЗ/ПЗ) от лесостепи до тундры в Новосибирской области (НСО), ТО, ХМАО и ЯНАО (табл. 2). Керны были отобраны пробоотборочным буром БТГ-1 с диаметром челнока 5 см. Керн был разрезан на образцы толщиной 5 см. Пробы торфа для анализа взяты с глубин, не превышающих 60 см. Ботанический состав и степень разложения (R) образцов торфа анализировали микроскопическим методом [6]. Перед анализом липидов образцы сушили при комнатной температуре. Анализ состава липидов проводили для 18 образцов фускум-торфа, 7 – мочажинного, 3 – пушицевого и 1 – кустарничкового.
Таблица 2.
Характеристика верховых торфов
| Глубина отбора, см | R, % | Место отбора | Т, °С | ПКЗ/ПЗ | Вид торфа | Координаты точки отбора (с.ш., в.д.) | ACL | Paq | CPI | KET |
|---|---|---|---|---|---|---|---|---|---|---|
| 24 | 7 | НСО (болото Убинское) | 0 | Лесостепь | Фускум | 55º19', 79º42' | 27.31 | 0.54 | 4.62 | 0.16 |
| 13–20 | 3 | Мочажинный | 26.61 | 0.60 | 3.69 | 0.15 | ||||
| 10 | 12 | Пушицевый | 27.59 | 0.44 | 7.30 | 0.20 | ||||
| 6 | 22 | ТО (болото Темное) | 0.3 | Южная тайга | Фускум | 56°49', 84°38' | 27.26 | 0.52 | 2.09 | 0.39 |
| 10–15 | 5 | Фускум | 28.26 | 0.32 | 2.45 | 0.26 | ||||
| 40–60 | 7 | ТО (болото Бакчарское) | –0.3 | Фускум | 57°01', 82°04' | 27.67 | 0.47 | 2.99 | 0.29 | |
| 30–60 | 5 | Фускум | 56°58', 82°36' | 28.05 | 0.40 | 10.09 | 0.22 | |||
| 30–60 | 10 | Мочажинный | 56°58', 82°37' | 26.36 | 0.62 | 8.69 | 0.30 | |||
| 16 | 5 | Мочажинный | 56º51', 82º41' | 26.45 | 0.60 | 5.18 | 0.27 | |||
| 30–60 | 5 | ТО (болото Центральное) | –0.4 | Фускум | 58°18', 84°55' | 26.94 | 0.59 | 8.84 | 0.22 | |
| 36 | 5 | ТО (болото Небига) | Фускум | 58º20', 85º01' | 27.07 | 0.58 | 3.35 | 0.23 | ||
| 24 | 5 | Пушицево-сфагновый | 28.39 | 0.34 | 6.22 | 0.23 | ||||
| 30–60 | 10 | ТО (болото Большое) | –1.1 | Фускум | 58°47', 81°11' | 26.80 | 0.59 | 7.68 | 0.20 | |
| 2 | 0 | ТО (Средне-Васюганское) | –0.9 | Средняя тайга | Фускум | 59°13', 78°14' | 26.73 | 0.59 | 6.11 | 0.41 |
| 57 | 10 | Фускум | 27.05 | 0.58 | 2.48 | 0.32 | ||||
| 18 | 5 | Пушицевый | 59º15', 78º16' | 28.05 | 0.38 | 6.20 | 0.18 | |||
| 20 | 5 | ХМАО (Кондинские озера) | –0.7 | Фускум | 60º51', 63º31' | 29.17 | 0.16 | 3.71 | 0.27 | |
| 24 | 7 | Мочажинный | 27.43 | 0.41 | 4.77 | 0.28 | ||||
| 40–50 | 5 | ХМАО (Мухрино) | –1.1 | Фускум | 60°53', 68°42' | 28.48 | 0.38 | 8.21 | 0.33 | |
| 40–50 | 5 | Фускум | 26.80 | 0.62 | 3.59 | 0.36 | ||||
| 30–40 | 7 | ХМАО/ЯНАО (Тету-Мамонтотяй) | –5.4 | Северная тайга | Фускум | 63°07', 75°41' | 26.30 | 0.70 | 6.28 | 0.48 |
| 10–20 | 7 | ЯНАО (Надым) | –5.4 | Мочажинный | 65°17', 72°53' | 25.28 | 0.79 | 5.54 | 0.47 | |
| 10–20 | 8 | Кустарничковый | 28.07 | 0.30 | 4.73 | 0.33 | ||||
| 10–20 | 0 | ЯНАО (Пангоды) | –5.6 | Лесотундра | Фускум | 65°50', 74°29' | 27.63 | 0.49 | 7.00 | 0.39 |
| 30–40 | 10 | Фускум | 28.23 | 0.33 | 6.16 | 0.32 | ||||
| 15–20 | 15 | ЯНАО (Газ-Сале) | –8.4 | Фускум | 67°20', 78°45' | 26.48 | 0.64 | 6.67 | 0.57 | |
| 15–20 | 10 | Мочажинный | 25.32 | 0.79 | 5.32 | 0.61 | ||||
| 10–14 | 20 | ЯНАО (Ямбург) | –8.0 | Тундра | Фускум | 67º55', 74º51' | 26.84 | 0.58 | 2.39 | 0.57 |
| 4–8 | 5 | ЯНАО (Ямал, оз. Сохонто) | –7.7 | Мочажинный | 69°08', 70°15' | 26.37 | 0.68 | 4.79 | 0.68 |
Липидные компоненты выделены из высушенного торфа и растений (3–5 г) экстракцией 7% раствором метанола в хлороформе при 60°C в течение 2 ч. Экстракт сконцентрирован на роторном испарителе и проанализирован методом хромато-масс-спектрометрии с использованием магнитного хромато-масс-спектрометра DFS фирмы Thermo Scientific (Германия). Разделение осуществляли на кварцевой капиллярной хроматографической колонке фирмы “Agilent” DB-5MS 30 м × 0.25 мм × 0.25 мкм; газ-носитель – гелий, внутренний стандарт – дейтероаценафтен. Температура печи была запрограммирована от 80 до 300°C (выдержка 30 мин) при скорости 4°C/мин, а температура инжектора поддерживалась при 270°C. Компоненты были идентифицированы с помощью компьютерной программы анализа данных и библиотеки NIST-05.
В образцах были идентифицированы н-алканы и н-алкан-2-оны. Распределение н-алканов было получено из масс-фрагментограмм по характеристическому иону m/z 57, н-алкан-2-онов – m/z 58 + 59. По распределению н-алканов рассчитаны: индекс средней длины углеродной цепочки (ACL = = Σodd(Cnn)Σodd(Cn), n = 21–33) [2]; коэффициент нечетности (CPI = [Σodd(C21–33) + Σodd(C23–35)]/ (2ΣevenC22–34), n = 21–35) и индекс влажности (Paq = (C23 + C25)/(C23 + C25 + C29 + C31)) [7]. По распределению н-алкан-2-онов рассчитан коэффициент КЕТ = (C23 + C25)/(C27 + C29 + C31) [8].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ботанический состав и степень разложения торфа. Фускум-торф на 70–95% сложен остатками S. fuscum, примесь образуют остатки вересковых кустарничков, пушицы (Eriophorum vaginatum), сосны, иногда гипнового мха (Polytrichum sp.). Мочажинный торф образован остатками S. fallax, S. balticum, S. majus или S. magellanicum, с примесью шейхцерии, клюквы, осок, а в северных регионах – и S. lindbergii, S. squarrosum, пушицы (Eriophorum scheihzeri), карликовой березки (Betula nana), осок. Пушицевый торф на 65–85% состоит из остатков пушицы влагалищной, примесь образуют S. magellanicum, S. fuscum, S. angustifolium, вересковые кустарнички, кора и корешки сосны. Пушицево-сфагновый торф отличается меньшим содержанием остатков пушицы (35%). Кустарничковый торф содержит 75% остатков вересковых кустарничков и морошки (Rubus chamaemorus), примесь дают S. fuscum и пушица влагалищная. Степень разложения торфа для большинства образцов составляет 5–10%.
Биомаркеры в болотных растениях. Как известно, н-алканы являются одними из наиболее представительных классов соединений, обнаруженных в торфе. Они синтезируются высшими растениями и мхами в составе их эпикутикулярных восков [9, 10]. Распределение н-алканов часто используется для определения источника органического вещества в отложениях – из водорослей, водных или наземных растений, каждый из которых характеризуется преобладанием структур с определенной молекулярной массой.
Среди торфообразующих растений распределение н-алканов у сфагновых мхов, которые обычно связаны с более влажными условиями, и у других видов, не относящихся к Sphagnum, явно различается. Согласно литературным данным, в большинстве сфагновых мхов преобладает н-алкан C23, в то время как у других растений, таких как злаки, ситниковые и вересковые, самым распространенным является гомолог C31 [1–3, 11–13, 16]. Есть данные [14, 15], что в пушице, шейхцерии, некоторых видах осок среди н-алканов преобладают гомологи С27–C29, в древесных растениях – С27. Другие (например, бриевые) мхи, в максимальном количестве содержат длинноцепо-чечные н-алканы С27–С31 [16, 17]. Кроме того, у некоторых видов Sphagnum (например, S. capillifolium, S. magellanicum, S. cuspidatum) наблюдалось бимодальное распределение: наряду с первым максимумом на С23 присутствовал второй на C31 [1, 2, 11].
Распределение н-алканов торфообразующих растений приведено в табл. 3. Во всех образцах преобладают нечетные н-алканы в основном от C15 до C33 с унимодальным распределением, максимальным либо при C23–С25, либо C27–С33. Среди вересковых кустарничков у хамедафны максимальное содержание приходится на н-алкан С29, у багульника на С31, тогда как у травяных растений наиболее распространены гомологи C31 и C27. У мха вида S. fuscum максимум приходится на н-алкан С25, у S. subsecundum доля С23 и С25 равны, у остальных сфагновых мхов преобладает гомолог С23, что совпадает с результатами предыдущих исследований [17]. Таким образом, наши данные по изучению торфообразующих растений Западной Сибири показывают, что преобладающими н-алканами у мхов Sphagnum являются C23 и С25, тогда как у других растений наиболее распространены н-алканы с более длинной цепью.
Таблица 3.
Содержание н-алканов в растениях болот (максимальные значения выделены жирным шрифтом)
| Вид растения | н-Алкан (мкг/г сухого растительного материала) | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | Сум-ма | |
| S. magellanicum | 0.14 | 0.24 | 0.77 | 0.32 | 2.62 | 0.33 | 1.79 | 0.14 | 0.75 | 0.09 | 0.21 | 0.06 | 0.08 | 0.02 | 0.03 | 7.59 |
| Scheuchzeria palustris | 0.31 | 0.48 | 2.14 | 1.16 | 4.79 | 1.11 | 7.53 | 1.35 | 17.84 | 1.39 | 9.76 | 0.29 | 1.90 | 0.12 | 0.56 | 50.71 |
| Eriophorum vaginatum | 0.14 | 0.16 | 0.58 | 0.21 | 0.72 | 0.26 | 1.10 | 0.16 | 0.97 | 0.10 | 1.31 | 0.10 | 2.63 | 0.04 | 0.63 | 9.08 |
| Carex globularis | 0.16 | 0.25 | 0.32 | 0.18 | 0.47 | 0.13 | 0.40 | 0.11 | 0.37 | 0.06 | 0.52 | 0.04 | 0.32 | 0.01 | 0.07 | 3.41 |
| S. fuscum | 0.03 | 0.06 | 1.02 | 0.29 | 2.46 | 0.36 | 3.38 | 0.45 | 1.67 | 0.22 | 0.70 | 0.13 | 0.54 | 0.03 | 0.10 | 11.46 |
| S. balticum | 0.04 | 0.07 | 1.35 | 0.26 | 2.99 | 0.49 | 1.64 | 0.37 | 0.94 | 0.14 | 0.70 | 0.05 | 0.16 | 0.01 | 0.05 | 9.27 |
| Ledum palustre | 0 | 0 | 0.12 | 0.14 | 0.35 | 0.21 | 0.86 | 0.31 | 2.13 | 0.65 | 19.99 | 1.02 | 38.93 | 0.96 | 10.64 | 78.80 |
| Chamaedaphne calyculata | 0 | 0 | 0.12 | 0.11 | 1.09 | 0.22 | 1.07 | 0.17 | 2.88 | 0.78 | 13.28 | 0.92 | 5.97 | 0.16 | 0.40 | 27.17 |
| S. fuscum | 0.04 | 0.06 | 2.00 | 0.35 | 4.77 | 0.70 | 6.49 | 0.70 | 3.01 | 0.31 | 0.79 | 0.25 | 0.70 | 0.04 | 0.14 | 20.36 |
| S. papillosum | 0.28 | 0.23 | 1.23 | 0.52 | 3.59 | 0.96 | 2.76 | 0.67 | 1.23 | 0.32 | 0.66 | 0.12 | 0.43 | 0.05 | 0.03 | 13.09 |
| S. subsecundum | 0.11 | 0.15 | 1.52 | 0.46 | 1.76 | 0.72 | 1.77 | 0.65 | 1.03 | 0.34 | 1.24 | 0.17 | 0.81 | 0.05 | 0.05 | 10.84 |
| S. fuscum | 0.27 | 0.32 | 1.81 | 0.53 | 5.52 | 0.69 | 7.09 | 0.39 | 3.25 | 0.63 | 2.31 | 0.91 | 1.61 | 0.53 | 0.44 | 26.30 |
| S. fuscum | 0.07 | 0.17 | 2.31 | 0.46 | 4.54 | 0.67 | 8.52 | 0.68 | 4.98 | 0.80 | 2.01 | 0.83 | 0.98 | 0.36 | 0.24 | 27.61 |
| S. balticum | 0.17 | 0.19 | 3.60 | 0.44 | 5.77 | 0.49 | 2.70 | 0.38 | 1.55 | 0.66 | 1.40 | 0.68 | 1.01 | 0.37 | 0.34 | 19.76 |
| Eriophorum scheuchzeri | 1.24 | 0.57 | 0.99 | 0.46 | 1.99 | 0.57 | 2.68 | 0.50 | 7.64 | 0.27 | 3.83 | 0.09 | 0.75 | 0.02 | 0.06 | 21.67 |
| Ledum palustre | 1.96 | 1.00 | 0.84 | 0.58 | 0.91 | 0.43 | 0.97 | 0.39 | 2.41 | 1.05 | 38.88 | 1.05 | 44.76 | 1.21 | 6.07 | 102.52 |
| Empetrum nigrum | 1.90 | 1.15 | 0.90 | 0.43 | 0.63 | 0.42 | 0.79 | 0.25 | 3.51 | 0.37 | 60.81 | 0.68 | 39.73 | 0.49 | 3.49 | 1.90 |
Распределение н-алкан-2-онов в болотных растениях приведено в табл. 4. Концентрация н-алкан-2-онов во мхах Западной Сибири существенно ниже, чем н-алканов (от 2 до 20 раз), а их ряд простирается в основном от C21 до C33 с преобладанием нечетных гомологов (табл. 3). У всех видов сфагновых мхов максимум в распределении н-алкан-2-онов приходится на С27. Такое распределение н-алкан-2-онов зафиксировано у различных видов сфагновых мхов, произрастающих в таких странах, как Великобритания, США, Испания, Китай [11, 12, 18, 19].
Таблица 4.
Содержание н-алкан-2-онов в болотных растениях Западной Сибири (максимальные значения выделены жирным шрифтом)
| Вид растения | н-Алкан-2-он (мкг/г сухого растительного материала) | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | сум-ма | |
| S. magellanicum | 0.02 | 0.01 | 0.02 | 0 | 0.03 | 0.01 | 0.14 | 0.03 | 0.17 | 0.01 | 0.03 | 0 | 0 | 0 | 0 | 0.47 |
| Scheuchzeria palustris | 0.03 | 0.01 | 0.11 | 0.01 | 0.14 | 0.02 | 0.20 | 0.03 | 0.19 | 0.02 | 0.11 | 0.01 | 0.03 | 0 | 0.01 | 0.91 |
| Eriophorum vaginatum | 0 | 0 | 0.01 | 0.01 | 0.02 | 0.01 | 0.05 | 0.01 | 0.04 | 0 | 0.02 | 0 | 0.04 | 0 | 0.11 | 0.35 |
| Carex globularis | 0.01 | 0.01 | 0.03 | 0.01 | 0.04 | 0.01 | 0.07 | 0.01 | 0.05 | 0 | 0.05 | 0 | 0.03 | 0 | 0.02 | 0.35 |
| S. fuscum | 0.03 | 0 | 0.08 | 0 | 0.28 | 0.06 | 1.09 | 0.39 | 2.97 | 0.24 | 0.60 | 0.03 | 0.09 | 0 | 0 | 5.86 |
| S. balticum | 0.02 | 0 | 0.05 | 0 | 0.07 | 0.02 | 0.26 | 0.09 | 0.45 | 0.04 | 0.09 | 0 | 0.01 | 0 | 0 | 1.10 |
| Ledum palustre | 0 | 0 | 0.03 | 0 | 0.08 | 0.01 | 0.45 | 0.01 | 0.82 | 0.05 | 1.40 | 0.01 | 0.22 | 0.01 | 0.04 | 3.13 |
| Chamaedaphne calyculata | 0 | 0 | 0.01 | 0 | 0.01 | 0 | 0.14 | 0.01 | 0.67 | 0.02 | 0.21 | 0.02 | 0.09 | 0.01 | 0.03 | 1.21 |
| S. fuscum | 0.11 | 0 | 0.07 | 0 | 0.35 | 0.11 | 1.66 | 0.70 | 6.16 | 0.48 | 0.98 | 0.05 | 0.09 | 0 | 0 | 10.76 |
| S. papillosum | 0 | 0 | 0.02 | 0 | 0.05 | 0.01 | 0.14 | 0.04 | 0.26 | 0.01 | 0.03 | 0 | 0.01 | 0 | 0 | 0.57 |
| S. subsecundum | 0 | 0 | 0.02 | 0 | 0.04 | 0.01 | 0.11 | 0.03 | 0.17 | 0.01 | 0.03 | 0 | 0.01 | 0 | 0 | 0.43 |
| S. fuscum | 0 | 0 | 0.06 | 0.01 | 0.32 | 0.06 | 0.46 | 0.12 | 1.43 | 0.10 | 0.38 | 0.01 | 0.07 | 0 | 0.01 | 3.04 |
| S. fuscum | 0 | 0. | 0.01 | 0 | 0.21 | 0.04 | 0.42 | 0.10 | 0.69 | 0.05 | 0.17 | 0.01 | 0.04 | 0 | 0 | 1.72 |
| S. balticum | 0 | 0 | 0.05 | 0 | 0.17 | 0.02 | 0.23 | 0.05 | 0.37 | 0.03 | 0.12 | 0.01 | 0.04 | 0 | 0.01 | 1.09 |
| Eriophorum scheuchzeri | 0 | 0 | 0.02 | 0 | 0.02 | 0 | 0.02 | 0 | 0.03 | 0 | 0.05 | 0 | 0.05 | 0. | 0.01 | 0.20 |
| Ledum palustre | 0 | 0 | 0.06 | 0.02 | 0.21 | 0.02 | 0.49 | 0.05 | 0.38 | 0.03 | 0.21 | 0.01 | 0.03 | 0 | 0.01 | 1.52 |
| Empetrum nigrum | 0.03 | 0 | 0.11 | 0 | 0.39 | 0 | 0.47 | 0 | 0.45 | 0 | 0.45 | 0 | 0.14 | 0 | 0.01 | 0.03 |
Сведения о присутствии н-алкан-2-онов ряда С21–C33 в составе других торфообразующих растений ограничены. Так, эти соединения с преобладанием гомологов С27 и С29 были обнаружены в травяных растениях Китая [19]. В вересковых кустарничках [12] и злаковых растениях [16] северной Испании максимум в распределении н-алкан-2-онов приходился на C27(C29) и C27(C31) соответственно. В составе н-алкан-2-онов стеблей бобовых и ситниковых U. europaeus и J. effusus северной Испании преобладали структуры С27 и С29 [12], а в этих же растениях, отобранных и проанализированных в другое время, был наиболее распространен гомолог C31 [16]. Такие различия могут быть связаны с сезонными изменениями температуры и/или влажности, которые влияют на распределение липидов у растений, что зафиксировано, по крайней мере, у н-алканов [20].
Концентрация н-алкан-2-онов в вересковых кустарничках и травяных растениях болот Западной Сибири значительно ниже, чем н-алканов (в 20–200 раз). В составе н-алкан-2-онов вересковых кустарничков южной тайги преобладают гомологи С27, С29, тундры – С25, С27 (табл. 4). У Пушицы влагалищной из южной тайги преобладает гомолог С33, в то время как у Пушицы Шейхцера в тундре максимальные значения у C29, С31. Гомологи н-алкан-2-онов C25 и С27 наиболее распространены в шейхцерии.
Распределение н-алканов традиционно используется для реконструкции условий торфообразования, таких как температура и влажность [2]. Некоторые исследователи (например, [20]) показали, что современные растения синтезируют соединения с более длинными углеродными цепочками в более теплом климате. Индекс средней длины углеродной цепочки ACL был предложен как показатель для различия преобладания н-алканов с низкой и высокой молекулярной массой [2].
Коэффициент нечетности CPI отражает преобладание гомологов с нечетным числом атомов углерода в молекулах. Индекс CPI в растениях имеет высокие значения, но в захороненном в осадке органическом веществе вследствие диагенеза и микробного поступления со временем снижается, приближаясь к единице в зрелых породах и нефтях [21].
Индекс средней длины углеродной цепочки (ACL) для всех образцов растений колеблется от 24.6 до 30.5 (табл. 1, рис. 1, а), тогда как индекс нечетности (CPI) находится в пределах от 3.3 до 36.0 (табл. 1, рис. 1, в). Сфагновые мхи имеют минимальные значения ACL и CPI, причем распределенные в узком диапазоне – от 25 до 26 и от 4.3 до 6.9 для большинства образцов соответственно. Коэффициент CPI у травяных растений (4.8–9.0) чуть выше, чем у мхов, в то время как у вересковых кустарничков этот показатель характеризуется высокими значениями и широким диапазоном данных (от 10.7 у хамедафны до 36.0 у водяники), т.е., различия в значениях CPI значимы между вересковыми и двумя другими группами растений. Таким образом, невысокие значения CPI могут являться не только следствием эффекта микробной деградации органического вещества в отложениях, но и определяться видовой принадлежностью растений. Индекс ACL также максимален у вересковых кустарничков (29–35), травяные растения показывают промежуточные значения (26.5–28.2). Различия в значениях ACL у разных видов растений, возможно, в большей мере являются следствием их разной видовой принадлежности, чем воздействия факторов окружающей среды [13, 22].
Рис. 1.
Значения индексов ACL (a), Paq (б), CPI (в) и КЕТ (г) в растениях-торфообразователях. Количество образцов: сфагновые мхи (9), травяные растения (4), вересковые кустарнички (4).
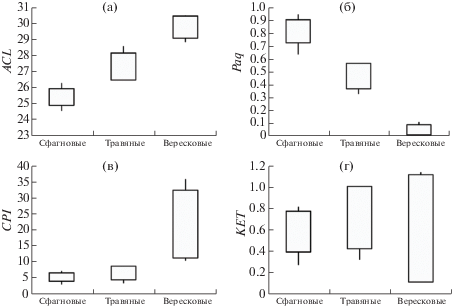
Индекс влажности Paq, разработанный [7] для оценки вклада водных и наземных растений в формирование озерных осадков на основе соотношения типичных для этих групп растений н-алканов C23, C25 и С29, С31, соответственно, успешно применяется и для реконструкции водных условий болот. Было предложено [3] использовать его для определения относительной распространенности видов Sphagnum по сравнению с другими торфообразующими растениями.
Большинство образцов сфагновых мхов, собранных в этом исследовании, имеют высокие значения Paq (0.72–0.90; рис. 1, б). В предыдущих исследованиях было показано, что значения Paq сильно различались у одного вида Sphagnum, произрастающего в разных условиях [23], а также у сфагновых мхов разных видов [11, 24]. Межвидовые и внутривидовые различия распределения н-алканов в сфагновых мхах могут быть ответом на различную влажность участков в пределах торфяника [3]. У травяных растений значения Paq ниже, чем у сфагновых мхов, и находятся в пределах (0.36–0.56), у кустарничков они минимальны и не превышают 0.1 (рис. 1, б). Таким образом, значения Paq мхов, травяных растений и кустарничков исследуемых нами болот Западной Сибири имеют существенные отличия и потенциально могут использоваться для определения доли н-алканов сфагновых мхов и других растений в верховых торфах.
н-Алкан-2-оны, преимущественно нечетныe структуры С21–С33 c преобладанием гомологов С27–С29, широко распространены в торфе и мхах [18, 24–26]. Полученные нами результаты, а также литературные данные свидетельствуют о достаточной стабильности н-алкан-2-онов в различных климатических условиях. Предложено рассматривать эти соединения как индикаторы палеоклимата, для этого авторы работы [8] ввели коэффициент КЕТ. Значения КЕТ находились в соответствии со значениями коэффициента пыльцы Abies/Cyperaceae, на основе которого определены периоды более влажного/менее влажного климата в голоцене. Повышенные коэффициенты KET зафиксированы в торфянике Hongyuan (Китай) в периоды более теплого/влажного климата из-за усиления муссона [8].
В большинстве западно сибирских сфагновых мхов значения коэффициента КЕТ находятся в пределах 0.4–0.8 (рис. 1, г). Для вида S. fuscum отмечена тенденция роста коэффициента со снижением среднегодовой температуры окружающей среды и увеличением влажности климата или обводненности болотных экотопов. В других растениях наблюдается более широкий разброс в значении КЕТ: в травяных растениях – от 0.4 до 1.0, в вересковых кустарничках – от 0.1 до 1.1. Поскольку в других растениях н-алкан-2-оны гораздо менее распространены, чем во мхах, ожидается, что они не вносят значительный вклад в органическое вещество верхового торфа. Следовательно, в сфагновых торфах коэффициент КЕТ можно потенциально рассматривать как индикатор условий их образования.
Биомаркеры в торфах. Типичное распределение н-алканов в липидах торфа показано на рис. 2. Во всех образцах преобладали нечетные н-алканы с распределением в основном от C12 (С13) до C33 (C35) и максимумом либо при C25 (С23) (рис. 2, а), либо C31 (С29) (рис. 2, б). Подобное распределение н-алканов в составе сфагновых мхов-гидрофитов и мочажинном торфе, а также в составе S. fuscum и фускум-торфе отмечено в работах [2, 17, 24, 27, 28]. В пушицевых и кустарничковом торфах преобладали гомологи С27–С31, что характерно для рассмотренных нами трав и кустарничков верховых болот (рис. 2, в, г). Большинство (13) образцов фускум-торфа показали максимум на С25, что отчетливо указывает на мох S. fuscum как основной источник ОВ этих торфов. Однако для трех образцов фускум-торфа наиболее распространенным н-алканом был С31, еще для одного – С29. В 5 мочажинных торфах максимум распределения н-алканов приходился на С23, доминирующий в топяных мхах, еще в двух образцах – на С27 и С29.
Рис. 2.
Параметры состава н-алканов и н-алкан-2-онов в мочажинном торфе лесотундры (а), фускум-торфе средней тайги (б), пушицевом торфе лесостепи (в) и кустарничковом торфе северной тайги (г).
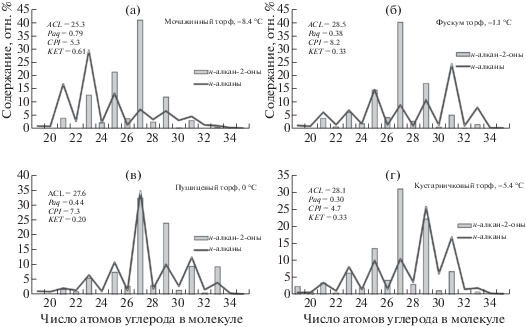
Смещение распределения н-алканов в торфе в высокомолекулярную область по сравнению со мхами может служить индикатором изменений в составе растительности и условиях окружающей среды в процессе торфообразования. Иногда, даже в сфагновом торфе, на распределение н-алканов может влиять присутствие остатков других видов растений, поэтому в этом случае распределение алканов может не соответствовать ботаническому составу торфа [14, 29]. Кроме того, вклад н-алканов в состав органического вещества торфа у разных видов растений различается, что видно, например, по более высокому содержанию н-алканов в вересковых кустарничках по сравнению с другими торфообразующими растениями [2, 12, 30]. В большинстве западно-сибирских сфагновых торфов вклад растений, не относящихся к сфагновым мхам, довольно ограничен, т.е. преобладание н-алканов C23 (С25) свидетельствует о том, что другие виды не вносят значительный вклад в формирование торфа. Только в формирование некоторых образцов торфа, в которых преобладают гомологи С27–С31, другие растения, а именно травы, вересковые кустарнички, некоторые древесные растения, по-видимому, вносили больший вклад в исходные растительные сообщества в сравнении с результатами, полученными при определении ботанического состава, где их количество незначительно [16]. Эти растения более активно разлагаются в торфе по сравнению со сфагновыми мхами. Поскольку интенсивная гумификация растений происходит преимущественно в верхнем аэробном слое торфяной залежи, то более высокое содержание высокомолекулярных алканов С27–С31 свидетельствует о более теплом и/или сухом климате во время отложения этого торфа. Следовательно, по распределению высокомолекулярных н-алканов в торфе можно проводить более качественную реконструкцию исходных растительных сообществ и климатических условий.
Ряд н-алкан-2-онов в торфах простирался в основном от C19 до C33, со значительным преобладанием нечетных гомологов. В целом было явное преобладание С27, в сфагновых торфах на втором месте по содержанию были гомологи С25 и С29 (рис. 2, а, б), в пушицевых и кустарничковом – С29 (рис. 2, в, г).
Сравнительный анализ состава биомаркеров в растениях и торфах верховых болот Западной Сибири. Результаты исследования состава н-алканов и н-алкан-2-онов в растениях верховых болот могут быть использованы для интерпретации источников этих соединений в торфе. В образцах торфа средние значения индекса ACL (26.3–28.1) (табл. 2, рис. 3, а) близки к средним значениям этого показателя для травяных растений (26.5–28.2) (табл. 1, рис. 1, а). Среднее значение Paq (0.37–0.67) в поверхностных торфах также сходно с таковым у травяных растений (0.36–0.56). Значения коэффициента КЕТ (0.3–0.6) в сфагновом торфе (рис. 3, г) несколько ниже, чем у мхов (0.4–0.8) (рис. 1, г). Таким образом, сфагновый торф имеет более высокое значение коэффициентов ACL и низкое – Paq и КЕТ по сравнению со мхами. Авторы работы [23], получившие подобные результаты при изучении растений и торфа Китая, предложили другое объяснение. Они предположили, что н-алканы C23 и C25, доминирующие во мхах, могут подвергаться преимущественной деградации по сравнению с их гомологами с более длинными цепями, что маскирует ведущий вклад в торф н-алканов сфагновых мхов. По нашему мнению, смещение распределения н-алканов в высокомолекулярную область в сфагновых торфах по сравнению со мхами, вероятнее всего, обусловлено тем, что для западносибирских олиготрофных сообществ со S. fuscum типичны присутствие и даже значительное участие сосны, вересковых кустарничков и пушицы, а для топяных – шейхцерии, осок, иногда пушицы. В связи со значительной подверженностью этих растений деструкции в процессе торфообразования [31, 32] содержание их остатков в торфах резко понижается, а остатков сфагновых мхов соответственно возрастает, обычно до 90–95%. Однако продукты распада органического вещества, в том числе н-алканы, сохраняются в торфе. Сфагновый торф имеет более низкие значения индекса нечетности CPI (5.4–7.4) (рис. 3, в), чем травяные и особенно кустарничковые растения (рис. 1, в), что подтверждает влияние разложения этих групп растений на состав н-алканов в торфах.
Рис. 3.
Значения индексов ACL (a), Paq (б), CPI (в) и КЕТ (г) в верховых торфах. Количество образцов: мочажинный торф (7), фускум-торф (18), пушицевый + кустарничковый (4), суммарно (29).
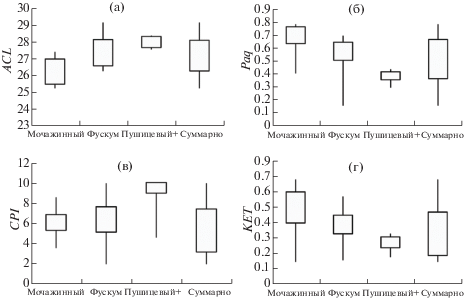
Состав торфа и в том числе его липидной части помимо вида преобладающего растительного источника определяется еще и другими факторами, прежде всего гидротермическими условиями болотных экотопов и климата во время отложения торфа. Низкие величины индекса ACL и высокие значения индекса влажности Paq зафиксированы для образцов верхового торфа северной тайги, лесотундры и тундры Западной Сибири – районов с наиболее низкой среднегодовой температурой воздуха (рис. 4, а, б).
Рис. 4.
Параметры состава н-алканов и н-алкан-2-онов в верховых торфах разных природно-климатических зон Западной Сибири.
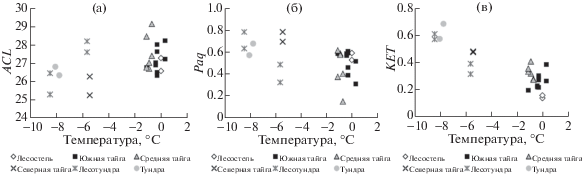
Согласно полученным нами данным, наиболее выраженная связь со средней температурой окружающей среды зафиксирована для коэффициента КЕТ (рис. 4, в): его значения увеличиваются в образцах торфа в направлении от юга к северу параллельно снижению температуры и увеличению влажности климата или обводненности болотных экотопов. Коэффициенты КЕТ для н-алкан-2-онов и Paq для н-алканов меняются однонаправленно от южных природно-климатических зон к северным, однако, степень корреляции для КЕТ существенно выше. Таким образом, для верховых торфов коэффициент КЕТ, рассчитанный по составу н-алкан-2-онов, потенциально может быть полезным маркером гидротермических условий торфообразования, но необходимы дальнейшие исследования в этом направлении.
ВЫВОДЫ
1. Изучены возможные взаимосвязи между молекулярным составом липидных биомаркеров, таких как н-алканы и н-алкан-2-оны, и различными видами растений (сфагновых мхов, травяных растений, вересковых кустарничков) и торфов верховых болот, произрастающих в разных природно-климатических зонах Западной Сибири.
2. Для исследованных растений значения коэффициента ACL понижаются, а Paq повышаются от вересковых кустарничков к травяным растениям и далее к сфагновым мхам, что соответствует экологическим требованиям этих групп растений к степени обводненности болотных экотопов. Существенные отличия Paq разных групп растений потенциально могут использоваться для определения доли их н-алканов в верховых торфах.
3. Виды торфа при низкой степени разложения наследуют распределение н-алканов и н-алкан-2-онов, характерное для исходных растительных сообществ. Так, преобладающим гомологом н-алканов в большинстве видов топяных сфагновых мхов и мочажинном торфе является C23, у мха S. fuscum и фускум-торфа доминирует гомолог С25. Максимум в распределении н-алкан-2-онов всех мхов и сфагновых торфов приходится на гомолог С27.
4. Средние значения коэффициента ACL в сфагновых торфах выше, а Paq ниже, по сравнению со мхами, однако это не исключает ведущего вклада в торф н-алканов из сфагновых мхов, так как более низкомолекулярные соединения могут подвергаться преимущественной деградации по сравнению с высокомолекулярными.
5. Средние значения коэффициента Paq в сфагновых торфах выше по сравнению с кустарничковыми и пушицевыми, что соответствует водным режимам их формирования. Значительное снижение показателей Paq для некоторых сфагновых торфов по сравнению со средним значением свидетельствует о вторичном изменении их свойств, возможно, в связи с возрастанием дренированности участка болота или влиянием пожаров.
6. Установленная тенденция увеличения значений коэффициента КЕТ в образцах торфа при понижении средней температуры окружающей среды, вероятнее всего связанная со снижением микробиологической активности при деструкции торфа в более холодных климатических условиях, свидетельствует о возможности использования этого коэффициента как индикатора температурного режима болотных палеоэкотопов и палеоклимата.
7. Существенное варьирование показателей Paq, KET и CPI в торфах одного вида, формирующихся в сходных природно-климатических условиях, также может быть обусловлено вторичным изменением их свойств из-за резких смен водного режима болотных экотопов в условиях континентального климата Западной Сибири.
Список литературы
Nott C.J., Xie S., Avsejs L.A., Maddy D., Chambers F.M., Evershed R.P. // Org. Geochem. 2000. V. 31. P. 231.
Pancost R.D., Baas M., van Geel B., SinningheDamsté J.S. // Org. Geochem. 2002. V. 33. P. 675.
Nichols J.E., Booth R.K., Jackson S.T., Pendall E.G., Huang Y. // Org. Geochem. 2006. V. 37. P. 1505.
Ortiz J.E., Gallego J.L.R., Torres T., Díaz-Bautista A., Sierra C. // Org. Geochem. 2010. V. 41. P. 454. https://doi.org/10.1016/j.orggeochem.2010.02.003
Naafs B.D.A., Inglis G.N., Blewett J., McClymont E.L., Lauretano V., Xie S., Evershed R.P., Pancost R.D. // Glob. Planet. Chang. 2019. V. 179. P. 57. https://doi.org/10.1016/j.gloplacha.2019.05.006
Тюремнов С.Н., Ларгин И.Ф., Ефимова С.Ф., Скобеева Е.И. Торфяные месторождения и их разведка. М., Недра, 1977. 264 с.
Ficken K.J., Li B., Swain D.L., Eglinton G. // Org. Geochem. 2000. V. 31. P. 745.
Zheng Y., Zhou W., Liu X., Zhang C.L. // Org. Geochem. 2011. V. 42. P. 25. https://doi.org/10.1016/j.orggeochem.2010.10.003
Eglinton G., Hamilton R.J. // Science. 1967. V. 156. P. 1322.
Freeman K.H., Pancost R.D. Biomarkers for Terrestrial Plants and Climate. In Treatise on Geochemistry: Second Edition. Elsevier Inc, 2013. V. 12. P. 395. https://doi.org/10.1016/B978-0-08-095975-7.01028-7
Baas M., Pancost R., van Geel B., Sinninghe Damsté J.S. // Org. Geochem. 2000. P. 31. № 6. P. 535. https://doi.org/10.1016/S0146-6380(00)00037-1
Ortiz J.E., Díaz-Bautista A., Aldasoro J.J., Torres T., Gallego J.L.R., Moreno L., Estébanez B. // Org. Geochem. 2011. V. 42. P. 586. https://doi.org/10.1016/j.orggeochem.2011.04.009
Bush R.T., McInerney F.A. // Geochim. Cosmochim. Acta 2013. V. 117. P. 161. https://doi.org/10.1016/j.gca.2013.04.016
Andersson R.A., Kuhry P., Meyers P., Zebühr Y., Crill P., Mörth M. // Org. Geochem. 2011. V. 42. P. 1065. https://doi.org/10.1016/j.orggeochem.2011.06.020
Ronkainen T., McClymont E.L., Väliranta M., Tuittila E.-S. // Org. Geochem. 2013. V. 59. P. 1. https://doi.org/10.1016/j.orggeochem.2013.03.005
Ortiz J.E., Borrego Á.G., Gallego J.L.R., Sánchez-Palencia Y., Urbanczyk J., Torres T., Domingo L., Estébanez B. // Org. Geochem. 2016. V. 95. P. 41. https://doi.org/10.1016/j.orggeochem.2016.02.009
Серебренникова О.В., Стрельникова Е.Б., Русских И.В. // Химия растительного сырья. 2019. № 3. С. 225. [Khimiya Rastitel’nogo Syr’ya, 2019. № 3. P. 225].https://doi.org/10.14258/jcprm.2019034558
Nichols J.E., Huang Y. // Org. Geochem. 2007. V. 38. P. 1972. https://doi.org/10.1016/j.orggeochem.2007.07.002
Zhang Y., Huang X., Wang R., Naafs B.D.A. // Chem. Geol. 2020. V. 544. P. 119622. https://doi.org/10.1016/j.chemgeo.2020.119622
Bush R.T., McInerney F.A. // Org. Geochem. 2015. V. 79. P. 65.
Didyk B.M., Simoneit B.R.T., Pezoa L.A., Riveros M.L., Flores A.A. // Atmos. Environ. 2000. V. 34. P. 1167.
Diefendorf A., Freimuth E. // Org. Geochem. 2017. V. 103. P. 1.
Zhao B., Zhang Y., Huang X., Qiu R., Zhang Z., Meyers P.A. // Org. Geochem. 2018. V. 124. P. 1. https://doi.org/10.1016/j.orggeochem.2018.07.008
Bingham E.M., McClymont E.L., Väliranta M., Mauquoy D., Roberts Z., Chambers F.M., Pancost R.D., Evershed R.P. // Org. Geochem. 2010. V. 41. P. 214.
Zheng Y., Zhou W., Meyers P.A., Xie S. // Org. Geochem. 2007. V. 38. P. 1927.
Andersson R.A., Meyers P.A. // Org. Geochem. 2012. V. 53. P. 63.
Серебренникова О.В., Стрельникова Е.Б., Русских И.В., Дучко М.А. // ХТТ. 2017. № 4. С. 3. [Solid Fuel Chemistry, 2017. № 51. P. 195. https://doi.org/10.3103/S0361521917040097].https://doi.org/10.7868/S0023117717040016
Серебренникова О.В., Дучко М.А., Коронатова Н.Г., Стрельникова Е.Б. // ХТТ. 2018. № 1. С. 38. [SolidFuelChemistry, 2018. № 52. P. 36. https://doi.org/10.3103/S0361521918010081].https://doi.org/10.7868/S0023117718010085
Schellekens J., Buurman P. // Geoderma. 2011. V. 164. P. 112.
Huang X., Xue J., Zhang J., Qin Y., Meyers P.A., Wang H. // Org. Geochem. 2012. V. 44. P 1. https://doi.org/10.1177/0959683612450202
Vishnyakova E.K., Koronatova N.G., Kosykh N.P. // IOP Conference Series: Earth and Environmental Science. 2018. C. 012025. https://doi.org/10.1088/1755-1315/201/1/012025
Никонова Л.Г., Головацкая Е.А., Курьина И.В., Курганова И.Н. // Почвоведение. 2019. № 9. С. 1092. [Eurasian Soil Science, 2019. V. 52. № 9. P. 1101. https://doi.org/10.1134/S1064229319090060].https://doi.org/10.1134/S0032180X19090065
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива


