Химия твердого топлива, 2022, № 1, стр. 49-56
ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ COS С ПОЛУЧЕНИЕМ CO И СЕРЫ: ПОБОЧНЫЕ ПРОДУКТЫ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ
О. Тайчман 1, *, В. Каплан 1, **, Э. Вахтель 1, ***, И. Любомирский 1, ****
1 Department of Molecular Chemistry and Materials Science Weizmann Institute of Science
7610001 Rehovot, 234 Herzl St, PO Box 26, Israel
* E-mail: oritaichman@gmail.com
** E-mail: valery.kaplan@weizmann.ac.il
*** E-mail: ellen.wachtel@weizmann.ac.il
**** E-mail: Igor.Lubomirsky@weizmann.ac.il
Поступила в редакцию 12.05.2021
После доработки 12.05.2021
Принята к публикации 13.10.2021
- EDN: JIXWQV
- DOI: 10.31857/S0023117722010078
Аннотация
Двуокись серы в отходящих газах угольных электростанций представляет опасность как для окружающей среды, так и для здоровья людей. Очистка бедных по содержанию серы отходящих газов эвтектическим расплавом карбонатов щелочных металлов при температуре 823 K может уменьшить эти опасности, но для эффективного и экономичного процесса необходимо проводить регенерацию карбонатного расплава, а любые образующиеся загрязняющие вещества, в частности карбонилсульфид (COS), известный нейротоксин, должны быть удалены. Чтобы оценить возможности стадии регенерации карбонатного расплава как заключительной стадии глубокой очистки отходящих газов угольных электростанций было изучено термическое разложение COS. Увеличение времени пребывания в реакционном пространстве от 7 до 44 мин привело к заметному увеличению степени термического разложения COS. Степень разложения COS составила ≈ 76% после 44 мин пребывания в реакторе при 823 К. Ни при каких условиях проведения опытов не были обнаружены другие продукты реакции, кроме CO и элементарной серы.
ВВЕДЕНИЕ
Очистка отходящих газов угольных ТЭЦ. В публикациях [1, 2] описан процесс регенерации эвтектических карбонатных расплавов, которые использовались для очистки разбавленных сернистых отходящих газов, выбрасываемых угольными электростанциями от SO2 [3]. Реакция очистки газов протекает при температуре 673–923 K и может быть записана как:
(1)
${\text{M}}{{{\text{e}}}_{2}}{\text{C}}{{{\text{O}}}_{3}} + {\text{S}}{{{\text{O}}}_{2}}({\text{г}}) = {\text{M}}{{{\text{e}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} + 2{\text{C}}{{{\text{O}}}_{2}}({\text{г}}),$Проведенные эксперименты показали, что почти полное удаление серы из расплава возможно при 823 K и реакция протекает достаточно быстро для крупномасштабного процесса. Этот процесс обеспечивает практическое решение двух проблем: (а) при 823 К температура достаточно низкая, чтобы реакционная ячейка из нержавеющей стали с высоким содержанием хрома была стабильной по отношению к эвтектическому расплаву; и (б) удаление серы в форме COS обеспечивает значительную свободу выбора конечного продукта. Было показано, что метод является практичным и экономичным для диапазона концентраций серы в отходящих газах, от 2 об. % (минимум для производства серной кислоты) до менее 80 ppm SO2.
Известны альтернативные методы очистки отходящих газов, например с использованием водной суспензии порошкообразного карбоната или гидроксида кальция в качестве нейтрализующего агента [5, 6]. Тем не менее отходящие газы, содержащие менее 2 об. % SO2, часто выбрасываются в атмосферу [7] на том основании, что их обработка слишком дорогостоящая [8]. Это привело к ежегодным глобальным выбросам диоксида серы в атмосферу в размере 100 млн тонн (в 2010 г.) [9]. Однако карбонилсульфид, который в нашем случае образуется при регенерации эвтектического расплава, также является загрязнителем окружающей среды [10]. Целью настоящего исследования было изучить возможность термического разложения карбонилсульфида при T ≈ 673–973 K с получением элементарной серы из очень разбавленных сернистых отходящих газов. Наше внимание было сосредоточено на практической осуществимости удаления COS при более низких температурах (приблизительно 823 К), чтобы избежать дополнительных затрат на дальнейшее нагревание газов, выходящих из карбонатного эвтектического расплава. Кроме того, в лабораторном эксперименте мы не были ограничены ни временем пребывания газа в реакционной камере, ни концентрацией реагентов.
Химия и термодинамика реакций термического разложения COS. Более ранние исследования химии и термодинамики реакций термического разложения COS часто были ограничены временем, температурой и концентрациями COS, которые обычно имеют место в передней части колонны Клауса. Подробные экспериментальные данные [11, 12] были получены в лабораторных кварцевых трубчатых реакторах в диапазоне концентраций COS (0.20–2.33 мол. % в смеси с азотом) при температуре 1073–1373 К. Наиболее вероятные пути термического разложения COS известны [12]:
В [11] было показано, что действительно при 1073 К не было обнаружено разложения COS из смеси, состоящей из 2 мол. % COS и азота при времени пребывания 0.5 с в горячей зоне реактора. Однако при 1328 К, когда время пребывания увеличилось до 1 с, степень разложения увеличилась до 88.5%. Параллельное увеличение концентрации COS в 10 раз мало изменило измеренную степень разложения COS. Разница между термодинамически предсказанной и измеренной [13] степенью разложения COS увеличивается в большей степени при низких температурах. Например, при 973 K прогнозируется равновесная конверсия COS < 30% с чистым (100 мол. %) газом COS [13]; однако при концентрации COS 1 мол. % в азоте может быть достигнуто равновесное превращение примерно 70%. Karan и др. [13] объясняют это отличие тем фактом, что идеальная газовая смесь сдвигает термодинамическое равновесие в таком направлении, чтобы увеличить общее количество молей газа; поэтому разложение COS благоприятно для более низкого парциального давления COS. Clark и др. [11] и Karan и др. [13] показали, что реакция (4) доминирует над реакцией (3), несмотря на результаты термодинамического расчета. Хотя причина этого несоответствия не была идентифицирована, это было предварительно приписано кинетическим ограничениям реакций, потребляющих COS [14]. Clark и др. [11] предположили существование переходного состояния, в котором реакция (4) может быть предпочтительнее реакции (3). Важно было бы получить надежные константы скорости конкурирующих реакций (3), (4) разложения COS в газовых смесях, но на сегодняшний день они недоступны. Кроме того, выражение скорости реакции первого порядка может быть неадекватным для описания кинетического поведения разложения COS. Однако кинетика реакции может либо противодействовать, либо способствовать сдвигу равновесия; в некоторых случаях кинетика реакции может быть решающим фактором, который следует учитывать.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В качестве исходного материала использовали газовую смесь (0.26 об. дол. COS, 0.74 об. дол. N2) и чистый CO2 (аналитическая погрешность ±2%; Airgas Specialty Gas Company, США; поставщик: Gas Technologies Company, Израиль). Эксперименты также проводились в присутствии потенциальных катализаторов: 1) древесного угля; 2) порошка аморфного γ-оксида алюминия собственного синтеза; 3) стандартного автомобильного каталитического конвертера с сотовой структурой с предварительной обработкой раствором царской водки для удаления платины и палладия или без предварительной обработки. Аморфный γ-оксид алюминия получали термическим разложением AlCl3 ⋅ 6H2O (99.8%) (Alfa Aesar) при 823 К на воздухе. Размеры кусков каталитического конвертера и древесного угля: ~(30 × 15 × 15) мм; размер зерна порошкаγ-оксида алюминия ~300–500 мкм. Удельная поверхность каталитического конвертера составляла 100 м2/г, тогда как для порошка γ-оксида алюминия и древесного угля она составляла 70 и 40 м2/г соответственно.
Методы. Термическое разложение COS проводили в течение ≤2 ч в лабораторной печи с регулируемой температурой при температуре 773–1273 К (рис. 1).
Рис. 1.
Лабораторная установка: 1 – печь с терморегулятором, 2 – кварцевый проточный реактор, 3 – пробоотборники газа, 4 – смеситель газа, 5 – расходомеры, 6 – клапаны, 7 – баллон (COS + N2), 8 – баллон с СО2, 9 – хромель-алюмелевая термопара, 10 – датчик температуры, 11 – сосуд для очистки газа, 12 – ловушка для серы при комнатной температуре, 13 – кристаллы серы, 14 – катализатор (в некоторых экспериментах).
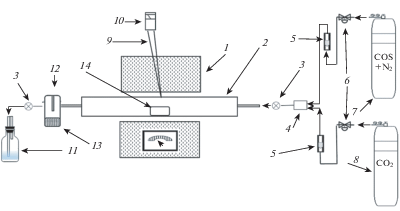
Изготовленный по индивидуальному заказу кварцевый трубчатый реактор диаметром (D) = = 3.6 см и длиной (L) = 100 см был помещен в печь с нагревательным элементом Kanthal (FeCrAl). Объем реактора в горячей зоне с постоянной температурой составлял 437 см3. Расход газа варьировался: 10, 20 или 60 мл/мин, и измерялся калиброванными расходомерами (New-Flow (Golden Mountain Enterprise Co., Ltd.)). При использовании катализаторов их помещали в середину горячей зоны печи (рис. 1). Среднее заполнение поперечного сечения реактора катализатором было следующим: для автомобильного катализатора и кусков угля – 40–60%; для порошка γ-оксида алюминия – 10–20%. Среднее время пребывания в горячей зоне печи при расходе 10 мл/мин составляло 44 мин; для расхода 20 мл/мин – 22 мин и для расхода 60 мл/мин – 7 мин. Газовая смесь (COS и N2) в некоторых экспериментах с примесью СО2 вводилась в реакционную зону печи. Для отбора проб газа было две точки: первая – после смесителя, но перед входом в реактор; а вторая– после выхода из печи. Любой твердый материал, образовавшийся в результате термического разложения, осаждался в ловушке при комнатной температуре, расположенной перед второй точкой отбора проб.
Состав газовых смесей (рассматриваемых как идеальные газы) как до, так и после прохождения через горячую зону реактора был количественно определен с помощью газового хроматографа SRI 8610C (SRI Instruments, США) с детектором теплопроводности и двумя колонками: MolecularSieve® (для газов с низким молекулярным весом) и HayeSep® (для газов с более высоким молекулярным весом) (SRI Instruments, США). Температура колонок варьировалась от 343 до 393 К. Калибровка газового хроматографа была выполнена путем ввода чистых газов с известным временем удерживания на колонке. Каждый из этих газов потенциально присутствовал в газовой фазе: N2, CO2, COS, O2 и CO (Компания Gas Technologies, Израиль: чистота газа 99.99%). Жидкий CS2 вводили непосредственно в реактор для калибровки газового хроматографа и измерения времени удерживания его хроматографической колонкой. В качестве газа-носителя использовался гелий. Объем пробы для анализа составлял 1 мл. Точность определения газов составляла примерно ±3 об. %.
Элементарная сера, собранная из ловушки при комнатной температуре, была исследована и проанализирована с помощью energy dispersive X-rayfluorescence spectroscopy (EDS, Leo Supra SEM, Zeiss, Germany) и методом powder X-ray diffraction (Rigaku, TTRAX III theta-theta goniometer; fixed monochrometer; 10kW, Cuanode; variable divergence slit, step size, 0.02o; speed, 1opermin.).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Расчет энергии Гиббса и константы равновесия для термического разложения чистого газообразного COS. Расчеты проводились с использованием компьютерной программы, основанной на стандартных значениях энтальпии разложения соединения (ΔH) и энтропии (ΔS) для чистых (100 мол. %) веществ [15], а также на значениях из NIST-JANAF Thermochemical Tables [16]. Как отмечалось выше, газообразный карбонилсульфид, скорее всего, разлагается по двум вариантам:
Например, энергия Гиббса в реакции (3) рассчитывалась как сумма энергий Гиббса для реакций 5(a)–(c):
(7)
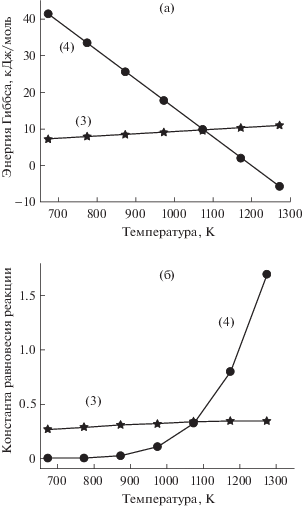
$\begin{gathered} {\text{COS}} = {\text{C}} + 0.5{{{\text{O}}}_{2}} + 0.5{{{\text{S}}}_{2}},\quad ({\text{a}}) \\ 0.5{\text{C}} + 0.5{{{\text{O}}}_{2}} = 0.5{\text{C}}{{{\text{O}}}_{2}},\quad \,\,\,\,({\text{b}}) \\ 0.5{\text{C}} + 0.5{{{\text{S}}}_{2}} = 0.5{\text{C}}{{{\text{S}}}_{2}}.\quad \,\,\,\,\,\,({\text{c}}) \\ \end{gathered} $Отметим, что в интересующем температурном диапазоне (773–1273 K) сера существует в основном в виде димера S2, а не в виде более часто наблюдаемого (при комнатной температуре) октамера S8 или промежуточных аллотропных форм. Результаты термодинамических расчетов, т.е. энергия Гиббса и константы равновесия для двух конкурирующих реакций, представлены в табл. 1 и на рис. 2. Из этих расчетов очевидно, что реакция (4) доминирует при температуре ниже 1073 К, а выше этой температуры реакция (3) термодинамически более благоприятна. Разбавление COS инертным газом-носителем, а также кинетика реакций во внимание не принимались.
Таблица 1.
Расчеты энергии Гиббса и константы равновесия как функции температуры для двух наиболее вероятных путей разложения чистого (100 мол. %) газа COS
| Темпе- ратура, K | COS (g) → 0.5CO2 (g) + 0.5CS2 (g) | COS (g) → CO (g) + 0.5S2 (g) | ||
|---|---|---|---|---|
| энергия Гиббса (кДж/моль) | константа равновесия | энергия Гиббса (кДж/моль) | константа равновесия | |
| 673 | 7.3 | 2.70E-01 | 41.4 | 6.10E-04 |
| 773 | 7.9 | 2.90E-01 | 33.5 | 5.50E-03 |
| 873 | 8.5 | 3.10E-01 | 25.6 | 3.00E-02 |
| 973 | 9.1 | 3.20E-01 | 17.7 | 1.10E-01 |
| 1073 | 9.8 | 3.40E-01 | 9.9 | 3.30E-01 |
| 1173 | 10.4 | 3.50E-01 | 2.1 | 8.00E-01 |
| 1273 | 11.0 | 3.50E-01 | –5.6 | 1.70E+00 |
Рис. 2.
Энергия Гиббса (а) и константа равновесия (б) как функция температуры для термического разложения чистого (100 мол. %) исходного газа COS по реакциям (3) и (4) с использованием стандартных значений из NIST-JANAF Thermochemical Tables [16].
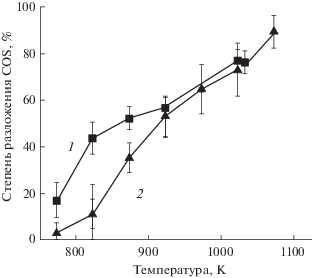
Влияние продолжительности пребывания газа в реакторе и температуры в рабочем пространстве реактора на степень разложения COS. Для изучения термического разложения COS в диапазоне температур 773–1273 K с концентрацией исходного газа COS 30 мол. % в смеси с азотом использовались стандартные протоколы газовой хроматографии (см. раздел Обсуждение результатов). Результаты показаны на рис. 3.
Рис. 3.
Степень термического разложения COS (%) в зависимости от температуры и времени пребывания в печи: 1 – 44 мин; 2 – 22 мин; 3 – 7 мин (исходная концентрация COS составляла 30 мол. % в смеси с азотом; было выполнено 4–7 повторных измерений; погрешность измерений приведена на графике); 4 – расчетная равновесная степень термического разложения COS (%) по данным [13]; 5 – экспериментальные данные из работы [13]: время пребывания газа при температуре от 1.2 до 1.5 с; исходная концентрация COS 2 мол. %.
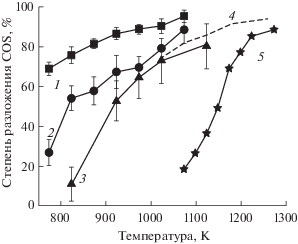
При более низких температурах и относительно быстром потоке газа через горячую зону печи 60 мл/мин (время пребывания 7 мин) не наблюдалось значительной степени разложения COS (рис. 3, кривая 3). Однако с повышением температуры степень разложения COS также увеличивалась и при 923 К составила 52% (рис. 3, кривая 3). Увеличение времени пребывания при фиксированной температуре печи привело к резкому увеличению степени термического разложения COS (рис. 3, кривые 1, 2). Степень разложения тем больше, чем выше температура, и она максимальна при самых низких скоростях потока, при более длительном времени пребывания газа в зоне реакции. Кривая 4 (пунктирная линия) на рис. 3 представляет собой кривую равновесного разложения чистого COS по данным [13]. Кривая 5 на рис. 3 взята из данных [13]. Очевидно, что для равновесного разложения чистого COS время пребывания при более низких температурах печи должно быть более 7 мин, что согласуется с данными [11, 13]. Ни при какой температуре и продолжительности опыта в реакторе не образовывались какие-либо другие продукты реакции, кроме CO (обнаруженного на газовых хроматограммах) и элементарной серы (осажденной в ловушке при комнатной температуре).
Прогнозируемое и наблюдаемое разложение COS. Результаты данной работы, а также работ [10, 13] показывают, что степень разложения COS значительно выше, чем прогнозируемая на основе энергии Гиббса и констант равновесия, рассчитанных для чистых веществ. Прогнозируемая равновесная степень разложения COS может быть легко рассчитана из данных [16]. Результаты расчетов представлены в табл. 2.
Таблица 2.
Сравнение расчетной степени термического разложения чистого (100 мол. %) COS из данных NIST-JANAF для чистых веществ [15, 16] и экспериментальных результатов для газовой смеси 30 мол. % COS с N2 при времени пребывания в горячей зоне печи 44 мин
| Температура, K | Расчетная степень термического разложения COS, % | Измеренная степень термического разложения COS, % |
|---|---|---|
| 773 | 5.0 | 68.9 ± 2.6 |
| 823 | 8.7 | 75.4 ± 2.4 |
| 873 | 14.1 | 79.8 ± 0.9 |
| 923 | 21.1 | 83.7 ± 1.1 |
| 973 | 29.6 | 86.8 ± 0.8 |
| 1023 | 39.1 | 85.9 ± 1.6 |
Подбор катализаторов для реакции термического разложения COS. Чтобы увеличить степень термического разложения COS и ускорить реакции его разложения при более низких температурах процесса, были проведены эксперименты с добавлением возможных катализаторов. Несколько материалов были исследованы в качестве катализаторов разложения COS, их свойства описаны в экспериментальном разделе. В качестве катализаторов использовались древесный уголь; порошок аморфного γ-оксида алюминия собственного синтеза и стандартный автомобильный каталитический конвертер с сотовой структурой с предварительной обработкой царской водкой для удаления платины и палладия или без предварительной обработки. Время пребывания газа в горячей зоне реактора – 44 мин. Было выполнено 4–7 повторных измерений (погрешность измерений приведена на графике).
Не было обнаружено заметного каталитического эффекта на реакцию разложения COS среди всех протестированных катализаторов (рис. 4).
Рис. 4.
Влияние потенциальных катализаторов на степень разложения COS в зависимости от температуры: 1 – при отсутствии катализатора; 2 – в присутствии катализатора; γ-оксид алюминия (а); уголь (б); автомобильный каталитический конвертер (в).
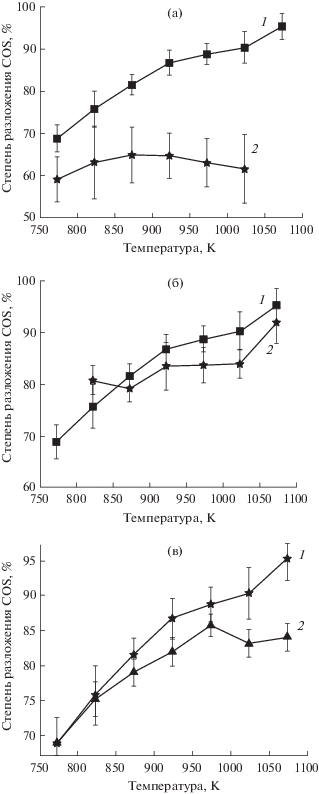
В работе [13] предполагалось, что стенка кварцевого реактора может действовать, как гетерогенный катализатор термического разложения COS, но авторы пришли к выводу, что лишь небольшая часть химических взаимодействий, связанных с термическим разложением COS, может быть катализирована при взаимодействии со стенкой реактора и подавляющее большинство этих химических взаимодействий были гомогенными газофазными реакциями, протекающими в газовом объеме.
Влияние CO2на разложение COS. Измерения проводились при различных температурах с добавлением CO2 в исходную газовую смесь. Поскольку CO2 – продукт регенерации карбонатно-сульфатного расплава после очистки отходящих газов угольных тепловых станций (уравнение (2)), он будет присутствовать в любой промышленной системе. В соответствии с результатами [10] наши измерения показали, что присутствие СО2 увеличивает степень разложения COS на СО и элементарную серу при температурах ниже 923 К и при времени пребывания в газе 7 мин. При температуре выше 923 К такого увеличения степени разложения COS не наблюдалось (рис. 5). Было выполнено 4–7 повторных измерений (погрешность измерений приведена на графике). Согласно результатам газохроматографического анализа, СО2 действовал как разбавитель инертного газа при всех исследованных температурах: объем (%) СО2 был постоянным в исходной и конечной газовых смесях с точностью до экспериментальной ошибки. По принципу Ле-Шателье, добавление CO2 должно уменьшить степень разложения COS (см. уравнение (3)), но должно увеличить количество COS, который разлагается (см. уравнение (4)). Кроме того, в исходной смеси (COS + N2 + CO2) содержание COS меньше (20 мол. %), чем в смеси (COS + N2), что, как отмечено выше, также способствует его термическому разложению.
Рис. 5.
Влияние добавки CO2 к газовой смеси COS + N2 на степень разложения COS в зависимости от температуры реактора (время пребывания 7 мин); концентрация исходного сырья COS 20 мол. %: 1 – (COS + + N2 + CO2), 2 – (COS + N2).
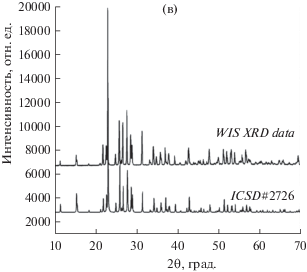
Элементарная сера и CO – потенциально ценные побочные продукты регенерации расплава. На фотографии затвердевшего материала из ловушки при комнатной температуре видны ярко-желтые кристаллы (рис. 6, а). EDS-анализ затвердевших образцов выявил элементарную серу (рис. 6, б). К сожалению, не удалось идентифицировать источник кремния и кислорода, также присутствующих в спектре EDS. Порошковые дифрактограммы (рис. 6, в) подтвердили идентификацию кристаллической фазы как S8, симметрия Fddd, пространственная группа № 70. Элементарная сера легко хранится и, кроме того, имеет множество применений: например, в аккумуляторных батареях, моющих средствах, фунгицидах, удобрениях, порохе или спичках. Переработанный монооксид углерода также потенциально ценен и может использоваться в коммерческих целях для обработки металлов, в производстве лекарств и продуктов питания. Однако, что более важно, в настоящее время предпринимаются усилия по разработке способов эффективного преобразования CO в синтетический газ для использования в зеленой энергетике [17, 18].
Рис. 6.
Фотография кристаллов серы, собранных при комнатной температуре из ловушки (12) на рис. 1 при комнатной температуре. Ширина изображения соответствует 1 мм (а). EDS-спектр (SEM) твердого материала между 0.5 и 3 кэВ, демонстрирующий значительный пик серы между 2.2 и 2.4 кэВ. Источник пиков кислорода и кремния в спектре не идентифицирован (б). Картина дифракции XRD кристаллов серы, измеренная, как описано в разделе 2, и сравнение с картиной ICSD № 2726 для орторомбической S8, пространственная группа Fddd (№ 70) (в).
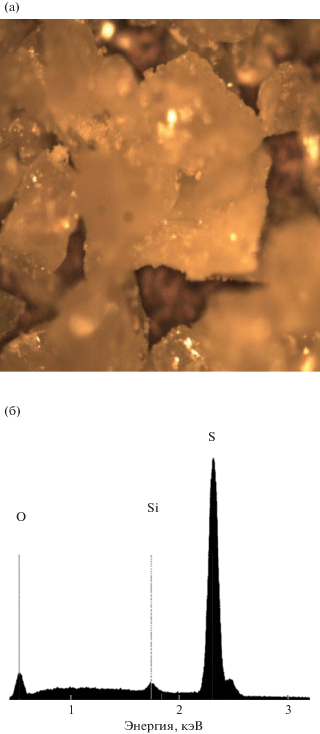
Рис. 6.
Окончание.
ВЫВОДЫ
Показана практическая значимость процесса очистки от серы отходящих газов угольных тепловых станций с помощью эвтектического расплава K2CO3–Na2CO3–Li2CO3. Уловленные расплавом сульфаты реагируют с CO, и вся присутствующая сера переходит в COS. Описана последняя стадия регенерации расплава, где опасный для здоровья и загрязняющий окружающую среду газообразный COS термически разлагается в температурном диапазоне 773–1123 К до элементарной нетоксичной серы. При низких температурах этого температурного диапазона и при времени пребывания 7 мин газовая хроматография не выявила значительного разложения COS. Однако при 973 К разложилось 52% COS. Добавление углекислого газа к исходной газовой смеси позволило увеличить степень термического разложения при температуре ниже 923K. Увеличение времени пребывания в печи до 44 мин привело к резкому увеличению термического разложения COS, т.е. степень разложения COS составила 90%. Сделан вывод, что в этих условиях реакция термического разложения COS близка к равновесной. Качественный элементный анализ EDS показал, что в результате реакции разложения COS получается элементарная сера. Этот метод очистки от серы отходящих газов угольных тепловых станций может значительно уменьшить выбросы SO2 в атмосферу на угольных электростанциях.
Список литературы
Kaplan V., Wachtel E., Dosmukhamedov N., Lubo-mirsky I. // Int. J. Oil, Gas and Coal Technology. 2018. № 18 (1/2). P. 25.
Kaplan V., Wachtel E., Lubomirsky I. // RSC Advances. 2013. № 3 (36). P. 15842.
Yosim S.J., Grantham L.F., Mckenzie D.E., Stegmann G.C. // Adv. Chem. Series. 1973. V. 127. P. 174.
Salem A., Soliman A., El-Haty I. // Air Quality, Atmosphere and Health, 2009. № 9 (2 (3)). P. 133.
Lee J., Cho H., Moon I., Lubomirsky I., Kaplan V., Kim J., Ahn J. // Computers & Chemical Engng, 2021, 146 (March 107227). P. 1.
Nannen L.W., West R.E., Kreith F. // J. Air Pollution Control Association. 1974. № 24 (1). P. 29.
Davenport W.G., King M. Schlesinger M., Biswas A.K. // Extractive Metallurgy of Copper. Oxford: Pergamon Press, 2002. 432 p.
Nolan P. // Coal-Tech 2000 International Conference. Jakarta, Indonesia, 2000. P. 1.
Klimont Z., Smith S.J., Cofala J. // Environmental Research Letters. 2013. № 8 (014003). P. 1.
Haas L.A., Khalafalla S.E. // J. Catalysis. 1973. № 30. P. 451.
Clark P.D., Dowling N.I., Huang M., Svrcek W.Y., Monnery W.D. // Industrial & Engng Chem. Res. 2001. V. 40 (2). P. 497.
Partington J.R., Neville H.H. // J. Chem. Soc. London. 1951. P. 1230.
Karan K., Megrotra A., Behie L. // Chem. Engng Communications. 2005. V. 192. P. 370.
Sames J.A., Paskall H.G. // Sulphur. 1984. V. 172. P. 47.
Turkdogan E.T. // Physical Chemistry of High Temperature Technology. New York: Academic Press Inc., 1980. 462 p.
Chase M.W. // NIST-JANAF Thermochemical Tables, New York: Amer. Chem. Soc. and Amer. Inst. Phys., 1998. 1952 p.
Cardona-Vargas A. Valencia D., Arrieta C.E., Amell A. // J. Physics: Conference Series. 2020. V. 1708 (012013). P. 1.
Steven S.C., Chuang S., Zhang L. // Handbook of Climate Change Mitigation and Adaptation. New York: Springer Science+ Business Media. 2015. 3297 p.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива


