Химия твердого топлива, 2022, № 1, стр. 19-27
Кинетическое изучение термического разложения первичной каменноугольной смолы в присутствии катализаторов с нанесенными на микросиликат оксидами никеля, кобальта и железа
С. Тянах 1, *, А. Тусипхан 1, **, А. М. Гюльмалиев 2, ***, Ма Фэн-Юнь 3, ****, Г. Г. Байкенова 4, *****, Д. А. Кайкенов 1, ******, А. И. Халитова 1, *******, М. И. Байкенов 1, ********
1 Карагандинский университет имени Е.А. Букетова
100028 Караганда, Республика Казахстан
2 ФГБУН Институт нефтехимического синтеза имени А.В. Топчиева РАН
119991 Москва, Россия
3 Синьцзянский университет
830046 Урумчи, СУАР, Китайская Народная Республика
4 Карагандинский университет Казпотребсоюза
100000 Караганда, Республика Казахстан
* E-mail: saika_8989@mail.ru
** E-mail: almas_kz_22@mail.ru
*** E-mail: gyulmaliev@ips.ac.ru
**** E-mail: ma_fy@126.com
***** E-mail: murzabek_b@mail.ru
****** E-mail: krg.daykai@mail.ru
******* E-mail: khalfiya2212@inbox.ru
******** E-mail: murzabek_b@mail.ru
Поступила в редакцию 07.07.2021
После доработки 27.07.2021
Принята к публикации 13.10.2021
- EDN: ZMHXAE
- DOI: 10.31857/S002311772201008X
Аннотация
Экспериментально определены термокинетические параметры термического разложения первичной каменноугольный смолы (ПКС) месторождения АО “Шубарколь комир” Республики Казахстан в присутствии нанокатализатора – микросиликата. На поверхности нанокатализатора предварительно были нанесены соли металлов VIII группы периодической системы Д.И. Менделеева: железо, кобальт и никель. Применен метод термогравиметрии в инертной атмосфере азота. Термокинетические параметры разложения ПКС (энергия активации, предэкспоненциальный множитель и константы скорости), найденные в отсутствие и в присутствии нанокатализатора, были рассчитаны с использованием методов термогравиметрического анализа. Полученные результаты кинетики разложения ПКС могут быть использованы при создании базы данных для проведения математического моделирования процесса переработки указанного вида сырья.
В настоящее время для изучения кинетики термического разложения органических материалов, таких как первичная каменноугольная смола (ПКС), широко используется термогравиметрический анализ [1, 2, 6–8]. Из-за сложного состава ПКС очень важно получить сведения о кинетике разложения ПКС в присутствии различных катализаторов, содержащих оксиды металлов VIII группы периодической системы Д.И. Менделеева. Для определения кинетических параметров термического разложения ПКС в присутствии катализаторов, содержащих оксиды металлов (железо, никель, кобальт), был использован интегральный метод, представленный в работе [1], и метод определения термокинетических параметров по точке перегиба на термогравиметрической кривой [2]. Из литературы [3, 4] также известно, что математические модели, используемые для определения кинетических характеристик деструкции полимеров в приложении к термическому разложению ПКС, вызывают определенные трудности из-за их сложного строения, многообразия типов химических связей и одновременно протекающих реакций. В связи с этим выработка рекомендации для выбора и разработки адекватной кинетической модели термодеструкции ПКС в присутствии катализатора и формирование банка данных кинетических характеристик являются одними из важнейших задач, которые стоят перед исследователями.
Цель работы – исследование кинетики термической деструкции ПКС в присутствии катализаторов с нанесенными на микросиликат оксидами металлов никеля, кобальта и железа с применением методов термогравиметрического анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования термокинетического разложения ПКС было использовано сырье, полученное в процессе коксования угля на предприятии коксохимического производства АО “Шубарколь комир”.
Физико-химические характеристики ПКС АО “Шубарколь комир” представлены в табл. 1 [5].
Таблица 1.
Физико-химические показатели ПКС АО “Шубарколь комир”
| Показатель | Проба (апрель 2019) |
|---|---|
| Плотность смолы при 20°С, кг/м3 | 1061 |
| Плотность смолы в пересчете на безводную при 20, кг/м3 | 1062 |
| Фракционный состав смолы (от безводной смолы), %: | |
| до 180°С | 3.0 |
| 180–230°С | 7.2 |
| 230–270°С | 15.1 |
| 270–300°С | 17.1 |
| выше 300°С | 52.4 |
| потери | 5.2 |
| Температура конца кипения, °С: | 315 |
| в парах | |
| в жидкости | 390 |
| Содержание воды, % | 2.2 |
| Массовая доля веществ, не растворимых в толуоле, % | 1.4 |
| Массовая доля веществ, не растворимых в хинолине, % | Отсутствует |
| Зольность, % | 0.03 |
Используемый микросиликат выполняет роль носителя и катализатора – продукт Карагандинского кремниевого завода ТОО “Tau-Ken.temir”.
Компонентный химический состав исходного микросиликата определяли с помощью рентгено-спектрального и гравиметрического методов (табл. 2).
Таблица 2.
Состав исходного микросиликата
| Содержание компонентов, % | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| SiO2 | TiO2 | Al2O3 | Fe2O3 | CaO | MgO | MnO | P2O5 | K2O | Na2O |
| 95.5 | 0.02 | <0.95 | <1.0 | 0.5 | 0.4 | 0.04 | 0.06 | <0.1 | 0.3 |
Исходный микросиликат предварительно измельчали, затем с помощью ситового анализа отбирали пробы с размером частиц 0.063 и 0.1 мм. Выщелачивание исходного микросиликата проводили с использованием 20%-ного раствора соляной кислоты с целью удаления щелочных и щелочноземельных металлов.
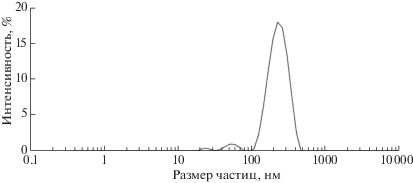
Размер частиц устанавливали с помощью лазерного определителя размера частиц Nano-S90 (рис. 1).
Катализатор получали методом мокрой пропитки выщелоченного микросиликата 1%-ным раствором солей CoCl2 · 6H2O, NiCl2 · 6H2O, FeSO4 · 7H2O. Пропитанный растворами солей микросиликат выдерживали в сушильном шкафу в течение 2 ч, при температуре 80–90°С, а затем высушивали при температуре 105°С также в течение 2 ч. Далее полученные образцы катализаторов прокаливали в муфельной печи при температуре 550°С в течение 2 ч (нанесенный катализатор).
Компонентный химический состав микросиликата после выщелачивания был установлен с помощью рентгено-спектрального и гравиметрического методов и приведен в табл. 3.
Таблица 3.
Состав микросиликата после выщелачивания
| Содержание компонентов, % | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| SiO2 | TiO2 | Al2O3 | Fe2O3 | CaO | MgO | MnO | P2O5 | K2O | Na2O |
| 97.439 | 0.023 | <0.95 | <1.0 | 0.414 | 0.304 | 0.033 | 0.057 | <0.1 | 0.276 |
Как видно из данных табл. 2 и 3, состав исходного микросиликата после выщелачивания практически не изменился.
Изучение морфологии поверхности исходного микросиликата и нанесенного катализатора проводили с помощью просвечивающего электронного микроскопа MIRA3 TESCAN высокого разрешения.
Термогравиметрическое исследование проводили с помощью дериватографа Labsys Evo TG-DTA/DSC 1600 (фирмы Setaram, Франция) в корундовых тиглях в интервале температур от 30 до 600°C в потоке аргона (скорость потока защитного и продувочного газов составляла 20 и 50 мл/мин соответственно). Кинетические параметры термического разложения смеси ПКС с катализаторами и микросиликата (константа скорости, энергия активации и предэкспоненциальный множитель) были рассчитаны методами, представленными в работах [1, 2]. Обработка результатов измерений выполнена с помощью пакета программ “OriginLab” и дистрибутив Python “Anaconda3”.
При расчете кинетических параметров термодеструкции ПКС в присутствии катализатора использовали следующие методы.
Интегральный метод. К изучению кинетики процессов термической деструкции по данным термогравиметрического анализа существует ряд подходов. В большей степени они разработаны для тех случаев, когда процесс проходит в одну стадию или стадии далеко разнесены по температурным интервалам и поэтому легко поддаются разделению на отдельные брутто-процессы. Как правило, предполагают протекание процесса по уравнению скорости порядка реакции подчиняющейся зависимости Аррениуса:
(1)
$\frac{{dm}}{{d{{\tau }}}} = - {{k}_{{\text{0}}}}{\text{ex}}{{{\text{p}}}^{{ - E/RT}}}{{m}^{n}},~$Первый подход используют для определения кинетических параметров процесса. При этом весь участок кривой ТГ относят к одной брутто-стадии. Этот путь позволяет заметно повысить надежность их определения, хотя и требует большой вычислительной работы.
Для обработки полученных кривых процесс термической деструкции ПКС можно представить следующим образом: исходное вещество А последовательно разлагается, образуя промежуточный твердый продукт В и летучий продукт P1. Затем В переходит в следующий промежуточный продукт С и выделяет летучий продукт P2 и т.д.:
(2)
$A\xrightarrow{{{{k}_{1}}}}B + {{P}_{1}}{\kern 1pt} \uparrow \xrightarrow{{{{k}_{2}}}}C + {{P}_{2}}{\kern 1pt} \uparrow \xrightarrow{{{{k}_{3}}}}.$Процесс термической деструкции в целом описывается схемой последовательных реакций первого порядка. За скоростью процесса следят по общему накоплению летучих веществ, т.е. измеряют их массу за определенный промежуток времени, масса выделившихся летучих веществ при этом равна потере массы твердого образца.
Скорость выделения летучих веществ на каждой стадии, как правило, можно описать уравнением реакции первого порядка с последующим определением констант скорости стадий.
Текущая масса выделившихся на данной стадии летучих веществ mi пропорциональна текущему числу молей ${{n}_{{{{P}_{i}}}}}$ (где i – номер стадии кинетической кривой выделения летучих веществ):
(3)
$\frac{{{{m}_{i}}}}{{{{m}_{{{{i}_{{{\text{max}}}}}}}}}} = \frac{{{{n}_{{{{P}_{i}}}}}}}{{{{n}_{{{{P}_{{{{i}_{{{\text{max}}}}}}}}}}}}} = \frac{{{{n}_{{{{P}_{i}}}}}}}{{{{n}_{{A,0}}}}}.~$Скорость выделения летучих веществ на некоторой стадии разложения будет определяться числом молей ПКС исходного или промежуточного вещества. Тогда система уравнений, описывающих двухстадийный процесс термической деструкции ПКС, может быть представлена в виде:
(4)
$\frac{{d{{n}_{A}}}}{{d{{\tau }}}} = - {{k}_{1}}{{n}_{A}};\quad \frac{{d{{n}_{B}}}}{{d{{\tau }}}} = {\text{\;}}{{k}_{1}}{{n}_{A}} - {{k}_{2}}{{n}_{B}};\quad \frac{{d{{n}_{C}}}}{{d{{\tau }}}} = {{k}_{2}}{{n}_{B}}.~$Скорости выделения летучих веществ:
(5)
$\frac{{d{{n}_{P}}_{1}}}{{d{{\tau }}}} = {{k}_{1}}{{n}_{A}}{\text{;}}\quad \frac{{d{{n}_{P}}_{{_{2}}}}}{{d{{\tau }}}} = {{k}_{2}}{{n}_{B}}.~$Изучаемый процесс протекает в неизотермических условиях и в одну стадию, поэтому константы скорости k изменяются в ходе эксперимента в соответствии с уравнением Аррениуса. Как правило, процесс проводят таким образом, что температура образца линейно зависит от длительности реакции, не меняясь по объему образца:
где ${{T}_{0}}$ – начальная температура, К; ${{\beta }}$ – скорость подъема температуры, К/мин.Тогда аррениусова зависимость констант на i-й стадии запишется так
(7)
${{k}_{i}} = {{k}_{{{{0}_{i}}}}}\exp \left( { - \frac{E}{{R({{T}_{0}} + {{\beta \tau }})}}} \right),$(8)
${{r}_{i}} = \frac{{d{{m}_{i}}}}{{d{{\tau }}}} = {\text{exp}}\left( {{{a}_{i}} - \frac{{{{b}_{i}}}}{{{{T}_{0}} + {{\beta \tau }}}}} \right)({{m}_{{{{i}_{{{\text{max}}}}}}}} - {{m}_{i}}),~$Величины скорости изменения массы образца определяются экспериментально как тангенс угла наклона касательной к кривой в заданных точках.
Подбор параметров ${{a}_{i}} = {\text{ln}}{{k}_{{{{0}_{i}}}}}{\text{\;и\;}}{{b}_{i}} = \frac{{{{E}_{i}}}}{R}$ осуществляется путем линеаризации уравнения скорости соответствующей стадии:
Последнее выражение представляет уравнение прямой линии в координатах
(10)
${\text{ln}}\frac{{{{r}_{i}}}}{{{{m}_{{{{i}_{{{\text{max}}}}}}}} - {{m}_{i}}}} - f\left( {\frac{1}{T}} \right),$Из тангенса угла наклона линий координат рассчитывают значения энергии активации Е процесса термодеструкции образцов, которые зависят от степени потери их массы.
Расчет энергий активации проводим графическим путем в аррениусовых координатах, на основании экспериментальнных данных строим зависимость константы скорости ${\text{ln}}\frac{{{{r}_{i}}}}{{{{m}_{{{{i}_{{{\text{max}}}}}}}} - {{m}_{i}}}}~$ от температуры $\left( {\frac{1}{T}} \right)~$.
Метод определения термокинетических параметров по точке перегиба на термогравиметрической кривой. Второй подход [2, 6–8] заключается в использовании трех уравнений, действующих для точки перегиба на ТГ. При постоянной скорости нагрева $\frac{{dT}}{{d{{\tau }}}} = {{\beta \;}}(T = {{T}_{0}} + {{\beta \tau )}}$ из (11) можно получить первое уравнение:
(12)
${{\left( {\frac{{dC}}{{dT}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}} = - \frac{Z}{{{\beta }}}{{e}^{{ - \frac{E}{{R{{T}_{{{\text{пер}}}}}}}}}}C_{{{\text{пер}}}}^{n}{\text{\;}}.{\text{\;}}$Так как в точке перегиба ${{\left( {\frac{{{{d}^{2}}C}}{{d{{{{\tau }}}^{2}}}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}}$ = 0, то из (12) имеем второе уравнение:
(13)
$E = - \frac{{nRT_{{{\text{пер}}}}^{2}}}{{{{C}_{{{\text{пер}}}}}}}{{\left( {\frac{{dC}}{{dT}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}}.~$Третье уравнение можно получить из уравнения (12) делением переменных и последующим интегрированием в пределах от 1 до ${{T}_{{{\text{пер}}}}}$ и от ${{T}_{{0~}}}{\text{\;до\;}}{{T}_{{{\text{пер}}}}}$:
(14)
$\mathop \smallint \limits_1^{{{C}_{{{\text{пер}}}}}} \frac{{dC}}{{{{C}^{n}}}} = - \frac{Z}{{{\beta }}}\mathop \smallint \limits_{{{T}_{0}}}^{{{T}_{{{\text{пер}}}}}} {{{\text{e}}}^{{ - \frac{E}{{R{{T}_{{{\text{пер}}}}}}}}}}dT.~$После ряда преобразований можно показать, что [6, 7]
(15)
$\mathop \smallint \limits_1^{{{C}_{{{\text{пер}}}}}} \frac{{dC}}{{{{C}^{n}}}} = - \frac{1}{{nC_{{{\text{пер}}}}^{{n - 1}}}}\left( {x - {{x}^{2}}{{{\text{е}}}^{x}}\mathop \smallint \limits_x^\infty \frac{{{{е}^{{ - u}}}}}{u}du} \right),~$Из (15)
где П(х) = $1 - x + {{x}^{2}}{{е}^{x}}\mathop \smallint \limits_x^\infty \frac{{{{e}^{{ - u}}}}}{u}du$.Используя табулированные значения определенного интеграла [8], можно получить
Для вычисления функции П(х) корреляционное уравнение для области $1 \leqslant x \leqslant 80$ имеет вид:
Таким образом, в случае $n \ne 1~$ для определения параметров E, n, k и Z имеем систему из трех уравнений (12), (13) и (17), которая решается численно итерационным методом. Приведем схему итерационной процедуры.
Задаются исходные данные: Cпер, Tпер, $~{{\left( {\frac{{dC}}{{dT}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}}$, β.
В качестве начального приближения принимаются n = 1.01 и шаг итерации h = 0.01.
Вычисляются следующие функции:
(20)
$E = - \frac{{nRT_{{{\text{пер}}}}^{2}}}{{{{C}_{{{\text{пер}}}}}}}{{\left( {\frac{{dC}}{{dT}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}},\quad x = \frac{E}{{R{{T}_{{{\text{пер}}}}}}},$При у2 ≤ 0.01 (точность расчета) итерация завершается.
Результатами расчета являются значения величин n, E, Z, k.
В формуле (20) Тпер – температура перевала, K; β – скорость нагрева, K/c; E – энергия активации, кДж/моль; R – газовая постоянная (R = = $8.314 \cdot {{10}^{{ - 3}}}$ кДж/моль); ${{C}_{{{\text{пер}}}}}$ – доля неразложившегося вещества в точке перегиба; ${{\left( {\frac{{dC}}{{dT}}} \right)}_{{T = {{T}_{{{\text{пер}}}}}}}}$ – скорость разложения в точке перегиба; n – показатель степени процесса (безразмерная величина); Z – предэкспоненциальный множитель, c–1; k – константа скорости процесса, c–1.
Метод определения энергии активации основывается на зависимости константы скорости от температуры, которая рассчитывается по уравнению Аррениуса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения морфологии поверхности катализатора и оценки размера частиц были сняты микрофотографии поверхности различных образцов катализаторов.
На рис. 2 представлены микрофотографии поверхности исходного (а) и нанесенных (б), (в), (г) катализаторов.
На микрофотографии поверхности исходного катализатора (рис. 2, а) видны участки, где размер частицы SiO2 составляет от 73.96 до 123.27 нм. На поверхности нанесенных катализаторов (рис. 2, б) наблюдаются участки, где сосредоточены частицы NiO (образец 5) размером 85.70, 94.84 и 106.32 нм, на рис. 2, в наблюдаются участки, где сосредоточены частицы FeO (образец 3) размером 157.2, 160.8 и 178.4 нм и на рис. 2, г наблюдаются участки, где сосредоточены частицы CoO (образец 4) размером 140.5, 159.4 и 211.7 нм.
Исследование морфологии поверхности образцов ненанесенного и нанесенного катализаторов проводили методом рентгенофлуоресцентного анализа (РФА). На рис. 3 представлены рентгенофлуоресцентные спектры ненанесенного (а) и нанесенного (б) катализаторов. Как следует из рис. 3, б, в спектре нанесенного катализатора появляется сигнал, указывающий на присутствие в образце никеля.
На рис. 4 представлены типичные термогравиметрические кривые для восьми образцов ПКС в присутствии микросиликата с нанесенными различными металлами (железо, никель, кобальт) VIII группы периодической системы Д.И. Менделеева. Из анализа кривых скорости потери массы (рис. 4, б) следует, что потеря массы в образцах связана с деструкцией ПКС в присутствии микросиликата с нанесенными металлами с образованием летучих веществ. Как показывает оценка степени влияния микросиликата и катализаторов с нанесенными металлами на деструкцию ПКС, как ненанесенный, так и нанесенный катализаторы оказывают воздействие на процесс термического разложения ПКС. Из рис. 4, а видно, что при термодеструкции образца 3 (табл. 4) экспериментальная потеря массы сместилась в область более низкой температуры. Величина скорости потери массы (рис. 4, б) подтверждает влияние катализатора на кинетику термодеструкции ПКС. Самая высокая скорость потери массы приходится на образец 3, а самая низкая скорость потери массы наблюдается для образца 2 (табл. 4).
Рис. 4.
Термогравиметрические кривые потери массы (а), (в) и скорости потери массы (б), (г) исследованных образцов ПКС в присутствии микросиликата с нанесенными различными металлами VIII группы.
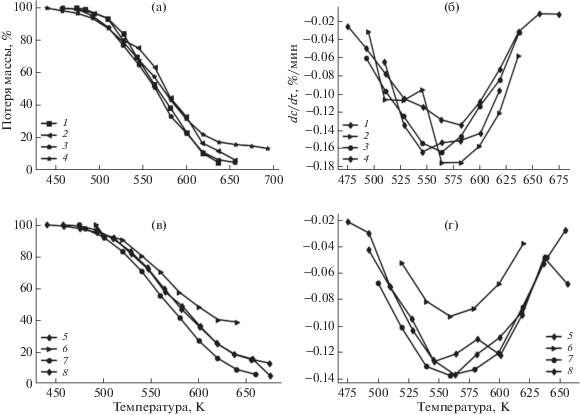
Таблица 4.
Термокинетические параметры деструкции смеси ПКС с катализатором, рассчитанные интегральным методом
| Исследуемая смесь | k0, с–1 | E, кДж/моль |
|---|---|---|
| ПКС (без катализатора) | 1.86 · 103 | 39.4 |
| Образец 1 (микросиликат + Ni 5%+ПКС, размер частиц 0.063 мм) | 1.1 · 105 | 59.84 |
| Образец 2 (микросиликат + Fe 1% + ПКС, размер частиц 0.063 мм) | 2.6 · 104 | 54.42 |
| Образец 3 (микросиликат + Ni 1%+ПКС, размер частиц 0.063 мм) | 1.2 · 104 | 48.82 |
| Образец 4 (микросиликат + Co 1% + ПКС, размером частиц 0.063 мм) | 6.1 · 103 | 47.82 |
| Образец 5 (микросиликат + Ni 5% + ПКС, размером частиц 0.063 мм, выщелоченный) | 5.6 · 103 | 48.38 |
| Образец 6 (микросиликат исходный + ПКС, размером частиц 0.063 мм) | 7 · 102 | 39.92 |
| Образец 7 с (микросиликат исходный + ПКС размером частиц 0.1 мм) | 8.7 · 102 | 38.24 |
| Образец 8 (микросиликат + Fe 1% + ПКС, размером частиц 0.1 мм | 5.7 · 101 | 41.04 |
Используя интегральный метод, с помощью уравнения (20) зависимости скорости термодеструкции смеси катализатора с первичной каменноугольной смолой от обратной температуры рассчитали энергию активации и предэкспоненциальный множитель (рис. 5, а, б).
Рис. 5.
Температурная зависимость скорости термодеструкци смеси катализатора (а), (б) с первичной каменноугольной смолой от обратной температуры.
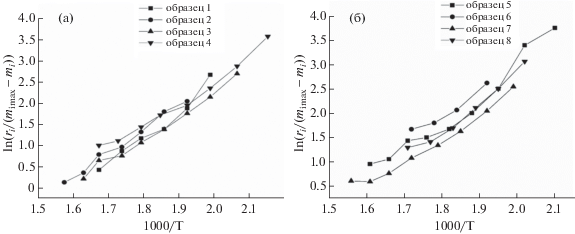
Расчетные данные кинетических параметров термодеструкции смеси ПКС с катализатором представлены в табл. 4, из которых следует, что для образцов 5–8 значения предэкспоненциального множителя и энергии активации увеличиваются с 5.7 · 101 до 5.6 · 103 с–1 и с 38.24 до 48.38 кДж/моль соответственно. Кривая потери массы образца 5 смещается (рис. 4, в) в область более низкой температуры относительно кривой образца 8. Из рис. 4, в, г следует, что при термодеструкции образца 5 потеря массы и скорость потери массы выше, чем при разложении образца 6. Интересно отметить, что при деструкции образца 7 наблюдается высокая активность разложения органической массы смолы. Это явление, по-видимому, связано с маленьким размером частиц исходного микросиликата, который составил 232 нм (рис. 1). Рассчитанные величины энергий активации и предэкспоненциального множителя увеличиваются в результате термодеструкции от исходного ПКС к смесям, содержащим катализатор и смолу, от 39.4 до 54.42 кДж/моль и от 1.86 · 103 до 1.1 · 105 с–1 соответственно. Низкое значение энергии активации и предэкспоненциального множителя характерны для образца 7 с размером частицы 0.1 мм, что согласуется с рис. 4, в, г, на котором наблюдается сдвиг кривой потери массы в область более низкой температуры и высокой скорости потери массы. Как следует из табл. 4, термокинетические параметры термодеструкции смеси катализатора и ПКС зависят от размера частиц катализатора (железо и никеля), нанесенного на поверхность микросиликата, и размеров частиц исходного микросиликата.
Таким образом, термокинетические параметры, рассчитаные с ипользованием интегрального метода для смеси ПКС с катализатором, зависят от величины наноразмерных частиц железа и никеля, расположенных на поверхности микросиликата.
В табл. 5 представлены параметры термодеструкции смеси ПКС с катализатором, полученные с использованием метода определения термокинетических параметров по точке перегиба на термогравиметрической кривой.
Таблица 5.
Термокинетические параметры деструкции смеси ПКС + катализатор, рассчитанные методом определения термокинетических параметров по точке перегиба на термогравиметрической кривой
| Исследуемая смесь | k0, с–1 | k | E, кДж/ моль |
|---|---|---|---|
| Образец 1 (микросиликат + Ni 5% + ПКС, размер частиц 0.063 мм) | 5.2 · 101 | 4.27 · 10–3 | 32.09 |
| Образец 2 (микросиликат + Fe 1% + ПКС, размер частиц 0.063 мм) | 3.04 · 101 | 4.91 · 10–3 | 42.52 |
| Образец 3 (микросиликат + Ni 1% + ПКС, размер частиц 0.063 мм) | 4.70 · 101 | 3.10 · 10–3 | 22.24 |
| Образец 4 (микросиликат + Co1% + ПКС, размером частиц 0.063 мм) | 3.12 · 101 | 5.02 · 10-3 | 41.60 |
| Образец 5 (микросиликат + Ni 5% + ПКС, размером частиц 0.063 мм, выщелоченный) | 8.38 · 102 | 2.21 · 10-3 | 16.41 |
| Образец 6 (микросиликат исходный + ПКС, размером частиц 0.063 мм) | 8.18 · 101 | 3.19 · 10-3 | 26.41 |
| Образец 7 с (микросиликат исходный + ПКС размером частиц 0.1 мм) | 1.99 · 100 | 3.74 · 10-3 | 28.84 |
| Образец 8 (микросиликат + Fe 1% + ПКС, размером частиц 0.1 мм) | 1.71 · 102 | 1.52 · 10-3 | 10.54 |
Расчетные значения константы скорости и энергия активации, представленные в табл. 5, показали, что нельзя сделать однозначный вывод об активности выбранных катализаторов, так как ПКС – это сложная органическая система, и величины кинетических параметров следует рассматривать как эффективные параметры формальной кинетики. Максимальные значения эффективных параметров, таких как константа скорости и энергия активации, можно рассматривать в качестве критериев оценки активности выбранных катализаторов. Из табл. 5 следует, что высокой каталитической активностью обладает образец 2, а наименьшей – образец 8. На основе представленных данных можно получить ряд активности выбранных катализаторов для термодеструкции смеси ПКС с катализатором, а именно: образец 2 > образец 4 > образец 1 > образец 7 > образец 6 > образец 3 > образец 5 > образец 8.
Таким образом, в результате использования метода определения термокинетических параметров по точке перегиба на термогравиметрической кривой были рассчитаны значения термокинетических параметров деструкции смеси ПКС с катализатором и на основании величин энергии активации был составлен ряд активности выбранных катализаторов.
Список литературы
Букварева О.Ф., Бухаркина Т.В. // Кинетика и термохимия процессов термодеструкции углеродсодержащих веществ. М.: РХТУ им. Д.И. Менделеева, 2001. 28 с.
Гюльмалиев А.М., Головин Г.С., Гладун Т.Г. Теоретические основы химии угля. М.: Изд-во МГГУ, 2003. 556 с.
Фетисова О.Ю., Кузнецов П.Н., Пуревсурен Б., Авид Б. // ХТТ. 2021. № 1. С. 3. [Solid Fuel Chemistry, 2021. V. 55. № 1. P. 1. https://doi.org/10.3103/S0361521921010031]https://doi.org/10.31857/S0023117721010035
Du Z., Sarofim A.F., Longwell J.P. // Energy and Fuels. 1990. V. 4. P. 296.
Aitbekova D.E., Makenov D.K., Andreikov E.I., Tsaur A.G., Ma Feng Yung, Baikenova G.G., Tusipkhan A., Muratbekova A.A., Baikenov M.I. // Hydrogen distribution in primary coke oven tar and its fractions. Bull. University Karaganda. Chemistry 2021. V. 101. № 1. P. 82. https://doi.org/10.31489/2021Ch1/82-90
Папков В.С., Слонимский Г.Л. // ВМС. 1966. Т. 8. № 1. С. 80.
Скляр М.Г., Шустиков В.И., Вирозуб И.В. // ХТТ. 1968. № 3. С. 22.
Янке Е., Эмде Ф. // Таблица функции. М.: Физматгиз, 1959. 420 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива