Химия твердого топлива, 2022, № 6, стр. 35-41
МАГНИТНЫЕ АКТИВИРОВАННЫЕ УГЛИ ДЛЯ АДСОРБЦИИ ТИПИЧНОГО ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ ИЗ ВОДНОЙ СРЕДЫ
А. Ю. Курмышева 1, *, М. Д. Веденяпина 1, **, С. А. Кулайшин 1, ***
1 ФГБУН Институт органической химии имени Н.Д. Зелинского РАН (ИОХ РАН)
119991 Москва, Россия
* E-mail: aukurm@gmail.com
** E-mail: mvedenyapina@yandex.ru
*** E-mail: s.kulaishin@mail.ru
Поступила в редакцию 21.07.2022
После доработки 21.07.2022
Принята к публикации 03.08.2022
- EDN: OPLDEU
- DOI: 10.31857/S0023117722060068
Аннотация
Изучена адсорбция 2,4-дихлорфеноксиуксусной кислоты на образцах активированных углей, модифицированных соединениями железа для приобретения этими образцами магнитных свойств. Методом РФА установлено образование на поверхности адсорбента магнитных частиц соединений оксидов железа, что позволяет технологически упростить систему разделения фаз после проведения адсорбции. Незначительное снижение адсорбционной емкости модифицированных соединениями железа образцов позволяет использовать их для очистки сточных вод от исследованного в работе гербицида.
ВВЕДЕНИЕ
2,4-дихлорфеноксиуксусная кислота (2,4-Д) является доступным и эффективным гербицидом, который широко используется в сельском хозяйстве [1]. 2,4-Д хорошо растворима в воде; поэтому она легко выщелачивается и обнаруживается в поверхностных, грунтовых водах [2] и даже в питьевой воде [3]. Этот гербицид обладает низкой биоразлагаемостью и токсичностью [4, 5]. Существует множество методов очистки сельскохозяйственных стоков, таких как фотокатализ [6], биодеградация [7], электробиодеградация [7], электрокаталитическая деградация [1], процесс Фентона [8], химическое окисление [9] и адсорбция [10]. Среди перечисленных методов адсорбция является наиболее предпочтительной из-за простоты аппаратурного оформления, низкой стоимости и эффективности [11]. Более того, углеродсодержащие адсорбенты, такие как активированный уголь (AУ), предпочтительнее других адсорбентов из-за лучших поверхностных характеристик и селективности [12].
Извлечение отработанного адсорбента из очищенных растворов является сложной задачей, особенно, если адсорбент используется в виде порошка или гранул [13]. В результате фильтрации и центрифугирования сорбент не удаляется полностью, а его остаточное количество в стоках может повлиять на естественные процессы в водных экосистемах. Поэтому в настоящее время популярна функционализация или включение на поверхность адсорбента магнитных наночастиц, с целью отделения адсорбента из очищаемой жидкости в магнитном поле [11]. Необходимое условие для придания магнитных свойств углеродсодержащим сорбентам – это нанесение на них частиц оксидов металлов [14]. Для этой цели можно использовать соединения на основе железа (Fe), никеля (Ni) и кобальта (Co). Из-за относительно низкой стоимости и большой доступности обычно используются соединения на основе железа, в частности соли железа [15]. Ряд исследований продемонстрировали применимость магнитных АУ для адсорбции красителей [16, 17], лекарственных препаратов [18, 19], тяжелых металлов [20, 21]. Однако содержание на поверхности АУ оксидов железа может привести к уменьшению площади поверхности и адсорбционной способности сорбента [22].
Целью настоящей работы является исследование адсорбционных свойств магнитных активированных углей для извлечения 2,4-Д из водных растворов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе была использована 2,4-дихлорфеноксиуксусная кислота (2,4-Д) производства фирмы Sigma-Aldrich Chemie (США). В качестве исходного сорбента был взят активированный уголь (АУ) фирмы Merck (Германия). Из исходного АУ было приготовлено два образца магнитных адсорбентов с разным массовым содержанием железа. Процесс нанесения оксидов железа на поверхность исходного АУ для обоих образцов включал в себя следующие стадии: в раствор, содержащий смесь солей FeSO4 и Fe2(SO4)3, добавляли навеску исходного АУ; перемешивали на магнитной мешалке в течение 30 мин с последующим добавлением 10 М NaOH до установления значения рН 10–11 и выдерживали суспензию при комнатной температуре 24 ч. Твердую часть суспензии отфильтровывали и промывали в дистиллированной воде до нейтрального значения рН, а затем промывали этанолом. Массовое соотношение солей железа к АУ для образца магнитного активированного угля МАУ-1 составило 0.5, для образца МАУ-2 – 0.35. Полученные таким образом МАУ-1 и МАУ-2 сушили при 85°С 24 ч.
Текстурные характеристики образцов исследовали с помощью низкотемпературной адсорбции азота при 77 К на анализаторе газовой сорбции “Autosorb iQ”, Quantachrome inst. (США). Содержание Fe на поверхности образцов МАУ-1 и МАУ-2 определяли методом рентгенофлуоресцентной спектрометрии с градуировкой по методу фундаментальных параметров на спектрометре “ARL PFX-101”. Структуру оксидов железа на поверхности образцов МАУ-1 и МАУ-2 определяли методом рентгенофазового анализа (РФА) на спектрометре “PANalytical Empyrean”. Наличие функциональных групп на поверхности образцов АУ определяли методом ИК-спектроскопии при помощи ИК-Фурье спектрометра “Bruker Alpha”. Измерения pH точки нулевого заряда (pHpzc) образцов АУ и МАУ проводили методом потенциометрического титрования, как в работах [23–25].
Адсорбцию 2,4-Д на образцах АУ из водных растворов с заданной концентрацией (25–200 мг/л) проводили в термостатированной ячейке с обратным холодильником при постоянном перемешивании магнитной мешалкой (150 об/мин) при 25°C. Концентрацию 2,4-Д в течение эксперимента определяли методом УФ-спектроскопии по поглощению при 283 нм на спектрофотометре “Hitachi U-1900”. Величину адсорбции qe (массу адсорбированной кислоты, приходящейся на 1 г адсорбента) рассчитывали по формуле:
где mс – масса сорбента, г; V – объем раствора, л; с0 и сt – концентрации 2,4-Д, мг/л в начале эксперимента и через время t, ч.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследований порометрических характеристик образцов сорбентов представлены в табл. 1, из данных которой видно, что площадь поверхности, определенная по методу БЭТ (SБЭТ), общий объем пор, как и объем микро- и мезопор, уменьшается для образцов угля, содержащих на своей поверхности соединения железа.
Таблица 1.
Порометрические характеристики образцов АУ и МАУ
| Характеристика образца сорбента (площадь по-верхности адсорбента по БЭТ и объем пор) | Образец | ||
|---|---|---|---|
| АУ | МАУ-1 | МАУ-2 | |
| SБЭТ, м2/г | 835 | 629 | 698 |
| Vобщ,см3/г | 0.700 | 0.630 | 0.560 |
| Vмикро, см3/г | 0.372 | 0.289 | 0.266 |
| Vмезо, см3/г | 0.328 | 0.341 | 0.294 |
Методом РФА были определены кристаллические структуры оксидов железа на поверхности образцов МАУ-1 и МАУ-2. Было установлено, что положение пиков и соотношение их интенсивностей на дифрактограмме подтверждают образование ромбоэдрических наночастиц α-Fe2O3 [26] на образце МАУ-1 и кубического магнетита Fe3O4 на образце МАУ-2 [27]. Пики на рис. 1, а имеют следующие значения 2θ ≈ 24.12°, 33.12°, 35.61°, 40.88°, 49.51°, 54.22°, 57.63°, 62.45° и 64.11°, соответствующие плоскостям (012, 104, 110, 113, 024, 116, 018, 214 и 300). Это согласуется с ромбоэдрически центрированной гексагональной структурой α-Fe2O3 [28]. Для образца МАУ-2 рентгенограмма характеризуется пиками 2θ ≈ 18.3°, 30.2°, 35.6°, 43.2°, 53.5° и 57°, соответствующими плоскостям (111, 220, 311, 400, 422 и 511) (рис. 1, б). Все плоскости образца МАУ-2 могут быть отнесены к гранецентрированному кубическому инверсному магнетиту Fe3O4 [29].
Методом рентгенофлуоресцентной спектрометрии определено содержание железа (%) на поверхности образцов: МАУ-1 – 3.36; МАУ-2 – 4.75. Согласно спецификации образца АУ (CAS No 7440-44-0), содержание железа в образце 0.03%.
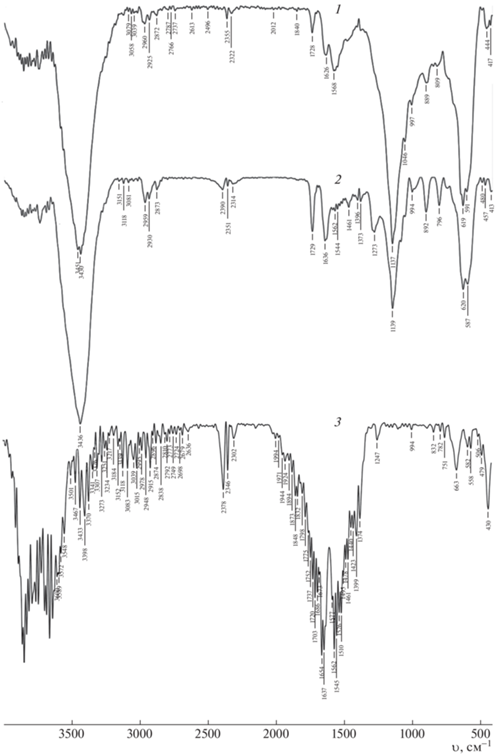
На рис. 2 представлены результаты ИК-спектроскопии исходного АУ и МАУ-1, МАУ-2. Для всех образцов характерен пик при 3400–3450 см–1, который обусловлен колебанием водорода гидроксильной группы. Полосы в диапазоне 1630–1400 см–1 относятся к валентным колебаниям C=O в ароматическом кольце [30, 31]. Также на спектрограмме всех образцов присутствуют полосы поглощения 1139 и 1137, что соответствует пикам колебания C–H. Выраженный пик в диапазоне 585–620 см–1 появляется на обоих образцах МАУ, не наблюдаемый на исходном АУ. Этот пик обусловлен колебанием связи Fe–O [32, 33], что указывает на присутствие феррочастиц на МАУ.
На рис. 3, а–в приведены кинетические зависимости адсорбции 2,4-Д на образцах АУ (а), МАУ-1 (б) и МАУ-2 (в) для различных исходных концентраций 2,4-Д (200–25 мг/л) и массой адсорбентов, равной 0.025 г. Кинетику адсорбции изучали по изменению концентрации 2,4-Д во времени.
На кинетических кривых адсорбции 2,4-Д на АУ и МАУ наблюдается быстрый рост, а затем приближение к некоторому предельному значению адсорбции (qе), более высокому для больших начальных концентраций субстрата. Быстрый рост величины адсорбции в первые минуты эксперимента можно объяснить наличием мезопор на поверхности образцов АУ.
Образец АУ обладал большей величиной адсорбционной емкости относительно МАУ-1 и МАУ-2, по-видимому, за счет меньшего содержания Fe на поверхности адсорбента (табл. 2).
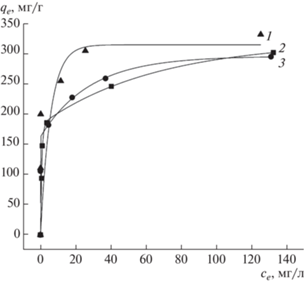
Из результатов адсорбционных экспериментов были построены изотермы адсорбции (рис. 4). Более продолжительный участок изотермы адсорбции в области Генри для образца АУ в сравнении с образцами МАУ объясняется большим адсорбционным сродством молекул 2,4-Д для этого образца.
Были рассчитаны изотермы по трем моделям: Ленгмюра (1), Темкина (2), Фрейндлиха (3). Уравнения изотерм приведены ниже:
где ${{q}_{m}}$ – максимальная емкость монослоя, (мг/г) и bL – адсорбционный коэффициент, (л/мг); где ${{b}_{T}}$ – адсорбционный коэффициент, Дж/моль, R – универсальная газовая постоянная – 8.314 Дж/(моль K); A – константа, л/г; T – абсолютная температура, K. где ${{K}_{{\text{F}}}}$ – коэффициент распределения или адсорбционный коэффициент, л/г.Рассчитанные параметры изотерм адсорбции по уравнениям (1)–(3) представлены в табл. 3, из данных которой следует, что изотерма адсорбции 2,4-Д на образцах с высокой точностью может быть описана изотермой Ленгмюра (1) и с меньшей точностью изотермами Темкина (2) и Фрейндлиха (3).
Таблица 3.
Параметры уравнения изотерм адсорбции для образцов АУ и МАУ
| Образец | Изотерма Ленгмюра | Изотерма Темкина | Изотерма Фрейндлиха | |||
|---|---|---|---|---|---|---|
| АУ | ${{q}_{m}}$, мг/г | 300 | ${{b}_{T}}$, Дж/моль | 2.67 | ${{K}_{{\text{F}}}}$, л/г | 211 |
| ${{b}_{L}}$, л/мг | 27.9 | $A$, л/г | 1.06 | 1/n | 0.1 | |
| ${{R}^{2}}$ | 0.97 | ${{R}^{2}}$ | 0.75 | ${{R}^{2}}$ | 0.83 | |
| МАУ-1 | ${{q}_{m}}$, мг/г | 278 | ${{b}_{T}}$, Дж/моль | 1.456 | ${{K}_{{\text{F}}}}$, л/г | 122.8 |
| ${{b}_{L}}$, л/мг | 0.468 | $A$, л/г | 1.04 | 1/n | 0.179 | |
| ${{R}^{2}}$ | 0.98 | ${{R}^{2}}$ | 0.92 | ${{R}^{2}}$ | 0.77 | |
| МАУ-2 | ${{q}_{m}}$, мг/г | 287 | ${{b}_{T}}$, Дж/моль | 5.78 | ${{K}_{{\text{F}}}}$, л/г | 130 |
| ${{b}_{L}}$, л/мг | 0.312 | $A$, л/г | 1.174 | 1/n | 0.174 | |
| ${{R}^{2}}$ | 0.995 | ${{R}^{2}}$ | 0.94 | ${{R}^{2}}$ | 0.82 | |
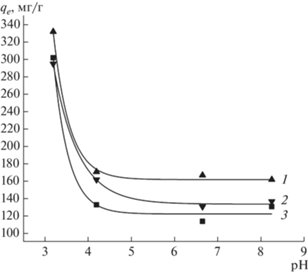
Влияние рН на адсорбционную емкость образцов АУ и МАУ изучали при определении адсорбционной емкости при различных значениях рН. Результаты иcследований представлены на рис. 5. Из данных рисунка видно значительное снижение эффективности адсорбции 2,4-Д по мере увеличения pH. Это указывает на то, что pH раствора является важным параметром, который следует учитывать в процессе адсорбции. Такую зависимость можно объяснить составом поверхностных групп сорбентов. Для всех образцов была определена точка нулевого заряда pHpzc, равная 5. При pH < 5 поверхность образцов сорбентов будет заряжена положительно, а при pH > 5 отрицательно. При pH раствора больше 4.5 большая часть молекул 2,4-Д находится в ионизированной форме с преобладанием 2,4-дихлорфеноксиацетат-ионов [34]. Это приводит к электростатическому отталкиванию этих ионов от отрицательно заряженной поверхности сорбента. Кроме того, в щелочной среде высокая подвижность ионов OH– может конкурировать с 2,4-дихлорфеноксиацетат-ионов за адсорбционные центры поверхности АУ [35–37]. Поскольку константа диссоциации 2,4-Д составляет 2.73 [38], то при pH 2-3 часть молекул 2,4-Д протонирована или имеет нейтральный заряд, тогда как АУ и МАУ будут иметь положительно заряженную поверхность. Следовательно, максимальная адсорбция 2,4-Д при pH 3 не ограничивается только электростатическим притяжением, но также может включать водородные и π-π связи [39]. Данные ИК-спектроскопии указывают на вклад водородных связей в процесс адсорбции наличием характеристических полос соответствующих функциональных групп C–H и C=O.
ЗАКЛЮЧЕНИЕ
Исследования РФА позволили установить образование на поверхности образцов адсорбентов МАУ-1 и МАУ-2 кислородных соединений железа, обладающих магнитными свойствами. Так, для МАУ-1 получена дифрактограмма, которая подтверждает наличие на его поверхности ромбоэдрических наночастиц α-Fe2O3, а для МАУ-2 гранецентрированного кубического инверсного магнетита Fe3O4. Магнитные частицы, содержащиеся на поверхности исследуемых углей, хотя и незначительно, снижают их адсорбционную емкость по отношению к 2,4-дихлорфеноксиуксусной кислоты, но являются эффективными в технологическом процессе отделения отработанных сорбентов от очищаемого раствора.
Список литературы
Dargahi A., Shokoohi R., Asgari G., Ansari A., Nematollahi D., Samarghandi M.R. // RSC Adv. 2021. I. 16. P. 9608.
Dargahi A., Ansari A., Nematollahi D., Asgari G., Shokoohia R., Samarghandi M.R. // RSC Adv. 2019. I. 9 . P. 5064.
Pirsaheb M., Dargahi A., Hazrati S., Fazlzadehdavil M. // Desalin. Water Treat. 2014. V. 52. P. 4350.
Ha D.D. // Biodegradation. 2018. V. 29 (5). P. 499.
Islam F., Wang J., Farooq M.A., Khan M.S.S., Xu L., Zhu J., Zhao M., Muños S., Li Q.X., Zhou W. // Environ. Int. 2018. V. 111. P. 332.
Sin J.-C., Lam S.-M., Zeng H., Lin H., Li H., Kumaresan A.K., Mohamed A.R., Lim J.-W. // Separ. Purif. Technol. 2020. V. 250. 117186.
Zhang J., Cao Z., Zhang H., Zhao L., Sun X., Mei F. // J. Hazard Mater. 2013. V. 262. P. 137.
Zhang Y., Xu X., Cai J., Pan Y., Zhou M. // Chemosphere. 2021. V. 266. 129063.
Hashimoto M., Taniguchi S., Takanami R., Giri R.R., Ozaki H. // Water Sci. Technol. 2010. V. 62. I. 3. P. 484.
Trivedi N.S., Mandavgane S.A. // Separ. Purif. Rev. 2018. V. 47. I. 4. P. 337.
Vinayagam R., Pai S., Murugesan G., Varadavenkatesan T., Narayanasamy S., Selvaraj R. // Chemosphere. 2022. V. 286. I. 3. 131938.
Tran T.K.N., Le T.T.N., Le H.S., Tran D.L., Nguyen Q.V., Pham T.M., Le V.T. // J. Nano Res. 2020. V. 61. P. 1.
Astuti W., Sulistyaningsih T., Kusumastuti E., Thomas G.Y.R.S., Kusnadi R.Y. // Biores. Technol. 2019. V. 287. 121426.
Reguyal F., Sarmah A.K. // Environ. Pollut. 2018. V. 233. P. 510.
Siddiqui M.T.H., Nizamuddin S., Baloch H.A., Mubarak N.M., Al-Ali M., Mazari S.A., Bhutto A.W., Abro R., Srinivasan M., Griffin G. // J. Environ. Chem. Eng. 2019. V. 7. I. 1. 102812.
Vahdati-Khajeh S., Zirak M., Tejrag R.Z., Fathi A., Lamei K., Eftekhari-Sis B. // Surf. Interf. 2019. V. 15. P. 157.
Zhu R., Xia J., Zhang H., Kong F., Hu X., Shen Y., Zhang W.-H. // J. Environ. Chem. Eng. 2021. V. 9. I. 6. 1065.
Baghdadi M., Ghaffari E., Aminzadeh B. // J. Environ. Chem. Eng. 2016. V. 4. I. 3. P. 330.
Labuto G., Carvalho A.P., Mestre A.S., Santos M.S., Modesto H.R., Martins T.D., Lemos S.G., Silva H.D.T., Carrilho E.N.V.M., Carvalho W.A. // Sust. Chem. Pharm. 2022. V. 28. 100703.
Rodríguez-Sánchez S., Díaz P., Ruiz B., González S., Díaz-Somoano M., Fuente E. // J. Environ. Manage. 2022. V. 312. 114897.
Kazak O. // Environ. Technol. Innovation. 2021. V. 24. 101856.
Juang R., Yei Y., Liao C., Lin K., Lu H. // J. Taiwan Inst. Chem. E. 2018. V. 90. P. 51.
Miyittah M.K., Tsyawo F.W., Kumah K.K., Stanley C.D., Rechcigl J.E. // Commun. Soil Sci. Plan. 2016. V. 47. I. 1. P. 101.
osai A.K., Chimuka L., Cukrowska E.M., Kotzé I.A., Tutu H. // Water Air Soil Pollut. 2019. V. 230. A. 188
Dávila-Jiménez M.M., Elizalde-González M.P., Guerrero-Morales M.A., Mattusch J. // Process. Saf. Environ. Protect. 2018. V. 120. P. 195.
Fouad D.E., Zhang C., El-Didamony H., Yingnan L., Mekuria T.D., Shah A.H. // Results Phys. 2019. V. 12. P. 1253.
Torres J.A., Silva M.C., Lopes J.H., Nogueira A.E., Nogueira F.G.E., Corrêa A.D. // Int. J. Biol. Macromol. 2018. V. 114. P. 1279.
Lassoued A., Lassoued M.S., Dkhil B., Ammar S., Gadri A. // Phys. E Low-Dimension Syst. Nanostruct. 2018. V. 97. P. 328.
Yu B.Y., Kwak S.-Y. // J. Mater. Chem. 2010. V. 20. P. 8320.
Oh W.D., Lua S.-K., Dong Z., Lim T.-T. // J. Hazard. Mater. 2015. V. 284. P. 1.
Saleh S., Kamarudin K.B., Ghani W.A.W.A.K., Kheang L.S. // Procedia Eng. 2016. V. 148. P. 228.
Peng X., Hu F., Zhang T., Qiu F., Dai H. // Bioresour. Technol. 2018. V. 249. P. 924.
Kumar A., Patra C., Kumar S., Narayanasamy S. // Environ. Res. 2022. V. 206. 112604.
Njoku V.O., Foo K.Y., Hameed B.H. // Chem. Eng. J. 2013. V. 215–216. P. 383.
Flores P.E.D., Ramos R.L., Mendez J.R.R., Ortiz M.M., Coronado R.M.G., Barron J.M. // J. Environ. Eng. Manage. 2006. V. 16. P. 249.
Hameed B.H., Salman J.M., Ahmad A.L. // J. Hazard. Mater. 2009. V. 163. P. 121.
Salman J.M., Hameed B.H. // Desalination. 2010. V. 256. I. 1–3. P. 129.
Hazrin H.M.M.N., Lim A., Li C., Chew J.J., Sunarso J. // Mater. Today: Proceed. 2022. V. 64. P. 4. P. 1557.
Rambabu K., Yammahi J.A., Bharath G., Thanigaivelan A., Sivarajasekar N., Banat F. // Chemosphere. 2021. V. 282. 131103.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива