Кинетика и катализ, 2019, T. 60, № 1, стр. 25-32
Влияние фуллерена, содержащего малеопимаримидный заместитель, на кинетику жидкофазного радикально-цепного окисления этилбензола
Л. Р. Якупова 1, *, И. М. Сахаутдинов 1, Р. Н. Маликова 1, Р. Л. Сафиуллин 1
1 Уфимский институт химии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра РАН
450054 Уфа, просп. Октября, 71, Россия
* E-mail: jkupova@anrb.ru
Поступила в редакцию 28.02.2018
После доработки 14.09.2018
Принята к публикации 08.06.2018
Аннотация
В модельной системе инициированного радикально-цепного окисления этилбензола исследовано влияние на кинетику поглощения кислорода производных фуллерена C60, содержащих малеопимароимидные фрагменты. Изученные соединения проявили себя как ингибиторы радикально-цепного окисления. Для всех производных фуллерена с малеопимаримидными заместителями отмечена значительная длительность их ингибирующего действия. Измерены константы скорости ингибирования fk7. Показано, что введение в молекулу фуллерена малеопимаримидного заместителя не только не снижает антирадикальную активность фуллерена, а даже увеличивает ее до fk7 = 1 × 104 л моль–1 с–1 (333 K).
В ходе исследования физико-химических свойств фуллерена С60 установлено, что они являются акцепторами как алкильных, так и пероксильных радикалов [1–4]. Основным преимуществом использования фуллерена в качестве медицинского антиоксиданта является его способность локализоваться внутри клетки в митохондриях и других компонентах, где в пораженных состояниях происходит образование свободных радикалов [5]. Существует мнение, что взаимодействие фуллерена с радикалами может быть каталитическим процессом. Другими словами, на поверхности молекулы фуллерена могут происходить реакции рекомбинации или диспропорционирования радикалов. Сам фуллерен при этом практически не расходуется. Благодаря этому свойству фуллерен считается наиболее эффективным акцептором радикалов [5, 6]. Константа скорости взаимодействия фуллерена с алкильными радикалами составляет 1 × 107 л моль–1 с–1 [7–9].
Меньше внимания уделено изучению реакции фуллерена с пероксильными радикалами, хотя в случае перекисного окисления последние играют более важную роль. Количественные данные о взаимодействии пероксильных радикалов с фуллереном не многочисленны (табл. 1). Установлено, что константа скорости взаимодействия фуллерена с пероксильными радикалами в зависимости от строения последних лежит в интервале 300–10 000 л моль–1 с–1. Очень мало изучены в качестве ингибиторов окисления производные фуллерена. В то же время показано, что производные фуллерена C60, содержащие сахарный заместитель, способны ингибировать перекисное окисление липидов в плазме человека [4]. В связи с этим исследование кинетики жидкофазного радикально-цепного окисления органических соединений в присутствии производных фуллерена представляет интерес.
Таблица 1.
Реакционная способность фуллерена С60 по отношению к пероксильным радикалам (ROO•)
| Фуллерен | ROO• | T, K | k7, л моль–1 с–1 | f | Лит. ссылка |
|---|---|---|---|---|---|
| С60 | PhCH(OO•)OH | 323 | 284 | 2–2.3 | [7] |
| C60 | PhC(CH3)2OO• | 303 | 310 | – | [8] |
| Производные С60 с ионолом | PhC(CH3)2OO• | 303 | (6.7–8.2) × 103 | 2 | |
| C60 | (O)P[N(CH3)2]2 N(CH3)CH2OO• | 323 | 9 × 103 | 5.4 | [10] |
| Производные С60 с сахаром* | CH3(CH2)13CH(OO•)COOH | 310 | 4.6 × 103 (C60-1S) | – | [4] |
| 8.0 × 103 (C60-2S) | |||||
| C60 | PhCH(OO•)CH3 | 343 | 2.0 × 103 | – | [11] |
| PhC(CH3)2OO• | 1.3 × 103 | ||||
| C60 | PhCH(OO•)CH3 | 343 | 2.0 × 103 | [12, 13] | |
| PhC(CH3)2OO• | 0.9 × 103 | ||||
| C70 | PhCH(OO•)CH3 | 10.8 × 103 | |||
| PhC(CH3)2OO• | 5.6 × 103 | ||||
| C60 | O(CH2C(H) OO•)2O | 333 | 2.4 × 104 | 1.8 | [9] |
| PhC(CH2)OO• | 1.2 × 103 | 2.1 | |||
| C60 | PhCH(OO•)OH | 323 | 1.4 × 102 | – | [14] |
| Производные C60 с тиофеновым заместителем | 12.6 × 102 | 2.1 | |||
| С60 | O(CH2C(H)OO•)2O | 348 | 2 × 104 | 0.5 | [15] |
| С60 | PhCH(OO•)CH3 | 338 | 4.6 × 103 | – | [16] |
| С60 | O(CH2C(H)OO•)2O | 348 | 6.56 × 104 (расчет) 1.8 × 104 (экспер.) | – | [17] |
Интенсивное изучение биологической активности растительных терпенов и их производных свидетельствует о перспективности использования этого класса природных соединений для создания лекарственных препаратов. Большой интерес вызывает аддукт левопимаровой кислоты с малеиновым ангидридом – малеопимаровая кислота [18–20]. В настоящей работе рассмотрено влияние производных фуллерена C60, содержащих малеопимаримидные фрагменты, на кинетику жидкофазного радикально-цепного окисления этилбензола, протекающего с участием пероксильных радикалов [21]. Серия изученных производных фуллерена отличается хорошей растворимостью в органических растворителях 0.2–0.4 г/мл [22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Этилбензол (ЭБ) очищали по методике, описанной в работе [21]. 2,2'-Азо-бис-изобутиронитрил (АИБН) и хлорбензол очищали согласно [23]. Производные фуллерена 1–8 (C60) (табл. 2) получали и очищали по известной методике [24–26]. Физико-химические характеристики производных фуллерена 1–8 (табл. 2) соответствовали литературным данным [22, 24].
Таблица 2.
Исследованные на антирадикальную активность производные фуллерена
| Соединение, мол. масса | Структура | Соединение, мол. масса | Структура |
|---|---|---|---|
| 1 М = 1285 |
 |
2 М = 1230 |
 |
| 3 М = 1304 |
 |
4 M = 1244 |
 |
| 5 M = 1188 |
 |
6 М = 1244 |
 |
| 7 М = 1271 |
 |
8 М = 1260 |
 |
В качестве инициатора использовали АИБН. Скорость инициирования рассчитывали по формуле: wi = 2ekр[АИБН], где kр – константа скорости распада АИБН в этилбензоле, 2е – вероятность выхода радикалов в объем. При проведении расчетов использовали величины lg kр = 15.4 – ‒ (130.6/θ) [с–1], где θ = 2.303RT × 10–3 кДж/моль, 2e = 1.2 [27].
Этилбензол окисляли кислородом воздуха при температуре 333 K в стеклянном реакторе, в который загружали этилбензол и раствор инициатора в хлорбензоле, термостатировали несколько минут, добавляли ингибитор в растворе этилбензола и затем следили за поглощением кислорода с помощью универсальной манометрической дифференциальной установки [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Жидкофазное окисление этилбензола в условиях нашего эксперимента (333 K, wi = 4.4 × × 10–8 моль л–1 с–1) протекало по радикально-цепному механизму с квадратичным обрывом цепи [21, 29]:
| ${\text{А И Б Н }}\xrightarrow{{{{k}_{i}}}}\quad{{{\text{r}}}^{ \bullet }}\xrightarrow{{{\text{RH}}}}{{{\text{R}}}^{\centerdot }},$ | (i) |
| ${{{\text{R}}}^{ \bullet }} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{1}}}}{\text{RO}}_{2}^{\centerdot },$ | (I) |
| ${\text{RO}}_{2}^{\centerdot } + {\text{RH}}\xrightarrow{{{{k}_{2}}}}{\text{ROOH}} + {{{\text{R}}}^{ \bullet }},$ | (II) |
| ${\text{RO}}_{2}^{\centerdot } + {\text{RO}}_{2}^{\centerdot }\xrightarrow{{2{{k}_{6}}}}\,\,{\text{м о л е к у л я р н ы е п р о д у к т ы }}{\text{.}}$ | (VI)* |
| * Нумерация реакций соответствует традиционной схеме жидкофазного окисления углеводородов. | |
Введение в окисляющийся субстрат производного фуллерена (C60) приводит к снижению скорости поглощения кислорода (рис. 1). В отдельном опыте было показано, что имид малеопимаровой кислоты не влияет на скорость окисления этилбензола в условиях эксперимента. Полученные данные можно объяснить расходованием радикалов по реакциям (VII) и (XI):
(VII)
${\text{RO}}_{2}^{\centerdot } + {{{\text{С }}}_{{60}}}\xrightarrow{{{{k}_{7}}}}\,\,{\text{ROOС }}_{{60}}^{\centerdot }$(VIII)
$\begin{gathered} {\text{ROOС }}_{{60}}^{\centerdot } + {\text{RO}}_{2}^{\centerdot } \to \\ \to \,\,{{{\text{С }}}_{{60}}} + {\text{п р о д у к т ы }}\left( {{\text{с п и р т и к е т о н }}} \right), \\ \end{gathered} $(X)
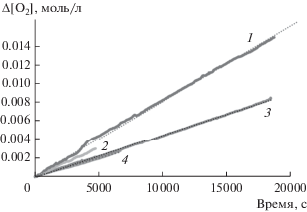
${{{\text{R}}}^{ \bullet }} + {\text{RС }}_{{60}}^{ \bullet } \to {\text{R}}{{{\text{C}}}_{{{\text{60}}}}}{\text{R}}{\text{.}}$Рис. 1.
Окисление этилбензола в отсутствие ингибитора (1) и в присутствии производных фуллерена: 2 (1.7 × 10–4 моль/л, 2), 1 (4.7 × 10–5 моль/л, 3) и 6 (6.4 × 10–4 моль/л, 4). Условия реакции: [ЭБ] = = 7.6 моль/л, wi = 4.4 × 10–8 л моль–1 с–1, 333 K.
Реакции (VII)–(X) предложены на основании данных о способности фуллерена присоединять как алкильный, так и пероксильный радикал [1, 2, 4, 6, 8, 9, 17, 30]. Однако было показано, что образующиеся при окислении 1,4-диоксана и этилбензола алкильные радикалы преимущественно взаимодействуют с кислородом [9, 12, 13]. Поэтому в дальнейшем реакции (IX) и (X) в настоящей работе не рассматривали.
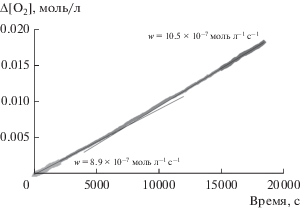
На рис. 1 видно (ср. кривые 1 и 3), что стехиометрический коэффициент ингибирования (f) f > > wiτ/[InH] = 4.4 × 10–8 × 18 000/(4.7 × 10–5) = 16. Следовательно, наблюдается многократный обрыв цепи. На рис. 2 представлена кинетическая кривая поглощения кислорода, соответствующая опыту, который проводили в течение 5.6 ч. В этом случае длительность индукционного периода составила примерно 7500 с. Следовательно, можно предположить, что для соединения 4 стехиометрический коэффициент ингибирования f ≈ 13. (Известно, что молекула фуллерена содержит 30 двойных связей [31]. Бензильные радикалы реагируют с C60, образуя радикальные и нерадикальные аддукты RnC60 (R = C6H5CH2) с n = 1 и до, по меньшей мере, 15 [6].)
Рис. 2.
Окисление этилбензола в присутствии производного фуллерена 5 в концентрации 4.7 × 10–5 моль/л. Условия реакции: [ЭБ] = 7.1 моль/л, wi = 8.6 × 10–8 л моль–1 с–1, 333 K. На графике приведена скорость окисления в начале и в конце опыта.
В табл. 3 приведена зависимость скорости окисления этилбензола от концентрации ингибитора. Согласно экспериментальным данным, присутствие C60 в среде окисляющегося этилбензола снижает длину цепи до ≥ 5 звеньев, следовательно, цепной режим сохраняется. Для оценки эффективности ингибирования (F) применили уравнение [32]:
(1)
$\begin{gathered} F = {{{{w}_{0}}} \mathord{\left/ {\vphantom {{{{w}_{0}}} {(w - {{w}_{i}})}}} \right. \kern-0em} {(w - {{w}_{i}})}}--{{(w - {{w}_{i}})} \mathord{\left/ {\vphantom {{(w - {{w}_{i}})} {{{w}_{0}}}}} \right. \kern-0em} {{{w}_{0}}}} = \\ = \,\,{{f{{k}_{7}}{{{[{{C}_{{60}}}]}}_{0}}} \mathord{\left/ {\vphantom {{f{{k}_{7}}{{{[{{C}_{{60}}}]}}_{0}}} {{{{(2{{k}_{6}}{{w}_{i}})}}^{{0.5}}}}}} \right. \kern-0em} {{{{(2{{k}_{6}}{{w}_{i}})}}^{{0.5}}}}},\quad \\ \end{gathered} $Таблица 3.
Зависимость скорости окисления этилбензола от концентрации производных фуллерена и эффективные константы скорости реакции fk7, измеренные для соединений 1–8. Условия реакции: [ЭБ] = 7.6 моль/л, wi = 4.4 × 10–8 л моль–1 с–1, 333 K.
| Соединение | [C60] × 104, моль/л | w × 107, л моль–1 с–1 | fk7, л моль–1 с–1 по ур-нию (2) |
fk7, л моль–1 с–1 по ур-нию (1) |
|---|---|---|---|---|
| – | 0 | 8.0 | – | – |
| 1 | 0.5 | 6.3 | – | (13.6 ± 1.1) × 103 |
| 1.6 | 5.5 | 14.7 × 103 | ||
| 3.1 | 2.7 | 8.8 × 103 | ||
| 4.4 | 2.1 | 8.2 × 103 | ||
| 2 | 1.6 | 4.5 | 9.7 × 103 | (10.3 ± 1.1) × 103 |
| 2.5 | 3.5 | 10.5 × 103 | ||
| 3.3 | 3.2 | 7.7 × 103 | ||
| 5.0 | 1.6 | 8.2 × 103 | ||
| 3 | 0.2 | 6.3 | – | (9.3 ± 0.8) × 103 |
| 3.1 | 3.3 | 8.1 × 103 | ||
| 4.7 | 2.5 | 7.6 × 103 | ||
| 6.2 | 2.4 | 6.2 × 103 | ||
| 4 | 0.8 | 6.8 | – | (9.4 ± 0.4) ×103 |
| 1.6 | 4.7 | 10.8 × 103 | ||
| 3.2 | 3.6 | 8.4 × 103 | ||
| 6.3 | 2.1 | 6.9 × 103 | ||
| 5 | 3.4 | 3.8 | 5.6 × 103 | (7.0 ± 0.3) × 103 |
| 6.7 | 2.5 | 6.7 × 103 | ||
| 0.5 | 9.0* | – | – | |
| 6 | 4.6 | 5.3** | 3.9 × 103 | – |
| 6.4 | 3.5 | 3.2 × 103 | ||
| 0.5 | 14.7*** | – | – | |
| 7 | 4.8 | 4.5 | 3.0 × 103 | (2.9 ± 0.6) × 103 |
| 9.6 | 3.6 | 2.6 × 103 | ||
| 8 | 12.9 | 2.3 | 2.0 × 103 | – |
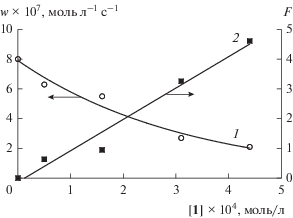
На рис. 3 представлена типичная зависимость снижения начальной скорости окисления этилбензола от концентрации C60 и результат обработки экспериментальных данных в координатах уравнения (1). Наблюдаемая удовлетворительная линеаризация зависимости позволяет оценить эффективность действия производных фуллерена в качестве ингибиторов окисления этилбензола. Полученные константы скорости (fk7) исследованных соединений представлены в табл. 3 (при расчете принимали 2k6 = 3.8 × 107 л моль–1 с–1 [33]).
Рис. 3.
Зависимости скорости поглощения кислорода при окислении этилбензола (1) и эффективности ингибирования F (2) от концентрации соединения 1 (r = 0.986) при [ЭБ] = 7.6 моль/л, 333 K и wi = 4.4 × × 10–8 моль л–1 с–1.
Также для расчета эффективной константы скорости ингибирования fk7 применили способ обработки кинетических кривых, предложенный в работе [34]. На рис. 4 представлена типичная зависимость параметра Δ[O2]–1 от [C60]/(wi(t – t')). Здесь t' – время достижения заданной глубины окисления Δ[O2] в опыте без добавления ингибитора (InH). Тангенс угла наклона начального участка зависимости, полученной в результате указанной обработки кинетической кривой, характеризует эффективность ингибирования и выражается уравнением:
(2)
$a = {{f{{k}_{7}}} \mathord{\left/ {\vphantom {{f{{k}_{7}}} {\left( {{{k}_{2}}[{\text{RH}}]} \right)}}} \right. \kern-0em} {\left( {{{k}_{2}}[{\text{RH}}]} \right)}}--{{{{{\left( {{{k}_{6}}{{w}_{i}}} \right)}}^{{0.5}}}} \mathord{\left/ {\vphantom {{{{{\left( {{{k}_{6}}{{w}_{i}}} \right)}}^{{0.5}}}} {\left( {{{k}_{2}}[{\text{RH}}]{{{\left[ {{{C}_{{60}}}} \right]}}_{0}}} \right)}}} \right. \kern-0em} {\left( {{{k}_{2}}[{\text{RH}}]{{{\left[ {{{C}_{{60}}}} \right]}}_{0}}} \right)}}.$Рис. 4.
Кинетическая кривая поглощения кислорода при окислении этилбензола в отсутствие ингибитора (1) и в присутствии соединения 8 (1.3 × 10–3 моль/л, 2) (а) и их обработка (б) по методу, предложенному в работе [29]. Условия реакции: [ЭБ] = 7.6 моль/л, 333 K и wi = 4.4 × 10–8 моль л–1 с–1.
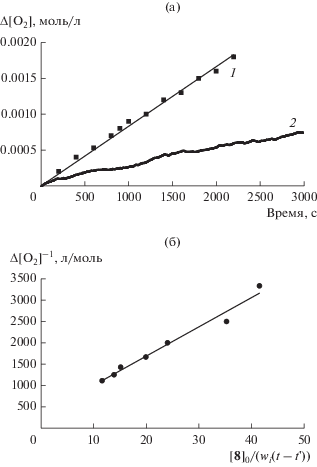
Кинетические кривые поглощения кислорода обрабатывали в координатах уравнения (2) (рис. 4). По тангенсу угла наклона полученных линейных зависимостей рассчитывали fk7. Из представленных в табл. 3 результатов следует, что эффективные константы скорости ингибирования fk7, полученные обоими методами, удовлетворительно согласуются между собой.
Экспериментальные данные свидетельствуют о том, что циклопентено- (1) и циклопропанозамещенные (2, 3) производные фуллерена обладают удовлетворительной антирадикальной активностью. Для них измерена эффективная константа скорости fk7 ≈ 1 × 104 л моль–1 с–1. По этому показателю они немного уступают ионолу, для которого в идентичных условиях константа скорости k7 = 2.3 × 104 л моль–1 с–1 [35]. Но при этом производные фуллерена отличаются намного большей длительностью ингибирующего действия. Реакционная способность соединений 6–8 по отношению к пероксильным радикалам оказалась невысокой (fk7 ≈ 3 × 103 л моль–1 с–1) и равной реакционной способности незамещенного фуллерена по отношению к пероксильным радикалам этилбензола (табл. 1). Для них также характерна значительная длительность их ингибирующего действия.
В табл. 1 представлены известные нам количественные данные о реакционной способности пероксильных радикалов по отношению к фуллерену и его производным. Анализ литературных данных свидетельствует о том, что значение константы скорости k7 зависит как от активности пероксильного радикала, так и от заместителя в молекуле фуллерена и может изменяться в диапазоне (3–75) × 103 л моль–1 с–1. Так, константа скорости реакции пероксильного радикала 1,4-диоксана с молекулой фуллерена k7 = 2.4 × 104 л моль–1 с–1 [9]. Для пероксильного радикала кумола с фуллереном получено fk7 = 3.1 × 102 л моль–1 с–1. Для фуллерена, содержащего ионол, константа скорости fk7 равна 1.5 × 104 л моль–1 с–1, при этом следует учесть, что эта константа относится к ингибирующей активности ионола, а наблюдаемое снижение скорости окисления после действия ионола не было количественно оценено [8]. Скорость взаимодействия пероксильного радикала этилбензола с незамещенной молекулой фуллерена характеризуется константой скорости реакции, равной 2 × 103 л моль–1 с–1 при температуре 343 K [12]. Отсюда следует, что введение в молекулу фуллерена малеопимаримидного заместителя не только не снижает антирадикальную активность фуллерена, а даже несколько увеличивает ее. Это и улучшенная растворимость изученных производных фуллерена в органических растворителях делает их перспективными для создания лекарственных препаратов.
Работа выполнена в соответствии с планом научно-исследовательских работ УфИХ РАН (№ гос. регистрации АААА-А17-117011910034-8).
Список литературы
Zeinalov E.B., Koûmehl G. // Polym. Degrad. Stab. 2001. V. 71. № 2. P. 197.
Ковтун Г.А., Каменева Т.М., Кочканян Р.О. // Катализ и нефтехимия. 2003. № 3. С. 36.
Булгаков Р.Г., Пономарева Ю.Г. // Изв. АН. Сер. хим. 2009. № 4. С. 769.
Horie M., Fukuhara A., SaitoY., YoshidaY., Sato H., Ohi H., Obata M., MikataY., Yano S., Niki E. // Bioorg. Med. Chem. Lett. 2009. V. 19. № 20. P. 5902.
Bakry R., Vallant R.M., Najam-ul-Haq M., Rainer M., Szabo Z., Huck C.W., Bonn G.K. // Int. J. Nanomed. 2007. V. 2. № 4. P. 639.
Krusic P.J., Wasserman E., Keizer P. N., Morton J.R., Preston K.F. // Science. 1991. V. 254. № 22. P. 1183.
Ковтун Г.О., Жила Р.С., Каменєва Т.М. // Катализ и нефтехимия. 2007. № 15. С. 97.
Enes R.F., Tomé A.C., Cavaleiro J.A.S., Amorati R., Fumo M.G., Pedulli G.F., Valgimigli L. // Chem. Eur. J. 2006. V. 12. № 17. P. 4646.
Юмагулова Р.Х., Медведева Н.А., Якупова Л.Р., Колесов С.В., Сафиуллин Р.Л. // Кинетика и катализ. 2013. Т. 54. № 6. С. 749.
Ковтун Г.О., Жила Р.С., Каменєва Т.М. // Доп. НАН України. 2008. № 12. С. 122.
Галимов Д.И., Булгаков Р.Г., Газеева Д.Р. // Изв. АН. Сер. хим. 2011. № 10. С. 2070.
Галимов Д.И., Газеева Д.Р., Мухамедьярова Р.К., Булгаков Р.Г. // Вестник Башкирск. ун-та. 2012. V. 17. № 4. С. 1671.
Bulgakov R.G., Galimov D.I., Gazeeva D.R. // Fuller. Nanotub. Car. N. 2013. V. 21. № 10. P. 869.
Жила Р.С., Трошин П.А. // Сборник научных трудов SWorld. Иваново, 2014. Т. 30. № 3. С. 34.
Сафарова И.В., Шарипова Г.М., Прозорова К.С., Герчиков А.Я. // Башкир. хим. журн. 2016. Т. 23. № 2. С. 59.
Сафарова И.В., Шарипова Г.М., Нугуманова Э.Ф., Герчиков А.Я. // Вестник Башкирск. ун-та. 2016. Т. 21. № 1. С. 37.
Герчиков А.Я., Шарипова Г.М., Сафарова И.В., Сахибгареева М.В., Спивак С.И. // Журн. физ. химии. 2017. Т. 91. № 6. С. 957.
Сахаутдинов И.М., Гумеров А.М., Гибадуллина Г.Г., Закирьянова О.В., Юнусов М.С. // Химия природ. соединений. 2015. № 2. С. 332.
Дикусар Е.А., Бей М.П., Ювченко А.П., Поткин В.И., Козлов Н.Г., Тлегенов Р.Т. // Химия растительного сырья. 2011. № 1. С. 105.
Yao G.Y., Ye M.Y., Huang R.Z., Li Y.J., Zhu Y.T., Pan Y.M., Liao Z.X., Wang H.S. // Bioorg. Med. Chem. Lett. 2013. V. 23. № 4. P. 6755.
Якупова Л.Р., Сахаутдинова Р.А., Фаттахов А.Х., Гимадиева А.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2013. Т. 54. № 3. С. 291.
Маликова Р.Н., Сахаутдинов И.М., Ишбаева С.М., Юнусов М.С. // Журн. общ. химии. 2017. Т. 87. № 10. С. 1749.
Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. № 3. P. 507.
Sakhautdinov I.M., Malikova R.N., Akchurina O.V., Petrova S.F., Yunusov M.S. // Lett. Org. Chem. 2017. V. 14. № 8. P. 575.
Torosyan S.A., Biglova Y.N., Mikheev V.V., Khalitova Z.T., Gimalova F.A., Miftakhov M.S. // Mendeleev Commun. 2012. V. 22. № 4. P. 199.
Biglova Y.N., Mikheev V.V., Torosyan S.A., Biglova R.Z., Miftakhov M.S. // Mendeleev Commun. 2015. V. 25. № 3. P. 202.
Кулицки З.И., Терман Л.М., Цепалов В.Ф., Шляпинтох В.Я. // Изв. АН СССР. Сер. хим. 1963. № 2. С. 253.
Якупова Л.Р., Проскуряков С.Г., Зарипов Р.Н., Рамеев Ш.Р., Сафиуллин Р.Л. // Бутлеров. сообщ. 2011. Т. 28. № 19. С. 71.
Эмануэль Н.М., Гал Д. Окисление этилбензола. М: Наука, 1984. 376 с.
McEwen C.N., McKay R.G., Larsen B.S. // J. Am. Chem. Soc. 1992. V. 114. № 11. P. 4412.
Wang I.C., Tai L.A., Lee D.D., Kanakamma P.P., Shen C.K.F., Luh T.-Y., Cheng C.H., Hwang K.C. // J. Med. Chem. 1999. V. 42. № 22. P. 4614.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Цепалов В.Ф., Шляпинтох В.Я. // Кинетика и катализ. 1962. Т. 3. № 6. С. 870.
Денисов Е.Т., Харитонов В.В., Фёдорова В.В. // Кинетика и катализ. 1975. Т. 16. № 2. С. 332.
Рогинский В.А, Фенольные антиоксиданты: реакционная способность и эффективность. М.: Наука, 1988. 243 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


