Кинетика и катализ, 2019, T. 60, № 3, стр. 403-408
Исследование окислительной конденсации метана на катализаторах Sr2 – xLaxTiO4: влияние степени замещения Sr и La
Р. В. Петров 1, *, Ю. А. Иванова 1, С. И. Решетников 1, Л. А. Исупова 1
1 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 5, Россия
* E-mail: petrov@catalysis.ru
Поступила в редакцию 30.11.2018
После доработки 14.01.2019
Принята к публикации 15.01.2019
Аннотация
Синтезированы катализаторы Sr2 –xLaxTiO4 (x = 0–2.0) на основе титаната стронция со структурой слоистого перовскита. Исследовано влияния степени замещения Sr на La на физико-химические (фазовый состав, текстурные характеристики) и каталитические свойства оксидов в реакции окислительной конденсации метана при температурах 700–800°С. Установлено, что наиболее активными и селективными в исследуемой реакции являются многофазные образцы Sr2 – xLaxTiO4 со степенью замещения x = 0.8–1.8, что, по-видимому, связано с наличием в них примесей оксидов лантана и стронция, с оптимальным их распределением по поверхности, а также величиной удельной поверхности.
Традиционные методы переработки метана в жидкие углеводороды осуществляются через сложные многостадийные процессы, реализация которых сопряжена с большими капиталовложениями. Более рациональными представляются одностадийные (без стадии получения синтез-газа) методы переработки метана с образованием С–С-связей в результате окислительной конденсации метана (ОКМ). В процессе ОКМ метан при высоких температурах (800–900°C) окисляется на катализаторах с образованием целевых продуктов – этана и этилена, и побочных – оксидов углерода [1, 2]. Схему реакции можно представить следующим образом:
(I)
${\text{C}}{{{\text{H}}}_{{\text{4}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}} \to \left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{, }}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}} \right){\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$(II)
${\text{C}}{{{\text{H}}}_{{\text{4}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}} \to \left( {{\text{CO, C}}{{{\text{O}}}_{{\text{2}}}}} \right){\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Несмотря на многочисленные исследования, практической реализации этот процесс пока не получил из-за недостаточно высоких выходов С2-углеводородов, что в основном связано с низкой эффективностью (селективностью, стабильностью) разрабатываемых катализаторов. Поэтому работы по синтезу перспективных катализаторов непрерывно продолжаются.
В результате проведенных обширных исследований было установлено, что каталитической активностью обладает широкий круг оксидных систем: оксиды щелочноземельных металлов (модифицированные ионами щелочных металлов [3]), оксиды редкоземельных металлов, смешанные оксиды щелочноземельных и редкоземельных металлов [4–6], а также сложные оксиды, содержащие в своем составе оксид марганца [7–9]. Наиболее перспективными с экономической точки зрения являются катализаторы, активные в области более низких температур (<800°С). Так, в этой области эффективны катализаторы на основе смешанных соединений щелочноземельных и редкоземельных элементов. В основном они содержат La2O3, промотированный ионами щелочноземельных металлов Sr, Mg, Ba и др. [10–13].
Наибольший интерес представляют материалы на основе Sr–La2O3, в реакции ОКМ они проявляют высокую активность [12, 14–17]. Особое внимание, наряду с нанесенными оксидными системами, заслуживают смешанные оксидные системы SrO и La2O3 со структурой подобной перовскиту (перовскит – CaTiO3). Благодаря своей кристаллической структуре (плотнейшая кубическая упаковка из ионов кислорода и катионов металла) они обладают рядом уникальных свойств (способностью к ионному обмену и интеркаляции ионов кислорода, высокой термостабильностью и т.д.), которые являются важными в катализе. Другой разновидностью смешанных оксидов являются слоистые перовскитоподобные системы, состоящие из перовскитных слоев (ABO3), чередующихся со слоями оксида (AO). Введение в структуру перовскитоподобных оксидов иновалентных и иноразмерных катионов металлов оказывает влияние на прочность связи металл–кислород и открывает дополнительную возможность регулировать их свойства, которые влияют на каталитическую активность. В работе [16] было показано, что оксидная система Sr2TiO4, полученная механохимическим методом, может выступать в качестве основы для разработки перспективных катализаторов для реакции ОКМ.
Целью нашей работы являлся синтез сложных оксидных систем со структурой слоистого перовскита Sr2 –xLaxTiO4 (x = 0–2) и исследование влияния степени замещения Sr на La на физико-химические (фазовый состав, текстурные характеристики) и каталитические свойства катализаторов в реакции окислительной конденсации метана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление образцов
Образцы готовили осаждением из раствора нитрата стронция Sr(NO3)2 в присутствии суспензии диоксида титана TiO2, предварительно измельченного в шаровой центробежно-планетарной мельнице при ускорении 40 g в течении 90 с. В качестве осадителя использовали 0.4 M раствор K2CO3. Осаждение вели при комнатной температуре до pH 9.5, затем осадок отфильтровывали, промывали до pH 7 и сушили в течение 10 ч при температуре 120°С. Все полученные образцы прокаливали при температуре 1100°С в течение 4 ч [17].
Методы исследования
Определение конверсии метана и селективности по продуктам (этан, этилен) проводили в проточной установке с неподвижным слоем катализатора [17]. Заранее приготовленная смесь реагентов из баллона через регулятор расхода газа поступала в реактор с катализатором при давлении, близком к атмосферному. Кварцевый реактор (внутренний диаметр 6 мм) обогревали высокотемпературной электропечью с псевдоожиженным слоем песка. На выходе из реактора отбирали пробы реакционной смеси, которые в режиме онлайн поступали на анализ в соединенные последовательно хроматографы ЛХМ-80 (Россия) и Цвет-500 (Россия), снабженные детекторами по теплопроводности. Газы СО2 и С2-углеводороды разделяли на колонке с полимерным сорбентом HayeSep, а H2, O2, N2, CH4 и CO – на такой же колонке с цеолитом 5А при температуре колонок 60 и 90°С соответственно. В качестве газа носителя использовали гелий.
Активность катализаторов в реакции ОКМ определяли при временах контакта 0.02–0.06 с. Исходная реакционная смесь содержала 46 мол. % CH4, 11.5 мол. % O2, 42.5 мол. % N2. Условия экспериментов были следующими: температура Т = = 700–800°С, давление P = 1 атм, объем катализатора 0.5 мл, фракция 0.25–0.5 мм (разбавленная кварцем 0.25–0.5 мм в объемном соотношении 1 : 4), объемная скорость подачи реакционной смеси 30 л/ч.
Пористую структуру образцов анализировали методом ртутной порометрии под давлением на порозиметре AutoPore IV 9500 V1.09 (“Micromeritics”, США).
Величину удельной поверхности (Sуд, м2/г) определяли методом БЭТ по тепловой десорбции аргона.
Фазовый состав исследовали методом рентгенофазового анализа (РФА). Рентгенограммы получали на дифрактометре Bruker D8 (“Bruker”, Германия) с использованием CuKα-излучения (λ = 1.5418 нм). Каждый образец сканировали по точкам с интервалом 0.05° в диапазоне 2θ от 10° до 70°. Состав фаз определяли при сопоставлении экспериментальных рентгенограмм с базой данных JCPDS. Расчет структурных параметров проводили с помощью программы FullProff.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и исследование физико-химических свойств образцов
Для исследования принципиальной возможности приготовления оксидных систем – титанатов Sr и La со структурой слоистого перовскита – методом осаждения синтезировали образцы Sr2 –x-LaxTiO4, различающиеся соотношением Sr и La (x = 0–2.0 с шагом, равным 0.2).
На рис. 1 представлены данные РФА для полученных образцов Sr2 – xLaxTiO4. Образец Sr2TiO4 (I4/MMM) обладает хорошо окристаллизованной структурой, подобной слоистому перовскиту, без примесей посторонних фаз. В структуре образцов со степенями замещения x = 0.2–0.6 помимо основной фазы Sr2TiO4 появляются примеси фаз TiO2 (P42/MNM) и La2O3 (P3-M1). В образце с x = 0.8 наблюдается образование фазы, подобной перовскиту SrTiO3 (PM3-M), а фаза Sr2TiO4 перестает быть основной (рис. 1а). В образцах с x ≥ 1.0 фаза Sr2TiO4 отсутствует. Основными фазами в образцах с х = 1.0–1.2 являются SrTiO3 и La2O3. Дальнейшее увеличение степени замещения до x = 1.4 приводит к образованию новой фазы La2TiO5 (PNAM), которая становится основной в образцах x = 1.6–2.0, а фаза SrTiO3, наоборот, постепенно исчезает. В области больших степеней замещения (x > 1.4) присутствует также фаза оксикарбоната лантана – La2O2(CO3) (AMA2), что обусловлено способностью La2O3 легко адсорбировать CO2 и взаимодействовать с ним [1] (рис. 1б). Интенсивные рефлексы фазы SrO (2θ = 29.77°, 34.69°, 49.88° и 59.33°) [18] трудно различать на рентгенограммах образцов с большими степенями замещения x ≥ 0.8 из-за перекрывания с сигналами других фаз, но вероятность присутствия SrO в образцах не исключена.
Рис. 1.
Данные РФА для катализаторов состава Sr2 –xLaxTiO4 при различных значениях x: a – х = 0 (1), 0.2 (2), 0.4 (3), 0.6 (4), 0.8 (5), 1.0 (6); б – х = 1.2 (7), 1.4 (8), 1.6 (9), 1.8 (10), 2.0 (11).
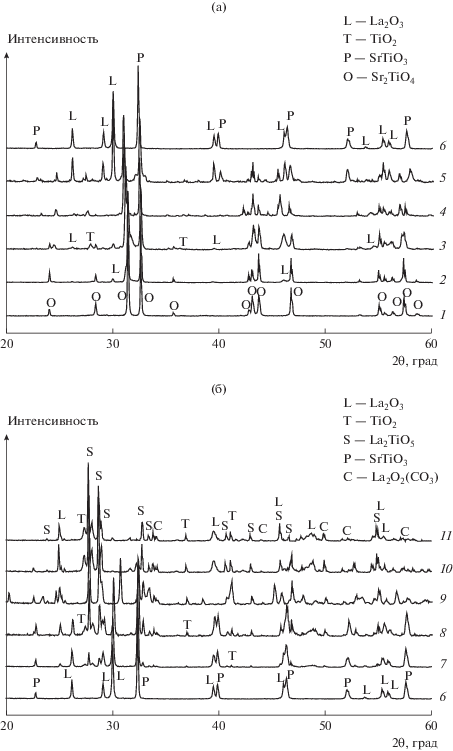
Согласно литературным данным, соединение SrLaTiO4 со структурой слоистого перовскита получить сложно [19] в силу значительных различий атомной координации в слоях SrO0 и LaО+, что приводит к сильному напряжению внутреннего электрического поля в решетке оксида [20]. Тем не менее La входит в структуру титаната стронция. Анализ положения основных рефлексов кристаллической структуры Sr2TiO4 (θ = 31.35° и 32.57°) показывает, что в образцах с x = 0.1–0.8 максимумы интенсивности рефлексов сдвигаются в сторону меньших углов. Это может означать, что атомы лантана входят в кристаллическую структуру Sr2TiO4 и замещают атомы Sr, а поскольку радиус La3+ (0.819 Å) больше радиуса Sr2+ (0.683 Å) параметры кристаллической решетки увеличиваются, чем и вызван сдвиг рефлексов в сторону меньших углов.
В табл. 1 представлены данные по удельной поверхности образцов, которая в зависимости от состава меняется в интервале 0.6–3.3 м2/г. Однофазный образец Sr2TiO4 обладает самым низкой величиной удельной поверхности 0.6 м2/г. Удельная поверхность образцов увеличивается с ростом степени замещения до x = 1.6, а затем уменьшается для x > 1.6. Изменение удельной поверхности образцов Sr2 – xLaxTiO4 в зависимости от х отражает, по-видимому, изменение дисперсности частиц, что, вероятно, связано с появлением новых фаз. Действительно, по данным рентгеновского анализа, размеры области когерентного рассеяния (ОКР) основных фаз проходят через минимум (табл. 1).
Таблица 1.
Фазовый состав оксидных систем Sr2–xLaxTiO4 в зависимости от содержания La
| x | Sуд, м2/г | Vпор, см3/г | Основные фазы | ОКР, Å | Примеси |
|---|---|---|---|---|---|
| 0 | 0.6 | 0.08 | Sr2TiO4 | 650 | – |
| 0.2 | 0.8 | – | Sr2TiO4 | 510 | TiO2, La2O3 |
| 0.4 | 0.8 | – | Sr2TiO4 | 470 | TiO2, La2O3 |
| 0.6 | 1.0 | – | Sr2TiO4 | 300 | SrTiO3, TiO2 |
| 0.8 | – | – | SrTiO3 La2O3 |
230 580 |
– |
| 1.0 | 1.3 | 0.122 | SrTiO3 La2O3 |
300 630 |
TiO2 |
| 1.2 | 1.8 | – | SrTiO3 La2O3 |
350 470 |
TiO2 |
| 1.4 | 2 | 0.200 | La2TiO5 SrTiO3, La2O3 |
440 310 310 |
TiO2, La2O2(CO3) |
| 1.6 | 3.3 | 0.210 | La2TiO5 | 580 | SrTiO3, TiO2, La2O2(CO3) |
| 1.8 | 2.5 | 0.121 | La2TiO5 La2O3 |
540 620 |
SrTiO3, TiO2, La2O2(CO3) |
| 2.0 | 1.5 | – | La2TiO5 La2O3 |
740 580 |
TiO2, La2O2(CO3) |
Данные сканирующей электронной микроскопии (СЭМ) подтверждают уменьшение размеров частиц образцов (рис. 2). Так, размер частиц однофазного образца Sr2TiO4 (х = 0) составляет 3–5 мкм, а для многофазных образцов состава х = = 1 частицы имеют размер 1–2 мкм, а состава x = = 1.6 – 0.5–1.0 мкм.
Таким образом, в системе Sr2 – xLaxTiO4 возможно формирование ограниченных твердых растворов со структурой слоистого перовскита в указанных условиях синтеза. Увеличение содержания La в исходном предшественнике до х ≤ 0.8 приводит к образованию, помимо фазы слоистого перовскита Sr2 –xLaxTiO4, фаз SrTiO3 и La2TiO5, а при x ≥ 1.0 фаза слоистого перовскита не образуется. При этом наблюдается уменьшение размеров частиц, о чем свидетельствуют данные ОКР, БЕТ (табл. 1) и СЭМ (рис. 2).
Исследование каталитической активности образцов
На рис. 3 представлены данные по изменению конверсии метана и селективности по С2-углеводородам в зависимости от содержания La (x) в синтезированных образцах.
Рис. 3.
Изменение конверсии метана и селективности образования С2-углеводородов при температурах 700 и 800°С и времени контакта 0.06 с.
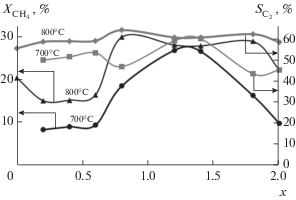
При повышении температуры испытаний конверсия метана на всех образцах возрастает, а при увеличении х – изменяется немонотонно (рис. 3). Так, при 800°С для образцов состава х = 0–0.6 конверсия метана составляет 15–20%, а выход С2-продуктов – 9–12% (рис. 3), что согласуется с данными работы [16] для катализатора Sr2TiO4 (при температуре испытаний 850°С селективность составила 60%, а выход С2-продуктов – ~12%). Максимальная конверсия метана при 800°С достигнута для образца с х = 0.8 и составляет ~30%, что при селективности 64% обеспечивает выход С2-продуктов, равный 19.2%. При полном замещении Sr на La (х = 2.0) выход снижается до 13%, т.е. в системе Sr2 – xLaxTiO4 наблюдается синергетический эффект. Полученные нами данные свидетельствуют о более высокой конверсии метана при 800°С для многофазных образцов в области составов х = 0.8–1.8, что может быть обусловлено наличием в этих образцах примесей оксидов стронция и лантана, а также более высокой удельной поверхностью этих образцов. Так, в работе [13] выход С2-продуктов на катализаторе Sr0.15La0.85O составил 18% при температуре 750°С.
Максимальные значения конверсии метана и селективности по C2-продуктам при температуре испытаний 700°С достигаются в более узком интервале составов (х = 1.2–1.4) и составляют 26 и 62% соответственно.
Увеличение времени контакта (0.02–0.06 с) при испытаниях приводит к повышению выхода С2-продуктов за счет увеличения конверсии метана, поскольку селективность по С2-продуктам практически не изменяется.
Активность оксидов SrO [21] и La2O3 [21, 22] в реакции ОКМ как индивидуальных, так и нанесенных на различные носители широко обсуждается в литературе. В образцах с низкой степенью замещения до х = 0.8 атомы Sr, по-видимому, связаны в структурах перовскита и не вносят дополнительного вклада в реакцию ОКМ. Замещение стронция на лантан нарушает структуру слоистого перовскита и приводит к образованию отдельных оксидных фаз La2O3, TiO2 и, вероятно, SrO. Отнесение рефлексов SrO на рентгенограммах многофазных образцов осложнено из-за перекрывания с рефлексами перовскитных фаз Sr2TiO4 и SrTiO3. Поэтому не исключено, что более высокая активность образцов со степенями замещения х = 1.2–1.4 при температурах 700–800°С обусловлена более высокой удельной поверхностью и присутствием активных в ОКМ оксидов La2O3 и SrO, их оптимальной дисперсностью и взаимным распределением относительно друг друга.
ЗАКЛЮЧЕНИЕ
Таким образом, синтезированы катализаторы на основе титаната стронция (A2TiO4, где А – катион Sr, La или Sr/La) различного стехиометрического состава и исследовано влияние степени замещения Sr на La на физико-химические (фазовый состав, текстурные характеристики) и каталитические свойства образцов.
Показана принципиальная возможность синтеза двойных оксидных систем Sr2 – xLaxTiO4 со структурой слоистого перовскита в образцах с х < < 0.8. Увеличение содержания лантана в реакционной смеси затрудняет образование фазы слоистого перовскита, и в образцах с х ≥ 1 она отсутствует, а формируются фазы SrTiO3 и La2TiO5, наряду с которыми присутствует примеси фаз La2O3 и, вероятно, SrO. Увеличение содержания La приводит к немонотонному увеличению дисперсности образцов за счет их многофазности.
Синтезированные образцы катализаторов на основе титаната стронция различного состава были испытаны в реакции окислительной конденсации метана при температурах 700 и 800°C. Установлено, что наиболее активными и селективными при этих температурах являются образцы катализатора Sr2 – xLaxTiO4 со степенью замещения x = 0.8–1.8, что, по-видимому, связано с оптимальным содержанием и взаимным распределением примесных активных оксидов La2O3 и SrO, а также более высокой удельной поверхностью этих образцов.
Список литературы
Onsager O.T., Lodeng R., Soraker P., Anundskaas A., Helleborg B. // Catal. Today. 1989. V. 4. P. 355.
Ломоносов В.И., Синев М.Ю. // Кинетика и катализ. 2016. Т. 57. № 5. С. 652.
Ito T., Lunsford J.H. // Nature. 1985. V. 314. P. 721.
Otsuka K., Jinno K., Morikawa A. // Chem. Lett. 1985. V. 14. P. 499.
Lin C.H., Campbell K.D., Wang J.X., Lunsford J.H. // J. Phys. Chem. 1986. V. 90. P. 534.
Otsuka K., Jinno K., Morikawa A. // J. Catal. 1986. V. 100. P. 353.
Jones C.A., Leonard J.J., Sofranko J.A. // J. Catal. 1987. V. 103. P. 311.
Sofranko J.A., Leonard J.J., Jones C.A., Gaffney A.M., Withers H.P. // Catal. Today. 1988. V. 3. P. 127.
Minachev Kh.M., Usachev N.Ya., Belanova E.P., Shirokova G.A. // Catal. Today. 1992. V. 13. P. 565.
Zhang Z.-L., Au C.T., Tsai K.R. // Appl. Catal. 1990. V. 62. P. 29.
Yingli B., Kaiji Z., Yutao J., Chiwen T., Xiangguong Y. // Appl. Catal. 1988. V. 39. P. 185.
Sollier B.M., Gymez L.E., Boix A.V., Miry E.E. // Appl. Catal. A. Gen. 2017. V. 532. P. 65.
Yamashita H., Machida Y., Tomita A. // Appl. Catal. A. Gen. 1991. V. 79. P. 203.
Song J., Sun Y., Ba R., Huang S., Zhao Y., Zhang J., Sun Y., Zhu Y. // Nanoscale. 2015. V. 7. P. 2260.
Karakaya C., Kee R.J. // Prog. Energy Combust. Sci. 2016. V. 55. P. 60.
Ivanov D.V., Isupova L.A., Gerasimov E.Yu., Dovlitova L.S., Glazneva T.S., Prosvirin I.P. // Appl. Catal. A. Gen. 2014. V. 485. P. 10.
Иванова Ю.А., Петров Р.В., Решетников С.И., Исупова Л.А. // Вест. ТГУ. Сер. Химия. 2017. № 8. С. 38.
Widiarti N., Suryana L.A., Wijayati N., Rahayu E.F., Harjito H., Wardhana S.B., Prasetyoko D., Suprapto S. // Bull. Chem. React. Eng. Catal. 2017. V. 12. P. 299.
Hosono H., Tanabe K., Takayama-Muromachi E., Kageyama H., Yamanaka S., Kumakura H., Nohara M., Hiramatsu H., Fujitsu S. // Sci. Technol. Adv. Mater. 2015. V. 16. № 033503. P. 1.
Pham A., Li S. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 11373.
Ghose R., Hwang H.T., Varma A. // Appl. Catal. A. Gen. 2013. V. 452. P. 147.
Zavyalova U., Holena M., Schlogl R., Baerns M. // Chem. Cat. Chem. 2011. V. 3. P. 1935.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



