Кинетика и катализ, 2019, T. 60, № 6, стр. 756-762
Кинетические автономные инварианты линейных химических реакций
В. Х. Федотов a, *, Н. И. Кольцов a
a ФГБОУ ВО Чувашский государственный университет им. И.Н. Ульянова, химико-фармацевтический факультет
428015 Чебоксары, Московский просп., 15, Россия
* E-mail: fvh@inbox.ru
Поступила в редакцию 07.03.2019
После доработки 17.04.2019
Принята к публикации 23.04.2019
Аннотация
Разработан метод расчета точных кинетических автономных инвариантов многостадийных линейных химических реакций, протекающих в безградиентном изотермическом реакторе через любое количество элементарных стадий с участием произвольного числа реагентов в рамках закона действующих масс. Такие инварианты представляют собой функции, которые остаются строго постоянными в течение всей реакции (т.е. не зависят от времени), хотя зависят от неравновесных концентраций реагентов, измеренных в двух экспериментах с разными начальными условиями (в дуал-экспериментах). Для динамических моделей линейных реакций всегда можно найти общие и частные аналитические решения, которые выражаются через начальные условия явным образом. Идея метода основана на выборе таких начальных условий, которые позволяют выразить неравновесные концентрации реагентов через постоянные кинетические параметры (константы скоростей стадий и скорости потока). Сформулирован критерий применимости метода. Показано, что число различных инвариантов равно числу реагентов. Полученные в работе соотношения применены к исследованию релаксационных свойств многостадийных линейных реакций, протекающих в закрытых и открытых изотермических системах. Найденные для этих реакций инвариантные кривые сопоставлены с кривыми изменения концентраций, измеренных в двух неравновесных экспериментах, в течение всего переходного процесса. Показано, что для этих реакций зависимости инвариантов от времени остаются строго постоянными, в то время как концентрации реагентов непрерывно изменяются (в том числе немонотонно) в ходе реакции. Полученные результаты расширяют представления о релаксационных закономерностях линейных химических реакций и могут быть использованы при решении обратных задач химической кинетики в условиях изотермического реактора идеального смешения.
Поиск неизвестных релаксационных закономерностей химических реакций является актуальной задачей химической кинетики [1–5]. Одной из недавно обнаруженных новых закономерностей являются автономные (не зависящие от времени) кинетические инварианты, сохраняющие свои значения в течение всего переходного процесса реакции. В настоящее время найдены точные инварианты линейных обратимых реакций с участием любого числа реагентов и для некоторых нелинейных реакций [6–16]. Недавно, инварианты нелинейной реакции были подтверждены и экспериментально [14]. Для их обнаружения использовался дуал-метод (dual-experiments method, DEM), впервые предложенный американо-брюссельской группой исследователей G. Yablonsky, D. Constales, G. Marin et al. [6–16] и основанный на двух экспериментах с взаимно-обратными (“термодинамическими”) граничными начальными условиями. Один из дуал-экспериментов стартует при наличии только исходного вещества, а второй – только продукта реакции. Этот подход был развит в работах [17–20], где изложен метод мультиэкспериментов (multi-experiments method, MEM), позволяющий использовать результаты двух и более неравновесных экспериментов с любыми физичными начальными условиями (не обязательно “термодинамическими”) и определять приближенные автономные инварианты (квазиинварианты) нелинейных реакций. Квазиинварианты отличаются от точных инвариантов тем, что остаются только приближенно (не строго) постоянными в ходе реакции. Точность квазиинвариантов зависит от значений кинетических параметров реакции и начальных условий. При некоторых значениях параметров МEМ может терять устойчивость и приводить к росту погрешности вычислений, что следует учитывать при его применении на практике. В связи с этим представляет интерес поиск новых подходов к развитию методов определения точных инвариантов различных классов реакций. Ниже описан новый, альтернативный метод расчета точных кинетических инвариантов линейных реакций, которые могут протекать через любое число элементарных стадий с участием произвольного числа исходных веществ и продуктов реакции [6–16].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Рассмотрим линейную химическую реакцию с участием n реагентов Аj, протекающую через s элементарных стадий вида
(1)
$\Sigma {{a}_{{ij}}}{{{\mathbf{А}}}_{j}} = \Sigma {{a}_{{ - ij}}}{{{\mathbf{А}}}_{j}},\,\,\,\,i = 1, \ldots ,s,\,\,\,\,~j = {\text{ }}1, \ldots ,n,$В открытых системах линейные реакции могут включать также нелинейные стадии с участием других реагентов, изменениями которых можно пренебречь (гипотеза квазистационарности Боденштейна–Семенова [1, 2]). Динамика реакций (1), (2) в безградиентном изотермическом реакторе в рамках закона действующих масс описывается системой линейных обыкновенных дифференциальных уравнений (ОДУ)
(3)
$\begin{gathered} А_{j}^{'} = \Sigma ({{a}_{{ - ij}}} - {{a}_{{ij}}})({{r}_{i}} - {{r}_{{ - i}}}) + {{q}_{0}}{{A}_{{0j}}} - q{{A}_{j}}, \\ j = {\text{ }}1, \ldots ,n, \\ \end{gathered} $Линейные реакции имеют только одно устойчивое равновесие Aj∞ [21], которое определяется из системы линейных алгебраических уравнений
(5)
$\begin{gathered} \Sigma ({{a}_{{ - ij}}} - {{a}_{{ij}}})({{r}_{{i~}}} - {{r}_{{ - i}}}){\text{ }} + {{q}_{0}}{{A}_{{0j}}} - q{{A}_{j}} = {\text{ }}0, \\ j = {\text{ }}1, \ldots ,n, \\ \end{gathered} $(6)
${{A}_{{j\infty }}} = {{{{\Delta }_{{j~}}}} \mathord{\left/ {\vphantom {{{{\Delta }_{{j~}}}} \Delta }} \right. \kern-0em} \Delta },~\,\,\,j = 1, \ldots ,n,$В открытых системах ЗС могут быть записаны в дифференциальной форме
Эти ЗС позволяют снизить порядок системы (3) на единицу и должны учитываться при выборе н. у. для экспериментов. Общее решение системы (3) определяется собственными числами (с. ч.) λ1, λ2, …, λ1n – корнями характеристического уравнения (х. у.)
(9)
${{\varphi }_{0}}{{\lambda }^{n}} + {{\varphi }_{1}}{{\lambda }^{{n - 1}}} + \ldots + {{\varphi }_{{n - 1}}}\lambda + {{\varphi }_{n}} = {\text{ }}0,$(10)
$\begin{gathered} {{A}_{j}}(t) = \Sigma {{С}_{{jk}}}\exp ({{\lambda }_{k}}t) + {{С}_{j}},\,\,\,\,j = {\text{ }}1, \ldots ,n, \\ k = 1, \ldots ,n, \\ \end{gathered} $(11)
$\begin{gathered} \exp \left( {mt} \right)\left( {P\cos nt + Q\sin nt} \right) = \\ = \exp \left( {mt} \right)R\sin (nt + a), \\ \end{gathered} $Применим к решениям (10) и (11) метод, аналогичный [17–20], немного модифицировав его. В исходном варианте этот метод допускает использование любых двух различных физичных н. у. Модификация состоит в более “жестком” выборе н. у., которые должны удовлетворять следующим достаточным условиям (критерию) применимости метода
(12)
${{С}_{{jk}}} = 0,\,\,\,\,k \ne {{k}_{0}}\,\,\,\,{\text{и}}\,\,\,\,{{С}_{{jk0}}} \ne 0,\,\,\,\,0 \leqslant {{A}_{{0j}}} \leqslant 1.$Эти условия выражают требования равенства нулю всех коэффициентов при экспонентах в (10) и (11), кроме одного коэффициента с номером k0, хотя бы для одного реагента с номером j0, при физичных значениях н. у. Они представляют собой систему (n – 1) линейных уравнений с n неизвестными, которая имеет бесконечное число решений. Если среди этих решений есть хотя бы одно физичное, то критерий (12) выполним и решения (10) и (11) для двух различных н. у. могут быть представлены в виде
(13)
$\begin{gathered} {{A}_{j}}_{1} = {{С}_{{jk,1}}}\exp ({{\lambda }_{k}}_{0}t) + {{С}_{j}}, \\ ~{{A}_{j}}_{2} = \Sigma {{С}_{{jk,2}}}\exp ({{\lambda }_{k}}_{0}t) + {{С}_{j}}. \\ \end{gathered} $При наличии комплексно-сопряженных с. ч. соответствующие пары слагаемых в (13) имеют вид (11). Найдем из первого уравнения (13) единственную зависящую от t экспоненту и вычислим, с учетом (9), остальные зависящие от t экспоненты
(14)
$\begin{gathered} \exp ({{\lambda }_{k}}_{0}t) = {{({{A}_{j}}_{1} - {{С}_{j}})} \mathord{\left/ {\vphantom {{({{A}_{j}}_{1} - {{С}_{j}})} {{{С}_{{jk,1}}}}}} \right. \kern-0em} {{{С}_{{jk,1}}}}}, \\ \exp ({{\lambda }_{j}}t) = {{[\exp ({{\lambda }_{k}}_{0}t)]}^{{{{\lambda j} \mathord{\left/ {\vphantom {{\lambda j} {\lambda k0}}} \right. \kern-0em} {\lambda k0}}}}} = \\ = {{[{{({{A}_{j}}_{1} - {{С}_{j}})} \mathord{\left/ {\vphantom {{({{A}_{j}}_{1} - {{С}_{j}})} {{{С}_{{jk,1}}}}}} \right. \kern-0em} {{{С}_{{jk,1}}}}}]}^{{{{\lambda j} \mathord{\left/ {\vphantom {{\lambda j} {\lambda k0}}} \right. \kern-0em} {\lambda k0}}}}}, \\ \end{gathered} $(15)
${{I}_{j}}(t) \equiv {{A}_{{j2}}} - \Sigma {{С}_{{jk,2}}}[{{({{A}_{j}}_{1} - {{{{С}_{j}})} \mathord{\left/ {\vphantom {{{{С}_{j}})} {{{С}_{{jk,1}}}}}} \right. \kern-0em} {{{С}_{{jk,1}}}}}]}^{{{{\lambda j} \mathord{\left/ {\vphantom {{\lambda j} {\lambda k0}}} \right. \kern-0em} {\lambda k0}}}}} = {{С}_{j}},$(16)
$\begin{gathered} {{K}_{j}}(t) \equiv \{ {{A}_{j}}_{2} - \\ - \,\,{{\Sigma {{С}_{{jk,2}}}[{{{({{A}_{j}}_{1} - {{{{С}_{j}}){\text{ }}} \mathord{\left/ {\vphantom {{{{С}_{j}}){\text{ }}} {{{С}_{{jk,1}}}}}} \right. \kern-0em} {{{С}_{{jk,1}}}}}]}}^{{{{\lambda j} \mathord{\left/ {\vphantom {{\lambda j} {\lambda k0}}} \right. \kern-0em} {\lambda k0}}}}}\} } \mathord{\left/ {\vphantom {{\Sigma {{С}_{{jk,2}}}[{{{({{A}_{j}}_{1} - {{{{С}_{j}}){\text{ }}} \mathord{\left/ {\vphantom {{{{С}_{j}}){\text{ }}} {{{С}_{{jk,1}}}}}} \right. \kern-0em} {{{С}_{{jk,1}}}}}]}}^{{{{\lambda j} \mathord{\left/ {\vphantom {{\lambda j} {\lambda k0}}} \right. \kern-0em} {\lambda k0}}}}}\} } {{{C}_{j}}}}} \right. \kern-0em} {{{C}_{j}}}} = 1. \\ \end{gathered} $Левые части выражений (15) и (16) не зависят от времени, а зависят только от концентраций одного из реагентов, кинетических параметров и н. у. реакции, т.е. являются точными автономными инвариантами, существенно нелинейными относительно концентраций любого из реагентов, измеренных в двух неравновесных экспериментах. При выполнении условий Aj1 > Сj они принимают действительные значения, являются физичными и наблюдаются на графиках в виде горизонтальных линий.
Таким образом, в закрытых и открытых системах в рамках закона действующих масс аналитические выражения для инвариантов линейных химических реакций (15) и (16), протекающих в безградиентном изотермическом реакторе, могут быть представлены в виде суммы концентраций реагентов (в степенях от констант скоростей стадий), найденных из двух неравновесных значений концентраций с любой заданной парой начальных условий, удовлетворяющих критерию применимости метода (12). Максимальное число таких инвариантов для выбранной пары начальных условий равно числу реагентов. При выборе другой пары начальных условий можно построить еще столько же инвариантов и т.д. Для их экспериментальной проверки необходимо данные двух соответствующих экспериментов подставить в левые части любого из инвариантных выражений (15) и (16) и сравнить их с константами в правых частях этих соотношений. Выполнение или невыполнение этих равенств будет, соответственно, означать приемлемость или неприемлемость исследуемого механизма химической реакции, что может быть полезно при решении обратных задач.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пример 1. Пусть реакция A = C протекает по последовательной схеме
Динамика таких реакций в закрытой системе описывается ОДУ вида (3):
(1.2)
$\begin{gathered} A{\kern 1pt} ' = - {{k}_{1}}A + {{k}_{{ - 1}}}B, \\ B{\kern 1pt} ' = {{k}_{1}}A - {{k}_{{ - 1}}}B - {{k}_{2}}B + {{k}_{{ - 2}}}C, \\ C{\kern 1pt} ' = {{k}_{2}}B - {{k}_{{ - 2}}}C. \\ \end{gathered} $Координаты равновесия (5) и (6) для этой системы равны A∞ = k–1k–2/Δ, B∞ = k1k–2/Δ, C∞ = = k1k2/Δ, Δ = k1k2 + k1k–2 + k–1k–2, а ЗС (7) запишется как
(1.3)
$A + B + C = {{A}_{0}} + {{B}_{0}} + {{C}_{0}} = {{A}_{\infty }} + {{B}_{\infty }} + {{C}_{\infty }} = {\text{ }}1.$Выразим отсюда B = 1 – A – C, подставим в (1.2) и получим два ОДУ относительно A и C, т.е. понизим порядок системы (3) на единицу
(1.4)
$\begin{gathered} A{\kern 1pt} ' = - {{k}_{1}}A + {{k}_{{ - 1}}}(1 - A - C), \\ C{\kern 1pt} ' = {{k}_{2}}(1 - A - C) - {{k}_{{ - 2}}}C. \\ \end{gathered} $Общее решение (1.4) определяется корнями х. у. (9), которое запишется как
где φ1 = k1 + k–1 + k2 + k–2, φ2 = k1k2 + k1k–2 + k–1k–2. Анализ показал, что уравнение (1.5) имеет только действительные корни. Пусть k1 = 1, k–1 = 1, k2 = 1, k–1 = 1, тогда φ1 = 4, φ2 = 3 и λ1 = –1, λ2 = –3, а решения (10) системы (1.4) запишутся как(1.6)
$\begin{gathered} A = ({{A}_{0}} - {{C}_{0}}){\text{exp}}{{( - t)} \mathord{\left/ {\vphantom {{( - t)} 2}} \right. \kern-0em} 2} + \\ + \,\,({{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} 2}} \right. \kern-0em} 2} + {{{{C}_{0}}} \mathord{\left/ {\vphantom {{{{C}_{0}}} 2}} \right. \kern-0em} 2} - {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}){\text{exp}}( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}, \\ \end{gathered} $(1.7)
$\begin{gathered} C = {\text{ }}({{C}_{0}} - {{A}_{0}})\exp {{( - t)} \mathord{\left/ {\vphantom {{( - t)} 2}} \right. \kern-0em} 2} + \\ + \,\,({{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} 2}} \right. \kern-0em} 2} + {{{{C}_{0}}} \mathord{\left/ {\vphantom {{{{C}_{0}}} 2}} \right. \kern-0em} 2} - {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3})\exp ( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}. \\ \end{gathered} $Из (1.6) видно, что условие применимости метода (12) к любому реагенту A (j0 = 1) или С (j0 = 2) по первой (k = 1) экспоненте запишется как A0 = C0, а по второй (k = 2) экспоненте примет вид A0 + C0 = 2/3. Выполним с учетом ЗС (1.3), например, второе из этих условий. Оно представляет собой одно линейное уравнение с двумя неизвестными, которое имеет бесконечное число решений. Одним из физичных решений с учетом ЗС (1.3) является A01 = 0, B01 = 1/3, C01 = 2/3. Второе н. у. выберем произвольно A02 = 2/3, B02 = 0, C02 = 1/3, но тоже с учетом ЗС. Для этих н. у. соотношения (13) примут вид
(1.8)
$\begin{gathered} {{A}_{1}} = {{ - 1} \mathord{\left/ {\vphantom {{ - 1} 3}} \right. \kern-0em} 3}\exp ( - t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}, \\ {{A}_{2}} = {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}\exp ( - t) + {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}\exp ( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}, \\ \end{gathered} $(1.9)
$\begin{gathered} {{C}_{1}} = {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}\exp ( - t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}, \\ {{C}_{2}} = {{ - 1} \mathord{\left/ {\vphantom {{ - 1} 6}} \right. \kern-0em} 6}\exp ( - t) + {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}\exp ( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}. \\ \end{gathered} $Из (1.8) и (1.9) видно, что для реагентов A и С соотношения (14) запишутся как
(1.10)
$\begin{gathered} \exp ( - t){\text{ }} = {\text{ }}1 - 3{{A}_{1}}, \\ \exp ( - 3t) = {{\exp }^{3}}( - t) = {{(1 - 3{{A}_{1}})}^{3}}, \\ \end{gathered} $(1.11)
$\begin{gathered} \exp ( - t) = 3{{C}_{1}} - 1, \\ \exp ( - 3t) = {{\exp }^{3}}( - t) = {{(3{{C}_{1}} - 1)}^{3}}. \\ \end{gathered} $Подставим (1.10) во второе уравнение (1.8) и найдем точный А-инвариант
или в нормированной форме(1.13)
${{K}_{A}}(t) \equiv 3{{A}_{2}} - (1 - {{3{{A}_{1}})} \mathord{\left/ {\vphantom {{3{{A}_{1}})} 2}} \right. \kern-0em} 2} - (1 - {{3{{A}_{1}}{{)}^{3}}} \mathord{\left/ {\vphantom {{3{{A}_{1}}{{)}^{3}}} 2}} \right. \kern-0em} 2} = {\text{ }}1.$Подставим (1.11) во второе уравнение (1.9) и найдем точный C-инвариант
или в нормированной форме(1.15)
${{K}_{С}}(t) \equiv 3{{C}_{2}} + {\text{ }}(3{{C}_{1}} - {{1){\text{ }}} \mathord{\left/ {\vphantom {{1){\text{ }}} 2}} \right. \kern-0em} 2} - (3{{C}_{1}} - {{1{{)}^{3}}} \mathord{\left/ {\vphantom {{1{{)}^{3}}} 2}} \right. \kern-0em} 2} = {\text{ }}1.$Инварианты (1.13), (1.15) и решения двух задач Коши показаны на рис. 1а и 1б.
Рис. 1.
а – Решения двух задач Коши и точный A-инвариант для реакции (1.1) при k1= 1, k–1 = 1, k2= 1, k–1 = 1, A01 = 0, B01 = 1/3, C01 = 2/3, A02 = 2/3, B02 = 0, C02 = 1/3: 1 – A1(t), 2 – A2(t), 3 – KA(t). б – Решения двух задач Коши и C-инвариант для реакции (1.1) при k1= 1, k–1 = 1, k2= 1, k–1 = 1, A01 = 0, B01 = 1/3, C01 = 2/3, A02 = 2/3, B02 = 0, C02 = 1/3: 1 – C1(t), 2 – C2(t), 3 – KC(t).
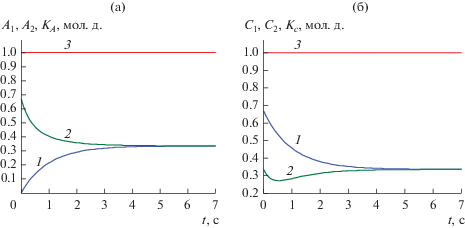
Как видно на рис. 1а и 1б, зависимости KA(t) и KC(t) представляют собой строго горизонтальные линии, т.е. не зависят от времени и являются точными инвариантами.
Если та же реакция A = С протекает по параллельной схеме
то ее динамика с учетом ЗС (1.3) описывается ОДУ(1.17)
$\begin{gathered} A{\kern 1pt} ' = - {{k}_{1}}A + {{k}_{{ - 1}}}(1 - A - C) - {{k}_{2}}A{\text{ }} + {\text{ }}{{k}_{{ - 2}}}C, \\ C{\kern 1pt} ' = {{k}_{2}}(1 - A - C) - {{k}_{{ - 2}}}C. \\ \end{gathered} $Коэффициенты х. у. (9) примут вид φ1 = k1 + k–1 ++ 2k2 + k–2, φ2 = k1k2 + k1k–2 + 2k2k–2 + k–1k–2 + k22, откуда при тех же значениях констант получим φ1 = 5, φ2 = 6, т.е. λ1 = –2, λ2 = –3, и соотношения (13) по реагенту A запишутся как
(1.18)
$\begin{gathered} {{A}_{1}} = {\text{ }}({{A}_{{01}}} - {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3})\exp ( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}, \\ {{A}_{2}} = ({{A}_{{02}}} - {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3})\exp ( - 3t) + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}. \\ \end{gathered} $Из (1.18) с учетом (15) и (16) для той же пары н. у. A01 = 0, B01 = 1/3, C01 = 2/3 и A02 = 2/3, B02 = 0, C02 = 1/3 получим ненормированный и нормированный инварианты
(1.20)
${{K}_{A}}\left( t \right) \equiv {{3{{A}_{1}}} \mathord{\left/ {\vphantom {{3{{A}_{1}}} 2}} \right. \kern-0em} 2} + 3{{{{A}_{2}}} \mathord{\left/ {\vphantom {{{{A}_{2}}} 2}} \right. \kern-0em} 2} = 1.$Нетрудно убедиться, что графики этих зависимостей тоже представляют собой строго горизонтальные линии, т.е. являются точными инвариантами.
Пример 2. Рассмотрим линейную трехстадийную схему реакции A = D:
(2.1)
$1)\,\,{\mathbf{A}} = {\mathbf{B}},\,\,\,\,{\text{ }}2)\,\,{\mathbf{B}} = {\mathbf{С}},\,\,\,\,3)\,\,{\mathbf{C}} = {\mathbf{D}}.$Динамика реакции (2.1) описывается ОДУ
(2.2)
$\begin{gathered} A{\kern 1pt} ' = - {{k}_{1}}A + {{k}_{{ - 1}}}B, \\ B{\kern 1pt} ' = {{k}_{1}}A - {{k}_{{ - 1}}}B - {{k}_{2}}B + {{k}_{{ - 2}}}C, \\ C{\kern 1pt} ' = {{k}_{2}}B - {{k}_{{ - 2}}}C - {{k}_{3}}C + {{k}_{{ - 3}}}D, \\ D{\kern 1pt} ' = {{k}_{3}}C - {{k}_{{ - 3}}}D. \\ \end{gathered} $Координаты равновесия (5) и (6) равны A∞ = = k–1k–2k–3/Δ, B∞ = k1k–2k–3/Δ, C∞ = k1k2k–3/Δ, D∞ = k1k2k3/Δ, где Δ = k1k2k3 + k1k–2k–3 + k1k2k–3 + + k–1k–2k–3, а ЗС (7) принимает вид
(2.3)
$\begin{gathered} A + B + C + D = {{A}_{0}} + {{B}_{0}} + {{C}_{0}} + {{D}_{0}} = \\ = {{A}_{\infty }} + {{B}_{\infty }} + {{C}_{\infty }} + {{D}_{\infty }} = 1. \\ \end{gathered} $Выразим отсюда B, подставим в (2.2) и получим систему ОДУ третьего порядка
(2.4)
$\begin{gathered} A{\kern 1pt} ' = - {{k}_{1}}A + {{k}_{{ - 1}}}B, \\ C{\kern 1pt} ' = {{k}_{2}}B - {{k}_{{ - 2}}}C - {{k}_{3}}C + {{k}_{{ - 3}}}D, \\ D{\kern 1pt} ' = {{k}_{3}}C - {{k}_{{ - 3}}}D, \\ \end{gathered} $(2.5)
${{\lambda }^{3}} + {{\varphi }_{1}}{{\lambda }^{2}} + {{\varphi }_{2}}\lambda + {{\varphi }_{3}} = {\text{ }}0,$(2.6)
$\begin{gathered} A = ({{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} 2}} \right. \kern-0em} 2} + {{{{C}_{0}}} \mathord{\left/ {\vphantom {{{{C}_{0}}} 2}} \right. \kern-0em} 2} - {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4})\exp ({{\lambda }_{1}}t) + \\ + \,\,{{С}_{{120}}}\exp ({{\lambda }_{2}}t) + {{С}_{{130}}}\exp ({{\lambda }_{3}}t) + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}, \\ \end{gathered} $(2.7)
$\begin{gathered} {{\alpha }_{{12}}}{{A}_{0}} + {{b}_{{12}}}{{B}_{0}} + {{\gamma }_{{12}}}{{C}_{0}} + {{\theta }_{{12}}} = {\text{ }}0, \\ {{\alpha }_{{13}}}{{A}_{0}} + {{b}_{{13}}}{{B}_{0}} + {{\gamma }_{{13}}}{{C}_{0}} + {{\theta }_{{13}}} = {\text{ }}0. \\ \end{gathered} $Эта система имеет бесконечно много решений. Выберем из них одно физичное решение, например, А01 = 0, B01 = 1/2, C01 = 0. Второе н. у. возьмем любое A02 = 1, B02 = 0, C02 = 0. Решения (2.6) для этих двух н. у. примут вид
(2.8)
${{A}_{1}} = - {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}\exp ({{\lambda }_{1}}t) + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4},$(2.9)
$\begin{gathered} {{A}_{2}} = {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}\exp ({{\lambda }_{1}}t) + {{С}_{{120,2}}}\exp ({{\lambda }_{2}}t) + \\ + \,\,{{С}_{{130,2}}}\exp ({{\lambda }_{3}}t) + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}, \\ \end{gathered} $(2.10)
$\begin{gathered} \exp ({{\lambda }_{1}}t) = 1 - 4{{A}_{1}},\,\,\,\,\exp ({{\lambda }_{2}}t) = {{(1 - 4{{A}_{1}})}^{{{{\lambda 2} \mathord{\left/ {\vphantom {{\lambda 2} {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}}, \\ \exp ({{\lambda }_{3}}t) = {{(1 - 4{{A}_{1}})}^{{{{\lambda 3} \mathord{\left/ {\vphantom {{\lambda 3} {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}}. \\ \end{gathered} $Подставим (2.10) в (2.9) и найдем точный А-инвариант системы (2.2):
(2.11)
$\begin{gathered} {{I}_{A}}(t) \equiv {{A}_{2}} - (1 - {{4{{A}_{1}})} \mathord{\left/ {\vphantom {{4{{A}_{1}})} 4}} \right. \kern-0em} 4} - {{С}_{{120,2}}}{{(1 - 4{{A}_{1}})}^{{{{\lambda 2} \mathord{\left/ {\vphantom {{\lambda 2} {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}} - \\ - \,\,{{С}_{{130,2}}}{{(1 - 4{{A}_{1}})}^{{\lambda {3 \mathord{\left/ {\vphantom {3 {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}} = {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}, \\ \end{gathered} $(2.12)
$\begin{gathered} {{K}_{A}}(t) \equiv 4{{A}_{2}} + 4{{A}_{1}} - 1 - 4{{С}_{{120,2}}}{{(1 - 4{{A}_{1}})}^{{{{\lambda 2} \mathord{\left/ {\vphantom {{\lambda 2} {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}} - \\ - \,\,4{{С}_{{130,2}}}{{(1 - 4{{A}_{1}})}^{{{{\lambda 3} \mathord{\left/ {\vphantom {{\lambda 3} {\lambda 1}}} \right. \kern-0em} {\lambda 1}}}}} = {\text{ }}1. \\ \end{gathered} $Рис. 2.
Решения задач Коши и A-инвариант для реакции (2.1) при k1 = 1, k–1 = 1, k2 = 1, k–1 = 1, k3 = 1, k–3 = 1, A01 = 0, B01 = 1/2, C01 = 0, D01 = 1/2, A02 = 1, B02 = 0, C02 = 0, D02 = 0: 1 – A1(t), 2 – A2(t), 3 – KA(t).
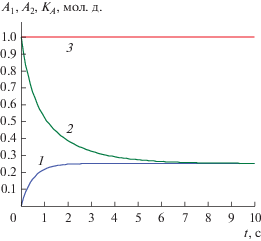
Инвариант (2.12) и решения двух задач Коши показаны на рис. 2. Решения системы (2.2) для других реагентов запишутся аналогично (2.6):
(2.13)
$\begin{gathered} C = ({1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4} - {{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} 2}} \right. \kern-0em} 2} - {{{{C}_{0}}} \mathord{\left/ {\vphantom {{{{C}_{0}}} 2}} \right. \kern-0em} 2})\exp ({{\lambda }_{1}}t) + \\ + \,\,{{С}_{{220}}}\exp ({{\lambda }_{2}}t) + {{С}_{{230}}}\exp ({{\lambda }_{3}}t) + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}, \\ \end{gathered} $(2.14)
$\begin{gathered} D = ({{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} 2}} \right. \kern-0em} 2} + {{{{C}_{0}}} \mathord{\left/ {\vphantom {{{{C}_{0}}} 2}} \right. \kern-0em} 2} - {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}){\text{exp}}({{\lambda }_{1}}t) + \\ + \,\,{{С}_{{320}}}{\text{exp}}({{\lambda }_{2}}t) + {{С}_{{330}}}{\text{exp}}({{\lambda }_{3}}t) + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}, \\ \end{gathered} $Пример 3. Рассмотрим реакцию, протекающую по линейной циклической схеме
(3.1)
$1)\,\,{\mathbf{А}} = {\mathbf{В}},\,\,\,\,2)\,\,{\mathbf{В}} = {\mathbf{С}},\,\,\,\,3)\,\,{\mathbf{С}} = {\mathbf{D}},\,\,\,\,4)\,\,{\mathbf{D}} = {\mathbf{A}}.$Эта реакция описывается ОДУ
(3.2)
$\begin{gathered} x{\kern 1pt} ' = {{r}_{1}} - {{r}_{2}},\,\,\,\,y{\kern 1pt} ' = {{r}_{2}} - {{r}_{3}}, \\ q{\kern 1pt} ' = {{r}_{3}} - {{r}_{4}},\,\,\,\,z{\kern 1pt} ' = {{r}_{4}} - {{r}_{1}}, \\ \end{gathered} $Пусть k1= 1, k2 = 2, k3 = 3, k4 = 4, k–1 = 0.5, k–2 = 0.3, k–3 = 0.3, k–4 = 1. Тогда λ1 = –6.2002 (действительное), а λ2,3 = –2.9499 ± 1.4520i (комплексно-сопряженные), и x-решения, с учетом (11), запишутся как
(3.4)
$\begin{gathered} x = {{С}_{{110}}}\exp ({{\lambda }_{1}}t) + ({{С}_{{120}}}\cos nt + \\ + \,\,{{С}_{{130}}}\sin nt)\exp \left( {mt} \right) + {{2676} \mathord{\left/ {\vphantom {{2676} {13\,405}}} \right. \kern-0em} {13\,405}}, \\ \end{gathered} $(3.6)
$\begin{gathered} {{x}_{2}} = {{С}_{{110\_2}}}\exp ({{\lambda }_{1}}t) + ({{С}_{{120\_2}}}\cos nt + \\ + \,\,{{С}_{{130\_2}}}\sin nt)\exp (mt) + {{C}_{1}}, \\ \end{gathered} $Из (3.5) получим
(3.7)
$\begin{gathered} {{E}_{1}} \equiv \exp ({{\lambda }_{1}}t) = ({{x}_{1}} - {{{{С}_{1}})} \mathord{\left/ {\vphantom {{{{С}_{1}})} {{{С}_{{110\_1}}}}}} \right. \kern-0em} {{{С}_{{110\_1}}}}}, \\ {{E}_{2}} \equiv \exp (mt) = {{E}_{1}}{{^{m}}^{{/\lambda 1}}}, \\ t = \ln {{[({{x}_{1}} - {{{{С}_{1}})} \mathord{\left/ {\vphantom {{{{С}_{1}})} {{{С}_{{110\_1}}}]}}} \right. \kern-0em} {{{С}_{{110\_1}}}]}}} \mathord{\left/ {\vphantom {{[({{x}_{1}} - {{{{С}_{1}})} \mathord{\left/ {\vphantom {{{{С}_{1}})} {{{С}_{{110\_1}}}]}}} \right. \kern-0em} {{{С}_{{110\_1}}}]}}} {{{\lambda }_{1}}}}} \right. \kern-0em} {{{\lambda }_{1}}}}. \\ \end{gathered} $Подставим (3.7) в (3.6) и найдем точный x-инвариант системы (3.2), (3.3):
(3.8)
$\begin{gathered} {{I}_{x}} \equiv {{x}_{2}} - {{С}_{{110\_2}}}{{E}_{1}} - ({{С}_{{120\_2}}}\cos nt + \\ + \,\,{{С}_{{130\_2}}}\sin nt){{E}_{2}} = {{С}_{1}}, \\ \end{gathered} $(3.9)
$\begin{gathered} {{K}_{x}} \equiv {{x}_{2}} - {{С}_{{110\_2}}}{{{{E}_{{1~}}}} \mathord{\left/ {\vphantom {{{{E}_{{1~}}}} {{{С}_{1}}}}} \right. \kern-0em} {{{С}_{1}}}} - \\ - \,\,({{С}_{{120\_2}}}\cos nt + {{С}_{{130\_2}}}\sin nt){{{{E}_{2}}} \mathord{\left/ {\vphantom {{{{E}_{2}}} {{{С}_{1}}}}} \right. \kern-0em} {{{С}_{1}}}} = 1. \\ \end{gathered} $Инвариант (3.9) и решения двух задач Коши показаны на рис. 3.
Рис. 3.
Решения задач Коши и x-инвариант для реакции (2.1) при k1 = 1, k2 = 2, k3 = 3, k4 = 4, k–1 = 0.5, k–2 = 0.3, k–3 = 0.3, k–4 = 1, x01 = 0.1403, y01 = 0.2015, q01 = 0, z01 = 1 – x0 – y0 – q0, x02 = 0, y02 = 0, q02 = 0, z02 = 1: 1 – x1(t), 2 – x2(t), 3 – Kх(t).
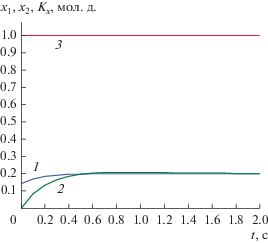
Решения (3.4) для других реагентов запишутся аналогично и дают точные y-, q- и z-инварианты для соответствующих реагентов.
Пример 4. Рассмотрим одну из возможностей применения инвариантов для решения обратных задач. Сравним две альтернативные линейные схемы (1.1) и (1.16) для реакции А = С. Пусть в результате экспериментов с двумя различными н. у. получены два набора данных A1эксп(t) и A2эксп(t). Рассчитаем для них инвариантные выражения K1(t) и K2(t) по соответствующим этим схемам формулам (1.13) и (1.20) (табл. 1). Анализ показал, что эти экспериментальные данные, с учетом погрешностей эксперимента, одинаково хорошо согласуются с обеими возможными схемами реакции – последовательной и параллельной. Однако среднее расчетное значение инвариантов Kсред ближе к теоретическим значениям Kтеор у последовательной схемы, что позволяет считать ее более вероятной.
Таблица 1.
Концентрации реагента А в реакции A = С по данным двух экспериментов с н. у.*
| t, с | А1эксп | А2эксп | K1 | K2 |
|---|---|---|---|---|
| мол. д. | ||||
| 0 | 0 | 0.67 | 1.0100 | 1.0050 |
| 1 | 0.10 | 0.55 | 1.1285 | 0.9750 |
| 2 | 0.15 | 0.50 | 1.1418 | 0.9750 |
| 3 | 0.20 | 0.37 | 0.8780 | 0.8550 |
| 4 | 0.25 | 0.35 | 0.9171 | 0.9000 |
| 5 | 0.30 | 0.33 | 0.9395 | 0.9450 |
| 6 | 0.33 | 0.33 | 0.9850 | 0.9900 |
| 7 | 0.33 | 0.33 | 0.9850 | 0.9900 |
| Kсред | 0.9981 | 0.9543 | ||
| Kтеор | 1 | 1 | ||
ЗАКЛЮЧЕНИЕ
Предложенный в работе метод определения автономных кинетических инвариантов многостадийных линейных химических реакций позволяет находить точные аналитические выражения, которые связывают неравновесные значения концентраций реагентов, измеренные в двух экспериментах с разными начальными условиями (не обязательно “термодинамическими”), но остаются строго постоянными в течение всего переходного процесса в безградиентном изотермическом реакторе. Этот метод представляет собой альтернативный подход к поиску и обнаружению аналитических выражений для неравновесных временных инвариантов химических реакций, впервые предложенный американо-брюссельской школой кинетиков [6–16]. В этих работах каждый механизм реакции характеризуется одним инвариантом в виде отношений концентраций всех реагентов, найденных в двух экспериментах с взаимно-обратными (“термодинамическими”) начальными условиями.
Отличия нашего метода состоят в следующем:
– каждый механизм реакции характеризуется множеством инвариантов (их число равно числу реагентов, причем для каждой пары начальных условий);
– инварианты представляются в виде суммы концентраций только одного (любого) из реагентов, измеренных в двух экспериментах с любыми неравновесными (не обязательно “термодинамическими”) начальными условиями;
– инварианты применимы как в закрытых, так и в открытых системах.
Такие инварианты могут быть использованы как новые средства идентификации механизмов химических реакций, проводимых с использованием релаксационных экспериментов. Метод может быть применен и к нелинейным реакциям в квазистационарных условиях, а также к некоторым нелинейным реакциям с тремя и более реагентами, допускающим точные аналитические решения.
Список литературы
Горбань А.Н., Быков В.И., Яблонский Г.С. Очерки о химической релаксации. Новосибирск: Наука, 1986. 320 с.
Кондепуди Д., Пригожин И. Современная термодинамика. От тепловых двигателей до диссипативных структур. М.: Мир, 2002. 461 с.
Кольцов Н.И., Федотов В.Х., Алексеев Б.В. // Кинетика и катализ. 1995. Т. 36. № 1. С. 51.
Кожевников И.В., Алексеев Б.В., Кольцов Н.И. // Кинетика и катализ. 1998. Т. 39. № 6. С. 919.
Алексеев Б.В., Кольцов Н.И. // Кинетика и катализ. 2002. Т. 43. № 1. С. 39.
Yablonsky G., Constales D., Marin G.B. // Chem. Eng. Sci. 2011. V. 66. № 1. P. 111.
Yablonsky G.S., Gorban A.N., Constales D. // Europhys. Lett. 2011. V. 93. № 2. P. 20004.
Constales D., Yablonsky G.S., Marin G.B. // Chem. Eng. Sci. 2012. V. 73. P. 20.
Constales D., Yablonsky G.S., Marin G.B. // Comp. Math. Appl. 2013. V. 65. P. 1614.
Yablonsky G.S. // Theor. Found. Chem. Eng. 2014. V. 48. № 5. P. 608.
Yablonsky G., Constales D., Marin G.B. // Adv. Chem. Phys. 2014. V. 157. P. 69.
Branco-Pinto D., Yablonsky G., Marin G., Constales D. // Entropy. 2015. V. 17. P. 6783.
Branco P.D., Yablonsky G., Marin G.B., Constales D. // Chem. Eng. Sci. 2017. V. 158. P. 370.
Peng B., Yablonsky G.S., Constales D., Marin G.B. // Chem. Eng. Sci. 2018. V. 191. P. 262.
Branco P.D., Yablonsky G., Marin G.B., Constales D. // Chem. Eng. Sci. 2018. V. 184. P. 25.
Yablonsky G.S., Branco P.D., Marin G.B., Constales D. // Chem. Eng. Sci. 2019. V. 196. P. 384.
Федотов В.Х., Кольцов Н.И. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. № 5. С. 72.
Федотов В.Х., Кольцов Н.И., Косьянов П.М. // Вестн. технол. ун-та. 2018. Т. 21. № 12. С. 181.
Федотов В.Х., Кольцов Н.И. // Вестн. технол. ун-та. 2019. Т. 22. № 1. С. 122.
Федотов В.Х., Кольцов Н.И. // Хим. физика. 2019. Т. 38. № 4. С. 23.
Зельдович Я.Б. // Журн. физ. химии. 1938. Т. 11. № 5. С. 685.
Корн Г., Корн Т. Справочник по математике. М.: Наука, 1978. 831 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


