Кинетика и катализ, 2019, T. 60, № 6, стр. 798-805
Исследование методом РФЭС взаимодействия Rh-фольги с NO2
М. Ю. Смирнов a, *, А. В. Калинкин a, В. И. Бухтияров a, b
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГАОУ ВО Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: smirnov@catalysis.ru
Поступила в редакцию 14.02.2019
После доработки 28.02.2019
Принята к публикации 05.03.2019
Аннотация
Методом рентгеновской фотоэлектронной спектроскопии (РФЭС) исследовано взаимодействие родиевой фольги с диоксидом азота в интервале температур 30–450°С при трех значениях давления NO2 – 10–6, 10–5 и 10–4 мбар. Начиная с температуры 150°С при всех трех давлениях на поверхности фольги образуется трехмерная пленка поверхностного оксида со стехиометрией Rh2O3. При давлении NO2, равном 10–6 мбар, с повышением температуры взаимодействия толщина пленки d сначала увеличивается, достигая максимума ~2.0 нм при 350°С, а затем уменьшается вследствие разложения Rh2O3 до металла. При давлении 10–5 и 10–4 мбар в интервале температур 150–450°С наблюдается монотонный рост d вплоть до 3.0 и 4.7 нм соответственно. В случае, когда взаимодействие происходит с участием молекулярного кислорода при давлении 10–4 мбар и температурах 30–450°С, поверхность Rh-фольги не окисляется. Проведено сравнение результатов исследования взаимодействия NO2 с Rh с данными, полученными ранее в сопоставимых условиях для Pd и Pt.
ВВЕДЕНИЕ
Родий является одним из важнейших компонентов различных каталитических систем, разработанных для нейтрализации выхлопных автомобильных газов, таких как трехмаршрутные катализаторы [1–3], ловушки для поглощения–восстановления оксидов азота [4]. Роль родия в каталитических нейтрализаторах определяется его способностью к низкотемпературной диссоциации молекул NO и NO2 [5–8], позволяющей восстанавливать содержащиеся в выхлопных газах оксиды азота до N2 с высокой селективностью [9, 10]. Родий входит в состав катализаторов, предназначенных и для других важных процессов: окисления аммиака в NO при получении азотной кислоты [11], разложения N2O [12], селективного окисления метана в синтез-газ [13–16], метанирования CO2 [17], гидрогенолиза алканов [18, 19].
Активность родиевых катализаторов зависит от состояния окисления поверхности. Известно, что молекулы NO диссоциируют на чистой поверхности металлического родия, но процесс ингибируется в присутствии атомов адсорбированного кислорода [20]. Напротив, реакция разложения N2O легче идет на окисленной поверхности родия [21, 22]. До сих пор дискуссионным остается вопрос о том, какое состояние родия является активным в окислении CO – еще одной реакции, протекающей при нейтрализации выхлопных газов. Имеются работы, результаты которых свидетельствуют в пользу как металлического [23–25], так и окисленного [26–28] родия. В то же время было установлено, что объемный стехиометрический оксид Rh2O3 проявляет очень низкую активность в реакции окисления CO по сравнению с металлическим родием [23, 29, 30]. При исследовании нанесенных родиевых катализаторов с помощью in situ РФЭС с использованием синхротронного излучения было показано, что в реакции участвует поверхность родия в окисленном состоянии, которое возникает только в контакте с реакционной средой и не является стехиометрическим поверхностным или объемным оксидом Rh2O3 [31].
В большинстве работ, посвященных влиянию окислительной среды на поверхность родия, было исследовано взаимодействие с молекулярным кислородом [32–38]. Показано, что помимо адсорбированных атомов в зависимости от условий может происходить образование приповерхностного (или растворенного) кислорода, поверхностных оксидов со стехиометрией Rh2O3 и RhO2, а также объемного оксида Rh2O3. В настоящей работе с применением метода РФЭС исследовано взаимодействие Rh-фольги с диоксидом азота, который обладает более высокой окислительной способностью по сравнению с O2 и которому, в то же время, уделено гораздо меньше внимания. Ранее вышеуказанный метод был применен нами для изучения окисления в NO2 поверхности массивных Pt [39], Pd [40] и Ag [41], а также нанесенных наночастиц Pt [42–45], Au [46] и Ag [41].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РФЭ-спектры получали в спектрометре “SPECS”, Германия, снабженном анализатором PHOBOS-150 с 9-канальным детектором, при использовании монохроматизированного излучения AlKα (hν = 1486.7 эВ). Угол регистрации фотоэлектронов относительно нормали к поверхности составлял 0°. Перед проведением исследований спектрометр был откалиброван по линиям Au4f7/2 и Cu2p3/2 металлических золота и меди, энергии связи которых равны 84.0 и 932.7 эВ соответственно. В качестве образца металлического родия была использована фольга чистотой 99.95% и размером 10 × 10 мм, закрепленная на держателе при помощи точечной сварки. Поверхность фольги очищали в камере подготовки образцов РФЭ-спектрометра посредством многократного выполнения следующей последовательности операций вплоть до исчезновения линий примесных элементов: 1) травление ионами Ar+; 2) прогрев в вакууме до Т = 600°С; 3) прогрев в NO2 при 300°С; 4) прогрев в вакууме до Т = 600°С. Нагрев образца до максимальной температуры 600°C осуществлялся косвенным способом от раскаленной вольфрамовой спирали. Температуру фольги измеряли при помощи хромель-алюмелевой термопары, приваренной точечной сваркой к держателю образца. После очистки фольги в РФЭ-спектре регистрировались только фотоэлектронные и Оже-линии родия. В согласии с литературными данными для массивного металлического родия [21, 28, 33, 36, 47] энергии связи линий Rh3d5/2 и Rh3p3/2 составили 307.1 и 496.3 эВ. Для обработки фольги диоксидом азота применяли источник, принцип работы которого основан на термическом разложении нитрата свинца [42]. Условия были аналогичны тем, при которых мы проводили исследования с другими металлическими фольгами [39–41]. Реакцию с NO2 осуществляли в камере подготовки в течение 30 мин при давлении 10–6, 10–5 или 10–4 мбар и постоянной температуре фольги, значение которой выбирали в интервале 30–450°С. После окончания реакции нагрев фольги и источника NO2 выключали одновременно. Обработку в кислороде выполняли в течение 30 мин в камере подготовки при давлении O2 10–4 мбар и постоянной температуре в диапазоне от 30 до 450°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
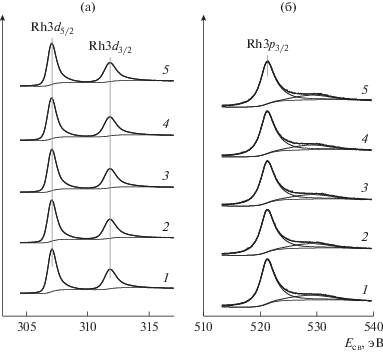
На рис. 1 и 2 приведены серии РФЭ-спектров регионов Rh3d (рис. 1), Rh3p1/2 (рис. 2) и O1s (рис. 2) для родиевой фольги в исходном состоянии и после ее обработки в NO2 при давлениях 10–6 мбар (рис. 1а, 2а), 10–5 мбар (рис. 1б, 2б), 10–4 мбар (рис. 1в, 2в) и температурах 30, 150, 250, 350 и 450°С. Спектры, характеризующие исходное состояние фольги после очистки ее поверхности, содержат дублетные линии Rh3d5/2–Rh3d3/2 и Rh3p3/2–Rh3p1/2 (линия Rh3p3/2 на рис. 2 не показана) с энергиями связи Eсв(Rh3d5/2) = 307.1, Eсв(Rh3d3/2) = 311.8, Eсв(Rh3p3/2) = 496.3 и Eсв(Rh3p1/2) = 521.2 эВ, что находится в хорошем согласии с табличными значениями для массивного металла [47]. Компоненты дублетных линий имеют характерную для металлического родия асимметричную форму с “хвостом”, вытянутым в направлении бóльших энергий связи. У линии Rh3p1/2 (равно как и у не приведенной на рис. 2 линии Rh3p3/2) имеется плечо, энергия связи которого на ~7 эВ выше, чем у основного пика. Аналогичные плечи, наблюдаемые в спектре палладиевой фольги на расстоянии ~6 эВ от линий Pd3p3/2 и Pd3p1/2 [40], относят к возбуждению поверхностного плазмона [48].
Рис. 1.
РФЭ-спектры в регионе Rh3d, записанные для родиевой фольги в исходном состоянии (1) и после взаимодействия с NO2 при давлении 10–6 (а), 10–5 (б) и 10–4 мбар (в) и температуре 30 (2), 150 (3), 250 (4), 350 (5) и 450°С (6). Время взаимодействия при каждом значении температуры 30 мин.
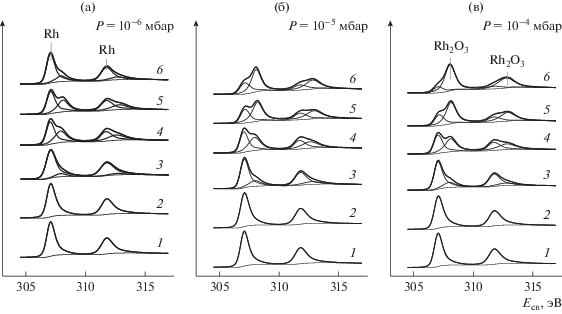
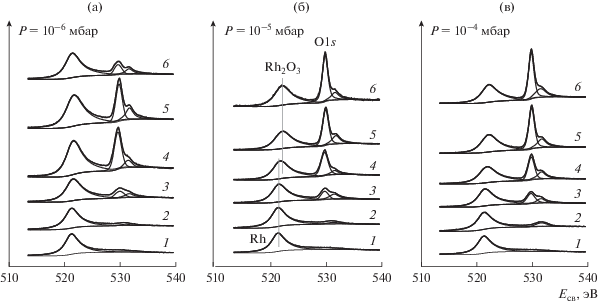
Рис. 2.
РФЭ-спектры в регионе Rh3p1/2 + O1s, записанные для родиевой фольги в исходном состоянии (1) и после взаимодействия с NO2 при давлении 10–6 (а), 10–5 (б) и 10–4 мбар (в) и температурах 30 (2), 150 (3), 250 (4), 350 (5) и 450°С (6). Время взаимодействия при каждом значении температуры 30 мин.
Вне зависимости от давления NO2 после проведения реакции с диоксидом азота при комнатной температуре спектры в регионах Rh3d и Rh3p практически не меняются. Начиная с температуры 150°С для всех значений давления NO2, форма линии Rh3d претерпевает существенные изменения, особенно заметные при P(NO2) равном 10–5 и 10–4 мбар. У каждой из компонент дублетной линии, отвечающей металлическому родию, появляется плечо со стороны большей энергии связи. При дальнейшем повышении температуры плечо трансформируется в отдельный пик. Спектры в регионе Rh3d были разложены на два дублета с помощью программы XPSPeak [49] в предположении о том, что параметры асимметрии, полученные при анализе спектра исходной фольги, сохраняют свои значения для дублета, относящегося к родию в металлическом состоянии, который присутствует в спектрах после реакции с NO2. При проведении разложения в таких условиях энергия связи для металлической составляющей линии Rh3d5/2 сохраняет свое исходное значение 307.1 эВ, а для линии, появляющейся в спектре после взаимодействия родиевой фольги с NO2, варьирует в пределах от 307.9 до 308.2 эВ. Эта величина соответствует Eсв(Rh3d5/2) в оксиде родия Rh2O3 [21, 28, 33, 34, 36, 37, 50]. Анализ спектров, представленных на рис. 1, показывает, что с повышением температуры взаимодействия соотношение оксидной и металлической составляющих возрастает в пользу оксида. Однако в том случае, когда давление NO2 равно 10–6 мбар, относительное содержание поверхностного оксида при достижении температуры 450°C уменьшается, а металла – увеличивается (рис. 1а), указывая на разложение оксида в этих условиях. При более высоких давлениях, 10–5 мбар (рис. 1б) и 10–4 мбар (рис. 1в), доля поверхностного оксида монотонно растет во всем интервале температур.
Взаимодействие родиевой фольги с NO2 также вызывает изменения в спектральном регионе Rh3p + O1s, показанном на рис. 2. В отличие от региона Rh3d, в котором образование поверхностного оксида Rh2O3 приводит к расщеплению исходной линии на два дублета, один из которых принадлежит оксиду, в указанном регионе обнаруживается только один дублет Rh3p, который с увеличением вклада поверхностного оксида смещается в сторону бóльших энергий связи (рис. 2, 3а). Попытка разложить спектр Rh3p на два дублета, которые можно было бы отнести металлическому и оксидному состояниям родия, успехом не увенчалась. Ранее аналогичное поведение линии Rh3p было описано авторами работы [51]: при окислении монокристалла сплава Pt10Rh90(111) смесью 5% O2 в N2 при давлении 1 атм и температуре 500–600°С наблюдался сдвиг линии Rh3p1/2 на 0.7 эВ в сторону высоких энергий связи, тогда как спектр Rh3d в этих условиях был представлен двумя дублетами. Возможно, такая особенность в поведении линии Rh3p обусловлена существенно бóльшим значением FWHM (2.9 эВ для исходной металлической фольги) по сравнению с FWHM линии Rh3d (0.75 эВ), при том что разность между энергиями связи Eсв(Rh3p3/2) оксидного и металлического состояний невелика.
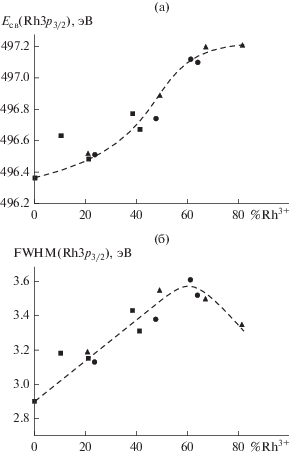
Рис. 3.
Энергия связи (а) и полная ширина на половине высоты (FWHM) (б) линии Rh3p3/2, определенные в процессе взаимодействия Rh-фольги с NO2 при давлении 10–6 (1), 10–5 (2) и 10–4 мбар (3) и разных температурах.
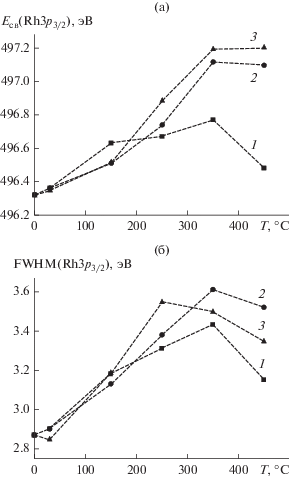
Когда взаимодействие протекает при давлении NO2, равном 10–5 и 10–4 мбар, величина смещения по отношению к исходной металлической фольге при T ≥ 350°C составляет 0.8–0.9 эВ. При давлении 10–6 мбар смещение меньше и достигает в максимуме ~0.4–0.5 эВ, а с повышением температуры до 450°С значение энергии связи Eсв(Rh3p3/2) снижается, по-видимому, вследствие разложения поверхностного оксида. В том случае, когда металлическое и оксидное состояния сосуществуют, наблюдается уширение линии Rh3p: FWHM составляет ~2.9 эВ для исходной фольги и 3.4–3.6 эВ после ее окисления в NO2 при 250–350°С (рис. 3б). После проведения реакции при максимальной температуре 450°С (а при давлении 10–4 мбар – также и при 350°С) отмечается небольшое уменьшение ширины линии Rh3p, которое можно объяснить повышением однородности состава поверхности фольги. При давлении 10–6 мбар это связано с преимущественным вкладом родия в металлическом состоянии, тогда как при 10–5 и 10–4 мбар основным компонентом в составе поверхности становится его оксид.
В спектральной области, представленной на рис. 2, помимо линии Rh3p1/2 регистрируются линии кислорода O1s, которые отсутствуют в спектре исходной фольги, но возникают после ее обработки в NO2. Первоначально после взаимодействия при 30°С наблюдается появление линии O1s с энергией связи ~531–531.5 эВ, не сопровождаемое изменениями в спектре Rh3d. Интенсивность линии тем больше, чем выше давление NO2. С ростом температуры ее интенсивность умеренно увеличивается, и вместе с этим появляется и растет интенсивная линия с энергией связи 529.6–529.9 эВ, которая, начиная с T ≈ 150°C, становится преобладающей. Эта линия, в согласии с литературными данными, принадлежит поверхностному оксиду родия [21, 28, 33, 36, 50–52]. Из интенсивностей линий O1s (529.6–529.9 эВ) и Rh3d5/2 (307.9–308.2 эВ), отвечающих поверхностному оксиду, с учетом факторов атомной чувствительности (ASF), взятых из [53], было рассчитано атомное отношение [O]ox/[Rh], величина которого в серии выполненных экспериментов варьировала в пределах от 1.5 до 1.7 при среднем значении 1.6, близком к стехиометрии Rh2O3. Другая линия O1s с энергией связи ∼531–531.5 эВ может принадлежать поверхностным гидроксильным группам, которые, вероятно, образуются в результате взаимодействия оксида с молекулами воды, присутствующими в остаточном газе вакуумной камеры. В частности, в работах [28, 33, 36] линию с такой энергией связи относят гидроксооксиду родия RhOOH.
После взаимодействия родиевой фольги с NO2 линий N1s в спектре не наблюдали. Известно, что молекулы NO2, вступающие в реакцию с родием, легко диссоциируют до атомов кислорода и молекул NO; последние в свою очередь также легко разлагаются до атомов N и O [5, 8, 54, 55]. Атомы азота вступают попарно в реакцию рекомбинации и покидают поверхность в виде молекул N2, а атомы кислорода связываются родием с образованием поверхностного оксида.
На рис. 4 показано, как изменяются доля родия в оксидном состоянии Rh3+ (рис. 4а) и атомное отношение кислорода (Eсв ≈ 529.6–529.9 эВ) к родию (рис. 4б) по мере повышения температуры взаимодействия. Зависимости на рис. 4 построены для трех значений давления NO2. Представленные на рис. 4а и 4б графики имеют схожую форму с прохождением через максимум при 250°С в случае давления 10–6 мбар и монотонным ростом при значениях давления 10–5 и 10–4 мбар. На рис. 5 приведены зависимости Eсв (рис. 5а) и FWHM (рис. 5б) линии Rh3p3/2 от доли оксида родия в составе поверхности, рассчитанной из интенсивностей соответствующих линий в спектре Rh3d. На графиках приведены экспериментальные точки, полученные для всех значений температур и давлений. Видно, что величина энергии связи монотонно возрастает с увеличением вклада оксидного состояния (рис. 5а). В то же время, в соответствии с приведенными выше рассуждениями, ширина линии Rh3p3/2 сначала растет по мере повышения доли оксида от 0 до ∼60%, но в дальнейшем уменьшается, когда содержание оксида становится >60% (рис. 5б).
Рис. 4.
Изменение доли родия в оксидном состоянии Rh3+ в составе поверхности (а) и атомного отношения [O]ox/[Rh], определенного из интенсивности линии O1s 529.6–529.9 эВ и интегральной интенсивности линии Rh3d, (б) в результате взаимодействия Rh-фольги с NO2 при давлении 10–6 (1), 10–5 (2) и 10–4 мбар (3) и разных температурах.
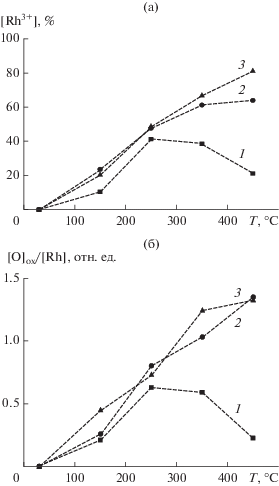
Рис. 5.
Энергия связи (а) и полная ширина на половине высоты (б) линии Rh3p3/2 в зависимости от доли родия в оксидном состоянии Rh3+ в составе поверхности.
В предположении, что в результате реакции с NO2 на поверхности фольги образуется сплошная пленка оксида родия, по ослаблению сигнала Rh3d металлического состояния была рассчитана толщина пленки d. Для оценки, необходимой для расчетов длины свободного пробега фотоэлектронов λ, испускаемых с уровня Rh3d5/2, в слое поверхностного оксида, была построена корреляционная зависимость, аналогичная приведенным в работе [56], с использованием базы данных [57]. Найденная таким образом величина λ составила ~1.91 нм. На рис. 6 представлены зависимости d от температуры взаимодействия для трех значений давления NO2. Значение d достигает ~5 нм, что указывает на формирование трехмерной оксидной пленки. На этом же рисунке показаны зависимости для пленок оксида палладия PdO, полученные при взаимодействии палладиевой фольги с NO2 в аналогичных условиях [40]. Так же как и для палладия, реакция окисления родия является активированным процессом, вследствие чего наблюдается рост d с температурой за исключением того случая, когда при P(NO2) = 10–6 мбар и T = 450°C величина d уменьшается из-за разложения Rh2O3. Как и при взаимодействии NO2 с Pd для заданного значения температуры в интервале 30–250°С давление слабо влияет на толщину пленки оксида родия, формирующейся в течение 30 мин, которых, вероятно, достаточно для достижения максимально возможного покрытия поверхности металла оксидом при данных условиях. По-видимому, скорость реакций окисления родия и палладия определяется не столько диссоциацией NO2, сколько внедрением образующихся при диссоциации атомов кислорода в объем металла с перестройкой его решетки в решетку оксида.
Рис. 6.
Изменение толщины оксидных пленок d на поверхности фольг Rh (1), Pd (2) и Pt (3), формирующихся в результате их взаимодействия с NO2 при давлении 10–6 (а), 10–5 (б) и 10–4 мбар (в), в зависимости от температуры.
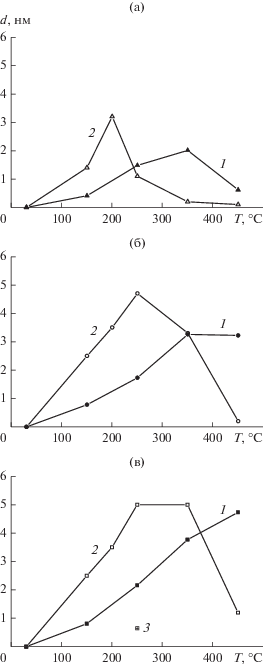
На рис. 6 видны также определенные отличия в поведении родия и палладия при их взаимодействии с NO2. При заданном давлении P(NO2) оксидная пленка на палладии начинает формироваться при более низких температурах. Кроме того, у палладия зависимости проходят через максимум при всех значениях давления, в то время как у родия максимум наблюдается только при 10–6 мбар, а при давлениях 10–5 и 10–4 мбар с повышением температуры d монотонно растет. Таким образом, родий окисляется труднее, чем палладий, но сформированная при этом пленка Rh2O3 оказывается более термостойкой, чем пленка PdO. Это согласуется с приведенными в справочнике [58] температурами разложения оксидов Rh2O3 (~1100°С) и PdO (~879°С).
На рис. 6в показано также значение d для оксидной пленки на поверхности платиновой фольги, образовавшейся в результате взаимодействия с NO2 при давлении 10–4 мбар и температуре 250°С и оцененной по данным работы [39]. Согласно [39], пленка представлена двумя оксидами – PtO и Pt3O4. Величина d ≈ 0.65 нм была получена в предположении о том, что пленка имеет состав PtO, значение λ = 1.79 нм для которого взято из работы [56]. Видно, что окисление платины протекает еще труднее, чем родия и тем более палладия. Это согласуется с результатами ранее проведенного нами исследования по взаимодействию наночастиц платиновых металлов, нанесенных на Al2O3 и SiO2, со смесью 13 мбар NO + 13 мбар O2 [59]. Было показано, что частицы Pd и Rh полностью окисляются уже при комнатной температуре, тогда как в случае платины в этих условиях происходит только растворение атомов кислорода в объеме частиц.
Как было сказано выше во введении, окисление поверхности родия, как массивного [28, 33, 35, 36, 51], так и в виде наночастиц, закрепленных на носителе [34, 37, 38, 60], происходит также в результате взаимодействия с молекулярным кислородом при повышенных давлениях. С целью сопоставления окислительной способности NO2 и O2 было изучено взаимодействие Rh-фольги с кислородом при давлении 10–4 мбар в температурном интервале 30–450°С. Спектры, полученные в регионах Rh3d и Rh3p1/2 + O1s, приведены на рис. 7а и 7б соответственно. Видно, что линии родия Rh3d и Rh3p после обработки в кислороде остаются неизменными, свидетельствуя, что в этих условиях оксидная пленка не образуется. Следовательно, окислительная способность NO2 по отношению к родию (а также к палладию и платине) существенно выше, чем у молекулярного кислорода, что, вероятно, определяется меньшей энергией диссоциации связи N–O в молекуле NO2 (305 кДж/моль) по сравнению с энергией диссоциации связи O–O в молекуле O2 (498 кДж/моль) [58].
ЗАКЛЮЧЕНИЕ
С помощью метода рентгеновской фотоэлектронной спектроскопии установлено, что при нагреве родиевой фольги в диоксиде азота при температуре ≥150°С в интервале давлений 10–6–10–4 мбар на поверхности фольги формируется трехмерная пленка оксида со стехиометрией, близкой к Rh2O3. В случае, когда взаимодействие происходит при давлении 10–6 мбар, с ростом температуры до ~350°С толщина пленки d сначала увеличивается до 2 нм, а при дальнейшем подъеме температуры уменьшается вследствие разложения Rh2O3. При давлении 10–5 и 10–4 мбар с повышением температуры вплоть до 450°С величина d монотонно возрастает до d ≈ 3–5 нм. При любом значении температуры в интервале 30–450°С толщина оксидной пленки тем больше, чем выше давление NO2. Взаимодействие в аналогичных условиях Rh-фольги с молекулярным кислородом не приводит к образованию поверхностного оксида родия.
Список литературы
Gandhi H.S., Graham G.W., McCabe R.W. // J. Catal. 2003. V. 216. P. 433.
Kaspar J., Fornasiero P., Hickey N. // Catal. Today. 2003. V. 77. P. 419.
Cooper J., Beecham J. // Platinum Met. Rev. 2013. V. 57. P. 281.
Amberntsson A., Fridell E., Skoglundh M. // Appl. Catal. B: Env. 2003. V. 46. P. 429.
Papapolymerou G.A., Schmidt L.D. // Langmuir. 1985. V. 1. P. 488.
Krause K.R., Schmidt L.D. // Catal. Lett. 1992. V. 14. P. 141.
Kaspar J., de Leitenburg C., Fornasiero P., Trovarelli A., Graziani M. // J. Catal. 1994. V. 146. P. 136.
Jirsak T., Dvorak J., Rodriguez J.A. // Surf. Sci. 1999. V. 436. P. L683.
Egelhoff W.F. / The Chemical Physics of Solid Surfaces and Heterogeneous Catalysis, Eds. King D.A., Woodruff D.P. New York: Elsevier, 1982.
Shelef M., Graham G.W. // Catal. Rev. Sci. Eng. 1994. V. 36. P. 433.
Сеттерфилд Ч. Практический курс гетерогенного катализа. Москва: Мир, 1984. С. 271.
Parres-Esclapez S., Illan-Gomez M.J., Salinas-Martinez de Lecea C., Bueno-Lopez A. // Int. J. Greenhouse Gas Control. 2012. V. 11. P. 251.
Hofstad K.H., Hoebink J.H.B.J., Holmen A., Marin G.B. // Catal. Today. 1998. V. 40. P. 157.
Mallens E.P.J., Hoebink J.H.B.J., Marin G.B. // J. Catal. 1997. V. 167. P. 43.
Buyevskaya O.V., Walter K., Wolf D., Baerns M. // Catal. Lett. 1996. V. 38. P. 81.
Eriksson S., Rojas S., Boutonnet M., Fierro J.L.G. // Appl. Catal. A: Gen. 2007. V. 326. P. 8.
Frontera P., Macario A., Ferraro M., Antonucci P. // Catalysts. 2017. V. 7. P. 59.
Lee C., Schmidt L.D. // J. Catal. 1986. V. 101. P. 123.
Gao S., Schmidt L.D. // J. Catal. 1988. V. 111. P. 210.
Root T.W., Schmidt L.D., Fisher G.B. // Surf. Sci. 1983. V. 134. P. 30.
Kondratenko E.V., Kraehnert R., Radnik J., Baerns M., Perez-Ramirez J. // Appl. Catal. A: Gen. 2006. V. 298. P. 73.
Bueno-López A., Such-Basáñez I., Salinas-Martínez de Lecea C. // J. Catal. 2006. V. 244. P. 102.
Gao F., Cai Y., Gath K.K., Wang Y., Chen M.S., Guo Q.L., Goodman D.W. // J. Phys. Chem. C. 2009. V. 113. P. 182.
Oh S.H., Carpenter J.E. // J. Catal. 1983. V. 80. P. 472.
Peden C.H.F., Goodman D.W., Blair D.S., Berlowitz P.J., Fisher G.B., Oh S.H. // J. Phys. Chem. 1988. V. 92. P. 1563.
Westerström R., Wang J.G., Ackermann M.D., Gustafson J., Resta A., Mikkelsen A., Andersen J.N., Lundgren E., Balmes O., Torrelles X., Frenken J.W.M., Hammer B. // J. Phys. Condens. Matter. 2008. V. 20. P. 184018.
Gustafson J., Westerström R., Resta A., Mikkelsen A., Andersen J.N., Balmes O., Torrelles X., Schmid M., Varga P., Hammer B., Kresse G., Baddeley C.J., Lundgren E. // Catal. Today. 2009. V. 145. P. 227.
Kibis L.S., Stadnichenko A.I., Koscheev S.V., Zaikovskii V.I., Boronin A.I. // J. Phys. Chem. C. 2016. V. 120. P. 19142.
Gustafson J., Westerstrom R., Mikkelsen A., Torrelles X., Balmes O., Bovet N., Andersen J.N., Baddeley C.J., Lundgren E. // Phys. Rev. B. 2008. V. 78. P. 045423.
Flege J.I., Sutter P. // Phys. Rev. B. 2008. V. 78. P. 153402.
Grass M.E., Zhang Y., Butcher D.R., Park J.Y., Li Y., Bluhm H., Bratlie K.M., Zhang T., Somorjai G.A. // Angew. Chem. Int. Ed. 2008. V. 47. P. 8893.
Peterlinz K.A., Sibener S.J. // J. Phys. Chem. 1995. V. 99. P. 2817.
Peuckert M. // Surf. Sci. 1984. V. 141. P. 500.
Burkhardt J., Schmidt L.D. // J. Catal. 1989. V. 116. P. 240.
Salanov A.N., Savchenko V.I. // React. Kinet. Catal. Lett. 1993. V. 49. P. 29.
Tolia A.A., Smiley R.J., Delgass W.N., Takoudis C.G., Weaver M.J. // J. Catal. 1994. V. 150. P. 56.
Weng-Sieh Z., Gronsky R., Bell A.T. // J. Catal. 1997. V. 170. P. 62.
Suhonen S., Valden M., Hietikko M., Laitinen R., Savimäki A., Härkönen M. // Appl. Catal. A: Gen. 2001. V. 218. P. 151.
Калинкин А.В., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2016. Т. 57. С. 833.
Смирнов М.Ю., Клембовский И.О., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 750.
Калинкин А.В., Смирнов М.Ю., Клембовский И.O., Сорокин А.М., Гладкий А.Ю., Бухтияров В.И. // ЖСХ. 2018. Т. 59. С. 1785.
Калинкин А.В., Сорокин А.М., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2014. Т. 55. С. 371.
Vovk E.I., Kalinkin A.V., Smirnov M.Yu., Klembovskii I.O., Bukhtiyarov V.I. // J. Phys. Chem. C. 2017. V. 121. P. 17297.
Smirnov M.Yu., Kalinkin A.V., Vovk E.I., Simonov P.A., Gerasimov E.Yu., Sorokin A.M., Bukhtiyarov V.I. // Appl. Surf. Sci. 2018. V. 428. P. 972.
Смирнов М.Ю., Вовк Е.И., Нартова А.В., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 631.
Калинкин А.В., Смирнов М.Ю., Бухтияров А.В., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. С. 785.
Нефедов В.И. Рентгеноэлектронная спектроскопия химических соединений. Справ. Москва: Химия, 1984. С. 132.
Zemlyanov D., Azalos-Kiss B., Kleimenov E., Teschner D., Zafeiratos S., Havecker M., Knop-Gericke A., Schlogl R., Gabasch H., Unterberger W., Hayek K., Klotzer B. // Surf. Sci. 2006. V. 600. P. 983.
http://xpspeak.software.informer.com/4.1/.
Marot L., Mathys D., De Temmerman G., Oelhafen P. // Surf. Sci. 2008. V. 602. P. 3375.
Beck D.D., DiMaggio C.L., Fisher G.B. // Surf. Sci. 1993. V. 297. P. 303.
Blomberg S., Lundgren E., Westerström R., Erdogan E., Martin N.M., Mikkelsen A., Andersen J.N., Mittendorfer F., Gustafson J. // Surf. Sci. 2012. V. 606. P. 1416.
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. Handbook of X-ray Photoelectron Spectroscopy. Eden Prairie: Perkin-Elmer Co., 1992.
Gibson K.D., Colonell J.I., Sibener S.J. // Surf. Sci. 1999. V. 443. P. 125.
Koda Y., Sumida H., Ogawa S., Tsukada C. // J. Surf. Sci. Nanotech. 2018. V. 16. P. 36.
Смирнов М.Ю., Вовк Е.И., Калинкин А.В., Симонов П.А., Герасимов Е.Ю., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 642.
Shinotsuka H., Tanuma S., Powell C.J., Penn D.R. // Surf. Interf. Anal. 2015. V. 47. P. 871.
Speight J.G. Lange’s Handbook of Chemistry. 16th Ed. New York: McGrows Hill, 2005.
Смирнов М.Ю., Вовк Е.И., Калинкин А.В., Пашис А.В., Бухтияров В.И. // Кинетика и катализ. 2012. Т. 53. С. 120.
Suhonen S., Hietikko M., Polvinen R., Valden M., Laitinen R., Kallinen K., Harkonen M. // Surf. Interface Anal. 2002. V. 34. P. 76.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ