Кинетика и катализ, 2020, T. 61, № 1, стр. 119-125
Исследование эффектов кислотного модифицирования алюмооксидного носителя катализаторов риформинга
В. Ю. Трегубенко a, *, А. С. Белый a
a Центр новых химических технологий ИК СО РАН
644040 Омск, ул. Нефтезаводская, 54, Россия
* E-mail: kalinina_ihcp1@mail.ru
Поступила в редакцию 19.03.2019
После доработки 24.05.2019
Принята к публикации 26.07.2019
Аннотация
Изучены текстурные и кислотно-основные характеристики исходного и модифицированного уксусной кислотой разной концентрации (от 0.83 до 17.4 моль/л) оксида алюминия. Показано, что обработка уксусной кислотой не оказывает существенного влияния на текстурные характеристики и фазовый состав носителей. По данным ИК-спектроскопии адсорбированного СО наблюдается увеличение концентрации льюисовских кислотных центров средней силы, а также повышение общей кислотности модифицированных носителей в сопоставлении с исходным оксидом алюминия. Наибольшей активностью в риформинге н-гептана среди Pt‒Re-систем обладает катализатор на основе носителя, обработанного уксусной кислотой с концентрацией 1.67 моль/л, что обусловлено оптимальным составом кислотных центров носителя.
ВВЕДЕНИЕ
При синтезе алюмоплатиновых катализаторов риформинга для повышения конверсии и выхода целевых продуктов, высокооктановых углеводородов, используют модифицирование носителя.
К известным способам модифицирования оксида алюминия относят кислотную, термическую, гидротермальную обработки, в том числе за счет совершенствования параметров синтеза, а также введение в его состав различных добавок ‒ текстурных и химических промоторов. В зависимости от способа воздействия на оксид алюминия или от природы модифицирующего агента возможно формирование различных по свойствам катализаторов в результате изменения химического состава и природы адсорбционных центров носителя.
Адсорбционные центры γ-Al2O3 представлены гидроксильными группами и льюисовскими кислотными центрами (ЛКЦ).
Получить требуемый спектр кислотности можно путем нанесения на оксид алюминия различных кислотных модификаторов (обработка растворами солей металлов, органических и минеральных кислот, введение цеолитов). В настоящее время представляют интерес способы варьирования относительного содержания функциональных групп и ЛКЦ на оксидной поверхности и их силы без изменения химического состава носителя. К этим методам относится, например, обработка оксида алюминия органическими кислотами, удаляющимися с поверхности носителя на стадии прокаливания при температуре ниже 500°С. Такой подход использовался в [1‒3]. В работе [1] авторы наблюдали увеличение количества адсорбированного водорода модифицированным уксусной или муравьиной кислотами оксидом алюминия. Предполагается, что нанесение на поверхность γ-Al2O3 с помощью ионного обмена анионов органических кислот, легко удаляемых последующей окислительной обработкой, приводит к возрастанию концентрации дефектов поверхности, образующихся при прокаливании и представляющих собой в этом случае анионные вакансии на поверхности оксида алюминия и координационно ненасыщенные атомы алюминия. В [4] было показано, что закрепление металлов/оксидов металлов происходит на дефектных участках поверхности оксида алюминия, которые могут быть отнесены к кислотным центрам Льюиса. Это открывает возможность систематического варьирования числа координационно-ненасыщенных Al3+ центров и обеспечения хорошего контроля дисперсности, морфологии каталитически активной фазы, а, следовательно, и каталитической активности металлов, нанесенных на γ-Al2O3.
Автор работы [3] наблюдал изменение пористой структуры оксида алюминия при обработке растворами кислот, обусловленное концентрацией и природой кислоты, при варьировании которых можно формировать заданную текстуру катализатора. Было показано, что при обработке оксида алюминия разбавленными растворами уксусной кислоты происходит уменьшение объема пор в области диаметров 20–50 Å и увеличение порометрического объема в интервале 50–100 Å, что может быть связано с формированием небольшого количества оснóвных солей алюминия, заполняющих наиболее тонкие поры.
Полученные в работах [5–7] зависимости между активностью катализаторов риформинга и свойствами носителя предполагают необходимость формирования на его поверхности строго определенного спектра кислотности как по природе и концентрации, так и по распределению центров различной силы.
Таким образом, цель настоящей работы заключалась в изучении влияния кислотного модифицирования оксида алюминия на физико-химические и каталитические показатели системы Pt–Re/Al2O3 в реакциях риформинга н-гептана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве носителя использовали γ-Al2O3 сферической формы с диаметром гранул 1.8 мм, произведенный в ЗАО “Промышленные катализаторы” (Рязань). Содержание примесей в оксиде алюминия составляет 0.017 мас. % Na2O и 0.001 мас. % Fe2O3.
Обработка уксусной кислотой
Прокаленный при 600°С носитель – оксид алюминия – обрабатывали раствором уксусной кислоты различной концентрации (от 0.83 до 17.4 М), объем которого рассчитывали, исходя из влагоемкости носителя. Влагоемкость свежепрокаленного оксида алюминия составляла 0.9 мл/г. Модифицированный уксусной кислотой γ-Al2O3 выдерживали 1 ч при комнатной температуре, затем сушили при 110°С, далее прокаливали в токе осушенного воздуха при 550°С в течение 2 ч. Образцом сравнения служил исходный оксид алюминия. Образцы носителей обозначали как Al2O3-х, где х – молярная концентрация раствора уксусной кислоты.
Перед нанесением платины и рения оксид алюминия хлорировали, для чего к носителю приливали раствор 1 Н соляной кислоты из расчета 2.7 мас. % ионов Cl к весу носителя. На последнем этапе проводили совместную пропитку растворами Н2[PtCl6] и HReO4 из расчета 0.2 мас. % Pt и 0.2 мас. % Re к весу носителя. Катализаторы сушили при 120°С в течение 1 ч и прокаливали в токе осушенного воздуха при подъеме температуры до 500°С и выдержкой 1 ч. Катализаторы обозначали как Pt‒Re/Al2O3-х.
Катализатор восстанавливали в токе осушенного водорода при 500°С в течение 1 ч с одновременным сульфидированием.
Процесс термического разложения органических солей алюминия на поверхности носителей исследовали методом термогравиметрического анализа (ТГA). Эксперименты осуществляли на термоанализаторе STA-449С (”Netzsch”, Германия) в потоке газовой смеси 20 об. % О2 в Ar со скоростью повышения температуры 10°С/мин.
Рентгенофазовый анализ (РФА) исследуемых образцов проводили на дифрактометре ДРОН-3 (Россия, СuKα-излучение, λ = 0.154 нм). Фазы оксидов алюминия идентифицировали по базе данных PDF2. Была зарегистрирована фаза γ-Al2O3 (№ 10-425). Размер области когерентного рассеяния (ОКР) определяли по формуле Селякова‒Шеррера.
Текстурные характеристики предварительно прокаленных при 550°С образцов изучали на адсорбционном приборе Sorptomatic-1900 (“CarloErbo”, Италия) по изотермам адсорбции‒десорбции азота при ‒196°С. Перед измерениями образцы тренировали в вакууме при температуре 300°С в течение 6 ч. Расчеты удельной поверхности по БЭТ (SБЭТ) выполняли в интервале равновесных относительных значений паров азота Р/Р0 = 0.05–0.33 по изотерме адсорбции. Адсорбционный объем пор (Vадс) находили по величине адсорбции азота при Р/Р0 = 0.990. Расчет распределения объемов пор по размерам в исследуемых образцах проводили методом Доллимора‒Хилла [8] по десорбционным ветвям изотерм.
Кислотные свойства носителей иcследовали методом инфракрасной (ИК) спектроскопии адсорбированного СО. ИК-спектры были сняты на Фурье-спектрометре Shimadzu 8300 (“Shimadzu”, Япония) с разрешением 4 см–1 и числом накоплений спектра 50. Для регистрации спектров образцы размалывали и прессовали в таблетки без связующего, вакуумировали в ИК-кювете в течение 1 ч при 500°С и остаточном давлении 10–4 Торр. Адсорбцию СО проводили при температуре ‒196°С и давлении 10 Торр. Спектры регистрировали в диапазоне 1200‒4000 см–1. Минимальная надежно регистрируемая концентрация ЛКЦ составляла 0.2 мкмоль/г.
Дисперсность платины в восстановленных катализаторах определяли методом газового титрования. Измерения осуществляли в статической стеклянной циркуляционной установке с хроматографическим анализом О2 методом внутреннего стандарта, используя инертные добавки N2. На поверхности катализатора предварительно адсорбировали водород при 150°С с последующей откачкой газовой среды при комнатной температуре до давления 10–2 мм рт. ст. Затем в реактор подавали кислород и после 10 мин циркуляции с помощью хроматографического метода находили количество израсходованного кислорода (ОТ). Дисперсность (D), представляющую собой отношение числа поверхностных атомов (Ptпов) платины к общему их числу (Ptобщ), с учетом стехиометрических коэффициентов адсорбции кислорода и водорода рассчитывали по формуле:
Катализаторы были протестированы в модельной реакции дегидроциклизации н-гептана, используя проточный реактор, при температуре 460‒520°С, давлении 1.0 МПа, объемной скорости подачи сырья (ОСПС) 8.2‒14 ч–1 и мольном соотношении H2 : сырье = 5 : 1. Состав полученной смеси углеводородов анализировали в online режиме на газовом хроматографе Цвет 800 (Россия) с использованием пламенно-ионизационного детектора. По данным о составе сырья и продуктов рассчитывали основные показатели риформинга н-гептана: степень превращения н-гептана и выход ароматических углеводородов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно результатам ТГА (табл. 1) образцы носителей, обработанные уксусной кислотой, характеризуются большей потерей массы при прокаливании, чем исходный образец.
Таблица 1.
Данные ТГА для исходного и модифицированных уксусной кислотой в различной концентрации носителей
| Образец | Потеря массы, мас. % | ||
|---|---|---|---|
| 25‒200°С | 200‒550°С | общая | |
| Al2O3-0 | 5.9 | 2.6 | 8.5 |
| Al2O3-0.83 | 5.9 | 4.9 | 10.8 |
| Al2O3-1.67 | 4.9 | 6.8 | 11.67 |
| Al2O3-8.33 | 2.5 | 14.2 | 16.7 |
| Al2O3-13.3 | 3.1 | 17.1 | 20.2 |
| Al2O3-17.4 | 2.8 | 14.0 | 16.8 |
На рис. 1 представлены дифференциальные кривые потери массы (кривые ДТГ) образцов. Основные максимумы скорости потери массы носителей приходятся на 100, 230‒260 и 450°C. Первый обусловлен удалением физически адсорбированной воды, более высокотемпературные ‒ разложением ацетатов алюминия с выделением СО, СО2 и Н2О [8, 9].
Рис. 1.
Дифференциальные кривые потери массы образцов оксида алюминия: 1 – Al2O3-0, 2 – Al2O3-0.83, 3 – Al2O3-1.67, 4 – Al2O3-8.33, 5 – Al2O3-13.3, 6 – Al2O3-17.4.
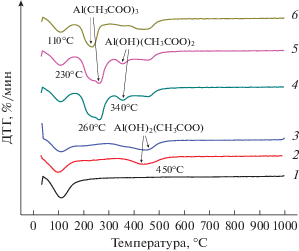
При взаимодействии оксида алюминия с уксусной кислотой образуются органические соли алюминия, которые в водной среде быстро гидролизуются. При этом возможно получение солей различного состава: Al(CH3COO)3, Al(ОН)(CH3COO)2, Al(ОН)2(CH3COO). Минимумы на кривых ДТГ (рис. 1) при температурах 230‒260, 340, 450°С соответствуют максимумам скорости потери массы образцов при разложении определенных солей. Так, чем больше в составе соли ОН-групп, тем при более высокой температуре происходит ее превращение.
Согласно литературным данным [10] основной ацетат алюминия состава Al(ОН)(CH3COO)2 разлагается в условиях дифференциально-термического анализа (ДТА) в атмосфере воздуха с удалением ОН–– и ацетатных групп в диапазоне 100‒200°С, термическое превращение оставшихся ацетатных групп наблюдается при 310°С, широкий экзотермический пик с максимумом при 420°С относится к сгоранию полученных газообразных продуктов.
Триацетат алюминия Al(CH3COO)3 разлагается с выделением уксусного ангидрида и образованием основных ацетатов алюминия, Al2О(CH3COO)4 или Al3О(CH3COO)7 ‒ при 120‒140°С, дальнейшее превращение в AlО(CH3COO) происходит при 200°С [10].
Таким образом, полученные в результате анализа ДТГ кривые (рис. 1) можно описать, опираясь на приведенные выше литературные данные. Для модифицированных образцов наблюдаемый максимум скорости потери массы при 230‒260°С, вероятно, соответствует разложению триацетата алюминия. Минимум на кривых ДТГ при 340°С, скорее всего, относится к реакциям окислительного распада основного ацетата алюминия Al(ОН)(CH3COO)2, тогда как при 450°С происходит термический распад Al(ОН)2(CH3COO). Твердым продуктом разложения всех солей является аморфный оксид алюминия [9, 10].
Влияние кислотной обработки на фазовый состав алюмооксидного носителя было изучено методом РФА.
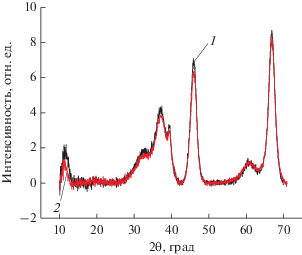
Полученные результаты свидетельствуют о высокой фазовой чистоте и оптимальных размерах первичных кристаллитов γ-Al2O3 (4.5‒4.7 нм). Для модифицированных образцов значение ОКР в основном уменьшается относительно немодифицированного носителя, что может говорить об аморфизации оксида алюминия вследствие воздействия уксусной кислоты и образования органических солей с последующим переосаждением аморфного Al2O3 в порах после прокаливания при 550°С. На дифрактограммах (рис. 2) для образца Al2O3-13.3 наблюдается некоторое снижение интенсивности пиков по сравнению с исходным Al2O3.
Для изучения текстуры образцов, подвергнутых сначала обработке уксусной кислотой, сушке при 110°С, а затем прокаливанию при 550°С, были получены изотермы низкотемпературной адсорбции‒десорбции азота. Характеристики пористой структуры исследуемых образцов оксида алюминия представлены в табл. 2. Все они обладают высокоразвитой пористой структурой. SБЭТ модифицированных образцов практически не изменяется относительно исходного Al2O3, однако несколько уменьшается объем и диаметр пор.
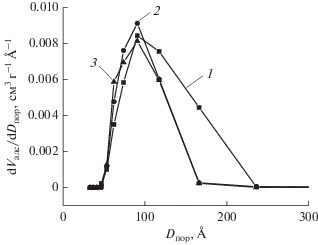
Прокаленный при 600°С исходный образец оксида алюминия имеет КРПР с максимумом распределения пор при 90 Å и наибольшей плотностью объема пор ~0.009 см3 г–1 Å–1 (рис. 3). На КРПР для модифицированных образцов Al2O3 практически отсутствуют поры с диаметром более 170 Å, что, скорее всего, обусловлено присутствием новой фазы оксида алюминия, образующейся при разложении органических солей алюминия и имеющей менее развитую собственную пористую структуру.
Рис. 3.
Кривые распределения пор по размерам для образцов оксида алюминия: 1 – Al2O3-0, 2 – Al2O3-1.67, 3 – Al2O3-17.4.
Поскольку самый вероятный механизм реакции дегидроциклизации н-алканов подразумевает участие как металлических, так и поверхностных кислотных центров оксида алюминия, была исследована льюисовская кислотность оксидов алюминия.
При кислотном модифицировании оксида алюминия помимо текстурных изменений, вероятно, происходит также изменение его гидроксильного покрова, а, следовательно, и кислотно-оснóвных центров поверхности.
Изучение кислотных свойств поверхности носителей проводили методом ИК-спектроскопии адсорбированных молекул СО. Результаты анализа ИК-спектров представлены в табл. 3.
Таблица 3.
Данные о кислотности исходного и модифицированных уксусной кислотой образцов оксида алюминия
| Образец | Типы ЛКЦ | Отношение ЛКЦ-2/ЛКЦ-3 |
Сумма всех ЛКЦ, мкмоль/м2 | |||
|---|---|---|---|---|---|---|
| ЛКЦ-1 | ЛКЦ-2 | ЛКЦ-3 | ЛКЦ-4 | |||
| υСО, см–1 | ||||||
| 2177‒2184 | 2189‒2193 | 2203‒2207 | 2235‒2240 | |||
| Концентрация, мкмоль/м2 | ||||||
| Al2O3-0 | 0.275 | 1.250 | 0.140 | 0.002 | 8.9 | 1.667 |
| Al2O3-1.67 | 0.420 | 1.390 | 0.112 | 0.002 | 12.4 | 1.924 |
| Al2O3-17.4 | 0.870 | 1.570 | 0.158 | 0.002 | 9.9 | 2.600 |
Спектры для исследуемых образцов оксида алюминия с адсорбированными на их поверхности молекулами СО содержат интенсивные полосы в области 2158‒2240 см–1, характерные для γ‑Al2O3 [11]. На поверхности оксидов алюминия имеются четыре основных типа ЛКЦ, концентрации которых изменяются в зависимости от обработки Al2O3: сильные (ЛКЦ-4 с п. п. при 2238‒2240 см–1), два типа ЛКЦ средней силы (ЛКЦ-3 с п. п. при 2203‒2207 см–1; ЛКЦ-2 с п. п. при 2189‒2191 см–1) и слабые (ЛКЦ-1 с п. п. при 2177‒2180 см–1). Эти полосы относятся к поверхностным координационно-ненасыщенным атомам алюминия. Полоса при 2233‒2235 см–1, вероятно, соответствует центру типа Alп, в этом случае атом алюминия связан с четырьмя атомами кислорода [12]. Такая структура может быть реализована на ребре кристаллитов. Последние три типа ЛКЦ относятся к структурному типу Alо, различия в которых обусловлены составом второй координационной сферы алюминия. Кроме того, на поверхности образцов идентифицированы ОН-группы, которые проявляют слабокислотные свойства и характеризуются п. п. при 2157‒2162 см–1; при модифицировании их количество практически не изменяется. Следует также отметить, что число сильных центров и ЛКЦ-3 незначительно. При модифицировании образцов уксусной кислотой концентрация этих центров изменяется мало. Наиболее существенные изменения происходят с центрами средней (ЛКЦ-2) и слабой (ЛКЦ-1) силы. Так, при обработке носителя 1.67 М раствором уксусной кислоты число центров ЛКЦ-1 увеличивается с 0.275 до 0.420 мкмоль/м2, количество центров ЛКЦ-2 повышается с 1.25 до 1.39 мкмоль/м2. Модифицирование оксида алюминия ледяной уксусной кислотой приводит к росту концентрации как ЛКЦ-1, так и ЛКЦ-2 с 1.25 и 0.275 до 1.57 и 0.870 мкмоль/м2 соответственно. Общее число ЛКЦ при обработке 1.67 М раствором уксусной кислоты увеличивается на 15.4%, а при пропитке ледяной уксусной кислотой наблюдается гораздо более существенное повышение – на 56%.
Изменение распределения кислотно-оснóвных центров поверхности оксида алюминия, вероятно, связано с химическим взаимодействием кислоты с оксидом алюминия с образованием органических солей алюминия. В работе [2] на модифицированном уксусной кислотой оксиде алюминия наличие ацетат-иона было подтверждено ИК-спектрами, в которых наблюдались две слабые полосы поглощения в области 1380 и 1580 см–1, идентифицируемые как симметричные и асимметричные валентные колебания карбоксилат-иона [13]. Увеличение концентрации кислоты-модификатора приводит к возрастанию интенсивности указанных полос поглощения.
Дисперсность платины для Pt‒Re-катализатора на основе необработанного Al2O3 составляет 69%, а для модифицированных систем – 78‒80%. Полученные данные свидетельствуют об увеличении дисперсности платины в катализаторе в результате кислотной обработки оксида алюминия, что может быть связано с повышением концентрации дефектов поверхности носителей, образующихся в результате удаления ацетат ионов и продуктов разложения органических солей алюминия при прокаливании.
Результаты каталитических испытаний в реакции дегидроциклизации н-гептана представлены в табл. 4. Приведены усредненные данные анализа четырех проб при температурах 460, 480, 500 и 520°С. Перед испытаниями образцы были восстановлены в токе водорода при 500°С непосредственно в реакторе. Показатели для катализаторов Pt‒Re/Al2O3-0.83, Pt‒Re/Al2O3-8.33 и Pt‒Re/ Al2O3-13.3 близки к значениям таковых для образца Pt‒Re/Al2O3-17.4, поэтому в табл. 4 не представлены.
Таблица 4.
Результаты каталитических испытаний биметаллических катализаторов в превращении н-гептана*
| Катализатор | Конверсия, % | Селективность, % | |||
|---|---|---|---|---|---|
| С1 | С3‒C4 | i-C5‒i-C7 | Ar | ||
| Pt‒Re/Al2O3-0 | 81.2 | 0.7 | 19.5 | 49.0 | 21.2 |
| Pt‒Re/Al2O3-1.67 | 87.4 | 0.8 | 20.0 | 42.5 | 27.1 |
| Pt‒Re/Al2O3-17.4 | 84.0 | 0.8 | 18.8 | 45.5 | 21.7 |
Из данных табл. 4 следует, что в присутствии катализаторов на основе модифицированных носителей конверсия сырья выше относительно образца сравнения.
Селективность образования газов С1 и С3‒С4 в результате модифицирования носителей меняется несущественно, что, вероятно, обусловлено незначительным изменением концентраций сильных ЛКЦ-4 и центров средней силы ЛКЦ-3, отвечающих за протекание реакций гидрогенолиза и гидрокрекинга.
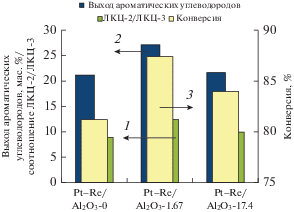
Таким образом, в риформинге н-гептана наибольший выход ароматических углеводородов (23.7 мас. %) наблюдается для образца Pt‒Re/Al2O3-1.67 по сравнению с катализатором Pt‒Re/Al2O3-0 (17.2 мас. %). Наблюдаемые эффекты, вероятно, связаны с различным составом кислотных центров носителя. Для Al2O3-1.67 характерно повышение концентрации слабых центров ЛКЦ-1 и снижение концентрации центров средней силы ЛКЦ-3 относительно исходного оксида алюминия. При этом соотношение ЛКЦ‑2/ЛКЦ-3 для данного образца максимальное – 12.4. Таким образом, выход ароматических углеводородов и конверсия н-гептана соответствуют изменениям соотношения типов ЛКЦ-2/ ЛКЦ-3, которые зависят от концентрации уксусной кислоты при обработке носителя.
Стоит отметить, что наблюдается закономерность изменения выхода ароматических углеводородов от соотношения кислотных центров типа 2 и 3 носителя, это может указывать на участие данных центров в реакции ароматизации. Активность катализаторов при этом в значительной степени определяется концентрацией ЛКЦ средней силы. Поэтому льюисовская кислотность оксида алюминия отвечает за потенциальную активность катализаторов, реализуемую при минимальном содержании средних ЛКЦ-3 с оптимальным соотношением ЛКЦ-2/ЛКЦ-3 = 12.4 (рис. 4). Наличие оптимального соотношения обусловлено тем, что при повышенной концентрации ЛКЦ-3 возможно усиление реакции гидрокрекинга с образованием побочных продуктов.
ЗАКЛЮЧЕНИЕ
Проведенные в работе исследования позволили установить, как изменяются физико-химические и каталитические свойства Pt‒Re-катализаторов на основе оксида алюминия, обработанного уксусной кислотой разной концентрации (от 0.83 до 17.4 М), введенной до стадии нанесения предшественников активных компонентов. Так, изменение фазового состава носителей в результате модифицирования не обнаружено. Отсутствует существенное влияние обработки уксусной кислотой и на текстурные характеристики носителей. Однако модифицирование носителя уксусной кислотой ведет к изменению его кислотных свойств, а именно к перераспределению концентраций между центрами разной силы. При обработке уксусной кислотой наблюдается рост концентрации льюисовских кислотных центров средней силы 2-ого типа. Использование при обработке носителя ледяной уксусной кислоты приводит к повышению общей кислотности и росту концентрации ЛКЦ-1, ЛКЦ-2 и ЛКЦ-3.
Результаты каталитических испытаний в реакции дегидроциклизации н-гептана показывают, что наибольшую активность проявляет образец Pt‒Re/Al2O3-1.67, вероятно, по причине более оптимального состава кислотных центров носителя, а также высокой дисперсности платины. Увеличение концентрации уксусной кислоты в алюмоплатинорениевом катализаторе нерационально для данной реакции, как по причине снижения выхода целевого продукта (ароматические углеводороды), так и по причине снижения общей каталитической активности образцов.
Список литературы
Борисевич Ю.П., Фомичев Ю.В., Левинтер М.Е. // Журн. физ. химии. 1982. Т. 56. Вып. 5. С. 1298.
Ламберов А.А., Романова Р.Г., Шмелев И.Г., Сопин В.Ф. // Журн. прикл. химии. 2002. Т. 75. Вып. 3. С. 407.
Шмелев И.Г. Разработка низкотемпературного катализатора парофазной дегидратации 1-фенилэтанола (метилфенилкарбинола). Автореферат Дисс. … канд. хим. наук: 02.00.15. Казань, 2003. 23 с.
Kwak J.H., Hu J., Mei D., Yi C.-W., Kim D.H., Peden C.H.F., Allard L.F., Szanyi J. // Science. 2009. V. 325. P. 1670.
Удрас И.Е., Затолокина Е.В., Паукштис Е.А., Белый А.С. // Кинетика и катализ. 2010. Т. 51. № 1. С. 88.
Виниченко Н.В., Голинский Д.В., Затолокина Е.В., Паукштис Е.А., Муромцев И.В., Гуляева Т.И., Белый А.С. // Кинетика и катализ. 2019. Т. 60. № 2. С. 264.
Passos F.B., Aranda D.A.G., Schmal M. // J. Catal. 1998. V. 178. P. 478.
Dollimore D., Heal G.R. // J. Colloid and Interface Sci. 1970. V. 33. № 4. P. 508.
Сударикова Е.Ю. Получение прекурсоров и синтез из них порошков высокочистого оксида алюминия. Автореферат Дисс. … канд. хим. наук: 05.17.01. Москва, 2009. 27 с.
Sato T., Ikoma S., Ozawa F. // Thermochim. Acta. 1984. V. 75. P. 129.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука. Сиб. отд., 1992. 255 с.
Кулько Е.В., Иванова А.С., Буднева А.А., Паукштис Е.А. Кинетика и катализ. 2005. Т. 46. №1. С. 141.
Handbook of Chemistry and Physics; Lide D.R.; Ed.-in-Chief, 73rd ed.; CRS Press, 1993. P. 9–152.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ