Кинетика и катализ, 2020, T. 61, № 1, стр. 126-133
Влияние свойств поверхности γ-Al2O3 на превращение метанола в ДМЭ по данным ИК-спектроскопии in situ
В. А. Матышак a, *, В. А. Садыков b, О. Н. Сильченкова a, Г. И. Лин c, А. Я. Розовский c
a ФГБУН Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
b ФГБУН “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
c ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 29, Россия
* E-mail: matyshak@polymer.chph.ras.ru
Поступила в редакцию 18.02.2019
После доработки 06.06.2019
Принята к публикации 01.07.2019
Аннотация
Образцы оксида алюминия разного происхождения проявляют различную активность в реакции дегидратации метанола в диметиловый эфир (ДМЭ). Для выяснения причин различия в их активности проведено сравнительное исследование структурных (РФА, удельная поверхность, пористость), поверхностных (кислотность по Бренстеду и Льюису, гидроксильный покров) свойств образцов оксида алюминия. С помощью ИК-спектроскопии in situ показано, что в условиях реакции превращения метанола на поверхности образцов оксида алюминия существуют формиат, альдегидоподобный комплекс, мостиковая и линейная метоксигруппы в разном соотношении. Для всех образцов проведено сравнение реакционной способности обнаруженных поверхностных соединений. Найдено, что активность образцов в образовании ДМЭ коррелирует со скоростью превращения мостиковой метоксигруппы. В свою очередь скорость превращения мостиковой метоксигруппы определяется кислотностью мостиковых гидроксильных групп. Повышение кислотности приводит к увеличению прочности связи метоксигруппы с поверхностью и уменьшению скорости превращения ее в ДМЭ. Линейная метоксигруппа претерпевает окислительное превращение в формиатный и альдегидный поверхностные комплексы. Обсуждается природа окислительной способности поверхности оксида алюминия.
ВВЕДЕНИЕ
Метанол является одним из ключевых реагентов в синтезе различных соединений. Основные маршруты превращения метанола – синтез диметилового эфира (ДМЭ) [1–3], метилформиата (МФ) [4], формальдегида [5], а также получение углеводородов (моторные топлива).
Исследование процесса превращения метанола в ДМЭ на различных оксидных системах подробно анализируется в обзорной работе [6]. В качестве возможных интермедиатов рассматриваются, в частности, метоксильные группы –O–CH3. Предполагается, например, что взаимодействие двух метоксигрупп приводит к появлению ДМЭ, а при реакции метоксигруппы с кислородом может происходить образование формальдегида [7, 8]. В качестве промежуточных соединений в реакциях превращения метанола указываются также формиатные комплексы [9] и сложные комплексы, включающие в свой состав две метоксигруппы и гидроксильную группу поверхности [10]. Спектральные проявления упомянутых поверхностных комплексов суммированы в [11–18].
Ранее нами методом ИК-спектроскопии in situ были изучены превращения поверхностных соединений в системе метанол/γ-Al2O3 [19]. Установлено, что в отсутствие метанола в газовой фазе диметиловый эфир (ДМЭ) образуется при взаимодействии двух мостиковых метоксигрупп, а в присутствии метанола – при взаимодействии метанола из газовой фазы с метоксигруппой на поверхности; линейные метоксигруппы превращаются в формиат и альдегид, являющиеся источниками СО2 в газовой фазе.
Литературные данные [6–18] показывают, что комплексы, возникающие при реакции метанола с поверхностью оксидных катализаторов, достаточно хорошо охарактеризованы, изучена их роль в образовании продуктов реакции. Однако природа и свойства активных центров, определяющих скорость протекания процесса, остаются неизвестными.
В связи с этим основной целью настоящей работы было исследование влияния свойств поверхности образцов γ-Al2O3 разного генезиса на скорость образования и расходования промежуточных соединений и, следовательно, на скорость образования диметилового эфира.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы образцы оксида алюминия разного происхождения: образец № 1 (Щелковский катализаторный завод), образец № 2 (Саратовский нефтехимический комбинат), образец № 3 (прокаленный при 700°C Al2O3 “Диспераль”), образец № 4 (Рязанский нефтеперерабатывающий завод). Рентгеновский анализ фазового состав образцов проводили на дифрактометре Дрон-3,5 (Россия) в монохроматизированном CuKα-излучении (λ = 1.54178 Å).
В табл. 1 приведены результаты фазового анализа исходных образцов, которые свидетельствуют, что технологические процессы их получения несколько различаются. Перед проведением экспериментов образцы подвергали высокотемпературной обработке (450°С) в потоке инертного газа.
Таблица 1.
Свойства образцов Al2O3
| Образец № | Удельная поверхность по БЭТ, м2/г | Объем пор, см3/г | Кислотность по Льюису (ЭПР), spin/м2 | Кислотность по Льюису (адс. СО), мкмоль/г | Фазовый состав по данным РФА |
|---|---|---|---|---|---|
| 1 | 247 | 0.35 | 2.2 × 1017 | Измерение не проводилось | γ-Al2O3 с примесью псевдобемита и бемита |
| 2 | 227 | 0.66 | 1.9 × 1017 | 2.9 × 1017 | γ-Al2O3 с примесью псевдобемита |
| 3 | 170 | Измерение не проводилось | Измерение не проводилось | Незначительна | γ-Al2O3 |
| 4 | 210 | 0.62 | Измерение не проводилось | Измерение не проводилось | γ-Al2O3 |
Удельную поверхность образцов измеряли методом БЭТ по тепловой десорбции аргона в потоке гелия. Характеристики пористости исследовали методом ртутной порозиметрии. Кислотность поверхности образцов изучали с помощью термопрограммируемой десорбции аммиака (ТПД) и методом электронного парамагнитного резонанса (ЭПР) по адсорбции антрахинона согласно методике, аналогичной описанной в работе [20]. Данная методика использует способность молекулы антрахинона образовывать парамагнитный комплекс с координационно-ненасыщенными катионами поверхности – льюисовскими кислотными центрами (ЛКЦ), антрахинон в этом комплексе играет роль донора. Дополнительные сведения о кислотности поверхности получали с помощью ИК-спектроскопии адсорбированной тест-молекулы СО на ИК-Фурье-спектрометре IFS-45 (“Brucker”, Германия) [21].
В табл. 1 суммированы некоторые характеристики исследуемых образцов. Измерения их каталитической активности в реакции дегидратации метанола в ДМЭ осуществляли с использованием проточной каталитической установки с металлическим реактором внутренним диаметром 11 мм и обогреваемыми газовыми линиями [22].
Спектрокинетические измерения в условиях реакции превращения метанола проводили по методике, аналогичной описанной в [23]. Экспериментальная установка включала ИК-Фурье-спектрометр Spectrum RX I FT-IR System (“Perkin Elmer”, США) или IFS-45 (“Brucker”, Германия), проточную обогреваемую кювету-реактор (V = = 1 см3), блок подготовки газов, систему анализа продуктов и реагентов. В качестве реагентов использовали смесь 4% метанола в гелии, чистота Не – 99.99%. Интенсивность полос поглощения (п. п.) в спектрах пропускания измеряли в единицах оптической плотности (А). Обычное число сканирований – 64, разрешение – 4 см–1.
Образец в виде таблетки массой 20 мг и площадью 2 см2 помещали в кювету, которая одновременно служила каталитическим проточным реактором. Перед измерениями образец обрабатывали в потоке инертного газа (He) при 450°С в течение часа, охлаждали до необходимой температуры и включали поток реакционной смеси (30 мл/мин).
Методика спектрокинетических исследований заключалась в одновременном измерении концентрации поверхностных соединений методом ИК-спектроскопии in situ и скорости образования продуктов реакции хроматографическим методом в стационарном режиме протекания реакции превращения метанола или при исключении метанола из потока реакционной смеси.
Определение концентрации реагентов и продуктов реакции проводили с использованием хроматографа марки 3700 (“Хроматограф”, Россия) с обогреваемыми линиями, газом-носителем служил гелий. Анализ ДМЭ, метанола и метана осуществляли на колонке с фазой Porapaq Q, пламенно-ионизационный детектор; анализ СО, Н2 и СО2 – на колонках с фазами Молекулярные Сита 5А и Porapaq Q, детектор по теплопроводности.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Стационарные измерения
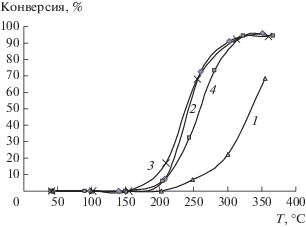
На рис. 1 приведены зависимости конверсии метанола в ДМЭ от времени контакта при 240°С. Видно, что активность образца № 1 заметно меньше, чем у других образцов. Для выяснения причины такого различия сравнительные спектрокинетические измерения проводили для “активных” (№ 2 и № 3) и “неактивного” (№ 1) образцов. Для исследования окислительной способности поверхности также были получены данные для образца № 2 после предварительной обработки в водороде (Al2O3 № 2(H2)).
Рис. 1.
Зависимости конверсии метанола от времени контакта при 240°С для образцов Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4).

На рис. 2 представлены ИК-спектры, зарегистрированные в условиях превращения метанола на вышеуказанных образцах. В спектрах всех образцов присутствуют полосы поглощения формиатного (1593, 1392, 1373 см–1) [15–17] и альдегидного (1318 см–1) [19] комплексов. П. п. колебания связи С=О в альдегиде маскируется интенсивным поглощением формиатного комплекса. Подробно это обстоятельство было доказано в [19]. Отнесение полос поглощения к колебанию С–О в линейной (1185–1194 см–1) и в мостиковой (1090–1105 см–1) метоксигруппах выполнено на основе многочисленных литературных данных по адсорбции метанола на различных оксидных системах [9–12, 15, 17, 18], и на оксиде алюминия [19, 24–27]. В ИК-спектре метоксигруппы должны также проявляться деформационные С–Н-колебания метильных групп. Однако они малоинтенсивны и наблюдаются только при высокой концентрации метоксигрупп на поверхности. В нашем случае (рис. 2) можно заметить слабое поглощение симметричных и несимметричных С–Н-колебаний в интервале 1450–1470 см–1.
Рис. 2.
Инфракрасные спектры в условиях реакции превращения метанола на образцах Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4) при 240°С.
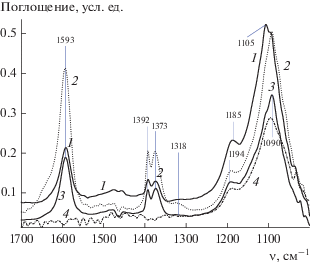
В диапазоне 2800–3000 см–1 присутствуют интенсивные п. п. 2941, 2841 и 2825 см-1 и малоинтенсивные п. п. (плечи) при 2905 и 2890 см–1 валентных С–Н-колебаний. В области валентных колебаний поверхностных ОН-групп наблюдается отрицательный пик при ~3720 см–1 (для удобства эти спектры приведены на рис. 6). Отрицательная интенсивность п. п. в разностных спектрах означает, что при взаимодействии метанола с поверхностью гидроксильные группы расходуются. В дальнейшем концентрацию поверхностных комплексов оценивали по интенсивности п. п. 1593 см–1 (формиат), 1318 см–1 (альдегид), а также по интенсивности п. п. мостиковой и линейной метоксигрупп.
Отметим, что частота колебания линейной метоксигруппы на образце № 1 примерно на 10 см–1 ниже, а мостиковой метоксигруппы – выше, чем на остальных образцах.
Продуктами превращения метанола на Al2O3 разного генезиса являются ДМЭ и Н2О. При температуре выше 300°С наблюдается образование Н2, СО, СО2 и СН4, их суммарная концентрация не превышает ~0.6%. На рис. 3 приведены зависимости конверсии метанола от температуры опыта. Видно, что и в этих экспериментах активность образца № 1 заметно ниже. Заметим также, что обработка образца № 2 в водороде практически не влияет на конверсию метанола в ДМЭ.
Рис. 3.
Зависимости конверсии метанола от температуры для образцов Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4).
На рис. 4а–4г представлены зависимости интенсивностей п. п. поверхностных соединений от температуры, измеренные в условиях, аналогичных тем, что были в опыте по конверсии. Видно, что интенсивность п. п. всех поверхностных комплексов проходит через максимум. Однако можно заметить, что температура начала падения интенсивности п. п. метоксигрупп (рис. 4а, 4б) соответствует температуре начала образования формиатных и альдегидных комплексов (рис. 4в, 4г).
Рис. 4.
Зависимости интенсивности п. п. поверхностных соединений от температуры для образцов Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4): а – линейная метоксигруппа; б – мостиковая метоксигруппа; в – формиат; г – альдегидный комплекс.
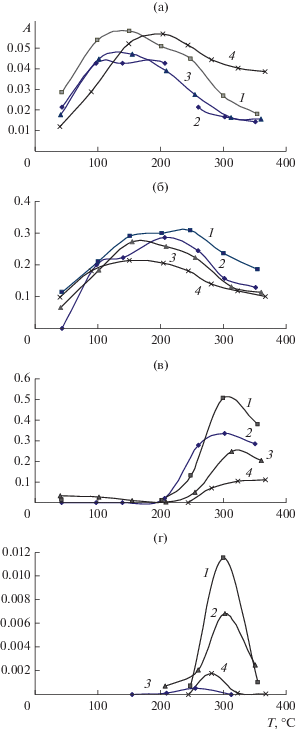
Среди температурных зависимостей интенсивности п. п. мостиковой метоксигруппы (рис. 4б) выделяется зависимость для образца № 1, максимум на которой сдвинут в сторону высоких температур по сравнению с другими образцами. Отметим, что это различие температур максимумов коррелирует с разницей температур начала конверсии метанола в ДМЭ (рис. 3).
Температурные зависимости интенсивности п. п. линейной метоксигруппы (рис. 4а) примерно одинаковы для всех образцов за исключением образца № 3, для которого максимум сдвинут в сторону более высоких температур. По-видимому, этот сдвиг свидетельствует о пониженной реакционной способности линейной метоксигруппы, что коррелирует с повышением температуры начала появления формиатных (рис. 4в) и альдегидных (рис. 4г) комплексов на этом образце.
Отметим также, что на поверхности образца № 2 после обработки его в водороде формиатный комплекс присутствует в заметно меньших количествах (рис. 4в), а альдегидный комплекс не образуется вовсе (рис. 4г).
Нестационарные измерения
После установления стационарных значений концентрации поверхностных соединений в потоке 4% метанола в гелии и исключения метанола из реакционной смеси было проведено наблюдение за изменением в ИК-спектрах интенсивности п. п. формиата, мостиковой и линейной метоксигрупп.
На рис. 5а представлены зависимости изменения интенсивности п. п. мостиковой метоксигруппы от времени при разных температурах и результаты обработки кинетических кривых. Полученные кинетические кривые позволяют определить эффективные константы, порядок процесса расходования поверхностных комплексов и величину энергии активации. Уравнение, описывающее изменение концентрации мостиковой метоксигруппы, имеет второй порядок (рис. 5б), в то время как порядок уравнения, описывающего изменение концентрации формиата и линейной метоксигруппы, близок к первому. В табл. 2 приведены соответствующие значения констант.
Рис. 5.
Зависимости интенсивности п. п. мостиковой метоксигруппы от времени после выключения метанола из реакционного потока (а) и результат обработки полученных кинетических кривых в координатах уравнения второго порядка (б) для образцов Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4).
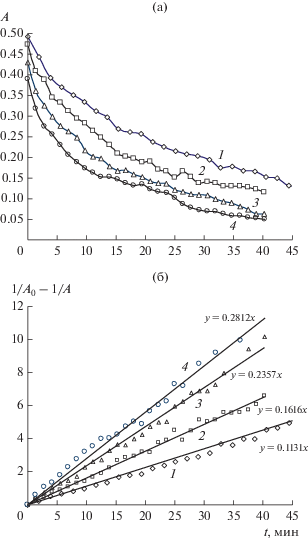
Рис. 6.
Инфракрасные спектры гидроксильного покрова образцов Al2O3 № 1 (1), № 2 (2), № 2(Н2) (3) и № 3 (4). В нижней части рисунка приведены спектры, полученные после адсорбции метанола на образцах № 2 (5) и № 3 (6) при 240°С.
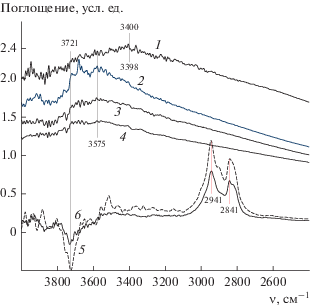
Таблица 2.
Константы скорости превращения поверхностных соединений в условиях реакции дегидратации метанола
| T, °C | Образование формиата (п. п. 1590 см–1) |
Расходование линейной метоксигруппы (п. п. 1190 см–1 ) |
Расходование мостиковой метоксигруппы (п. п. 1090 см–1) |
|---|---|---|---|
| k, мин–1 (n = 1) | k, мин–1 (n = 1)* | k, мин–1 (n = 2)* | |
| Al2O3 № 2 | |||
| 210 | 0.036 | 0.082 | 0.19 |
| 240 | 0.072 | 0.125 | 0.24 |
| 260 | 0.078 | 0.157 | 0.34 |
| 280 | – | – | 0.40 |
| Al2O3 № 2(H2) | |||
| 206 | 0.07 | 0.084 | 0.18 |
| 240 | 0.086 | 0.115 | 0.24 |
| 260 | – | 0.18 | 0.30 |
| 280 | – | 0.20 | 0.36 |
| Al2O3 № 1 | |||
| 208 | 0.048 | 0.046 | 0.113 |
| 241 | 0.060 | 0.076 | 0.162 |
| 258 | 0.084 | 0.101 | 0.230 |
| 280 | – | 0.116 | 0.280 |
* Размерности констант скорости расходования метоксигрупп по первому и второму порядку в данном случае совпадают, поскольку поверхностные заполнения выражаются в безразмерных единицах (единицах оптической плотности). Прочерки означают, что при указанных температурах в спектрах отсутствуют соответствующие полосы поглощения.
Видно, что константы скорости превращения метоксигрупп для образца Al2O3 № 1 примерно в полтора раза меньше, чем для других образцов при прочих равных условиях. Кроме того, для образцов, на поверхности которых не наблюдается альдегидный комплекс, отмечается равенство константы скорости расходования линейной метоксигруппы и константы скорости образования формиатного комплекса (образцы Al2O3 № 1 и Al2O3 № 2(H2). Этот факт свидетельствует в пользу того, что формиатный комплекс образуется из линейной метоксигруппы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 6 приведены спектры гидроксильного покрова разных образцов Al2O3. Уровень шумов в этих спектрах достаточно высок. Связано это с тем, что промышленные образцы Al2O3 характеризуются сильным поглощением в области гидроксильныx групп. Однако качественные выводы о состоянии разных образцов они сделать позволяют. В частности, спектры гидроксильных групп образцов оксида алюминия № 2 и № 3 характеризуются широкой интенсивной полосой водородносвязанных ОН-групп с максимумом при 3575 см–1 и более слабыми высокочастотными полосами мостиковых (3720 см–1) ОН-групп [21]. Интенсивность полос поглощения терминальных ОН-групп (>3750 cм–1) очень мала. Спектр гидроксильного покрова неактивного образца Al2O3 № 1 значительно отличается от других спектров наличием широкой интенсивной п. п. водородносвязанных ОН-групп при 3400 см–1. На ее фоне полосы мостиковых и терминальных ОН-групп практически не видны.
Как уже было отмечено, интенсивность п. п. мостиковых групп существенно выше, чем таковая терминальных ОН-групп. В соответствии с представлениями о механизме образования метоксигрупп [19, 28] первые участвуют в формировании мостиковой метоксигруппы, вторые – линейной. В итоге (рис. 2) п. п. мостиковых метоксигрупп значительно интенсивнее п. п. линейной метоксигруппы. Участие гидроксильных групп в образовании метоксигрупп при взаимодействии метанола с поверхностью проявляется в спектрах в виде отрицательных пиков с частотами, характерными для гидроксильных групп, причем частоты этих пиков несколько различаются (спектры в нижней части рис. 6). Отметим, что интенсивность отрицательного поглощения коррелирует с интенсивностью поглощения на этих частотах в соответствующих спектрах водородносвязанных гидроксилов.
Различия в свойствах поверхности образцов проявляются и по отношению к адсорбции аммиака (рис. 7). Спектры термодесорбции аммиака характеризуются наличием низко- и высокотемпературных пиков, связанных с адсорбцией аммиака на бренстедовских (БКЦ) и льюисовских (ЛКЦ) кислотных центрах соответственно [21]. Можно видеть, что спектр образца Al2O3 № 1 отличается от спектров остальных образцов: пик, соответствующий адсорбции аммиака на БКЦ, интенсивнее, чем для других образцов, а его максимум примерно на 20°С сдвинут в сторону высоких температур (кривая 1). Кроме того, концентрация ЛКЦ для образца № 1 выше, чем для образца № 2 (табл. 1).
Рис. 7.
Термодесорбционные спектры после адсорбции аммиака на образцах γ-Al2O3 № 1 (1), № 2 (2) и № 3 (3).
Таким образом, можно сформулировать различия в свойствах поверхности всех изученных оксидов алюминия: очевидно, из-за различия в свойствах исходного сырья и особенностей технологии приготовления кристаллиты “активных” и “неактивных” образцов Al2O3 ограняются кристаллическими плоскостями разного типа. В итоге на поверхности “неактивного” образца возрастает плотность расположения и кислотность поверхностных гидроксильных групп и, как следствие, увеличивается прочность связи иона аммония, а соответствующий пик десорбции аммиака сдвигается в сторону высоких температур [21].
Поскольку активация метанола с образованием метоксигрупп происходит с участием гидроксильных групп, то описанное изменение свойств гидроксильного покрова в значительной степени влияет на этот процесс: частота колебания мостиковой метоксигруппы повышается, а линейной метоксигруппы – понижается. Увеличение или уменьшение частоты колебания свидетельствует об изменении прочности связи метоксигрупп с поверхностью и, следовательно, их реакционной способности, о чем свидетельствуют значения констант скорости превращения, приведенные в табл. 2. Из этих данных видно, что скорость расходования метоксигрупп на Al2O3 № 1 ниже, чем для остальных образцов.
В соответствии с представлениями, развитыми нами ранее в [19, 28], взаимодействие между двумя мостиковыми метоксигруппами приводит к образованию диметилового эфира в газовой фазе. В присутствии в газовой фазе метанола наблюдается также его реакция с метоксигруппой на поверхности, которая дает главный вклад в процесс образования диметилового эфира.
Уменьшение константы расходования мостиковой метоксигруппы является главной причиной падения скорости образования диметилового эфира, поскольку остальные характеристики разных оксидов достаточно близки (удельная поверхность, диаметр и объем пор, табл. 1). Снижение реакционной способности мостиковой метоксигруппы на Al2O3 № 1 проявляется и в повышении температуры максимума на кривой зависимости концентрации этого комплекса от температуры (рис. 4б).
В соответствии с теми же представлениями [19, 28] линейная метоксигруппа участвует в десорбции с образованием метанола в газовой фазе, в превращении в формиат и альдегид, являющихся, в свою очередь, источниками СО2 в газовой фазе. Участие какой-либо формы кислорода для формирования формиата и альдегида очевидно. Поскольку характеры кинетических кривых накопления этих комплексов на поверхности принципиально различаются [19], а оба комплекса получаются из метоксигрупп одного и того же типа, это означает, что природа кислорода, участвующего в образовании этих комплексов, различна. Данный факт может быть связан с наличием на поверхности Al2O3 разных форм адсорбированного кислорода. Роль молекулярных и атомарных форм поверхностного кислорода в образовании формиата подробно обсуждается в [29–31].
Другими словами, поверхность оксида алюминия до некоторой степени (нестационарно) обладает окислительными свойствами, причем для изученных нами образцов эти свойства различны, что проявляется в разной концентрации формиатных и альдегидных комплексов на их поверхности (рис. 4в, 4г) при прочих равных условиях. Дополнительным подтверждением наличия окислительных свойств является уменьшение интенсивности п. п., характерной для формиатного комплекса, и полное отсутствие п. п., соответствующей альдегидному комплексу, при проведении реакции на предварительно обработанном в потоке водорода (400°С, 1 ч) образце Al2O3 № 2(Н2) (рис. 2, спектр 2, рис. 4г). Видно, что центры, на которых происходит адсорбция кислорода, способного окислить линейную метоксигруппу до альдегида, чрезвычайно чувствительны к восстановительной обработке оксида алюминия. После тренировки Al2O3 не только в водороде, но и в потоке газа, содержащего примесь углеводорода, в частности, метанола, в спектрах in situ полосы поглощения альдегидного комплекса не наблюдаются. На скорость образования диметилового эфира предварительная обработка не сказывается. Напомним, что при тренировке образцов в потоке Не активный кислород не удаляется.
Возможными центрами активации кислорода являются поверхностные дефекты оксида алюминия. О том, что на поверхности оксидных систем существует кислород, проявляющий необычные свойства, сообщается во многих работах. В частности, в [32, 33] приводятся сведения о наличии на поверхности цеолитных катализаторов (цеокар-2) прочносвязанного кислорода, который остается на поверхности при высокотемпературной обработке в инертной атмосфере и может быть удален лишь по реакции адсорбционного замещения при взаимодействии с Н2, Н2О или СО2.
При 240°С на поверхности образца Al2O3 № 1 альдегидный комплекс отсутствует. Это обстоятельство позволяет сравнить константы скорости расходования линейной метоксигруппы и скорости образования формиата (в нашем случае такое сравнение возможно, поскольку в уравнения, описывающие и образование формиата, и расходование метоксигруппы, будет входить одна и та же концентрация метоксигрупп). Видно (табл. 2), что указанные константы хорошо совпадают и это доказывает, что источником образования формиата действительно является линейная метоксигруппа.
ЗАКЛЮЧЕНИЕ
В заключение можно отметить, что активность образцов в образовании ДМЭ коррелирует со скоростью превращения мостиковой метоксигруппы. В свою очередь скорость превращения мостиковой метоксигруппы определяется кислотностью мостиковых гидроксильных групп. Повышение кислотности приводит к увеличению прочности связи метоксигруппы с поверхностью и уменьшению скорости превращения ее в ДМЭ.
Линейная метоксигруппа претерпевает окислительное превращение в формиатный и альдегидный поверхностные комплексы. Окислительная способность поверхности оксида алюминия связана с атомарным и молекулярным кислородом, адсорбированным на дефектных местах поверхности.
Список литературы
Vishwanathan M., Roh H.-S., Kim J.-N. // Catal. Lett. 2004. V. 96. P. 23.
Tleimat-Manzalji R., Bianchi D., Pajonk G.M. // React. Kinet. Catal. Lett. 1993. V. 51. P. 29.
Bianchi D., Chafik T., Khalfallah M., Teichner S.J. // Appl. Catal. A: Gen. 1995. V. 123. P. 89.
Sambeth J.E., Juan A., Gambaro L. // J. Mol. Catal. A: Chem. 1997. V. 118. P. 283.
Sambeth J.E., Centeno M.A., Paul A. // J. Mol. Catal. A: Chem. 2000. V. 161. P. 89.
Bakhtyari A., Rahimpour M.R. Methanol. Science and Engineering. Ch. 10. Methanol to Dimethyl ether. Amsterdam, Netherlsnds: Elsevier, 2018. P. 281.
Крылов О.В., Матышак В.А. Промежуточные соединения в гетерогенном катализе. Москва: Наука, 1996. 315 с.
Матышак В.А., Хоменко Т.И., Лин Г.И., Завалишин И.Н., Розовский А.Я. // Кинетика и катализ. 1999. Т. 40. С. 269.
Neophytides S.G., Marchi A.J., Froment G.F. // Appl. Catal. A: Gen. 1992. V. 86. P. 45.
Martin K.A., Zabransky R.F. // Appl. Spectrosc. 1991. V. 45. P. 68.
Давыдов А.А. ИК-спектроскопия в химии поверхности окислов. Новосибирск: Наука, 1984. 241 с.
Daturi M., Binet C., Lavalley J-C., Galtayries A., Spoken R. // Phys. Chem. Chem. Phys. 1999. V. 1. P. 5717.
Siokou A., Nix R.M. // J. Phys. Chem. B. 1999. V. 103. P. 6984.
Novakova J., Kubelkova L., Dolysek Z. // J. Catal. 1987. V. 108. P. 208.
Lamotte J., Moravek V., Bensitel M., Lavalley J.C. // React. Kinet. Catal. Lett. 1988. V. 36. P. 113.
Knop-Gericke A., Havecker M., Schedel-Niedrig Th., Schlogl R. // Top. Catal. 2000. V. 10. P. 187.
Carley A.P., Owens A.W., Rajumon M.K., Roberts M.W., Jackson S.D. // Catal. Lett. 1996. V. 37. P. 79.
Ueno A., Onishi T., Tamaru K. // Trans. Faraday Soc. 1971. V. 67. P. 3585.
Матышак В.А., Березина Л.А., Сильченкова О.Н., Третьяков В.Ф., Лин Г.И., Розовский А.Я. // Кинетика и катализ. 2009. Т. 50. С. 120.
Pushkar Y.N., Parenago O.O., Fionov A.V., Lunina E.V. // Colloids and Surfaces. A: Physicochemical and Engineering Aspects. 1999. V. 158. P. 179.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука, 1992. 254 с.
Kипнис M.A., Самохин П.В., Бондаренко Г.Н., Волнина Э.A., Костина Ю.В., Яшина O.В., Барабанов В.Г., Корнилов В.В. // Журн. физ. химии. 2011. Т. 85. № 8. С. 1435.
Matyshak V.A., Krylov O.V. // Catal. Today. 1996. V. 25. P. 1.
Малахова И.В., Ермолаев В.К., Данилова И.Г. // Кинетика и катализ. 2003. Т. 44. С. 587.
Alekseev A.V., Lopatin Yu.N., Tsyganenko A.A. // React. Kinet. Catal. Lett. 1974. V. 1. P. 443.
Busca G., Rossi P.F., Lorenzelli V. // J. Phys. Chem. 1985. V. 89. P. 5433.
DeVito D.A., Giardoni F., Kiwi-Minsker L. // J. Mol. Srtuct. 1999. V. 469. P. 7.
Березина Л.А., Матышак В.А., Корчак В.Н., Бурдейная Т.Н., Третьяков В.Ф., Лин Г.И., Розовский А.Я. // Кинетика и катализ. 2009. Т. 50. С. 806.
Matsushima T., White J. // J. Catal. 1976. V. 44. P. 183.
Herd A.C., Onishi T., Tamaru K. // Bull. Chem. Soc. Japan. 1974. V. 47. P. 575.
Yamashita K., Naito S., Tamaru K. // J. Catal. 1985. V. 94. P. 353.
Вишнецкая М.В., Тактарова Г.Н., Топчиева К.В. // Кинетика и катализ. 1985. Т. 26. С. 1271.
Вишнецкая М.В., Тактарова Г.Н., Топчиева К.В. // Кинетика и катализ. 1985. Т. 26. С. 1272.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


