Кинетика и катализ, 2020, T. 61, № 6, стр. 812-817
Влияние реакционных условий на скорость получения водорода в водных растворах глицерина на фотокатализаторах Pt/TiO2
А. Ю. Куренкова a, Е. А. Козлова a, В. В. Каичев a, *
a ФГБУН Федеральный исследовательский центр Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: vvk@catalysis.ru
Поступила в редакцию 28.03.2020
После доработки 27.04.2020
Принята к публикации 28.04.2020
Аннотация
Изучены процессы фотокаталитического получения водорода из водных растворов глицерина под действием мягкого УФ-излучения в присутствии фотокатализаторов на основе диоксида титана с нанесенной платиной при варьировании рН реакционной среды, концентрации субстрата и длины волны источника излучения. Установлено, что зависимость скорости фотокаталитического получения водорода от концентрации субстрата подчиняется механизму Ленгмюра–Хиншельвуда. Максимальная активность в получении водорода составила 10.4 ммоль ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}\,\,{{{\text{ч}}}^{{ - 1}}}$.
ВВЕДЕНИЕ
Стремительное сокращение запасов нефти требует широкого освоения альтернативных источников энергии. В настоящее время повышенное внимание приковано к применению в качестве топлива водорода. Преимущество водорода заключается в том, что теплота его сгорания очень велика, а продуктом сгорания является вода – экологически чистый продукт. Основными возобновляемыми источниками водорода являются вода и биомасса [1]. Среди различных органических веществ, используемых для получения водорода, особый интерес представляет глицерин – побочный продукт синтеза биодизеля из растительных масел. Производство биодизеля во всем мире растет из года в год, соответственно, растет производство глицерина и падает цена последнего. Таким образом, утилизация глицерина, совмещенная с выделением водорода, представляет практический интерес [2].
Известно, что фотокаталитическое бескислородное разложение растворенных органических веществ на полупроводниковых катализаторах под действием УФ-излучения позволяет получать водород. При этом из одного моля глицерина образуется семь молей водорода:
(I)
${{{\text{С}}}_{3}}{{{\text{Н}}}_{8}}{{{\text{О}}}_{3}} + 3{{{\text{Н}}}_{2}}{\text{О}} \to 7{{{\text{Н}}}_{2}} + 3{\text{С}}{{{\text{О}}}_{2}}.$В настоящее время для фотокаталитического выделения водорода в качестве катализатора наиболее активно используется платинированный диоксид титана. Нанесение металла на полупроводник сильно влияет на его электрохимические свойства. Если работа выхода электрона в металле превышает работу его выхода из зоны проводимости полупроводника, электрон переходит на частицу металла, в результате чего возникает барьер Шоттки, препятствующий обратному переходу электрона. Наивысший барьер Шоттки образует платина из-за наибольшего значения работы выхода по сравнению с другим металлам [1]. Благодаря этому системы металл/полупроводник имеют высокую активность в фотокаталитических процессах. Большие усилия направлены на синтез и модификацию фотокатализаторов получения водорода из водных растворов глицерина. Недавно было показано, что предварительное прокаливание коммерческого диоксида титана Evonik P25 при 500°С с дальнейшим нанесением на него платины (1 мас. %) приводит к заметному росту активности фотокатализатора по сравнению с использованием непрокаленного TiO2 Evonik P25 с нанесенной платиной [3]. Известно, что добиться увеличения скорости фотокаталитических реакции можно не только за счет изменения состава катализаторов, но и за счет варьирования условий проведения процесса, таких как рН реакционной среды и концентрация субстрата [4]. Соответственно, целью настоящей работы являлась оптимизация условий проведения процесса получения водорода из водных растворов глицерина под действием мягкого УФ-излучения с длинами волн 367 и 380 нм и выявление основных параметров, влияющих на скорость реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление фотокатализаторов
Для приготовления катализаторов и выполнения кинетических экспериментов использовали следующие реактивы: TiO2 (Evonik P25), NaOH (“Реахим”, ч. д. а.), H2PtCl6 (“Реахим”, ч.), NaBH4 (“Acros Organics”, 98%), C3H8O3 (“Вектон”, ч. д. а.), H2SO4 (“Сигма Тек”, ос. ч.). Реактивы применяли без дополнительной очистки.
Для получения прокаленного носителя TiO2 T500 навеску коммерческого диоксида титана Evonik P25 выдерживали в муфельной печи при 500°С в течении 3 ч. После охлаждения до комнатной температуры TiO2 помещали в стакан, в который затем при перемешивании добавляли необходимые для получения образца с 1 мас. % платины количества растворов H2PtCl6 (0.2 M) и боргидрида натрия (0.1 M). Полученную суспензию перемешивали в течение 60 мин при комнатной температуре. Далее фотокатализатор промывали дистиллированной водой и высушвали при 50°С. Образцу была присвоена аббревиатура 1%Pt/TiO2 T500. Для сравнения платину (1 мас. %) наносили тем же методом на необработанный диоксид титана Evonik P25. Этот образец обозначен как 1%Pt/Evonik P25.
Катализаторы были охарактеризованы методами рентгеновской дифракции, рентгеновской фотоэлектронной спектроскопии (РФЭС) и оптической электронной спектроскопии диффузного отражения (ЭСДО). Рентгенофазовый анализ (РФА) проводили на порошковом дифрактометре D8 Advance (“Bruker”, Германия) с применением излучения CuKα. Дифрактограммы записывали в диапазоне 2θ от 20° до 80°. РФЭС-исследования осуществляли на фотоэлектронном спектрометре (“SPECS Surface Nano Analysis GmbH”, Германия) с монохроматизированным излучением AlKα. Для учета эффекта зарядки образцов использовали пик Ti2p3/2 с энергией связи 459.0 эВ [5]. Спектры диффузного отражения регистрировали на спектрофотометре UV-2501 PC (“Shimadzu”, Япония), оснащенном ячейкой диффузного отражения ISR-240A.
Измерение скорости фотокаталитического выделения водорода
Активность фотокатализатора была исследована в статическом реакторе. Суспензию в реакторе, содержащую 50 мг фотокатализатора и 100 мл водного раствора глицерина, продували аргоном для удаления кислорода до начала фотокаталитической реакции. Затем суспензию облучали ультрафиолетовым излучением с длиной волны 367 нм (38 мВт/см2) либо 380 нм (71 мВт/см2) с помощью светодиодных источников излучения LED (Китай). Площадь кварцевого окна реактора составляла 22.5 см2. Количество выделяющегося водорода измеряли в течение 90 мин с помощью газового хроматографа (“Хромос”, Россия). Изменение pH суспензии производили путем добавления определенного объема (50–1000 мкл) раствора 10% H2SO4 либо навески NaOH (50–600 мг).
Кажущуюся квантовую эффективность процесса рассчитывали по следующей формуле:
(1)
$Ф\left( \% \right) = \frac{{{{W}_{0}}\left( {{{{\text{H}}}_{2}}} \right)}}{{{{N}_{{{\text{фот}}}}}}} \times 100,$Поток фотонов определяли по нижеприведенной формуле:
где N – мощность излучения, S – площадь светового пятна, ${{N}_{{{\text{фот}}}}}$ поток фотонов, $h\frac{c}{{\lambda }}$ – энергия кванта света.Поток фотонов при использовании светодиода 380 нм составил 3.1 × 10–4 Э/мин, при использовании светодиода 367 нм – 1.6 × 10–4 Э/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
Свойства фотокатализатора 1%Pt/TiO2 T500
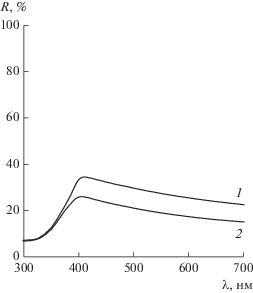
Анализ фотокатализаторов Evonik P25 и TiO2 T500 методом РФА (табл. 1, рис. 1) показал, что прокаливание при температуре 500°С не приводит к изменению фазового состава диоксида титана. Дифрактограммы фотокатализаторов приведены на рис. 1. С применением метода Ритвельда обнаружено, что оба образца содержат 84–85 мас. % анатаза и 15–16 мас. % рутила. Для изучения оптических свойств синтезированных фотокатализаторов были получены спектры диффузного отражения (рис. 2). Видно, что спектры 1%Pt/Evonik P25 и 1%Pt/TiO2 T500 практически совпадают и имеют край поглощения около 390 нм, что характерно для образцов, состоящих большей частью из анатаза. Поглощение при длине волны более 400 нм возникает за счет нанесения наночастиц платины.
Таблица 1.
Свойства фотокатализаторов TiO2 Т500 и Evonik P25
| Образец | Анатаз, $\left\langle D \right\rangle $ нм | Рутил, $\left\langle D \right\rangle $*, нм | Анатаз/рутил (мас.) | SBET, м2 г–1 | V, см3 г–1 |
|---|---|---|---|---|---|
| TiO2 Т500 | 19 | 31 | 85:15 | 52 | 0.49 |
| Evonik P25 | 19 | 30 | 85:15 | 55 | 0.48 |
Далее фотокатализаторы были исследованы методом РФЭС. Относительные концентрации (атомные соотношения) элементов в приповерхностном слое катализаторов, определенные на основании данных РФЭС, приведены в табл. 2. Спектры Ti2p содержат два узких симметричных пика, соответствующих спин-орбитальному дублету Ti2p3/2–Ti2p1/2. Энергия связи Ti2p3/2 составляет 459.0 эВ, что соответствует титану в состоянии Ti4+ в структуре TiO2. Прокаливание диоксида титана приводит к увеличению атомного соотношения [O2-]/[Ti4+] от 2.0 в образце 1%Pt/Evonik P25 до 2.3 в образце 1%Pt/TiO2 T500, что указывает на образование катионных вакансий в 1%Pt/TiO2 T500. Подробно процесс образования вакансий в процессе отжига диоксида титана в потоке воздуха был рассмотрен ранее [3].
Таблица 2.
Относительные атомные концентрации элементов в приповерхностном слое исследованных катализаторов и значения энергий связи Pt4f7/2, O1s и C1s
| Образец | [Pt]/[Ti] | [O2–]/[Ti] | Значение энергии связи, эВ | ||
|---|---|---|---|---|---|
| Pt4f7/2 | O1s | C1s | |||
| 1%Pt/Evonik P25 | 0.0148 | 2.00 | 71.0 (Pt0) | 530.2 | 285.2 |
| 1%Pt/TiO2 Т500 | 0.0171 | 2.31 | 71.1 (Pt0) | 530.0 | 285.1 |
Кинетические зависимости процесса получения водорода из водных растворов глицерина
На начальном этапе работы было проведено сравнение активности двух образцов – 1%Pt/Evonik P25 и 1%Pt/TiO2 T500 (табл. 3). Ранее было показано, что фотокаталитическое выделение водорода из водных растворов глицерина на сульфидных фотокатализаторах протекает с более высокой эффективностью в щелочной среде [2], поэтому выделение водорода осуществляли с использованием щелочных растворов глицерина (рН 12.7). Оказалось, что при облучении светом с длиной волны 367 нм прокаливание диоксида титана при температуре от 500°C не оказывает влияния на активность катализатора 1%Pt/TiO2 T500 по сравнению с непрокаленным образцом 1%Pt/Evonik P25. Более интересны результаты, полученные при использовании источника излучения с максимумом испускания при длине волны 380 нм, близкой к видимому диапазону. Установлено, что прокаливание диоксида титана Evonik P25 перед нанесением на него платины приводит к росту активности катализатора практически в два раза. Можно предположить, что увеличение активности происходит за счет образования дефектов, катионных вакансий. Недавно было показано [3], что вакансии VTi, дивакансии VTi + O и тривакансии VTi + O + Ti образуются во время термической активации диоксида титана. Будучи отрицательно заряженными, эти дефекты внутри наночастицы TiO2 могут играть роль дырочных ловушек, тем самым увеличивая время жизни электрон-дырочных пар в полупроводнике. Край поглощения обоих фотокатализаторов находится около 390 нм, таким образом, дефектная структура образца 1%Pt/TiO2 Т500 начинает играть значительную роль при облучении светом с длиной волны, близкой к этому значению.
Таблица 3.
Зависимость скорости выделения H2 на фотокатализаторах Pt/TiO2 от длины волны излучения*
| Источник излучения | Образец | W, мкмоль Н2/мин | Ф**, % |
|---|---|---|---|
| 380 нм | 1%Pt/TiO2 Т500 | 3.6 ± 0.3 | 1.16 |
| 1%Pt/Evonik P25 | 2.0 ± 0.2 | 0.65 | |
| 367 нм | 1%Pt/TiO2 Т500 | 2.6 ± 0.3 | 1.63 |
| 1%Pt/Evonik P25 | 2.8 ± 0.3 | 1.75 |
Для фотокатализаторов по формуле (1) была рассчитана квантовая эффективность. Оказалось, что данная величина для фотокатализаторов не превышает 2% для использованного излучения. Для дальнейших экспериментов был выбран светодиодный источник излучения с максимумом испускания 380 нм, поскольку такая длина волны находится ближе к диапазону видимого света, и образец 1%Pt/TiO2 Т500, обладавший наибольшей активностью при данной длине волны. В целях повышения квантовой эффективности получения водорода было решено варьировать условия проведения процесса. Для определения оптимального значения pH суспензии была проведена серия экспериментов с изменением концентрации щелочи и кислоты. Установлено, что полученная зависимость имеет куполообразный вид (рис. 3), при этом катализатор наиболее активен в отсутствии щелочи и кислоты: скорость реакции составляет 8.7 ± 0.9 мкмоль H2/мин с кажущейся квантовой эффективностью 2.8%. Добавление и щелочи, и кислоты приводит к практически линейному падению скорости.
Рис. 3.
Зависимость скорости выделения H2 на фотокатализаторе 1%Pt/TiO2 T500 от pH раствора. Условия эксперимента: С(Pt/TiO2) = 0.5 г/л; С0(глицерина) = 2.8%, V = 100 мл, t = 90 мин, λ = 380 нм.
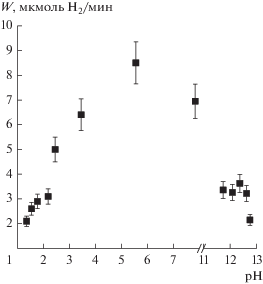
Максимальная скорость реакции достигается при рН около 6. При этом по литературным данным значение pI, потенциала изоэлектрической точки, диоксида титана имеет значение 6–7 [6, 7]. Соответственно, процесс образования водорода протекает максимально эффективно, когда поверхность фотокатализатора не заряжена. Для уточнения механизма фотокаталитического получения водорода были получены зависимости скорости процесса от концентрации субстрата при различных рН: 5.7 (без добавления щелочи либо кислоты) и 12.7 (0.05 М раствор NaOH) (рис. 4).
Рис. 4.
Зависимость скорости выделения H2 на фотокатализаторе 1%Pt/TiO2 T500 от начальной концентрации глицерина в отсутствие NaOH (1) и при C0(NaOH) = 0.05 M (2). Условия эксперимента: С(Pt/TiO2) = 0.5 г/л; V = 100 мл, t = 90 мин, λ = 380 нм.
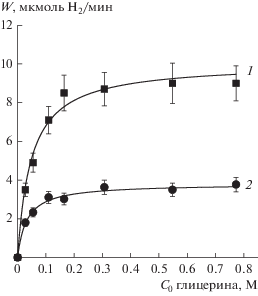
Видно, что характерной особенностью найденных зависимостей является линейный рост скорости при малых концентрациях субстрата с выходом на плато при высоких концентрациях (рис. 4). Традиционно зависимости подобного рода аппроксимируют уравнением Ленгмюра–Хиншельвуда для мономолекулярной реакции [8]:
где W0 – начальная скорость фотокаталитического выделения водорода; k – эффективная константа скорости; K – константа адсорбции молекулы реагента; С0 – начальная концентрация субстрата. В табл. 4 приведены параметры аппроксимации экспериментальных данных с использованием предложенной модели. Следует отметить, что аппроксимация экспериментальных данных с помощью уравнения (3) имеет высокую точность (R2 = 0.99).Таблица 4.
Параметры аппроксимации экспериментальных данных уравнением (3)
| Параметр | Значение | |
|---|---|---|
| без добавления NaOH | C0(NaOH) = 50 мМ | |
| K, M–1 | 21 ± 2 | 31 ± 3 |
| k, мкмоль/мин | 10.6 ± 0.8 | 3.8 ± 0.3 |
| R2 | 0.99 | 0.99 |
Известно, что первой стадией любого фотокаталитического процесса является образование электрон-дырочной пары:
где ФК – фотокатализатор, а h+ и e– – фотогенерированные электроны и дырки.Согласно предложенной модели (3) далее происходит адсорбция субстрата – глицерина – на поверхности фотокатализатора:
(III)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{\text{OH}} + {\text{Z}}\,\, + \to \\ \to {\text{ Z--C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{\text{OH}}, \\ \end{gathered} $(IV)
$\begin{gathered} {\text{Z--C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{h}}}^{ + }} \to {\text{ }} \\ \to {\text{Z--C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{\text{O}}{{{\kern 1pt} }^{\centerdot }}\,\, + {{{\text{H}}}^{ + }}, \\ \end{gathered} $(V)
$\begin{gathered} {\text{Z--C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{\text{OH}} + {\text{O}}{{{\text{H}}}^{\centerdot }} \to \\ \to {\text{ Z--C}}{{{\text{H}}}_{2}}{\text{OHCHOHC}}{{{\text{H}}}_{2}}{{{\text{O}}}^{\centerdot }} + {{{\text{H}}}_{2}}{\text{O}}, \\ \end{gathered} $(VI)
${{{\text{H}}}^{ + }} + {{{\text{e}}}^{ - }} = \raise.5ex\hbox{$\scriptstyle 1$}\kern-.1em/ \kern-.15em\lower.25ex\hbox{$\scriptstyle 2$} {{{\text{H}}}_{2}}{{.}_{{}}}$С помощью уравнения (3) ранее были описаны кинетические закономерности фотокаталитического выделения водорода из водных растворов спиртов (метанола [9], этанола [10], глицерина [11], глюкозы [12]), уксусной кислоты [13], триэтаноламина [14] и фосфорорганических соединений [15]. Подобная зависимость была получена для процесса выделения водорода из водных растворов глицерина в присутствии фотокатализатора Pt/TiO2, допированного фтором [16]. Следует отметить, что модель Ленгмюра–Хиншелвуда подразумевает одностадийное окисление адсорбированного субстрата, в то время как фотовосстановление кислородсодержащих молекул с выделением водорода включает несколько стадий [8]. Однако, исходя из соответствия экспериментальной зависимости уравнению (3), можно сделать вывод, что окисление глицерина на поверхности фотокатализатора происходит очень быстро, и лимитирующей стадией является адсорбция субстрата [17].
Аппроксимация экспериментальных данных (рис. 4, табл. 4) показала, что при рН 12.7 константа адсорбции глицерина К выше, чем в нейтральной среде, однако скорость образования водорода по уравнению (VI) резко падает с добавлением щелочи, так как константа скорости k больше при рН 5.7. Это объясняется тем, что в щелочной среде на поверхности диоксида титана присутствуют группы Ti–OH; однако при рН ~ 13 образуются анионы ${{{\text{C}}}_{3}}{{{\text{H}}}_{7}}{\text{O}}_{3}^{ - }$, которые могут конкурировать с гидроксильными группами за места на поверхности диоксида титана. Следует отметить, что максимальное значение скорости образования водорода составило 8.7 мкмоль Н2/мин или 10.4 ммоль гкат ч–1, что является очень высоким показателем для подобных систем [16, 18].
ЗАКЛЮЧЕНИЕ
Итак, в настоящей работе исследована активность фотокатализаторов на основе диоксида титана Evonik P25 с нанесенной платиной в получении водорода из водных растворов глицерина при облучении светодиодными источниками излучения с максимумом испускания при длинах волн 367 и 380 нм. Показано, что при облучении с длиной волны 380 нм, близкой к видимому диапазону, прокаливание диоксида титана Evonik P25 при 500°С перед нанесением платины приводит к росту активности фотокатализатора в два раза за счет образования дефектов – катионных вакансий. Установлено, что зависимость скорости фотокаталитического выделения водорода от концентрации субстрата подчиняется механизму Ленгмюра–Хиншельвуда, а зависимость от рН имеет куполообразный вид. Максимальная активность синтезированных фотокатализаторов в процессе получении водорода превосходит значения, описанные в литературе. Таким образом, результаты настоящей работы свидетельствуют, что создание дефектной структуры путем термической активации диоксида титана, нанесение платины и подбор условий проведения реакции позволяют получать водород с высокой эффективностью.
Список литературы
Козлова Е.А., Пармон В.Н. // Успехи химии. 2017. Т. 86. № 9. С. 870.
Lyubina T.P., Markovskaya D.V., Kozlova E.A., Parmon V.N. // Int. J. Hydrogen Energy. 2013. V. 38. P. 14173.
Kurenkova A.Y., Kremneva A.M., Saraev A.A., Murzin V., Kozlova E.A., Kaichev V.V. // Catal. Lett. 2020. DOI: 10.1007/s10562-020-03321-w.
Марковская Д.В., Козлова Е.А. // Кинетика и катализ. 2018. Т. 59. С. 685.
Kaichev V.V., Popova G.Ya., Chesalov Yu.A., Saraev A.A., Zemlyanov D.Y., Beloshapkin S.A., Knop-Gericke A., Schlögl R., Andrushkevich T.V., Bukhtiyarov V.I. // J. Catal. 2014. V. 311. P. 59.
Gumy D., Morais C., Bowen P., Pulgarin C., Giraldo S., Hajdu R., Kiwi J. // Appl. Catal. B. 2006. V. 63. P. 76.
Luo Y., Tian Y., Zhu A., Liu H., Zhou J. // J. Electroanal. Chem. 2010. V. 642. P. 109.
Puga A.V. // Coordin. Chem. Rev. 2016. V. 315. P. 1.
Lin W.C., Yang, W.D., Huang I.L., Wu T.S., Chung Z.J. // Energy Fuel. 2009. V. 23. P. 2192.
Patsoura A., Kondarides D.I., Verykios X.E. // Catal. Today. 2007. V. 124. P. 94.
Fujita S.I., Kawamori H., Honda D., Youshida H., Arai M. // Appl. Catal. B. 2016. V. 181. P. 818.
Fu X., Long J., Wang X., Leung D.Y.C., Ding Z., Wu L., Zhang Z., Li Z., Fu X. // Int. J. Hydrogen Energy. 2008. V. 33. P. 6484.
Zheng X.J., Wei Y.J., Wei L.F., Xie B., Wei M.B. // Int. J. Hydrogen Energy. 2010. V. 35. P. 117094.
Chowdhury P., Gomaa H., Ray A.K. // Chemosphere. 2015. V. 121. P. 54.
Kozlova E.A., Vorontsov A.V. // Int. J. Hydrogen Energy. 2010. V. 35. P. 7337.
Vaiano V., Lara M.A., Iervolino G., Matarangolo M., Navio J.A., Hidalgo M.C. // J. Photochem. Photobiol. A. 2018. V. 365. P. 52.
B. Ohtani // Chem. Lett. 2008. V. 37. P. 217.
López-Tenllado F.J., Hidalgo-Carrillo J., Montes V., Marinas A., Urbano F.J., Marinas J.M., Ilieva L., Tabakova T., Reid F. // Catal. Today. 2017. V. 280. P. 58.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ