Кинетика и катализ, 2020, T. 61, № 6, стр. 826-835
Синтез титанмагниевых катализаторов полимеризации пропилена: замещение кетонов на дибутилфталат
Д. К. Маслов a, Г. Д. Букатов a, *
a ФГБУН Федеральный исследовательский центр Институт катализа СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: bukatov@catalysis.ru
Поступила в редакцию 11.03.2020
После доработки 08.05.2020
Принята к публикации 08.05.2020
Аннотация
Синтезированы титанмагниевые катализаторы (ТМК) полимеризации пропилена в присутствии кетонов различного строения в качестве внутреннего донора. Мольное отношение хлорида титана к кетону в ТМК зависит от строения кетона. Состав и каталитические свойства полученных ТМК в полимеризации пропилена значительно отличаются от аналогичных характеристик ТМК, приготовленного без кетона. Синтезированы ТМК замещением кетонов на стереорегулирующий донор – дибутилфталат (ДБФ, ДБФ/Mg = 0.05 моль/моль). Показано, что кетоны замещаются на фталат, размер кристаллитов MgCl2 (~6.5 нм в направлении 110) не меняется. Данные о мольном отношении Ti/донор = 2 для разных доноров (кетон, фталат) и одних и тех же кристаллитов MgCl2 согласуются с присутствием в них преимущественно боковых граней 104. Каталитические свойства замещенных катализаторов слабо зависят от типа использованного кетона и близки к показателям для стандартного ТМК, полученного с одним фталатом (ДБФ/Mg = 0.2 моль/моль) на стадии формирования хлорида магния. Следовательно, кетоны участвуют в процессе формирования хлорида магния аналогично сложным эфирам. Последующее их замещение на фталат позволяет получать ТМК с высокими активностью и стереоспецифичностью.
ВВЕДЕНИЕ
Нанесенные титанмагниевые катализаторы (ТМК) Циглера–Натта являются практически единственными катализаторами для получения изотактического полипропилена (ПП) [1]. Они состоят из тетрахлорида титана и стереорегулирующего электронодонорного соединения (внутренний донор, internal donor, ID) на поверхности кристаллитов MgCl2 в качестве носителя [2, 3]. При полимеризации пропилена эти ТМК используются в комбинации с алюминийорганическим сокатализатором (обычно, AlEt3) и другим стереорегулирующим донором (внешний донор, обычно, алкоксисиланы). Внутренний донор обеспечивает высокую изотактичность ПП, влияет на стереорегулярность полимерных цепей и их молекулярно-массовое распределение (ММР) (см. обзор [4] и ссылки в нем).
Внутренний донор ID также участвует в формировании кристаллитов MgCl2 при синтезе катализатора [5–11]. В современных катализаторах кристаллиты MgCl2 образуются при взаимодействии магнийсодержащих соединений с TiCl4 непосредственно в процессе синтеза ТМК. С этой целью часто используются разные этоксисодержащие производные магния, например, Mg(OEt)2, MgClx(OEt)2– x, MgCl2 · nEtOH. Их взаимодействие с тетрахлоридом титана дает промежуточные продукты, в частности, этоксихлориды титана TiCl3(OEt), которые образуют молекулярные комплексы с MgCl2 и не дают полностью сформироваться кристаллитам MgCl2. Введение внутреннего донора позволяет удалить алкоксипроизводные титана и окончательно сформировать кристаллиты MgCl2 [10, 11].
Таким образом, донор, с одной стороны, контролирует стереоспецифичность катализатора и свойства ПП, а с другой стороны, участвует в синтезе кристаллитов MgCl2, обеспечивая высокую активность катализатора. В ряде случаев доноры могут обеспечить требуемые свойства ПП, но быть неэффективны при получении кристаллитов MgCl2, приводя к низкой активности катализатора. Поэтому проведение синтеза ТМК в два этапа может быть более целесообразным. Ранее [12] мы синтезировали катализаторы в два этапа. На первом этапе получали катализатор взаимодействием этоксида магния с тетрахлоридом титана в присутствии бутилацетата. Было показано, что происходило образование хлорида магния, на поверхности кристаллитов (на боковых гранях) которого были адсорбированы хлорид титана и бутилацетат. На втором этапе на уже сформированном хлориде магния бутилацетат замещали на стереорегулирующие доноры ID: фталат, 1,3-диэфир, диолдибензоат. Полученные образцы сравнивали со стандартными катализаторами, когда хлорид магния образовывался в присутствии ID. Свойства (индекс расплава, ММР) полимеров, полученных на замещенном или стандартном катализаторах с одним и тем же стереорегулирующим донором, были близки.
Представляет интерес использовать для формирования хлорида магния более простые доноры с одним атомом кислорода вместо двух (этилбензоат, простые 1,3-диэфиры) или более (фталат, диолдибензоат, сукцинат) в обычно применяемых стереорегулирующих донорах. В настоящей работе мы использовали кетоны для синтеза хлорида магния на первом этапе синтеза катализатора. На втором этапе мы замещали кетон на уже сформированном хлориде магния на дибутилфталат (как ранее замещали бутилацетат на разные ID [12]) и сравнивали полученные замещенные катализаторы со стандартным ТМК, синтезированным с одним дибутилфталатом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Гептан, дибутилфталат (ДБФ) и хлорбензол выдерживали над молекулярными ситами. Коммерческие TiCl4, пропилен и триэтилалюминий, реактивы (“Aldrich”) – дипропилкетон (ДПК), бутилизопропилкетон (БиПК), бутилфенилкетон (БФК), диизопропилкетон (ДиПК), изопропилфенилкетон (иПФК), дифенилкетон (ДФК) и магнийэтоксихлорид (МЭХ) – применяли без дополнительной очистки.
Синтез катализаторов с кетонами
Твердый МЭХ состава Mg(OEt)nCl2– n с размером частиц 25 мкм использовали готовым (приготовлен согласно [13]). Катализаторы с кетонами получали через взаимодействие МЭХ с TiCl4 в присутствии хлорбензола (TiCl4/хлорбензол = 1 об./об.). Синтез проводили в три стадии в атмосфере аргона. На первой стадии в реактор загружали TiCl4 и нагревали до 100°С, затем вводили МЭХ и через 5 мин хлорбензол (TiCl4/Mg = 13 моль/моль). Далее температуру поднимали до 110°С, добавляли кетон (К, К/Mg = 0.3 моль/моль) и выдерживали реакционную смесь при 110°С в течение часа. После остановки мешалки и осаждения твердого продукта маточный раствор декантировали. На второй стадии в реактор загружали смесь TiCl4 и хлорбензола (TiCl4/хлорбензол = 1 об./об., TiCl4/Mg = 13 моль/моль), реакционную смесь перемешивали при 110°С в течение 30 мин и после осаждения твердого продукта маточный раствор декантировали. Третья стадия повторяла вторую. Полученные катализаторы промывали 4 раза гептаном при постепенном снижении температуры: 75°С–60°С–45°С–Ткомн в общей сложности в течение 40 мин.
Синтез замещенных катализаторов
Замещенные ТМК синтезировали аналогично катализаторам с кетонами с некоторыми отличиями на первой стадии: в реактор при комнатной температуре загружали смесь TiCl4/хлорбензол (1 : 1 об./об.) и вводили ТМК (TiCl4/Mg = 13 моль/моль) с соответствующим кетоном вместо МЭХ, затем при 110°С добавляли ДБФ (ДБФ/Mg = 0.05 моль/моль). Вторую и третью стадию проводили так же, как и в синтезе ТМК с кетонами.
Синтез ТМК без донора, а также сравнительного и стандартного катализаторов
ТМК без донора получали подобно ТМК с кетонами, но без добавления кетона. Сравнительный ТМК синтезировали аналогично замещенным ТМК, но вводили ТМК без донора вместо ТМК с кетоном. Стандартный ТМК готовили так же, как и ТМК с кетонами, но с введением фталата (ДБФ/Mg = 0.2 моль/моль) вместо кетона.
Химический анализ
Содержание Ti и Mg определяли методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой на приборе Optima 4300 DV (“Perkin-Elmer”, США) из раствора катализатора в 5% H2SO4 водном растворе. Содержание этоксигрупп (в виде этанола) и неароматических доноров измеряли методом газовой хроматографии на приборе Кристалл-2000 (“Хроматэк”, Россия) с пламенно-ионизационным детектором из раствора катализатора в метилцеллозольве на капиллярной колонке Carbowax-20М (30 м × 0.32 мм) при 220°С с помощью программы NetChrom v2.0. В качестве внутреннего стандарта использовали дециловый спирт. Содержание ароматических доноров определяли методом жидкостной хроматографии на приборе LC-20 Prominence (“Shimadzu”, Япония) с УФ детектором из раствора катализатора в ацетонитриле на колонке RESTEK Pinnacle II С18 5 мкм (250 × 4.6 мм) при 40°С. Внутренним стандартом служил диметилфталат.
Рентгенофазовый анализ
Исследование ТМК методом рентгенофазового анализа (РФА) осуществляли на дифрактометре NEW D8 ADVANCE (“Bruker”, Германия) с применением CuKα-излучения (λ = 1.54184 Å) в диапазоне 2θ = 5°–75°. Размер области когерентного рассеяния (ОКР) в направлении 110 рассчитывали по формуле Шеррера по пику при 2θ = 50°.
Полимеризация пропилена
Пропилен полимеризовали в автоклаве в гептане (300 мл) при температуре 70°С и общем давлении 7 бар в течение 1 ч в присутствии водорода (1 об. % в газовой фазе). В качестве сокатализатора использовали триэтилалюминий (4 ммоль AlEt3/л), в качестве внешнего донора – циклогексилметилдиметоксисилан (CHMDMS, Al/Si = 20 моль/моль). Навеска катализатора составляла приблизительно 10 мг. Перед полимеризацией проводили предполимеризацию при 30°С и давлении пропилена 1 бар в течение 2 мин. Содержание атактического ПП (АПП) находили как долю фракции ПП, растворимой в полимеризационном гептане.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ТМК, полученные с разными кетонами в качестве внутреннего донора
В табл. 1 представлены данные о составе катализаторов, синтезированных с разными кетонами в качестве внутренних доноров. Видно, что катализаторы содержат 3.8–4.2% титана, 16.6–17.6% магния, 6.1–8.6% кетона. Полагая, что титан и магний присутствуют в катализаторах в виде хлоридов, можно оценить суммарное содержание MgCl2, TiCl4 и ID. Оно составляет от 87 до 93% для разных ТМК, что относительно близко к 100%. ТМК с разными кетонами по составу мало различаются между собой, но существенно отличаются от ТМК, полученного без донора. ТМК без донора содержит 7.8% титана и 4.2% этоксигрупп в виде побочного продукта титанирования TiCl3(OEt) [10]. Более низкое содержание титана (4%) и этоксигрупп (0.35–1.5%) в ТМК, синтезированных в присутствии кетонов, указывает, что кетоны удаляют побочный продукт TiCl3(OEt) и, тем самым, участвуют в формировании кристаллитов MgCl2 подобно сложным эфирам.
Таблица 1.
Данные о составе ТМК, полученных с разными кетонами
| Кетон | Без кетона | ДПК | БФК | ДФК | БиПК | иПФК | ДиПК |
|---|---|---|---|---|---|---|---|
| Ti, % | 7.8 | 3.6 | 3.9 | 3.8 | 4.0 | 4.1 | 4.2 |
| Mg, % | 15.2 | 17.3 | 17.6 | 16.6 | 16.5 | 16.8 | 16.9 |
| К, % | 0 | 6.4 | 8.6 | 8.2 | 5.5 | 6.1 | 4.7 |
| OEt, % | 4.2 | 1.5 | 1.5 | 0.5 | 1.5 | <0.1 | <0.1 |
| MgCl2 + TiCl4 + ID*, % | 91 | 90 | 93 | 89 | 87 | 89 | 88 |
| Ti/Mg, моль/моль | 0.26 | 0.105 | 0.112 | 0.116 | 0.123 | 0.124 | 0.126 |
| К/Mg, моль/моль | 0 | 0.078 | 0.073 | 0.066 | 0.063 | 0.060 | 0.059 |
| (Ti + К)/Mg, моль/моль | 0.26 | 0.183 | 0.185 | 0.182 | 0.186 | 0.184 | 0.185 |
| Ti/К, моль/моль | – | 1.34 | 1.53 | 1.76 | 1.95 | 2.07 | 2.16 |
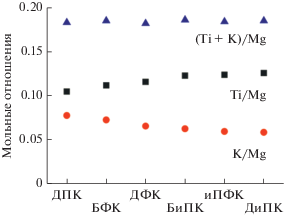
Рисунок 1 демонстрирует изменение мольных отношений Ti/Mg, К/Mg и (Ti + К)/Mg (К – кетон) в полученных катализаторах в зависимости от применяемого кетона. Кетоны на рис. 1 (и в табл. 1) расположены в ряд по мере увеличения объема (разветвления у ближайшего к кислороду углеродного атома) заместителей: пропил (бутил) < < фенил < изопропил. Видно, что в указанном ряду наблюдается тенденция к небольшому снижению мольного отношения К/Mg (с 0.078 в случае ДПК до 0.059 в случае ДиПК) при одновременном повышении мольного отношения Ti/Mg (с 0.105 до 0.126 соответственно). Как следствие, мольное отношение Ti/К в этом ряду кетонов заметно возрастает (с 1.3 до 2.2).
Отметим, что суммарное мольное отношение (Ti + К)/Mg для разных катализаторов практически не изменяется и равно 0.182–0.186. Это может указывать на то, что количество хлорных вакансий на боковых гранях образующихся кристаллитов MgCl2, на которых адсорбируются TiCl4 и донор, примерно одинаково. Предполагается, что доноры из-за большего сродства к MgCl2 по сравнению с TiCl4 адсорбируются в первую очередь. Оставшиеся доступные хлорные вакансии занимает хлорид титана. Кетоны с более объемными заместителями по стерическим причинам будут адсорбироваться менее плотно (на большем расстоянии между соседними кетонами), что дает возможность для большей адсорбции хлорида титана. Этим можно объяснить наблюдаемые тенденции изменения мольных отношений Ti/Mg, К/Mg и (Ti + К)/Mg на рис. 1.
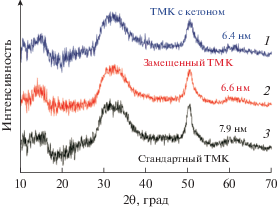
По данным РФА катализатора, полученного с ДФК (рис. 2, кривая 1), размер области когерентного рассеяния (ОКР или размер кристаллитов) MgCl2 в направлении 110 (вдоль слоя Cl–Mg–Cl) равен 6.4 нм.
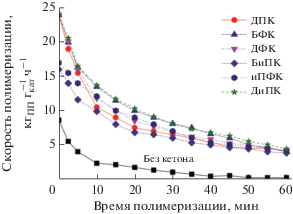
В табл. 2 и на рис. 3 (зависимость скорости полимеризации от времени) представлены результаты полимеризации пропилена на полученных катализаторах. ТМК с кетонами имеют высокую начальную скорость полимеризации (активность) (16–22 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1), которая быстро снижается в процессе полимеризации. Средняя активность равна 6.6–9.5 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1. Изотактичность получаемого ПП в случае разных кетонов составляет в основном 86–87%. Содержание атактической фракции ПП, растворимой в гептане при полимеризации, равно 10–12%.
Таблица 2.
Каталитические показатели для ТМК, полученных с разными кетонами
| Кетон | Без кетона | ДПК | БФК | ДФК | БиПК | иПФК | ДиПК |
|---|---|---|---|---|---|---|---|
| A*, кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 | 1.5 | 7.5 | 9.5 | 8.4 | 6.6 | 7.3 | 9.2 |
| A0, кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 | 7.5 | 22 | 22 | 21 | 17 | 16 | 21 |
| АПП, % | 18.2 | 12.6 | 11.2 | 11.1 | 10.1 | 10.8 | 11.5 |
| XI = 100 – XS**, % | 78.8 | 84.3 | 85.7 | 87.0 | 86.9 | 86.6 | 86.6 |
Примечание. А и А0 – средняя и начальная скорости полимеризации (активности ТМК) соответственно. *Условия полимеризации: 70°C, 1 ч, 7 бар, [H2] = 1 об. %, [AlEt3] = 4 ммоль/л, AlEt3/CHMDMS = 20. **Изотактичность ПП, определяемая как XI = 100 – XS, где XS – доля фракции ПП, растворимой в ксилоле при 23°C.
Отметим, что катализатор, синтезированный без донора, имеет низкие начальную (7.5 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) и среднюю (1.5 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) активности, а также меньшую стереоспецифичность (изотактичность ПП составляет 78.8%).
Таким образом, данные о составе и каталитических свойствах ТМК с кетонами указывают, что кетоны участвуют в формировании катализатора (кристаллитов MgCl2) и обеспечивают высокую активность ТМК.
ТМК, полученные замещением кетонов на дибутилфталат
В табл. 3 приведены сведения о составе катализаторов, синтезированных замещением кетонов на дибутилфталат при мольном отношении ДБФ/Mg = 0.05. Они содержат 2.9–3.2% титана, 16.1–17.2% магния и 6.9–8.6% ДБФ. Видно, что фталат практически полностью замещает алифатические кетоны. Содержание ароматических кетонов в составе замещенных ТМК незначительно: 0.25, 0.4 и 1.2% для иПФК, БФК и ДФК соответственно. Отличие ароматических кетонов от алифатических, по-видимому, связано с увеличением донорных свойств атома кислорода в них из-за влияния мезомерного эффекта бензольного кольца. Полагая, что титан и магний присутствуют в катализаторах в виде хлоридов, можно вычислить суммарное содержание MgCl2, TiCl4 и ID, которое составляет 85–89% для разных ТМК.
Таблица 3.
Состав стандартного, сравнительного и замещенных (для разных кетонов) ТМК
| ТМК | Замещенные | Стандарт. | Сравнит. | |||||
|---|---|---|---|---|---|---|---|---|
| Кетон | ДПК | БФК | ДФК | БиПК | иПФК | ДиПК | без кетона |
без кетона |
| ДБФ/ Mg, моль/моль | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.2 | 0.05 |
| Ti, % | 3.0 | 3.0 | 2.9 | 3.2 | 2.9 | 3.0 | 2.6 | 3.9 |
| Mg, % | 17.2 | 17.3 | 16.1 | 17.1 | 16.8 | 17.0 | 17.2 | 15.6 |
| ДБФ, % | 7.3 | 6.9 | 7.7 | 8.4 | 8.3 | 8.6 | 9.5 (1.9)* | 7.6 |
| К, % | н.о.*** | 0.4 | 1.2 | н.о. | 0.25 | н.о. | 0 | 0 |
| MgCl2 + TiCl4 + ID**, % | 87 | 88 | 85 | 89 | 87 | 87 | 90 | 85 |
| Ti/Mg, моль/моль | 0.088 | 0.088 | 0.091 | 0.095 | 0.087 | 0.089 | 0.077 | 0.13 |
| ДБФ/Mg, моль/моль | 0.037 | 0.035 | 0.042 | 0.043 | 0.043 | 0.044 | 0.059 | 0.043 |
| (Ti + 2ДБФ + К)/Mg, моль/моль | 0.162 | 0.161 | 0.185 | 0.181 | 0.175 | 0.177 | 0.195 | 0.216 |
| Ti/ДБФ, моль/моль | 2.4 | 2.5 | 2.2 | 2.2 | 2.0 | 2.0 | 1.3 | 3.0 |
По данным РФА для замещенного катализатора (рис. 2, кривая 2) размер ОКР (кристаллитов) MgCl2 в направлении 110 равен 6.6 нм, что близко к 6.4 нм для катализатора до замещения доноров (рис. 2, кривая 1). Это указывает, что сформированные в присутствии кетона кристаллиты MgCl2 сохраняются на стадии замещения доноров. Ранее аналогичные данные были получены нами при замещении бутилацетата на стереорегулирующие внутренние доноры [12].
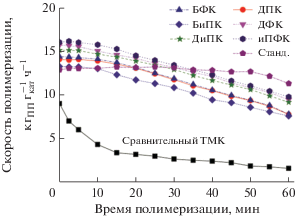
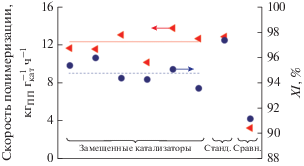
Из данных, представленных в табл. 4, видно, что активность замещенных ТМК является высокой и находится в основном в интервале 11.6–13.8 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 (10.2 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 с в случае БиПК). Они стабильнее, чем ТМК с кетонами, и демонстрируют более высокую скорость полимеризации (рис. 4 vs. рис. 3) и стереоспецифичность (0.7–1.3 vs. 10–12% АПП, изотактичность полимера 93.6–96 vs. 86–87%).
Таблица 4.
Каталитические свойства стандартного, сравнительного и замещенных (для разных кетонов) ТМК
| ТМК | Замещенные | Стандарт. | Сравнит. | |||||
|---|---|---|---|---|---|---|---|---|
| Кетон | ДПК | БФК | ДФК | БиПК | иПФК | ДиПК | без кетона |
без кетона |
| ДБФ/Mg, моль/моль | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.2 | 0.05 |
| A*, кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 | 11.7 | 11.6 | 13.1 | 10.2 | 13.8 | 12.7 | 12.9 | 3.3 |
| АПП, % | 0.7 | 0.7 | 1.0 | 0.8 | 0.7 | 1.3 | 0.4 | 3.9 |
| XI = 100 – XS**, % | 95.4 | 96.0 | 94.4 | 94.3 | 95.1 | 93.6 | 97.4 | 91.2 |
Рис. 4.
Скорость полимеризации от времени для стандартного, сравнительного и замещенных (для разных кетонов) катализаторов.
Таким образом, введение фталата с мольным отношением ДБФ/Mg = 0.05 значительно изменяет состав и каталитические свойства ТМК.
Сравнение замещенных ТМК с катализаторами, полученными с одним ДБФ
В табл. 4 для сравнения приведены данные для катализаторов, полученных по стандартной методике с одним ДБФ (без кетона) при мольном отношении ДБФ/Mg = 0.05 (сравнительный ТМК) и 0.2 (стандартный ТМК).
Сравнительный ТМК (ДБФ/Mg = 0.05) содержит в своем составе 3.9% титана, 15.6% магния и 7.6% ДБФ. Он обладает низкой активностью (3.3 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) и невысокой стереспецифичностью (изотактичность ПП равна 91.8%).
В состав стандартного ТМК (ДБФ/Mg = 0.2) входит меньше титана (2.6%) и больше фталата: 9.5% ДБФ, а также 1.4% диэтилфталата (ДЭФ) и 0.5% этилбутилфталата (ЭБФ), которые образуются при обмене между OBu- и OEt-группами из-за побочного взаимодействия ДБФ с TiCl3OEt при синтезе катализатора. Активность стандартного ТМК (12.9 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) и изотактичность полученного полимера (97.4%) являются высокими.
В табл. 5 и на рис. 5 сопоставлены данные о составе, активности и стереоспецифичности для сравнительного, стандартного и замещенных ТМК. Видно, что замещенные ТМК по составу ближе к стандартному, чем к сравнительному катализатору. Также они имеют значительно бóльшую активность и стереоспецифичность, чем сравнительный ТМК, и по этим показателям также близки к стандартному ТМК. По всей видимости, введения одного фталата в количестве ДБФ/Mg = 0.05 недостаточно для формирования кристаллитов MgCl2 и образования стереоспецифических активных центров. В то же время добавление такого же количества фталата (ДБФ/Mg = 0.05) к уже сформированному в присутствии кетонов хлориду магния позволяет получить высокоактивные и высокостереоспецифические катализаторы. Следовательно, кетоны участвуют в формировании кристаллитов MgCl2, а затем замещаются на фталат с образованием стереоспецифических активных центров. Можно заключить, что на стадии формирования кристаллитов MgCl2 кетоны действуют аналогично сложным эфирам, например, как бутилацетат [12] или фталат [10, 11].
Таблица 5.
Сравнение ТМК, приготовленных разными методами
| ТМК | Сравнительный | Замещенные | Стандартный |
|---|---|---|---|
| К/Mg, моль/моль | Без кетона | 0.3 | Без кетона |
| ДБФ/Mg, моль/моль | 0.05 | 0.05 | 0.2 |
| Ti, % | 3.9 | >2.9–3.2 | ≥2.6 |
| Mg, % | 15.6 | <16.1–17.3 | ≤17.2 |
| ДБФ, % | 7.6 | ∼6.9–8.6 | ≤9.5 |
| A, кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 | 3.3 | <10.2–13.8 | ≤12.9 |
| Изотактичность ПП (XI), % | 91.2 | <93.6–96.0 | <97.4 |
| d110, нм | н.о.* | 6.6 | <7.9 |
Рис. 5.
Каталитические свойства стандартного, сравнительного и замещенных (для разных кетонов) ТМК. Линиями показаны средние значения скорости полимеризации (сплошная) и изотактичности ПП (пунктирная) для замещенных ТМК.
В табл. 5 также приведены данные о размере ОКР (кристаллитов) MgCl2 в направлении 110, полученные методом РФА (рис. 2) для стандартного и замещенного катализаторов. Они равны 7.9 и 6.6 нм соответственно. Следовательно, при использовании кетонов на стадии формирования кристаллитов MgCl2 можно получать ТМК с кристаллитами меньшего размера, что важно для синтеза катализаторов с высокой активностью.
О распределении донора и TiCl4 на MgCl2
Известно, что хлорид титана и донор в ТМК адсорбируются на боковых гранях кристаллитов MgCl2, так как на этих гранях ионы магния имеют хлорные вакансии. Доля таких ионов магния тем выше, тем меньше размер кристаллитов MgCl2 в направлении 110 (вдоль слоя хлорида магния). Ее можно оценить исходя из состава катализатора как мольное отношение (Ti + K)/Mg. Из данных табл. 1 видно, что это отношение для различных кетонов имеет сходные значения, равные 0.182–0.186. Можно полагать, что размеры кристаллитов MgCl2, образующихся в присутствии разных кетонов, также близки.
Вместе с тем мольные отношения Ti/Mg и K/Mg зависят от используемого кетона. В частности, с увеличением объема (разветвленности) алкильных групп наблюдается некоторое снижение мольного отношения K/Mg с 0.078 до 0.059 с одновременным повышением мольного отношения Ti/Mg с 0.105 до 0.126 (рис. 1). В результате мольное отношение Ti/K, характеризующее распределение донора и хлорида титана вдоль боковой грани, возрастает в этом ряду кетонов более заметно (с 1.34 до 2.16).
Логично полагать, что кетон, имея один атом кислорода, образует комплекс с одним ионом магния. Если считать, что на боковой грани 104 (с расстоянием между ионами магния 0.36 нм) кетон по стерическим причинам в исследованных условиях не может занимать соседние ионы магния (в противном случае не было бы возможности для адсорбции TiCl4 на MgCl2), то соседние с кетоном ионы магния будет занимать TiCl4. Полагается, что TiCl4 адсорбируется на ионах магния в мономерной или димерной форме [14, 15 и ссылки в ней]. Тогда в первом случае TiCl4 и кетон на боковой грани MgCl2 будут чередоваться как …КTiКTiКTiКTi…, и мольное отношение Ti/K = 1. В случае образования димеров TiCl4 между кетонами их распределение будет …КTiTiКTiTiКTiTi…, а мольное отношение Ti/K = 2. По-видимому, с увеличением объема алкилов кетона прочность комплексов кетона с ионами магния снижается и уступает таковой для димерных комплексов TiCl4. В результате мольное отношение Ti/K будет повышаться от 1 к 2. Таким образом, наблюдаемое возрастание мольного отношения Ti/K в ряду исследуемых кетонов, по-видимому, связано с увеличением доли димеров TiCl4 по сравнению с мономерной формой TiCl4.
В замещенных катализаторах мольные отношения Ti/Mg и донор/Mg (табл. 3) ниже, чем в исходных катализаторах, синтезированных в присутствии кетонов (табл. 1). Это можно объяснить тем, что фталат образует комплексы с двумя ионами магния, а кетон – с одним ионом магния. Тогда долю ионов магния с хлорными вакансиями в случае замещенных катализаторов можно оценить как (Ti + 2ДБФ)/Mg (или (Ti + 2ДБФ + К)/Mg в случае ароматических кетонов). Из данных табл. 3 видно, что для четырех замещенных ТМК это отношение составляет 0.175–0.185, что близко к значениям (Ti + K)/Mg = 0.182–0.186 для катализаторов, полученных с кетонами (табл. 1). Для этих же замещенных ТМК мольное отношение Ti/ДБФ равно 2–2.2, что указывает на распределение димерных комплексов TiCl4 между фталатами …ДБФTiTiДБФTiTiДБФTiTi… . Отметим, что в данном случае для образования комплексов димера TiCl4 и донора требуются 4 иона магния, а не три, как при аналогичном распределении в случае кетонов. Поэтому при замещении кетонов на фталат можно ожидать снижения мольных отношений Ti/Mg и донор/Mg в пропорции 4 : 3, т.е. в 1.33 раза. Это соответствует отмеченному выше изменению содержания титана в ТМК с кетонами и в замещенных ТМК (~4 vs. ~3%). Надо полагать, что на стадии замещения кетона на фталат должна происходить полная перестройка поверхностных комплексов, включая десорбцию кетона и димеров TiCl4 между кетонами с последующей адсорбцией фталата и новых димеров TiCl4 между фталатами.
Для двух замещенных катализаторов наблюдаются более высокие значения Ti/ДБФ = 2.4–2.5 из-за пониженного мольного отношения ДБФ/Mg = 0.35–0.37 (против 0.042–0.044 для других катализаторов) (табл. 3). Возможно, в синтезах этих замещенных катализаторов было введено несколько меньшее количество фталата, что и привело к снижению значения ДБФ/Mg. Присутствия заметных остатков кетона при этом не наблюдается, по-видимому, из-за более низкой концентрации кетонов в маточном растворе: K/Mg = 0.073–0.078 (количество кетона в составе ТМК) на стадии замещения по сравнению с K/Mg = 0.3 при синтезе катализатора с кетоном. В случае использования малых количеств фталата (ДБФ/Mg ниже 0.05) ионы магния между титанами частично будут оставаться с незаполненной хлорной вакансией, т.к. фталата недостаточно, а TiCl4 не способен занимать подряд все ионы магния (на грани 104 с расстоянием Mg–Mg 0.36 нм). В результате мольное отношение Ti/донор может быть выше двух.
Отметим, что распределение TiCl4 и доноров не обсуждается применительно к боковой грани 110 MgCl2 по следующим причинам.
1. Известно, что боковая грань 110, которая содержит 4-х координированные ионы магния с двумя хлорными вакансиями, термодинамически менее стабильна, чем боковая грань 104, содержащая 5-ти координированные ионы магния с одной хлорной вакансией. В работе [6] было показано, что комплексы MgCl2 · nEtOH · mID образуют кристаллиты с углами 90° и 120° (боковые грани 110 и 104), когда в качестве ID используются этилбензоат или фталат, и кристаллиты с углами только 120° (боковая грань 110, по мнению авторов [6]), когда в качестве ID применяется 1,3-диэфир. Авторы предположили, что в последнем случае бидентатный донор 1,3-диэфир стабилизирует преимущественное образование менее стабильной боковой грани 110 по сравнению с гранью 104. В нашем случае формирование боковых граней кристаллитов MgCl2 происходит в присутствии кетона – донора с одним атомом кислорода. Поэтому, в отличие от синтеза с 1,3‑диэфиром, нет оснований ожидать преимущественного формирования нестабильной боковой грани 110.
2. Мольное отношение Ti/K = 2 для ряда ТМК, полученных с кетонами (табл. 1), указывает на распределение TiCl4 на боковой грани кристаллитов MgCl2 в виде димеров между кетонами. Согласно данным многих работ (см. [2–4] и ссылки там) на боковой грани 110 с расстоянием между ионами магния 0.63 нм образуются изолированные комплексы TiCl4. Если на этой грани рядом с комплексом TiCl4 снова может сформироваться комплекс TiCl4 (в соответствии с Ti/K = 2), то тогда возможно также появление комплексов TiCl4 в виде тримеров и более длинных цепочек. В этом случае для ТМК с большой долей боковых граней 110 мольное отношение Ti/K должно быть значительно выше 2. Если же в этих ТМК на грани 110 образуются преимущественно комплексы с кетоном (вместо комплексов с TiCl4), то Ti/K должно быть существенно ниже 2.
3. Мольное отношение Ti/ДБФ = 2 для ряда замещенных ТМК (табл. 3) также указывает на распределение TiCl4 в виде димеров между комплексами с ДБФ. На боковой грани 110 из-за большого расстояния между ионами магния (0.63 нм) комплексы ионов магния с ДБФ могут располагаться подряд и препятствовать образованию комплексов с TiCl4. Но тогда для ТМК с большой долей боковых граней 110 мольное отношение Ti/ДБФ должно быть значительно ниже, чем полученное мольное отношение Ti/ДБФ = 2 (табл. 3).
Таким образом, найденные данные о мольном отношении Ti/K = 2 и Ti/ДБФ = 2 для двух сильно отличающихся доноров и одних и тех же кристаллитов MgCl2 лучше согласуются с присутствием в синтезированных ТМК кристаллитов MgCl2 c боковыми гранями 104 и незначительной долей граней 110.
ЗАКЛЮЧЕНИЕ
Получены ТМК с разными кетонами в качестве внутреннего донора и без донора. ТМК с кетонами содержат значительно меньше титана и этокси-групп по сравнению с катализатором, приготовленным без донора. Следовательно, кетоны удаляют продукты взаимодействия магнийсодержащего соединения с TiCl4 (в частности, этоксихлориды титана) и участвуют в формировании кристаллитов хлорида магния. В синтезированных катализаторах с увеличением объема заместителей кетона (разветвления у ближайшего к кислороду углеродного атома) наблюдается небольшое снижение мольного отношения К/Mg (с 0.078 до 0.059) при одновременном увеличении мольного отношения Ti/Mg (с 0.105 до 0.126 соответственно). Как следствие, мольное отношение Ti/К в этом ряду кетонов заметно возрастает (с 1.3 до 2.2), что может быть связано с повышением доли димерных комплексов TiCl4 по сравнению с мономерными комплексами TiCl4, образующимися между кетонами на боковых гранях кристаллитов MgCl2.
При полимеризации пропилена ТМК с кетонами, если сравнивать их с ТМК без кетона, имеют высокую начальную (16–22 vs. 7.5 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) и среднюю (6.6–9.5 vs. 1.5 кгПП${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1) активность и бóльшую стереоспецифичность. Таким образом, данные о составе и каталитических свойствах ТМК с кетонами указывают, что кетоны участвуют в формировании кристаллитов MgCl2 и обеспечивают высокую активность ТМК.
Синтезированы ТМК замещением кетонов на дибутилфталат (ДБФ/Mg = 0.05 моль/моль), а также ТМК с одним фталатом: сравнительный (ДБФ/Mg = = 0.05 моль/моль) и стандартный (ДБФ/Mg = = 0.2 моль/моль). Фталат практически полностью замещает алифатические и в значительной мере ароматические кетоны. Замещенные катализаторы по составу ближе к стандартному, чем к сравнительному ТМК. Изменение мольных отношений Ti/Mg и донор/Mg на стадии замещения кетона на фталат соответствует предположению, что фталат образует комплексы с двумя ионами магния на боковой грани 104, а кетон – с одним ионом магния. Полагается, что при этом происходит полная перестройка поверхностных комплексов с десорбцией кетона и димеров TiCl4 и последующей адсорбцией фталата и новых димеров TiCl4 между фталатами. Данные о мольном отношении Ti/донор = 2 для сильно разных доноров (кетон, фталат) и одних и тех же кристаллитов MgCl2 согласуются с присутствием в них преимущественно боковых граней 104 и малой долей граней 110.
По данным РФА размер кристаллитов MgCl2 в направлении 110 при замещении кетона на фталат практически не меняется (6.4 и 6.6 нм соответственно), т.е. сформированные в присутствии кетона кристаллиты MgCl2 сохраняются на стадии замещения доноров. Эти значения меньше размера кристаллитов MgCl2 для стандартного катализатора (7.9 нм), т.е. в присутствии кетона можно получать кристаллиты MgCl2 малого размера для синтеза ТМК с высокой активностью.
Замещенные ТМК имеют значительно бóльшую активность и стереоспецифичность, чем сравнительный, и близки по составу и свойствам к стандартному ТМК. Таким образом, кетоны участвуют в формировании кристаллитов MgCl2 подобно сложным эфирам. Их замещение на ДБФ сохраняет структуру MgCl2 и позволяет получать высокоэффективные ТМК.
Список литературы
Ali S. // Catal. Rev. 2014. V. 27. P. 7.
Barbe P.C., Cecchin G., Noristi L. // Adv. Polym. Sci. 1987. V. 81. P. 1.
Albizzati E., Giannini U., Collina G., Noristi L., Resconi L. / Polypropylene Handbook. Eds. Moore E.P. Jr. Cincinnati: Hanser-Gardner. 1996. P. 11.
Taniike T., Terano M. // Adv. Polym. Sci. 2013. V. 257. P. 81.
Chadwick J.C., Morini G., Balbontin G., Camurati I., Heere J.J.R., Mingozzi I., Testoni F. // Macromol. Chem. Phys. 2001. V. 202. P. 1995.
Andoni A., Chadwick J.C., Niemantsverdriet H.J.W., Thune P.C. // J. Catal. 2008. V. 257. P. 81.
Makwana U., Singala K., Patankar R.B., Singh S., Gupta V.K. // Macromol. Chem. Phys. 2009. V. 210. P. 69.
Singh G., Kaur S., Makwana U., Patankar R.B., Gupta V.K. // J. Appl. Polym. Sci. 2012. V. 125. P. 896.
Song B.G., Ihm S. // Appl. Polym. Sci. 2014. V. 131. P. 40536.
Chumachenko N.N., Zakharov V.A., Bukatov G.D., Sergeev S.A. // Appl. Catal. A: Gen. 2014. V. 469. P. 512.
Chumachenko N.N., Zakharov V.A., Sergeev S.A., Cherepanova S.V. // Polyolefins. 2017. V. 4. P. 111.
Bukatov G.D., Maslov D.K., Sergeev S.A., Matsko M.A. // Appl. Catal. A: Gen. 2019. V. 577. P. 69.
Пaтeнт 2191196C1 PФ. 2002.
Potapov A.G., Kriventsov V.V., Kochubey D.I., Bukatov G.D., Zakharov V.A. // Macromol. Chem. Phys. 1997. V. 198. P. 3477.
Monaco G., Toto M., Guerra G., Corradini P., Cavallo L. // Macromolecules. 2000. V. 33. P. 8953.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ