Кинетика и катализ, 2021, T. 62, № 5, стр. 647-654
Математическое моделирование неизотермического пиролиза биомассы сорго на основе трехкомпонентной кинетической модели
С. Г. Заварухин a, b, *, В. А. Яковлев a
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГБОУ ВО Новосибирский государственный технический университет
630073 Новосибирск, просп. К. Маркса, 20, Россия
* E-mail: zsg@catalysis.ru
Поступила в редакцию 06.04.2021
После доработки 02.06.2021
Принята к публикации 03.06.2021
Аннотация
Методом термогравиметрии (ТГ) получены экспериментальные данные по пиролизу биомассы сорго в инертной атмосфере при скорости нагрева 3 К/мин. Проведено математическое моделирование процесса на основе трехкомпонентной кинетической модели. Согласно модели, биомасса представляется суммой трех компонент – гемицеллюлозы, целлюлозы и лигнина, пиролиз которых протекает по независимым параллельным реакциям первого порядка. Для определения кинетических параметров модели предложена поэтапная методика обработки экспериментальных данных, основанная на различии температурных диапазонов пиролиза гемицеллюлозы, целлюлозы и лигнина. Выделяя и обрабатывая соответствующие фрагменты данных ТГ, последовательно были определены кинетические параметры сначала лигнина, потом целлюлозы и затем гемицеллюлозы. Энергии активации пиролиза компонент биомассы были равны: для лигнина – 25 кДж/моль, целлюлозы – 105 кДж/моль и гемицеллюлозы – 30 кДж/моль. Расхождение между экспериментальными и расчетными данными ТГ в диапазоне температур выше 440 К составило 0.6%.
Графический реферат
ВВЕДЕНИЕ
Пиролиз биомассы рассматривается как один из способов получения альтернативных видов топлив – жидкого (бионефть), твердого (углистый остаток) и газообразного [1]. В качестве сырья для производства биотоплива опробованы более сотни различных видов биомассы [2]. Для ряда видов биомассы изучали кинетику пиролиза, используя как изотермические опыты, так и опыты с динамическим режимом по температуре, в частности, с линейной зависимостью температуры от времени [3–24]. В экспериментах измеряли динамику изменения массы образца со временем (методы ТГ и ДТГ), а в более полных исследованиях – состав газовой фазы [3, 22].
При построении кинетических моделей применяли несколько подходов. В ряде работ процесс моделировали одной реакцией со сложной кинетикой. После подбора функции, описывающей скорость реакции, определяли энергию активации и предэкспоненциальный множитель (метод Коутса–Редферна) [10, 14, 19, 20]. Другой подход основывался на представлении, что основные компоненты биомассы – гемицеллюлоза, целлюлоза и лигнин – пиролизуются независимо друг от друга по реакциям первого порядка. Модель трех независимых параллельных реакций первого порядка успешно применялась для описания кинетики пиролиза ряда видов биомассы и отходов [3, 4, 6, 8, 9, 11–13, 15, 22]. Развитие и обобщение данной модели проводили в направлении увеличения числа компонент и реакций и изменения порядков реакций [13, 16–18, 21]. В ряде работ для построения кинетических моделей использовали многостадийные механизмы и учитывали вторичные реакции разложения продуктов [5, 7, 23–25]. Обзор существующих кинетических схем и моделей приводится в [26–28].
После формулировки кинетической модели ее параметры определяют из сравнения экспериментальных и расчетных данных, решая так называемую обратную задачу химической кинетики [29]. Как правило, при этом применяют метод наименьших квадратов. При минимизации целевой функции важно задавать начальное приближение как можно ближе к решению и свести число параметров к минимуму. Трехкомпонентная кинетическая модель характеризуется девятью параметрами. В настоящей работе предлагается метод, позволяющий последовательно определять кинетические параметры за три шага, на каждом шаге по три параметра. Такой подход проще, чем нахождение минимума целевой функции одновременно по всем параметрам.
Поэтапный метод нахождения кинетических параметров применен для обработки данных по пиролизу биомассы сорго, полученных в динамическом режиме по температуре. Сорго выбрано как один из перспективных источников биомассы. Ранее пиролиз биомассы сорго рассматривали в работах [25, 30]. В [30] исследовали выход пиролизной жидкости в зависимости от температуры и времени пиролиза, а в [25] была предложена многостадийная кинетическая модель для изотермического пиролиза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы биомассы сорго были предоставлены ассоциацией EUBIA (Belgium Бельгия) в виде пеллет, представляющих собой цилиндрические гранулы диаметром 6 мм и длиной от 1 до нескольких см. Пеллеты были размолоты в мельнице, в экспериментах использовали фракцию 125–160 мкм. Элементный анализ биомассы сорго был выполнен с помощью CHNS-анализатора EA-3000 (“HEKAtech GmbH”, Германия) в Новосибирском институте органической химии СО РАН. Результаты анализа приведены в табл. 1. Влажность определяли путем сушки образца до постоянной массы при температуре 105°С в течение 4 ч (ГОСТ 24027.2-80), зольность – путем прокаливания образца в муфельной печи до постоянной массы при температуре 580°С в течение 3.5 ч (ГОСТ 11022-95). Влажность образца составила 4.6%, зольность – 4.4%.
Пиролиз проводили в кварцевом реакторе в атмосфере аргона. Расход аргона составлял 20 л/ч. Реактор был оснащен весами Мак-Бена, что позволяло измерять массу образца в зависимости от времени. Внутри реактора размещалась кварцевая корзинка, подвешенная с помощью нити к калиброванной кварцевой пружине. Коэффициент растяжения пружины равнялся 0.146 мм/мг. Растяжение пружины фиксировали с помощью катетометра с точностью 0.03 мм. Точность измерения веса образца составляла 0.2 мг.
Навеску образца весом 50 мг в начале эксперимента выдерживали в течение 15 мин в токе аргона при комнатной температуре и затем включали нагрев. Пиролиз проводили в динамическом режиме по температуре со следующими параметрами: при температуре до 170°С скорость нагрева была около 20°С/мин, при температуре выше 170°С – 3°С/мин. Эксперимент прекращали при достижении температуры в реакторе 600°С. В процессе эксперимента снимали зависимости массы образца и температуры от времени с интервалом 2 мин. По полученным данным строили кривую потери массы образца (ТГ) и дифференциальную кривую скорости изменения массы (ДТГ). Кривые ТГ и ДТГ нормировали исходной массой образца, чтобы отнормированная масса образца в начальный момент времени была равна единице. Ниже в тексте под массой образца подразумевается его отнормированная масса.
КИНЕТИЧЕСКАЯ МОДЕЛЬ
Для описания экспериментальных данных по пиролизу биомассы сорго в неизотермическом режиме использовали трехкомпонентную модель, согласно которой биомасса состоит из трех компонент – гемицеллюлозы, целлюлозы и лигнина, и пиролиз каждого компонента протекает по независимой реакции первого порядка.
Масса пиролизуемого образца m является суммой масс влаги, гемицеллюлозы, целлюлозы и лигнина
где i – номер компонента (0 – влага, 1 – гемицеллюлоза, 2 – целлюлоза, 3 – лигнин), mi – масса i-го компонента.Изменения массы гемицеллюлозы, целлюлозы и лигнина (i = 1, 2, 3) со временем описываются уравнениями
(2)
$\frac{{{\text{d}}{{m}_{i}}}}{{{\text{d}}t}} = - {{k}_{i}}\left( {{{m}_{i}} - {{r}_{i}}} \right),$Константа скорости каждой реакции представляется в аррениусовской форме
где Ai и Ei – предэкспоненциальный множитель и энергия активации i-ой реакции, R – газовая постоянная, Т – температура.Для удобства описания процесса пиролиза и обработки экспериментальных данных были введены дополнительные величины: r – углистый остаток после полного пиролиза образца и gi – изменяемая масса i-го компонента, для которых выполняются следующие соотношения
С использованием введенных величин выражение (1) и уравнения (2) записываются в виде
Для условий динамического эксперимента по температуре при постоянной скорости нагрева (T = Tн+ qt, где Tн – температура начала нагрева, q – скорость нагрева) зависимость величин gi для гемицеллюлозы, целлюлозы и лигнина от температуры подчиняются уравнениям
МЕТОДИКА ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ МОДЕЛИ
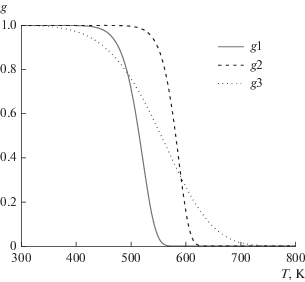
На основании литературных данных о кинетических параметрах пиролиза гемицеллюлозы, целлюлозы и лигнина [15] был проведен предварительный анализ процесса пиролиза этих компонент применительно к условиям проведенных экспериментов (q = 3 К/мин). Из работы [15] были взяты характерные кинетические параметры Ei и Аi пиролиза гемицеллюлозы, целлюлозы и лигнина (хлопок, размер частиц 250 мкм) и на основе численного решения уравнений (5) определены температуры окончания пиролиза каждого компонента Тiк. Уравнения с начальными условиями gi = 1 при T = 300 K решали методом Рунге–Кутта с переменным шагом с использованием программы Mathcad. На рис. 1 представлены зависимости величин gi от температуры.
Из рис. 1 видно, что температуры окончания пиролиза каждого компонента не совпадают, Т1к = 560 К (гемицеллюлоза), Т2к = 620 К (целлюлоза), Т3к = 720 К (лигнин). Это позволяет последовательно, обрабатывая соответствующие фрагменты ТГ, определять кинетические параметры сначала лигнина, потом целлюлозы и затем гемицеллюлозы.
В табл. 2 приведены значения кинетических параметров, используемых в численном моделировании, и рассчитанные температуры окончания пиролиза каждого компонента.
Таблица 2.
Характерные кинетические параметры пиролиза гемицеллюлозы, целлюлозы и лигнина [15] и рассчитанные значения температур окончания пиролиза этих компонент при скорости нагрева 3 К/мин
| Компонент | Аi, мин–1 | Ei, кДж/моль |
Тiк, К |
|---|---|---|---|
| Гемицеллюлоза | 4.2 × 108 | 95.1 | 560 |
| Целлюлоза | 1.2 × 1012 | 145.1 | 620 |
| Лигнин | 2.5 × 101 | 30.8 | 720 |
Алгоритм обработки экспериментальных данных сорго состоял в следующем.
При температуре выше Т2к (температура окончания пиролиза целлюлозы) изменение массы образца происходит только за счет лигнина, т. к. влага испарилась, а массы пиролизованных гемицеллюлозы и целлюлозы уже не меняются.
В этом температурном диапазоне изменение массы образца описывается уравнением
(6)
$\begin{gathered} \frac{{{\text{d}}m}}{{{\text{d}}T}} = \frac{{{\text{d}}{{g}_{3}}}}{{{\text{d}}T}} = - \frac{{{{A}_{3}}}}{q}\exp \left( { - \frac{{{{E}_{3}}}}{{RT}}} \right){{g}_{3}} = \\ = - \frac{{{{A}_{3}}}}{q}\exp \left( { - \frac{{{{E}_{3}}}}{{RT}}} \right)\left( {m - r} \right). \\ \end{gathered} $Сравнивая экспериментальные данные по массе образца в диапазоне Т > Т2к с расчетными данными, полученными путем численного решения уравнения (6), определяли кинетические параметры лигнина А3, E3 и углистый остаток r методом наименьших квадратов. При этом минимизировали следующую функцию
(7)
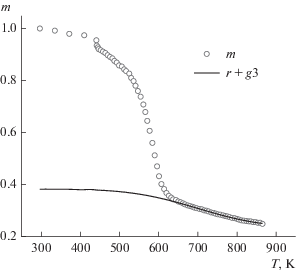
$F\left( {{{A}_{3}},~{{E}_{3}},~r} \right) = \mathop \sum \limits_j {{({{m}_{{\exp j}}} - {{m}_{{{\text{calc}}j}}})}^{2}},$Интегрируя уравнение (6) с найденными параметрами А3, E3 и r в обратном направлении по температуре от Т2к до начальной температуры Тн, равной 443 К, определяли, как меняется величина r + g3 во всем диапазоне по температуре. В частности, в начальный момент времени эта величина равна r + g3(Тн). Вычитая из нее r, находили параметр g3(Тн), равный изменению массы лигнина при полном пиролизе. На рис. 2 показаны экспериментальная зависимость массы образца m(T) и расчетная зависимость величины r + g3 от температуры.
Рис. 2.
Экспериментальная зависимость массы образца m и расчетная зависимость величины r + g3 от температуры.
Если из экспериментальных данных зависимости массы образца от температуры m(T) (3) вычесть величину r + g3, то получается остаток s3, в который лигнин уже не входит
При температуре выше Т1к (конец пиролиза гемицеллюлозы) величина s3 совпадает с g2, т. к. в этом диапазоне влаги нет, m0 = 0 и g1 = 0. Поэтому уравнение для s3 совпадает с уравнением для g2
(9)
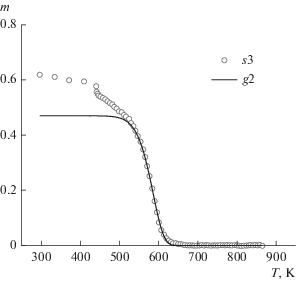
$\frac{{{\text{d}}{{g}_{2}}}}{{{\text{d}}T}} = - \frac{{{{A}_{2}}}}{q}\exp \left( { - \frac{{{{E}_{2}}}}{{RT}}} \right){{g}_{2}}.$Аналогично, сравнивая экспериментальные зависимости величины s3 от температуры в диапазоне Т > Т1к с расчетными данными, полученными путем численного решения уравнения (9), находили кинетические параметры целлюлозы А2 и E2. Далее, интегрируя уравнение (9) в обратном направлении по температуре от Т1к до Тн, определяли, как меняется величина g2 во всем диапазоне по температуре. В частности, по ее значению в начальный момент времени находили параметр g2(Тн), равный изменению массы целлюлозы при полном пиролизе. На рис. 3 показаны экспериментальная зависимость величины s3 и расчетная зависимость величины g2 от температуры.
Рис. 3.
Экспериментальная зависимость величины s3 и расчетная зависимость величины g2 от температуры.
Вычитая из s3 величину g2, получаем остаток s2 = m0 + g1, в который входят только влага и гемицеллюлоза. Обозначим температуру окончания сушки образца Т0к, которая составляет около 450 К. При Т > Т0к остаток s2 совпадает с величиной g1 и его изменение описывается уравнением
(10)
$\frac{{{\text{d}}{{g}_{1}}}}{{{\text{d}}T}} = - \frac{{{{A}_{1}}}}{q}\exp \left( { - \frac{{{{E}_{1}}}}{{RT}}} \right){{g}_{1}}.$Из сравнения экспериментальных данных в диапазоне Т > Т0к величины s2 с расчетными данными, полученными путем численного решения уравнения (10), находили кинетические параметры гемицеллюлозы A1 и E1. Интегрируя уравнение (10) в диапазоне Т0к до Тн, определяли, как меняется величина g1 во всем диапазоне по температуре и ее значение g1(Tн), равное изменению массы гемицеллюлозы при полном пиролизе. На рис. 4 показаны экспериментальная зависимость величины s2 и расчетная зависимость величины g1 от температуры.
Рис. 4.
Экспериментальная зависимость величины s2 и расчетная зависимость величины g1 от температуры.
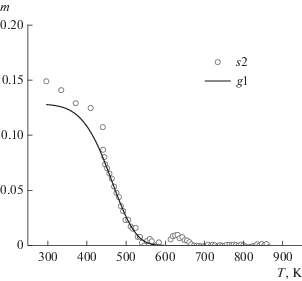
Если из остатка s2 вычесть величину g1, то получим остаток s1, в который входит только влага. По значению остатка s1 при начальной температуре находили расчетное влагосодержание исходного образца.
Таким образом, обработка экспериментальных данных по данной методике позволяет вычислять кинетические параметры Ai, Ei пиролиза трех компонент–лигнина, целлюлозы и гемицеллюлозы, входящих в состав биомассы сорго, изменяемые массы компонент в начальный момент gi(Tн), массу углистого остатка всего образца при полном пиролизе, а также расчетное влагосодержание исходного образца.
После определения всех параметров и расчета зависимости массы образца от времени различие между экспериментальными и расчетными данными оценивали с помощью следующего критерия:
где суммы взяты по экспериментальным точкам с температурой выше 450 К, при которой считалось, что влага уже испарилась.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальные данные ТГ по пиролизу биомассы сорго были обработаны по предложенной выше методике. Было получено: углистый остаток после полного пиролиза образца r равен 0.235, влажность исходного образца – 0.021. Значения параметров Ai, Ei, gi(Tн) и Tiк приведены в табл. 3.
Таблица 3.
Значения параметров модели
| Компонент | Аi, мин–1 |
Ei, кДж/моль |
gi(Tн) | Tiк, K |
|---|---|---|---|---|
| Гемицеллюлоза | 1.254 × 102 | 30.27 | 0.128 | 547 |
| Целлюлоза | 2.587 × 108 | 105.2 | 0.470 | 674 |
| Лигнин | 1.459 | 25.42 | 0.146 | 865 |
С использованием полученных значений параметров модели была рассчитана зависимость массы образца от температуры на основе зависимости (3) и уравнений (5). На рис. 5 приводится сравнение расчетных и экспериментальных данных. Расхождение между ними наблюдается в диапазоне температур ниже 440 К, в котором происходит сушка образца от влаги. Различие между измеренной влажностью (4.6%) и расчетной (2.1%), по-видимому, связано с частичным разложением лигнина при температуре ниже 440 К.
Рис. 5.
Сравнение расчетных (линия) и экспериментальных (точки) данных зависимости массы образца от температуры.
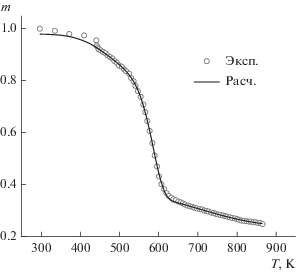
Для диапазона температур выше 440 К значение критерия δ (11) составляет 0.6%.
На рис. 6 приводится сравнение расчетных и экспериментальных данных ДТГ (–dm/dT).
Рис. 6.
Сравнение расчетных (линия) и экспериментальных (точки) данных зависимости производной массы образца по температуре от температуры.
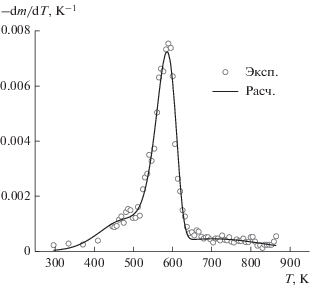
Сравнивая энергии активации компонент (табл. 3) с аналогичными характерными энергиями из [15] (табл. 2), можно заметить, что в настоящей работе они ниже для гемицеллюлозы и целлюлозы. По-видимому, это объясняется наличием в образцах сорго микропримесей соединений K, Na, Fe и Ca, выступающих в роли катализаторов пиролиза лигноцеллюлозного сырья. О влиянии минеральных микропримесей в качестве катализаторов на процесс пиролиза сообщалось в [6, 31 ]. Возможно, также на процесс пиролиза компонент биомассы накладывается вторичная реакция пиролиза углистого остатка с низкой энергией активации, что приводит к уменьшению наблюдаемой энергии активации пиролиза компонент.
Предложенная методика определения параметров трехкомпонентной модели может быть полезной при обработке данных по неизотермическому пиролизу других видов биомассы.
ЗАКЛЮЧЕНИЕ
Получены экспериментальные данные по пиролизу биомассы сорго в инертной атмосфере для динамического режима по температуре при скорости нагрева 3 К/мин с использованием метода TГ. Проведено математическое моделирование процесса на основе трехкомпонентной кинетической модели. Согласно модели, биомасса представляется суммой трех компонент – гемицеллюлозы, целлюлозы и лигнина, пиролиз которых протекает по независимым параллельным реакциям первого порядка. Для определения кинетических параметров модели предложена методика обработки экспериментальных данных, основанная на различии температурных диапазонов пиролиза гемицеллюлозы, целлюлозы и лигнина. Выделяя и обрабатывая соответствующие фрагменты данных ТГ, последовательно определяли кинетические параметры сначала лигнина, потом целлюлозы и затем гемицеллюлозы. Энергии активации пиролиза компонент биомассы составили: для лигнина – 25 кДж/моль, целлюлозы – 105 кДж/моль и гемицеллюлозы – 30 кДж/моль. Предложенная методика позволяет определять также расчетное влагосодержание образца, углистый остаток и изменение масс компонент при полном пиролизе. Расхождение между экспериментальными и расчетными данными ТГ в диапазоне температур выше 440 К составило 0.6%.
Список литературы
Biomass Conversion Processes for Energy and Fuels. Edited by S.S. Sofer and O.R. Zaborsky. Plenum Press, N.Y. and London, 1981. P. 420.
Yaman S. // Energy Convers. Manage. 2004. V. 45. P. 651.
Gonzalez J.F., Encinar J.M., Canito J.L., Sabio E., Chacon M.J. // Anal. Appl. Pyrolysis. 2003. V. 67. P. 165.
Caballero J.A., Conesa J.A., Font R., Marcilla A. // J. Anal. Appl. Pyrolysis. 1997. V. 42. P. 159.
Miller R.S., Bellan J. // Combust. Sci. Technol. 1997. V. 126. P. 97.
Teng H., Wei Y.C. // Ind. Eng. Chem. Res. 1998. V. 37. P. 3806.
Lanzetta M., Di Blasi C. // J. Anal. Appl. Pyrolysis. 1998. V. 44. P. 181.
Orfao J.J.M., Antunes F.J.A., Figueiredo J.L. // Fuel. 1999. V. 78. P. 349.
Helsen L., Van den Bulck E. // J. Anal. Appl. Pyrolysis. 2000. V. 53. P. 51.
Guo J., Lua A.C. // J. Therm. Anal. Calorim. 2000. V. 59. P. 763.
Sorum L., Gronli M.G., Hustad J.E. // Fuel. 2001. V. 80. P. 1217.
Garsia-Perez M., Chaala A., Yang J., Roy C. // Fuel. 2001. V. 80. P. 1245.
Gronli M.G., Varhegyi G., Di Blasi C. // Ind. Eng. Chem. Res. 2002. V. 41. P. 4201.
Vlaev L.T., Markovska I.G., Lyubchev L.A. // Thermochim. Acta. 2003. V. 406. P. 1.
Vamvuka D., Karakas E., Kastanaki E., Grammelis P. // Fuel. 2003. V. 82. P. 1949.
Manya J.J., Velo E., Puigjaner L. // Ind. Eng. Chem. Res. 2003. V. 42. P. 434.
Gomez C.J., Manya J.J., Velo E., Puigjaner L. // Ind. Eng. Chem. Res. 2004. V. 43. P. 901.
Meszaros E., Varhegyi G., Jakab E., Marosvolgyi B. // Energy Fuels. 2004. V. 18. P. 497.
Capart R., Khesami L., Burnham A.K. // Thermochim. Acta. 2004. V. 417. P. 79.
Фетисова О.Ю., Микова Н.М., Таран О.П. // Кинетика и катализ. 2020. Т. 61. № 6. С. 804.
Gomez C.J., Varhegyi G., Puigjaner L. // Ind. Eng. Chem. Res. 2005. V. 44. P. 6650.
Radmanesh R., Courbariaux Y., Chaouki J., Guy C. // Fuel. 2006. V. 85. P. 1211.
Molto J., Font R., Conesa J.A., Martin-Gullon I. // J. Anal. Appl. Pyrolysis. 2006. V. 76. P. 124.
Miranda R., Sosa Blanco C., Bustos-Martinez D., Vasile C. // J. Anal. Appl. Pyrolysis. 2007. V. 80. P. 489.
Заварухин С.Г., Стрельцов И.А., Яковлев В.А. // Кинетика и катализ. 2011. Т. 52. № 4. С. 510.
Conesa J.A., Marcilla A., Caballero J.A., Font R. // J. Anal. Appl. Pyrolysis. 2001. V. 58–59. P. 617.
Di Blasi C. // Prog. Energy Combust. Sci. 2008. V. 34. P. 47.
Sharma A., Pareek V., Zhang D. // Renew. Sust. Energ. Rev. 2015. V. 50. P. 1081.
Кольцов Н.И. // Кинетика и катализ. 2020. Т. 61. № 6. С. 783.
Piskorz J., Majerski P., Radlein D., Scott D.S., Bridgwater A.V. // J. Anal. Appl. Pyrolysis. 1998. V. 46. P. 15.
Antal M.J., Varhegyi G. // Ind. Eng. Chem. Res. 1995. V. 34. P. 703.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ