Кинетика и катализ, 2021, T. 62, № 6, стр. 773-781
Pt/Ce0.75Zr0.25O2 – x-катализаторы паровой конверсии СО: морфология и каталитические свойства
А. М. Горлова a, b, *, П. А. Симонов a, О. А. Стонкус a, В. П. Пахарукова a, b, П. В. Снытников a, Д. И. Потемкин a, b
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГАОУ ВО Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: gorlova@catalysis.ru
Поступила в редакцию 25.06.2021
После доработки 28.07.2021
Принята к публикации 01.08.2021
Аннотация
Методом сорбционно-гидролитического осаждения приготовлены высокодисперсные катализаторы
1.9 вес. % Pt/Ce0.75Zr0.25O2– x и 5 вес. % Pt/Ce0.75Zr0.25O2-x со средним размером частиц 0.9 нм. Показано, что катализаторы активны в реакции паровой
конверсии СО в смеси, имитирующей синтез-газ, получаемый паровой конверсией природного
газа. При начальной концентрации СО 10 об. % и объемной скорости 30000 нсм3${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 концентрация СО на выходе из реактора для 1.9 вес. % Pt/Ce0.75Zr0.25O2– x составляет 2.5 об. % при 325°С и концентрации метана на выходе 0.01 об. %, а для
5 вес. % Pt/Ce0.75Zr0.25O2– x – 1.5 об. % при 300°С и концентрации метана на выходе 0.075 об. %. Наблюдаемые порядки
реакции паровой конверсии СО по СО и H2O в присутствии 5 вес. % Pt/Ce0.75Zr0.25O2– x оказались близки к нулю, а наблюдаемая энергия активации для обоих катализаторов
составила 86 кДж/моль. Исследование катализаторов методом просвечивающей электронной
микроскопии показало, что узкое распределение по размерам и высокая дисперсность нанесенных
частиц сохраняются в ходе реакции. Однако происходит некоторое укрупнение частиц Pt,
средний размер увеличивается до 1.4 и 1.6 нм для образцов, содержащих 1.9 и 5 вес.
% Pt соответственно. Для катализаторов после реакции наблюдаются существенные различия
в величинах площади поверхности металлической Pt, определяемой хемосорбцией СО и микроскопически.
По всей видимости, они связаны с нахождением части поверхностных атомов Pt в окисленном
состоянии. Показано, что температурные зависимости удельной каталитической активности
в паровой конверсии СО, отнесенной к длине границы металл–носитель, совпадают для
катализаторов 1.9 вес. % Pt/Ce0.75Zr0.25O2– x и 5 вес. % Pt/Ce0.75Zr0.25O2– x. На основании этого сделано предположение о ведущей роли границы Pt–Ce0.75Zr0.25O2– x в катализе реакции паровой конверсии СО.
Графический
реферат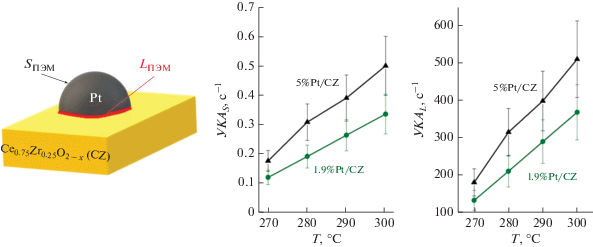
ВВЕДЕНИЕ
Запрос мирового сообщества на “чистую” энергетику, минимизирующую выбросы парниковых и токсичных газов в атмосферу, стимулирует развитие водородной энергетики, которая считается одной из основных альтернатив традиционным подходам. В частности, водород предлагается использовать для питания низкотемпературных топливных элементов с протонобменной мембраной (ПОМТЭ), в которых электроэнергия вырабатывается посредством его электрохимического окисления кислородом из воздуха. Такие топливные элементы могут функционировать как в стационарном режиме, так и на борту различных портативных систем [1].
Однако ПОМТЭ требовательны к чистоте подаваемого водорода, в частности, максимальное допустимое содержание примеси СО составляет 10 ppm [2]. С другой стороны, процессы производства чистого водорода из воды (электролиз, фотолиз) на данный момент характеризуются низкой эффективностью и жесткими требованиями к чистоте воды. Поэтому в качестве основного подхода рассматривается получение водорода из синтез-газа (смесь СО и Н2), который является продуктом реакции паровой конверсии метана или газификации биомассы [3].
Процесс удаления СО из синтез-газа традиционно включает две стадии [4]. Первая – паровая конверсия (ПК СО) [5], которая позволяет снизить содержание монооксида углерода до ~0.5 об. %. Затем оставшийся СО превращается в СО2 или СН4 посредством избирательного окисления [6, 7] или метанирования [8] соответственно. Поскольку, с одной стороны, протекание ПК СО термодинамически невыгодно при высоких температурах ввиду экзотермичности реакции (${{\Delta }_{r}}H_{{298}}^{^\circ }$ = –41.2 кДж/моль [9]), а с другой – скорость реакции увеличивается с ростом температуры, в промышленности ПК СО проводят в двух последовательно соединенных реакторах [10]: в первом при температурах 350–500°С реакция идет на железо-хромовом оксидном катализаторе, после чего смесь охлаждается и переходит во второй реактор, где при температурах 150–350°С остаток СО (~3 об. %) окисляется на медно-цинковом оксидном катализаторе. Однако такая система недостаточно легка и компактна для портативного использования; кроме того, применяемые катализаторы требуют длительной активации в реакционной смеси, в результате которой они становятся пирофорными [11]. Поэтому актуальна задача разработки катализаторов, позволяющих проводить ПК СО в одну стадию при относительно низких температурах с высокой эффективностью.
В ходе многочисленных исследований было показано, что наиболее активны в ПК СО каталитические системы на основе оксидов с высокой кислородной подвижностью, в частности, оксида церия (СеО2), в том числе допированного различными металлами (Zr, La, Y) [9]. Обнаружено, что причиной активности таких катализаторов является участие поверхности оксида в каталитическом цикле. В качестве нанесенного активного компонента чаще всего выступают благородные металлы – Pt или Au [12]. Несмотря на большое число публикаций, посвященных Pt-содержащим церий-оксидным системам для низкотемпературной паровой конверсии СО, единого представления о природе активных центров в катализаторах такого типа до сих пор нет. В недавней работе [13] на основании данных, полученных методами ex situ и in situ просвечивающей электронной микроскопии (ПЭМ), а также ИК-спектроскопии диффузного отражения (ИКДО) и рентгеновской фотоэлектронной спектроскопии (РФЭС) при давлениях, близких к атмосферному, был сделан вывод о протекании реакции на границе “платина–носитель”, в частности, на центрах типа Pt0–кислородная вакансия–Се3+. Ранее подобные предположения были высказаны в ряде других исследований [14–16]. В большинстве работ, посвященных системам типа Pt/CeO2 в низкотемпературной паровой конверсии СО, используются модельные разбавленные смеси, содержащие только СО и Н2О. В то же время на практике в реакционной смеси находятся в больших количествах Н2 и СО2, которые, будучи продуктами реакции, оказывают влияние на ее кинетические и термодинамические параметры. Кроме того, присутствие водорода в исходной смеси может способствовать протеканию побочной реакции метанирования оксидов углерода; следовательно, селективность наряду с активностью катализатора становится важным показателем. Таким образом, исследования кинетики и механизма реакции низкотемпературной паровой конверсии СО на Pt/CeO2, особенно в “реальных” смесях, по-прежнему актуальны.
Если ключевую роль в активности Pt/CeO2 катализаторов в ПК СО играет граница Pt–носитель, то для достижения максимальной активности катализатора необходимо обеспечить максимальную дисперсность наночастиц Pt при ее достаточно высоком содержании в катализаторе. Одним из методов приготовления, позволяющих этого добиться, является сорбционно-гидролитическое осаждение [17, 18]. Оно основано на медленной кинетике лигандного обмена в щелочных растворах хлоридных комплексов платиновых металлов. Это дает возможность подобрать необходимые концентрации хлоридов металлов, осадителя (Na2CO3) и температуру для получения метастабильного раствора, в котором гомогенное осаждение гидроксидов платиновых металлов не происходит по кинетическим причинам. Однако при внесении в раствор носителя начинается осаждение частиц гидроксидов металлов в порах носителя по механизму гетерогенного зародышеобразования.
Цель настоящей работы – выяснение локализации протекания реакции низкотемпературной паровой конверсии СО на катализаторах Pt/Ce0.75Zr0.25O2– x, полученных сорбционно-гидролитическим осаждением, а также определения влияния содержания платины в катализаторе на его активность в смеси, имитирующей получаемый паровой конверсией природного газа синтез-газ, и концентрацию метана на выходе из реактора. Кроме того, в работе представлены результаты исследования морфологии катализаторов методами просвечивающей электронной микроскопии и хемосорбции СО; из экспериментальных данных рассчитаны наблюдаемая энергия активации и порядки реакции по СО и Н2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление образцов
Образцы Pt/Ce0.75Zr0.25O2– x, содержащие 1.9 и 5 вес. % Pt (далее 1.9Pt/CZ и 5Pt/CZ соответственно), были приготовлены методом сорбционно-гидролитического осаждения [18]. Свежеприготовленный водный раствор K2[PtCl4] + Na2CO3 (Na : Cl = 1.1 : 2 моль/моль) по каплям при перемешивании добавляли к суспензии Ce0.75Zr0.25O2– x (ООО “Экоальянс”) в воде. Перемешивали в течение 20 мин при комнатной температуре, затем 30 мин (1.9Pt/CZ) или 90 мин (5Pt/CZ) при 80°С. Раствор от порошка отделяли фильтрованием, промывали, высушивали, выдерживали по 10 мин в токе N2 при 80 и 100°С, затем восстанавливали в Н2 по 10 мин при 100, 150 и 200°С и в течение 30 мин при 250°С. Результаты элементного анализа полученных образцов показали соответствие содержания платины заданному.
При приготовлении образца 1.9 вес. % Pt/SiO2 (1.9Pt/SiO2) к навеске K2[PtCl4] добавляли водный раствор NH3 (NH3 : Pt = 40 : 1 моль/моль), выпавший зеленый осадок (соль Магнуса) растворяли нагреванием до кипения, периодически вливая воду и раствор NH3. После растворения осадка приливали небольшое количество раствора NH3, после чего добавляли SiO2 (SБЭТ = 110 м2/г). Перемешивали в течение 15 мин при комнатной температуре, затем 15 мин при 70°С. Далее образец тщательно промывали холодной водой, сушили, прокаливали в N2 по 10 мин при 100, 150, 200 и 250°С, затем восстанавливали в Н2 при 250°С в течение 30 мин.
Исследование каталитической активности
Каталитическую активность образцов в реакции паровой конверсии СО определяли в трубчатом кварцевом U-образном проточном реакторе (внутренний диаметр – 3 мм) при атмосферном давлении в диапазоне температур 250–325°С. Состав реакционной смеси на входе в реактор (с точностью ±1 отн. %): 5–15 об. % СО, 15 об. % СО2, 15–45 об. % Н2О, 40–50 об. % Н2, Ar – баланс. Размер гранул катализатора составлял 0.2–0.5 мм. Контроль температуры осуществляли с помощью термопары, помещенной в центр слоя катализатора. В экспериментах по измерению зависимости конверсии СО от температуры загрузка катализатора была 125 мг, объемная скорость – 30 000 нсм3${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1. В экспериментах по определению удельной каталитической активности загрузку катализатора и объемную скорость подбирали так, чтобы в заданном температурном диапазоне конверсия СО не превышала 50%. Водяной пар подавали с помощью сатуратора, газовые линии обогревали и до, и после реактора. Стоит отметить, что использование сатуратора позволило обеспечить стабильность концентрации водяного пара в течение эксперимента, отклонение от заданного значения составляло ±1 отн. %. Состав смеси до и после реактора определяли при помощи газового хроматографа ХРОМОС ГХ-1100 (“ХРОМОС”, Россия), оснащенного детектором по теплопроводности (колонка – молекулярные сита CaA) и пламенно-ионизационным детектором (колонка PorapakQ) с метанатором с чувствительностью по СО, СН4 и СО2 ~ 1 ppm. Разделение на колонке СО, СН4 и СО2 с последующим метанированием оксидов углерода позволяет анализировать все эти соединения на пламенно-ионизационном детекторе.
Перед проведением измерений активности катализаторы выдерживали 5 ч в реакционной смеси при 300°С, чтобы добиться стационарности каталитических характеристик. Протекание реакции ПК СО характеризовали конверсией СО (ХСО), которую рассчитывали из экспериментальных данных согласно уравнению:
где [CO]вх – входная концентрация СО, [CO]вых – концентрация СО на выходе из реактора. В приведенной формуле не учитывается изменение объема смеси и расход СО в ходе побочной реакции метанирования, поскольку концентрация СН4 на выходе из реактора во всех экспериментах была незначительной (<0.08 об. %).Исследование катализаторов физико-химическими методами
Полученные катализаторы были исследованы на просвечивающем электронном микроскопе (ПЭМ) Themis Z (“Thermo Fisher Scientific”, Нидерланды) с двухкорректорной системой регуляции астигматизма при ускоряющем напряжении 200 кВ. Образцы препарировали на медные сетки диаметром 3 мм, покрытые углеродной пленкой с сетью отверстий. Спиртовые суспензии образцов диспергировали ультразвуком частотой 35 кГц и наносили на подложки.
Расчет площади поверхности платины и длины границы Pt–CZ из данных ПЭМ для катализаторов после реакции производили по следующим формулам c учетом приближения, что частицы платины на поверхности носителя имеют форму полусферы:
Поверхность и средний размер частиц платины в нанесенных катализаторах определяли методом импульсной адсорбции СО (хемосорбция СО). Образец помещали в реактор, в котором восстанавливали катализатор в токе Н2 при 350°С в течение 30 мин. Затем снижали температуру до 20°С и импульсами подавали заданное количество монооксида углерода, отслеживая момент его появления на выходе из реактора. Из этих данных находили количество адсорбированного СО и дисперсность платины. Размер частиц рассчитывали исходя из данных об общей поверхности металла и с учетом предположений, что весовое содержание платины в образце равно заданному и что на один поверхностный атом металла адсорбируется одна молекула СО [19]. Носитель Се0.75Zr0.25O2– x не поглощает СО при 20°С, поэтому хемосорбция СО на нанесенных катализаторах происходит только на металле. Ошибка определения дисперсности составляла 10 отн. %. Средний размер частиц и площадь поверхности платины определяли из полученных данных по формулам:
где dPt,адс – средний размер частиц платины по данным хемосорбции СО (м), nS – поверхностная концентрация атомов платины (штук/м2), М = = 195.08 г/моль – атомный вес платины, NA– число Авогадро, Sадс – удельная поверхность платины (м2/гPt), D – дисперсность, определяемая из данных хемосорбции СО.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Приготовленные катализаторы продемонстрировали высокую активность в ПК СО (рис. 1). Видно, что в присутствии 1.9Pt/CZ равновесная конверсия СО достигается при 325°С, а в присутствии 5Pt/CZ – около 300°С. Для сравнения, в работе [20] равновесные значения конверсии СО наблюдаются при температурах выше 360°С (~70%) и объемной скорости 40000 нсм3${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 для катализатора 1 вес. % Pt/CeO2, а в исследовании [21] при объемной скорости 6000 нсм3${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 для 2.13 вес. % Pt/Fe2O3–CeO2–Al2O3 значение конверсии СО достигает равновесного (~90%) при 280°С; в обоих случаях состав смеси был близок к используемому в настоящей работе.
Рис. 1.
Зависимости конверсии СО (сплошные линии) и концентрации СН4 (пунктирные линии) от температуры в реакции ПК СО. Состав смеси (об. %): 10 СО, 15 СО2, 30 Н2О, 45 Н2.

Также представлены данные для 1.9 вес. % Pt/SiO2 (1.9Pt/SiO2), который в аналогичных условиях продемонстрировал низкую активность. Поскольку реакцию проводили в условиях, допускающих метанирование оксидов углерода, важно отметить, что для исследуемых катализаторов наблюдаемая концентрация метана на выходе из реактора не превышала 0.1 об. %. Таким образом, можно утверждать, что полученные катализаторы обладают высокой селективностью.
Исследовано влияние концентраций СО и Н2О на скорость ПК СО на катализаторе 5Pt/CZ. Наблюдаемые порядки реакции по СО и Н2О составили 0.13 и 0.1 соответственно, то есть были близки к нулю. Эти результаты хорошо соотносятся с данными из других работ для схожих по составу систем [22]. Таким образом, для изученных катализаторов скорость реакции слабо зависит от исходных концентраций реагентов.
Данные просвечивающей электронной микроскопии для катализаторов до реакции показывают (рис. 2а, 2б), что оба образца характеризуются равномерным распределением частиц платины по поверхности носителя и их высокой дисперсностью (ввиду отсутствия значительных различий микрофотографии приведены только для 5Pt/CZ). Наблюдается уплощение частиц платины относительно стандартной полусферической формы (рис. 2д), что является проявлением сильного взаимодействия металл–носитель.
Рис. 2.
Микрофотографии ПЭМ образца 5Pt/CZ: а, б – исходный, в–д – после ПК СО, е – карта распределения элементов для изображения (в).

По микрофотографиям образцов после реакции (рис. 2в–2е) видно, что равномерное распределение частиц по поверхности, также как и их высокая дисперсность, сохраняются. Заметной агрегации частиц металла и следов углерода на поверхности катализаторов не отмечается. Оба катализатора характеризуются достаточно узким распределением по размерам нанесенных частиц как в исходном виде, так и после реакции (рис. 3).
Рис. 3.
Гистограммы распределений по размерам нанесенных частиц платины в катализаторах Pt/CZ до и после реакции ПК СО.
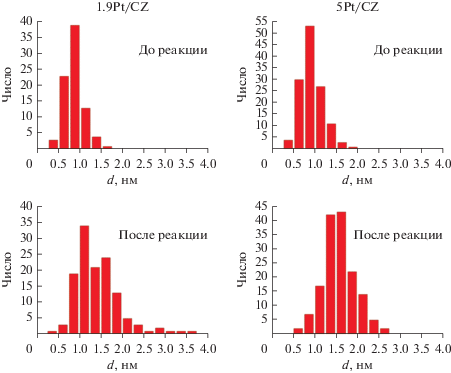
Средний размер частиц платины на поверхности носителя был определен с использованием данных ПЭМ и хемосорбции СО. Результаты приведены в табл. 1. Фиксируется укрупнение частиц металла после реакции, однако наблюдается значительное различие между данными этих двух методов. Размеры частиц как до, так и после реакции, рассчитанные по результатам хемосорбции СО, оказываются в несколько раз больше по сравнению с теми, что были определены с помощью ПЭМ. Кроме того, хемосорбция СО также демонстрирует более значительное увеличение размера частиц в ходе реакции. Вероятно, такое несоответствие связано с тем, что часть платины, детектируемой ПЭМ, оказывается недоступной для хемосорбции СО и, следовательно, для катализа. Несмотря на сопоставимую дисперсность частиц платины в 1.9Pt/SiO2, катализатор проявляет низкую активность в ПК СО, что говорит об инертности SiO2 в этой реакции и подтверждает выводы о важности роли носителя в каталитическом цикле.
Таблица 1.
Средний размер частиц Pt в образцах xPt/CZ (x = 1.9, 5) и 1.9Pt/SiO2 до и после проведения реакции
| Образец | ПЭМ | Хемосорбция СО | ||
|---|---|---|---|---|
| dдо, нм | dпосле, нм | dдо, нм | dпосле, нм | |
| 1.9Pt/CZ | 0.9 ± 0.2 | 1.4 ± 0.5 | 3.2 ± 0.3 | 15 ± 1 |
| 5Pt/CZ | 0.9 ± 0.3 | 1.6 ± 0.4 | 1.9 ± 0.2 | 7.9 ± 0.8 |
| 1.9Pt/SiO2 | – | 1.7 ± 0.3 | 1.6 ± 0.3 | – |
С учетом представленных данных можно утверждать, что метод приготовления катализаторов, использованный в данной работе, несмотря на простоту, позволяет воспроизводимо получать на поверхности носителя высокодисперсные и относительно стабильные частицы с узким распределением по размеру.
Поскольку вопрос о природе активных центров в платиновых церий-оксидных катализаторах ПК СО остается дискуссионным, в настоящей работе удельная каталитическая активность была вычислена исходя из двух предположений: 1) в реакции задействована вся поверхность платины (УКАS); 2) реакция протекает на границе контакта Pt–CZ (УКАL). Таким образом, для расчетов использовали данные об удельной поверхности платины и длине границы Pt–CZ в катализаторах после реакции. Отметим, что слабая зависимость скорости ПК СО от концентраций СО и Н2О позволила применять для расчета УКА точки, в которых конверсия СО не превышала 50%. Важно отметить, что для вычисления УКАL (рис. 4а) использовали данные ПЭМ, поскольку из данных хемосорбции СО оценить длину границы Pt–CZ затруднительно. С другой стороны, хемосорбция СО дает более корректную оценку доступной поверхности платины, поэтому из двух пар кривых на графике УКАS-T (рис. 4б) более достоверной, скорее всего, является именно пара, полученная из данных этого метода. Напомним, что, согласно правилу Борескова о постоянстве удельной каталитической активности, в идеальном случае профили УКА для двух катализаторов должны совпадать, если в расчет берутся истинные активные центры. Размеры частиц Pt для катализаторов 1.9Pt/CZ и 5Pt/CZ близки, поэтому возможный размерный эффект не должен оказывать существенного влияния на УКА.
Рис. 4.
Температурная зависимость удельной каталитической активности: а – на единицу поверхности платины; б – на единицу длины границы Pt–CZ. Состав смеси (об. %): 10 СО, 15 СО2, 30 Н2О, 45 Н2. Загрузка катализатора: 150 мг (1.9Pt/CZ), 75 мг (5Pt/CZ); объемная скорость: 60000 (1.9Pt/CZ) или 200 000 (5Pt/CZ) нсм3 ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1.
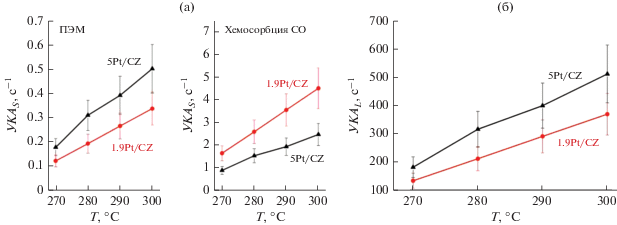
Видно, что УКАL, рассчитанные для двух катализаторов с использованием данных ПЭМ, достаточно хорошо сходятся (с учетом погрешности определения УКА около 20%), чего нельзя сказать для УКАS (рис. 4а).
Была определена наблюдаемая энергия активации ПК СО на катализаторах 1.9Pt/CZ и 5Pt/CZ (рис. 5). Значения для обоих катализаторов совпали и составили 86 кДж/моль. Энергии активации для похожих систем, определенные в других работах, близки к полученной нами величине [22].
Рис. 5.
Температурная зависимость УКА, отнесенной к длине границы Pt–CZ, в Аррениусовских координатах для катализаторов 1.9Pt/CZ и 5Pt/CZ.

Сильные различия в данных о размере частиц и площади поверхности платины, найденных разными методами, затрудняют анализ результатов и не позволяют сделать однозначный вывод о локализации протекания реакции ПК СО на катализаторах Pt/CZ. Причина таких различий возможно в изменении зарядового состояния платины, обусловленном воздействием СО, H2 или Н2О, что, например, подробно обсуждается для Pt/CeO2-катализатора окисления СО в работе [23]. “Растекание” частиц платины по поверхности оксида в ходе реакции также может влиять на заряд поверхностных атомов платины. В свою очередь от заряда атомов платины может зависеть их способность к хемосорбции СО, что, следовательно, способно привести к некорректному результату. Таким образом, для более корректной интерпретации полученных в настоящей работе результатов планируется проведение дополнительных in situ РФЭС-исследований, которые позволили бы отследить динамику зарядового состояния платины при обработке компонентами реакционной смеси. Однако отметим, что корреляция УКА с длиной границы Pt–CZ представляется корректной, так как нет данных о неоднородности такой границы, а температурные зависимости УКА, отнесенной к длине границы металл–носитель, совпали для катализаторов 1.9Pt/CZ и 5Pt/CZ. Таким образом, мы считаем, что полученные результаты косвенно подтверждают выводы о протекании реакции на границе Pt–CZ, сделанные для похожих систем в других работах [13, 24].
ЗАКЛЮЧЕНИЕ
В ходе работы были приготовлены методом сорбционно-гидролитического осаждения, охарактеризованы методами ПЭМ и хемосорбции СО и испытаны в реакции паровой конверсии СО катализаторы 1.9 вес. % Pt/Ce0.75Zr0.25O2– x и 5 вес. % Pt/Ce0.75Zr0.25O2– x. Показано, что использованный метод приготовления позволяет сформировать на поверхности носителя высокодисперсные устойчивые к спеканию в условиях реакции частицы платины с узким распределением по размерам. Катализаторы продемонстрировали высокую активность в смеси, имитирующей синтез-газ, полученный паровой конверсией природного газа: равновесная конверсия СО при объемной скорости 30 000 нсм3${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 была достигнута при 325 и 300°С для образцов с содержанием платины 1.9 и 5 вес. % соответственно. При этом концентрация метана на выходе из реактора не превышала 0.07 об. %, что говорит о высокой селективности представленных катализаторов. Наблюдаемые порядки паровой конверсии СО на 5Pt/CZ оказались близки к нулю, а наблюдаемая энергия активации для обоих катализаторов составила 86 кДж/моль, что хорошо соотносится с данными для схожих по составу систем, имеющимися в литературе.
Существенные различия в данных о размере частиц и площади поверхности платины, полученных разными методами, не позволяет сделать однозначный вывод о локализации активных центров, на которых протекает реакция. Предположительно, причиной может быть различие в зарядовом состоянии платины до и после реакции. Однако корреляция УКА с длиной границы Pt–CZ представляется корректной, так как нет информации о неоднородности такой границы, а температурные зависимости УКА, отнесенной к длине границы металл–носитель, совпали для катализаторов 1.9Pt/CZ и 5Pt/CZ. Это косвенно подтверждает выводы о протекании реакции на границе металл–носитель, сделанные для похожих систем в ряде других работ. Для выяснения причин расхождения данных, уточнения роли поверхностных платиновых центров различной природы в катализе реакции паровой конверсии СО и влияния реакционной среды на состояние платины планируется проведение in situ РФЭС-исследований при обработке различными компонентами реакционной смеси.
Список литературы
Sharaf O.Z., Orhan M.F. // Renew. Sustain. Energy Rev. 2014. V. 32. P. 810.
Park E.D., Lee D., Lee H.C. // Catal. Today. 2009. V. 139. № 4. P. 280.
Керженцев М.А., Матус Е.В., Рундау И.А., Кузнецов В.В., Исмагилов И.З., Ушаков В.А., Яшник С.А., Исмагилов З.Р. // Кинетика и катализ. 2017. Т. 58. № 5. С. 614.
Choudhary T.V., Goodman D.W. // Catal. Today. 2002. V. 77. № 1–2. P. 65.
Baronskaya N.A., Minyukova T.P., Khassin A.A., Yurieva T.M., Parmon V.N. // Russ. Chem. Rev. 2010. V. 79. № 11. P. 1027.
Потемкин Д.И., Конищева М.В., Задесенец А.В., Снытников П.В., Филатов Е.Ю., Коренев С.В., Собянин В.А. // Кинетика и катализ. 2018. Т. 59. № 4. С. 499.
Ильичев А.Н., Быховский М.Я., Фаттахова З.Т., Шашкин Д.П., Федорова Ю.Е., Матышак В.А., Корчак В.Н. // Кинетика и катализ. 2019. Т. 60. № 5. С. 654.
Takenaka S., Shimizu T., Otsuka K. // Int. J. Hydrogen Energy. 2004. V. 29. № 10. P. 1065.
Palma V., Ruocco C., Cortese M., Renda S., Meloni E., Festa G., Martino M. // Metals. 2020. V. 10. № 7. P. 1.
Voitic G., Pichler B., Basile A., Iulianelli A., Malli K., Bock S., Hacker V. / Fuel Cells and Hydrogen: From Fundamentals to Applied Research (book). Elsevier B.V., Amsterdam. 2018. P. 215.
Ivanova S., Laguna O.H., Centeno M.Á., Eleta A., Montes M., Odriozola J.A. / Renewable Hydrogen Technologies: Production, Purification, Storage, Applications and Safety (book). Elsevier B.V., Amsterdam. 2013. Ch.10. P. 225.
Chen W.H., Chen C.Y. // Appl. Ener. 2020. V. 258. P. 114078.
Li Y., Kottwitz M., Vincent J.L., Enright M.J., Liu Z., Zhang L., Huang J., Senanayake S.D., Yang W.C.D., Crozier P.A., Nuzzo R.G., Frenkel A.I. // Nat. Commun. 2021. V. 12. № 1. P. 1.
Efstathiou A.M. // Catalysis: Volume 28 (book). The Royal Society of Chemistry, Cambridge. 2016. Ch. 7. P. 175.
Shekhar M., Wang J., Lee W.-S., Damion Williams W., Min Kim S., A. Stach E., T. Miller J., Nicholas Delgass W.H., Ribeiro F. // J. Am. Chem. Soc. 2012. V. 134. № 10. P. 4700.
Chen Y., Lin J., Li L., Qiao B., Liu J., Su Y., Wang X. // ACS Catal. 2018. V. 8. № 2. P. 859.
Симонов П.А., Шойнхорова Т.Б., Снытников П.В., Потемкин Д.И., Беляев В.Д. Патент RU 2653360 C1. 2017.
Shoynkhorova T.B., Simonov P.A., Potemkin D.I., Snytnikov P.V., Belyaev V.D., Ishchenko A.V., Svintsitskiy D.A., Sobyanin V.A. // Appl. Catal. B: Environ. 2018. V. 237. P. 237.
Bergeret G., Gallezot P. // Handbook of Heterogeneous Catalysis. Wiley-VCH Verlag GmbH & Co., New Jersey. 2008. P. 738.
Pastor-Pérez L., Ramos-Fernández E.V., Sepúlveda-Escribano A. // Int. J. Hydrogen Energy. 2019. V. 44. № 39. P. 21837.
Gonzalez Castaño M., Reina T.R., Ivanova S., Centeno M.A., Odriozola J.A. // J. Catal. 2014. V. 314. P. 1.
Reddy G.K., Smirniotis P.G. // Water Gas Shift Reaction (book). Elsevier B.V., Amsterdam. 2015. P. 225.
Boronin A.I., Slavinskaya E.M., Figueroba A., Stadnichenko A.I., Kardash T.Y., Stonkus O.A., Fedorova E.A., Muravev V. V., Svetlichnyi V.A., Bruix A., Neyman K.M. // Appl. Catal. B: Environ. 2021. V. 286. P. 119931.
Kalamaras C.M., Gonzalez I.D., Navarro R.M., Fierro J.L.G., Efstathiou A.M. // J. Phys. Chem. C. 2011. V. 115. № 23. P. 11595.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


